Introducción
En la actualidad existen numerosas afecciones del tórax en las que está indicada una intervención quirúrgica. Por otro lado, el cirujano en general y el cirujano torácico en particular cada vez tienen que aplicar técnicas más complejas, en pacientes de edad más avanzada y, lógicamente, con mayor morbilidad asociada o concomitante. Aunque el ámbito de la cirugía torácica es muy amplio (técnicas diagnósticas y terapéuticas sobre pulmón, mediastino, pared, etc.), en sus mútiples posibilidades de actuación es la cirugía de exéresis, la mayoría de las ocasiones en el cáncer de pulmón, una de las técnicas más frecuentes. Por ello esta cirugía está sujeta a complicaciones, algunas de ellas específicas, que pueden afectar el pronóstico vital de los pacientes. En general, cuando el estado funcional pulmonar es normal, el margen de tolerancia a la exéresis es muy amplio, pero no debemos olvidar que en estos enfermos coexisten otros factores y enfermedades que pueden influir en el resultado final y que, por tanto, deben considerarse factores de riesgo.
Nuestro objetivo es evaluar cuáles son los factores de riesgo que pueden influir en la morbilidad y mortalidad con vistas a una cuidadosa preparación preoperatoria y un eventual tratamiento de sus complicaciones, así como a una correcta valoración pronóstica postoperatoria.
En líneas generales se ha considerado que los factores de riesgo más importantes son: la amplitud de la exéresis y el estado funcional pulmonar del paciente. Sin embargo, la evaluación de su estado general es esencial, porque no debemos olvidar que en estos enfermos coexisten otras enfermedades y deficiencias que deben considerarse factores de riesgo.
Factores de riesgo generales
J.L. Bravo Bravo
Edad
Es evidente que con la edad se asiste a un deterioro de las funciones internas, menor capacidad de respuesta al estrés, disminución de la sensibilidad al dolor e incremento de las enfermedades, lo que hace sospechar que edad y comorbilidad van muy unidas1. Por lo que se refiere al aparato respiratorio, se produce básicamente (entre otras modificaciones como disminución de la capacidad pulmonar y del volumen corriente, incremento de la frecuencia respiratoria, etc.) una disminución de la fuerza de los músculos respiratorios2.
Así pues, las cuestiones que nos debemos plantear son: ¿cuál es el riesgo?, ¿se debe operar a los pacientes de cierta edad?, ¿cuál es el límite de edad?
El Lung Cancer Study Group3 señala una mortalidad del 3,7 frente al 7% en pacientes mayores de 70 años. En nuestro país se ha visto que la edad superior a los 70 años incrementa el riesgo de morbilidad (el 35 frente al 32,4%) y mortalidad (el 8,7 frente al 6,6%).
En el año 1996 Harpole et al4 consideraban los 75 años como la edad límite para la decisión quirúrgica. Sin embargo, como ya se ha evaluado en algunos países, dentro de unos años más del 40% de los pacientes con cáncer de pulmón tendrán más de 75 años. Así pues, entre los pacientes de edad avanzada deberíamos considerar 2 subgrupos: de 70 a 80 años y mayores de 80 años. En este último grupo prácticamente sólo estarían indicadas las lobectomías y las resecciones menores. Por tanto, podemos señalar que la edad es un factor de riesgo evidente sobre todo cuando se practican resecciones amplias, aunque per se no debe ser causa de inoperabilidad. Es evidente que en los últimos años se han producido: a) un aumento del número de personas de edad avanzada cuyo estado de salud ha mejorado con el progreso de la medicina; b) un avance en la evaluación preoperatoria del estado de los pacientes, en particular de su estado cardíaco; c) mayor disponibilidad de los equipos médicos y quirúrgicos, y d) modificación de la mentalidad médica con respecto a los enfermos de edad avanzada.
Otros estudios, como el de Osaki et al5, demuestran que la mortalidad y la supervivencia son similares entre los pacientes de edad avanzada y los jóvenes. En el trabajo de Osaki et al5, y esto parece importante, las tasas de supervivencia en los pacientes de edad avanzada no dependieron del estadio de la enfermedad, del tipo histológico del tumor o de la comparación resección completa frente a resección incompleta. El pronóstico dependía de las complicaciones, en particular de las respiratorias y cardíacas. Estos datos apuntan a que el octogenario que presenta un cáncer de pulmón tendrá una serie de beneficios con la condición de que no se produzcan complicaciones cardiorrespiratorias.
Hábito tabáquico
Es bien sabido que el hábito tabáquico, independientemente de las modificaciones del volumen espiratorio forzado en el primer segundo (FEV1) que produce, incrementa la posibilidad de complicaciones postoperatorias. Sin embargo, la frecuencia de éstas disminuye si se ha dejado de fumar en las últimas 8 semanas. Patel et al6 observan que continuar fumando es uno de los mejores predictores de morbilidad.
Se ha comprobado que el abandono del hábito tabáquico comporta una disminución progresiva del riesgo de presentar cáncer de pulmón, además de una más adecuada recuperación tras la cirugía pulmonar.
Las atelectasias son un hallazgo común tras la anestesia general y su relevancia clínica depende de la extensión del colapso pulmonar. Su incidencia oscila entre un 2 y un 10%. La consecuencia inmediata es la hipoxemia, cuya intensidad se correlaciona con la extensión de la atelectasia y que es secundaria al shunt intrapulmonar originado en zonas mal ventiladas pero bien perfundidas. El tabaco influye en su aparición, junto con otra serie de enfermedades de manera concomitante como la enfermedad pulmonar obstructiva crónica (EPOC), la infección pulmonar, la enfermedad neurológica, la escasa capacidad de cooperación y la escasa fuerza muscular.
En cuanto a los factores de riesgo preoperatorios de presentar una neumonía nosocomial postoperatoria, de nuevo hay que valorar el antecedente de tabaquismo.
Estado nutricional
Los pacientes quirúrgicos son especialmente propensos a presentar alteraciones del estado nutricional debido a varios factores: a) la enfermedad quirúrgica motivo de su ingreso; b) el período de dieta absoluta condicionada por la actuación quirúrgica; c) las potenciales complicaciones del postoperatorio que generan una persistencia en el estado catabólico, y d) el hecho de que no exista un sólo test que determine el estado nutricional, si bien se han descrito múltiples parámetros para predecirlo y para relacionarlo con las complicaciones del postoperatorio.
El estado nutricional se puede valorar con datos subjetivos como la fuerza muscular, la capacidad ventilatoria o la propia agilidad, y con una serie de datos objetivos como son la historia dietética y los parámetros antropométricos, bioquímicos o inmunológicos.
Sin duda, la malnutrición produce debilidad muscular y disminución de los mecanismos de defensa. La relación albúmina sérica/estado nutricional y la hipoproteinemia suelen ser datos tardíos que pueden contribuir a subestimar el déficit nutricional de estos pacientes. Sin embargo, la transferrina sérica, al tener una vida más corta que la albúmina, se puede considerar un parámetro más sensible para valorar esa desnutrición7.
Obesidad
La obesidad es otro de los parámetros que pueden inducir una mayor predisposición para las atelectasias, la hipoxemia y el incremento de las infecciones respiratorias poscirugía. Funcionalmente este grupo de enfermos presenta disminución de los volúmenes pulmonares con cierre prematuro de las vías respiratorias y disminución de la presión arterial de oxígeno y de la diferencia alveoloarterial de oxígeno.
Comorbilidad como factor de riesgo
F. Heras Gómez
El envejecimiento de la población y el incremento de pacientes con enfermedades crónicas determinan que sea habitual tratar quirúrgicamente a muchos enfermos con importante limitación funcional, afectación multiorgánica y deterioro del estado general.
En la década de los años setenta Feinstein introdujo en el ámbito médico el término comorbidity o comorbilidad para describir "la presencia de 2 o más procesos patológicos independientes, de etiopatogenia y fisiopatología distintas, en un mismo individuo". La comorbilidad implica la presencia de alteraciones físicas y psicológicas adicionales a la enfermedad que el paciente presenta. Su análisis es complejo, pues el solapamiento sintomático de los diversos procesos, la ocasional escasez de los síntomas o la variabilidad de los criterios diagnósticos hacen difícil su adecuada evaluación.
Existen diversas escalas para valorar la comorbilidad, como la Charlson Comorbidity Scale8 y la Cumulative Illness Rating Scale Geriatric. Según estas escalas, entre los enfermos diagnosticados de un proceso neoplásico, el 36% presenta también enfermedades vasculares, el 30% enfermedades cardíacas y el 29% trastornos endocrinos. Entre los pacientes intervenidos quirúrgicamente de cáncer de pulmón, el 73% presenta una o varias enfermedades graves acompañantes9, y la comorbilidad es mayor en los de edad avanzada. En ellos, además de los procesos relacionados con la edad, son frecuentes la coexistencia de un importante hábito tabáquico y la presencia de otras enfermedades: respiratorias, cardiovasculares, arteriopatías periféricas, hipertensión, diabetes, etc.
Enfermedades respiratorias
La EPOC es el proceso respiratorio más frecuente. Su prevalencia es muy alta y está en relación con el consumo de tabaco. La presencia de obstrucción crónica y poco reversible al flujo aéreo origina una disminución del FEV1 y de su relación con la capacidad vital forzada10. La EPOC se encuentra entre los antecedentes del 23 al 50% de los enfermos intervenidos de cáncer de pulmón9,10. La hiperreactividad bronquial y la retención de secreciones, características en estos pacientes, contribuyen a la aparición de trastornos respiratorios postoperatorios9-12, principalmente insuficiencia respiratoria, neumonías, atelectasias, empiemas, edemas posneumonectomía y fístulas broncopleurales, hecho que incrementa la tasa de mortalidad postintervención13. También influye en la aparición de complicaciones cardiológicas, principalmente arritmias10,14. Dependiendo de su gravedad, la EPOC es responsable del 25 al 75% de estas complicaciones y la causante del 25% de la mortalidad postoperatoria en los pacientes con más de 75 años.
Los pacientes con antecedentes de asma pueden también presentar complicaciones tras la intervención quirúrgica, principalmente broncospasmo e insuficiencia respiratoria.
Las infecciones respiratorias son frecuentes en los pacientes con bronquiectasias y procesos obstructivos. La infección por Streptococcous pneumoniae, Haemophilus influenzae y Pseudomonas aeruginosa es muy frecuente en las exacerbaciones de los pacientes con EPOC.
La principal medida preventiva es su adecuado tratamiento preoperatorio mediante broncodilatadores, corticoides e incluso antimicrobianos, según el antibiograma, si presentan infección respiratoria acompañante. La eliminación del hábito tabáquico antes de la intervención quirúrgica y la realización de fisioterapia respiratoria preoperatoria contribuyen a reducir las complicaciones y la mortalidad postoperatorias11.
En los pacientes intervenidos de cáncer de pulmón la coexistencia de enfermedades pulmonares intersticiales, como la sarcoidosis, la histiocitosis X y las neumoconiosis, aumenta las complicaciones respiratorias, principalmente neumonías e insuficiencia respiratoria aguda, eleva la tasa de mortalidad e influye de forma significativa en la supervivencia a los 5 años, reduciéndola del 62,5 al 36,5%15.
Enfermedades cardiovasculares
Afectan al 20% de los pacientes con edad avanzada y son la causa del 50% de la mortalidad postoperatoria.
La cardiopatía isquémica incrementa la morbilidad y la mortalidad en los enfermos que van a ser sometidos a una intervención quirúrgica no cardíaca. La insuficiencia respiratoria postoperatoria es más frecuente en los pacientes operados de cáncer de pulmón con antecedentes de isquemia coronaria10. El 2% presenta infarto agudo de miocardio durante la intervención, con una mortalidad del 25 al 70% en el postoperatorio inmediato, generalmente debida a nuevos infartos. En los pacientes con enfermedad coronaria que han tenido un infarto, la incidencia de infarto agudo postoperatorio es de 10 a 50 veces más elevada que en los que no tienen ese antecedente. La incidencia es mayor cuanto más reciente ha sido el infarto. En una amplia serie de pacientes intervenidos de cáncer de pulmón, el 13% presentaba antecedentes de enfermedades cardiovasculares16 y el riesgo postoperatorio fue más elevado, con una morbilidad del 43% y una mortalidad del 11%. La angina inestable es una contraindicación absoluta para la realización de cirugía no cardíaca, pues se acompaña de un 30% de complicaciones, con una elevada mortalidad.
La insuficiencia cardíaca, independientemente de su causa, es un importante factor de riesgo tanto durante el acto quirúrgico como en el postoperatorio. La mortalidad aumenta en relación con su intensidad. Las lesiones estenóticas sintomáticas se asocian a fallo cardíaco postoperatorio y habitualmente requieren reemplazamiento valvular. El 25% de los pacientes con insuficiencia cardíaca congestiva sintomática presentan edema agudo de pulmón en el postoperatorio, cifra claramente superior al 6% que presentan los que no tienen signos activos de insuficiencia cardíaca. El 8,4% de los pacientes intervenidos de resecciones pulmonares con antecedentes de cardiopatía isquémica e insuficiencia cardíaca congestiva presentaron fibrilación auricular en el postoperatorio inmediato17.
La presencia de arritmias es un importante factor de riesgo que debe evaluarse antes de la intervención. Las arritmias sintomáticas o con repercusión hemodinámica incrementan las complicaciones posquirúrgicas, principalmente cuando se realiza neumonectomía.
Las enfermedades vasculares periféricas aumentan de forma significativa la morbilidad y la mortalidad en los pacientes intervenidos de cáncer de pulmón16. El vínculo de unión entre el cáncer de pulmón y la enfermedad ateromatosa arterial es el consumo de tabaco. En estos pacientes es frecuente la coexistencia del proceso neoplásico con lesiones coronarias y carótidas que aumentan las complicaciones y la mortalidad postoperatorias.
La hipertensión arterial es un factor de riesgo que incrementa las complicaciones cardíacas postoperatorias, fundamentalmente arritmias, infarto de miocardio e insuficiencia cardíaca.
La diabetes mellitus produce alteraciones importantes en el epitelio alveolar y en la lámina basal de los capilares pulmonares. Esta microangiopatía ocasiona trastornos en la función pulmonar, con alteraciones de la difusión por disminución del lecho capilar. En los pacientes diabéticos se aprecia una reducción de la elasticidad pulmonar, que en los pacientes jóvenes insulinodependientes se asocia también a una disminución de los volúmenes pulmonares. La diabetes insulinodependiente aumenta la tasa de complicaciones en los pacientes intervenidos de cáncer de pulmón16 e influye significativamente en la aparición de fístulas broncopleurales postoperatorias18. La diabetes se ha incluido recientemente entre los predictores clínicos de riesgo cardiovascular19.
Función pulmonar como factor de riesgo
F. González Aragoneses
Cuando se sienta la indicación de una cirugía de resección pulmonar, la primera pregunta que debemos contestar es si el paciente la va a tolerar, sabiendo que los factores más significativos de la morbimortalidad postoperatoria son las enfermedades cardiopulmonares, el estadio del tumor y la extensión de la resección20. Tras la obligada historia clínica y exploración física, que pueden ponernos sobre aviso de una afección pulmonar, tendremos que realizar una evaluación funcional preoperatoria.
Parece lógico efectuar de forma escalonada una serie de pruebas de función respiratoria, de menor a mayor complejidad, para lo que resultan útiles los diagramas. La primera prueba que se realizó fue la de "subir escaleras", en la que se asegura que, si una persona puede subir más de 2 pisos, podrá tolerar una neumonectomía; si puede subir más de un piso, se supone que tolerará una lobectomía. Curiosamente es una prueba que algunos incluyen al final de todos los estudios más sofisticados para aquellos pacientes sobre los que aún existen dudas.
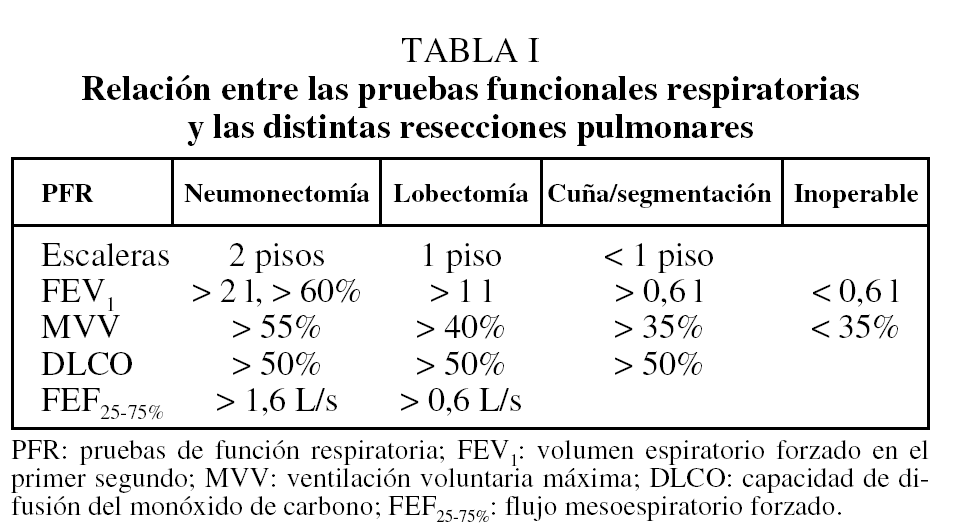
En una primera fase se realizan la espirometría, el estudio de la capacidad de difusión y la gasometría arterial basal. Dentro de la espirometría, el FEV1 se considera el mejor método para predecir las complicaciones postoperatorias y es el más usado para tomar decisiones. La ventilación voluntaria máxima depende mucho del esfuerzo del paciente. Para algunos, la capacidad de difusión del monóxido de carbono (DLCO) es el índice más importante para predecir la mortalidad postoperatoria y el único que permite predecir las complicaciones, pero otros estudios no lo han confirmado. La gasometría arterial basal no ha sido muy estudiada para prever las complicaciones postoperatorias. Una hipoxemia inferior a 45 mmHg y una hipercapnia superior a 50 mmHg se consideran contraindicación absoluta para la resección. También indican una grave alteración de la desaturación en el ejercicio y señalan la necesidad de estudios más complejos20 (tabla I).
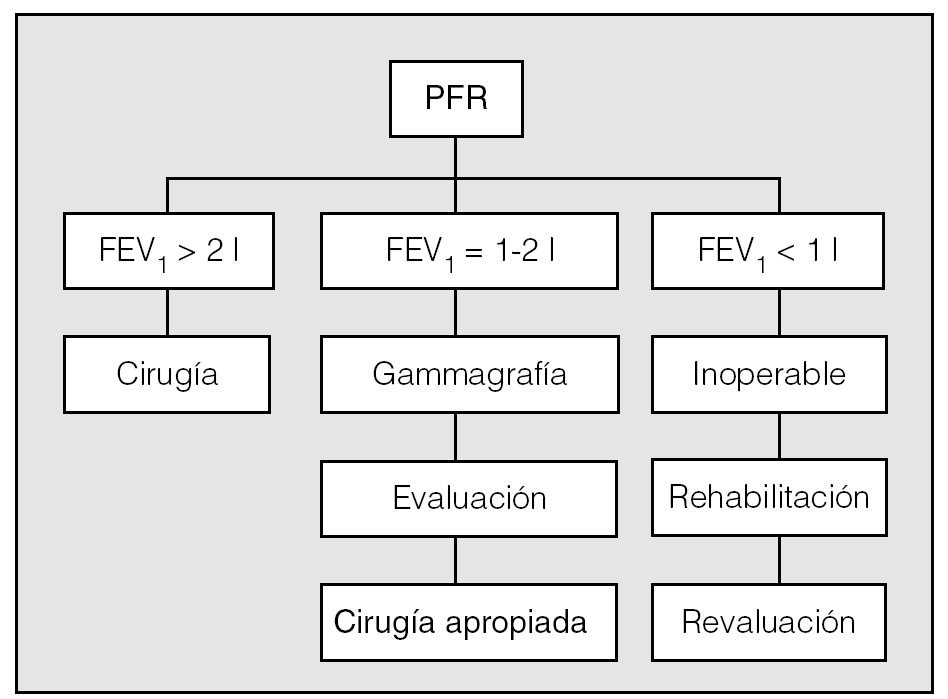
Miller21 propuso en 1992 un algoritmo que sigue Ginsberg20 y en el que por encima de un FEV1 de 2 l el paciente toleraría la neumonectomía y por debajo de 1 l sería inoperable. A los pacientes con valores intermedios se les sometería a una gammagrafía pulmonar para predecir el FEV1 postoperatorio y así calcular si tolerarían la resección teniendo en cuenta el porcentaje de función pulmonar a resecar y restante (fig. 1).
Fig. 1. Algoritmo de actuación. FEV1: volumen espiratorio forzado en el primer segundo; PFR: pruebas de función respiratoria.
De esta forma se introduce la idea de predecir la función postoperatoria con la gammagrafía pulmonar. Estudios no prospectivos muestran que un FEV1 postoperatorio inferior al 35-40% se asocia a una mayor mortalidad. De forma similar, una DLCO postoperatoria inferior al 40% se asocia a una mayor mortalidad y para algunos es el índice que mejor predice la insuficiencia respiratoria postoperatoria22. El FEV1 postoperatorio se puede calcular con la fórmula de Juhl y Frost23: FEV1 preoperatorio x (1 [S x 5,26]/100), donde S es el número de segmentos afectados.
Otros tests como la broncospirometría y la oclusión total unilateral de la arteria pulmonar son invasivos, requieren equipos especiales y ya no se realizan al haber quedado superados por la gammagrafía pulmonar.
En los pacientes con FEV1 inferior al 80% debe calcularse, por tanto, el valor postoperatorio tanto por medio de la gammagrafía como de las pruebas de esfuerzo, en el orden que se considere según el diagrama que sigamos. Estas pruebas determinan el consumo de oxígeno, el consumo máximo de oxígeno, el gasto de anhídrido carbónico y la ventilación-minuto. De esta forma se intenta disminuir al máximo la morbimortalidad de la resección pulmonar, sin caer en el extremo de no realizar la cirugía en pacientes límites que sí la tolerarían.
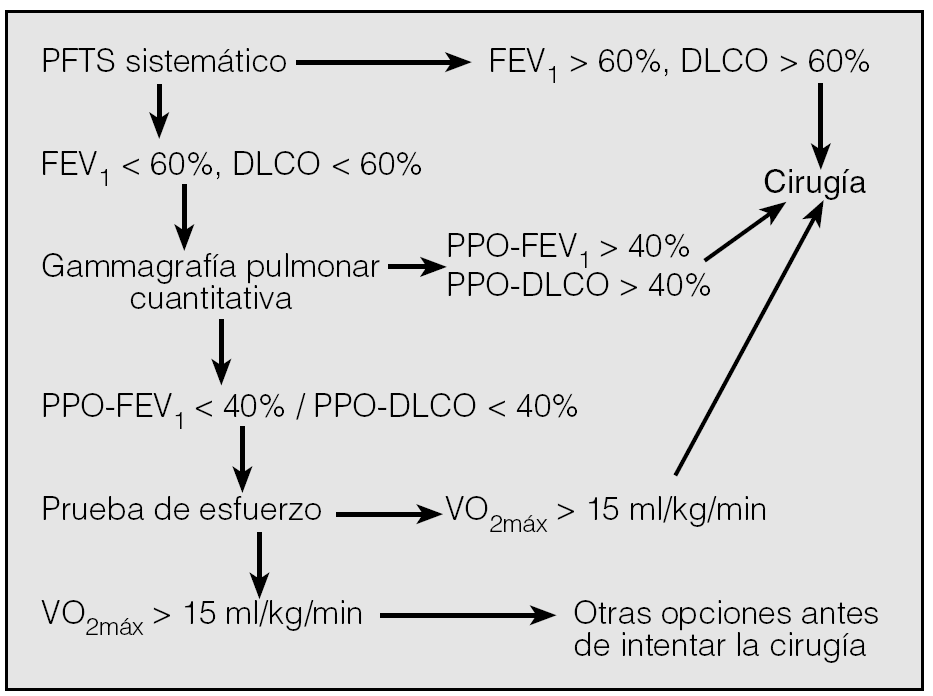
Se han propuesto varios modelos tanto de orden de pruebas como de valores límite de decisión. Algunos proponen que si el FEV1 y la DLCO son superiores al 60%, se tolera incluso la neumonectomía. Si son menores del 60%, hacen las estimaciones postoperatorias con gammagrafía de perfusión, con unos límites del 40% para el FEV1 y la DLCO. Si estos valores están por debajo del 40%, realizan los estudios de esfuerzo con un límite postoperatorio de 15 ml/kg para el consumo máximo de oxígeno24 (fig. 2).
Fig. 2. Algoritmo propuesto por Datta y Lahiri24. DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; PFTS: pruebas de función respiratoria; PPO-FEV1: volumen espiratorio máximo forzado en un segundo predicho postoperatorio; PPO-PLCO: capacidad de difusión predicha postoperatoria; VO2máx: consumo de oxígeno.
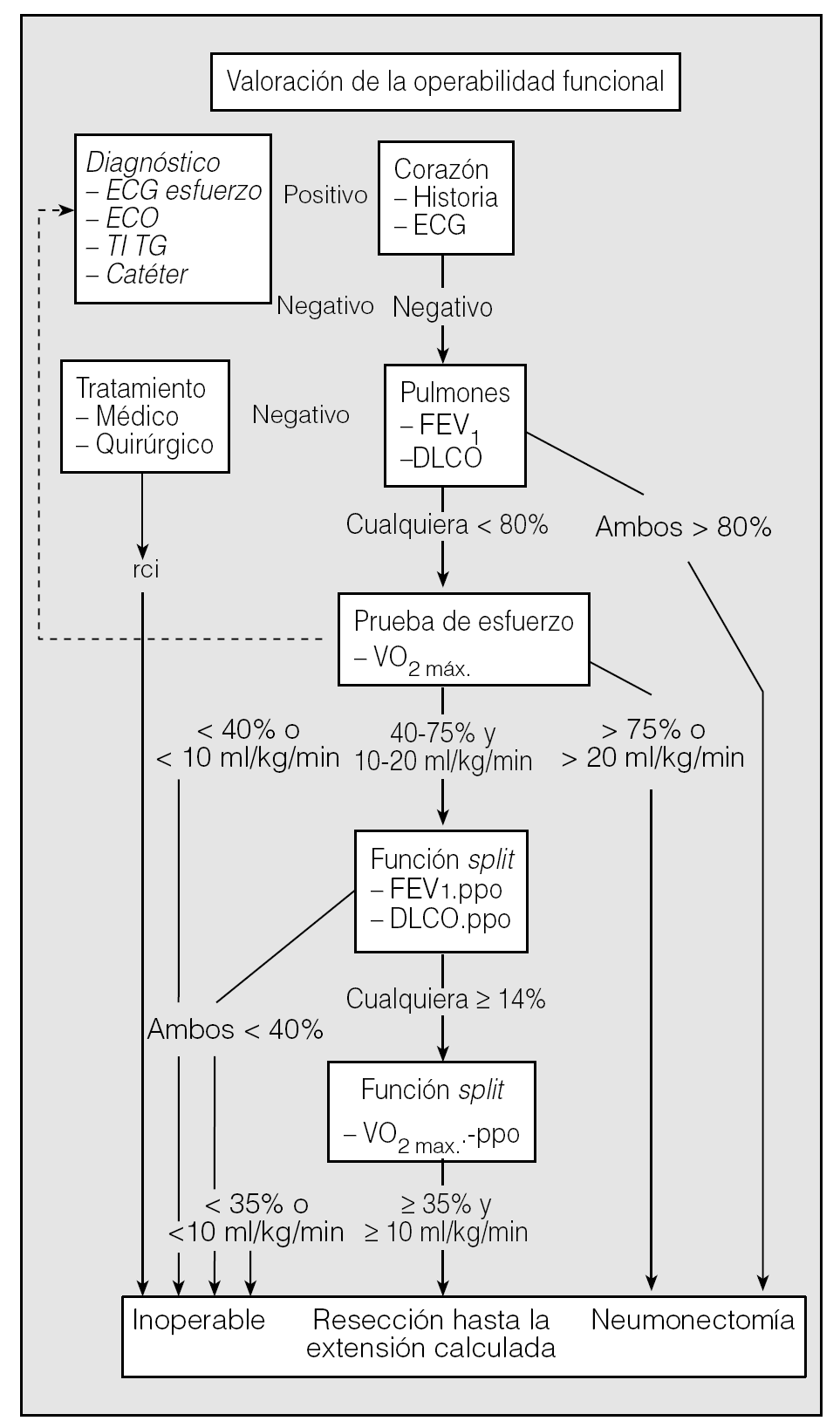
Bolliger et al25 evalúan de forma prospectiva un algoritmo que incorpora la historia cardíaca con electrocardiograma y los 3 parámetros de FEV1, DLCO y consumo máximo de oxígeno, así como sus respectivos valores postoperatorios calculados a partir de las gammagrafías de perfusión. Siguiendo este esquema en 137 pacientes, las complicaciones postoperatorias en los primeros 30 días aparecieron en 15 casos (11%), con 2 muertes (mortalidad global del 1,5%). Al comparar a estos pacientes con una serie previa observan que las complicaciones se reducen en un 50%, con el mismo porcentaje de pacientes inoperables (un 4% ahora y un 5% antes). De esta forma rebajan la morbimortalidad sin aplicar un algoritmo más riguroso como sesgo para mejorar los resultados (fig. 3). Nuestro grupo sigue el diagrama de Bolliger y Perruchoud26 y ha realizado diversos estudios sobre este tema27,28.
Fig. 3. Algoritmo propuesto por Bolliger y Perruchoud26.
Es posible que con la videotoracoscopia, al tener menos complicaciones que la toracotomía, se pueda rebajar el límite de operabilidad funcional. Lo mismo ocurre con la cirugía de reducción de volumen pulmonar, que consigue resecar nódulos pulmonares, en pacientes con enfisema grave, al resecar también áreas pulmonares enfisematosas.
En conclusión, el seguimiento de algoritmos establecidos, los avances en la técnica quirúrgica (videotoracoscopia, cirugía del carcinoma con reducción del volumen pulmonar) y los cuidados pre y postoperatorios pueden permitir resecciones en pacientes que hasta hace poco se consideraban funcionalmente inoperables29.
El tratamiento como factor de riesgo
J.J. Rivas de Andrés
Al hablar del tratamiento quirúrgico como factor de riesgo no sólo debemos considerar el riesgo inherente a la técnica, sino que debemos evaluar otros aspectos relacionados con ella, como la anestesia o el riesgo añadido de otros tipos de tratamiento como es el multimodal en el tratamiento del cáncer de pulmón.
La anestesia como factor de riesgo en la cirugía torácica
La anestesia general implica modificaciones en la función del aparato respiratorio, si bien los cambios inducidos en el intercambio gaseoso no suelen suponer, en general, un incremento del riesgo vital. Sin embargo, existen complicaciones inherentes a la anestesia en la cirugía torácica y, por lo tanto, pueden modificar el riesgo del tratamiento:
1. Complicaciones neurovasculares debidas a una posición anómala y a compresiones que se previenen con la posición y acolchamiento adecuados.
2. Las derivadas de la intubación traumática o incorrecta, casi siempre selectiva, con tubos de doble luz o bloqueadores bronquiales. Hemos de destacar la posición anómala del tubo y la lesión de la vía respiratoria. La primera es la complicación anestésica más frecuente en cirugía torácica. Ocurre hasta en un 30% de tubos aparentemente bien colocados, por lo que se aconseja la inspección sistemática con fibrobroncoscopio30. La mala ubicación puede provocar hipoxemia brusca, retención de anhídrido carbónico y acidosis. La rotura de la vía respiratoria se da en 0,5-2 casos por cada 1.000 intubaciones31, por lo general en la parte membranosa de la tráquea. Intraoperatoriamente se puede manifestar con enfisema mediastínico, subcutáneo, neumotórax contralateral, inestabilidad hemodinámica y hemorragia de la vía respiratoria. Si pasa inadvertida, en el postoperatorio se pueden añadir tos, disnea y hemoptisis.
Disponemos de una serie de maniobras destinadas a superar situaciones complejas, incluso críticas, que pueden surgir durante la cirugía, y que nos sirven para el control de la hipoxemia, las arritmias o el broncospasmo.
La cirugía como factor de riesgo
El cirujano torácico cada vez tiene que aplicar técnicas más complejas en pacientes de edad más avanzada y con una mayor comorbilidad, lo que evidentemente potencia el riesgo.
La toracotomía aumenta el trabajo respiratorio a la vez que produce un menoscabo del aporte energético, lo que favorece la fatiga muscular y propicia la aparición de insuficiencia ventilatoria, sobre todo en pacientes con deterioro previo. Sin embargo, a pesar de las numerosas técnicas empleadas en la evaluación de la función muscular y su deterioro tras la cirugía, de momento se desconoce su valor real como factor de riesgo.
En cambio, sí se conoce el riesgo en función de la amplitud de la exéresis a realizar. La mayoría de los autores refiere una morbilidad entre el 15 y el 47%3,16,32; el carácter prospectivo o retrospectivo de los distintos trabajos y la consideración de las distintas complicaciones pueden ser algunos de los motivos de esta diferencia. La mortalidad oscila entre el 1 y el 12%16,22,32-34, motivada fundamentalmente por la proporción entre los diferentes tipos de procedimiento, comorbilidad previa y origen de la muestra de estudio. La mortalidad en las resecciones menores (del 0,8 al 1,4%35,36) y en las lobectomías (del 1,2 al 4,4%4,35,36) es claramente inferior a la de la neumonectomía3,4,16,35-38. Prácticamente todos los autores16,38 consideran a esta última uno de los principales factores de riesgo. La mortalidad que produce se suele situar en el 8%, con extremos entre el 3,1 y el 16,7%3,4,35,38, con un incremento de la mortalidad en las neumonectomías derechas respecto a las izquierdas37. Por otro lado, la cirugía extendida presenta en general un riesgo algo mayor que la cirugía estándar.
Tratamiento de inducción y cirugía torácica
Los trabajos de Roth y Rossell supusieron en 1994 una modificación de nuestra actitud en el abordaje del estadio IIIA. También están en marcha trabajos acerca de la quimioterapia de inducción en estadios iniciales como, por ejemplo, el NACTH del Grupo Español de Cáncer de Pulmón (GECP).
Sin embargo, sigue sin estar claro si estos tratamientos modifican la morbimortalidad postoperatoria al compararla con la de la cirugía sola. Hay autores que no encuentran un incremento de la morbimortalidad31,39-41. Siegenthaler et al41, del MD Anderson, en un estudio no aleatorio de 355 pacientes, no lo observan, y en el análisis multivariante de este estudio señalan como causantes de la morbimortalidad la enfermedad coronaria y la neumonectomía. Otros autores42,43 sí observan un incremento de la morbimortalidad en los pacientes sometidos a inducción que parece estar en relación con el incremento de la fístula bronquial y el edema posneumonectomía.
Podemos señalar, a la luz de la bibliografía consultada, que, aunque el tratamiento de inducción incrementa el riesgo, se puede realizar con una aceptable morbimortalidad. La neumonectomía derecha se asocia a un incremento significativo del riesgo postoperatorio.
Decía Harold C. Urschel que la neumonectomía es una enfermedad por sí misma y Jean Deslauriers señala que la neumonectomía derecha es una muy mala enfermedad.
Conclusión
A pesar del avance de las técnicas empleadas en cirugía, los facultativos estamos obligados a valorar una serie de factores de diferente índole. Los más básicos son: la edad del paciente, su estado general, el hábito tabáquico y el estado nutricional. Además, en un mismo paciente se pueden dar otras enfermedades que sin duda van a influir en el devenir de la enfermedad una vez tratada. En gran número de casos se va a llevar a cabo una amputación funcional respiratoria, que puede provocar complicaciones quirúrgicas que, a su vez, pueden estar relacionadas con la anestesia, con las diferentes técnicas quirúrgicas empleadas o con tratamientos complementarios.