La hipertensión arterial pulmonar (HAP) es una enfermedad en la que se implican, entre otras, la vía del óxido nítrico (NO). Se ha descrito un polimorfismo en el gen de la sintasa inducible del NO (NOS2) que consiste en la repetición del pentanucleótido CCTTT dando lugar a menor producción de NO. El objetivo del estudio fue conocer si este polimorfismo incrementa la susceptibilidad para desarrollar HAP.
MétodosSe compararon 64pacientes diagnosticados de HAP gruposi y iv y 50controles sanos. Mediante PCR se genotiparon las muestras de ADN para este polimorfismo. Se comparó la distribución en ambos grupos y se correlacionó con parámetros clínicos, hemodinámicos y respuesta terapéutica.
ResultadosSe observó una distribución significativamente diferente en el número de repeticiones entre pacientes y controles (p<0,0001). Agrupando las muestras en formas cortas (ambos alelos con menos de 12repeticiones) y largas (≥12repeticiones) se observó que los primeros tenían un riesgo casi 4veces superior de desarrollar HAP (odds ratio: 3,83; IC95%: 1,19-12,32; p=0,024). No hubo diferencias entre los tipos más frecuentes de HAP ni en la respuesta terapéutica o supervivencia. No existió correlación entre parámetros hemodinámicos y el número de repeticiones en los pacientes, solo débil correlación con la presión arterial pulmonar sistólica.
ConclusionesExisten diferencias significativas en la distribución del polimorfismo CCTTT del gen NOS2 entre pacientes con HAP y población sana. Una menor repetición del pentanucleótido CCTTT en el gen de la NOS2 podría incrementar el riesgo de desarrollar HAP.
One of the pathways involved in pulmonary arterial hypertension (PAH) is the nitric oxide (NO) pathway. A polymorphism in the inducible NO synthase (NOS2) gene has been described, consisting of the CCTTT pentanucleotide repeat, which causes a reduction in NO production. The aim of this study was to determine if this polymorphism increases susceptibility to developing PAH.
MethodsSixty four patients with a diagnosis of PAH groupsi and iv and 50 healthy controls were compared. DNA genotyping of the samples for this polymorphism was performed using PCR. The distribution between both groups was compared and correlated with clinical and haemodynamic parameters and therapeutic response.
ResultsA significantly different distribution was observed in the number of repeats between patients and controls (P<.0001). When the samples were categorised by short forms (both alleles with less than 12repeats) and long forms (≥12 repeats), it was observed that the former had an almost 4-fold risk of developing PAH (odds ratio: 3.83; 95%CI: 1.19-12.32, P=.024). There were no differences between the most common types of PAH, either in therapeutic response or survival. There was no correlation between haemodynamic parameters and the number of repeats in the patients, and only a weak correlation with systolic PAH.
ConclusionsThere are significant differences in the distribution of the NOS2 promotor CCTTT polymorphism between patients with PAH and the healthy population. A minor CCTTT pentanucleotide repeat in the NOS2 gene may increase the risk of developing PAH.
La hipertensión arterial pulmonar (HAP) es una enfermedad poco frecuente que de forma progresiva da lugar a un incremento de las resistencias de las arterias pulmonares. Esto es debido a una disfunción del endotelio, caracterizada por el aumento de la producción de sustancias con efecto vasoconstrictor y proliferativo y disminución de otras con efecto opuesto. Entre estas últimas se encuentra el óxido nítrico (NO), que además de ser un potente vasodilatador pulmonar, tiene otras acciones como la inhibición de la activación plaquetaria o de la proliferación de las células musculares lisas de los vasos sanguíneos1. El NO es sintetizado a partir de la L-arginina mediante la sintasa del NO (NOS), y existen 3isoformas: NOS1 o neuronal, NOS2 o forma inducible y NOS3 o endotelial. La NOS2 es la principal fuente de NO en situaciones inflamatorias que impliquen exposición a citocinas, como factor de necrosis tumoral alfa, IL-1, interferón-gamma y endotelina-1 (ET-1)2. El gen de la NOS2 se encuentra localizado en el cromosoma12, al igual que el gen que codifica la proteína transportadora de serotonina, otro importante actor en la regulación del tono vascular pulmonar. Existen numerosos trabajos que han demostrado una disminución en la concentración de NO tanto en el plasma como en los pulmones de pacientes con HAP idiopática o asociada3,4. La causa de esta disminución parece ser una menor actividad de la NOS que da lugar a una disminución de la síntesis endógena de NO5. En situaciones proinflamatorias la actividad NOS probablemente es en su mayor parte dependiente de NOS2, dado que la forma constitutiva (NOS3) tiene una concentración mucho menor. ET-1, en el caso de pacientes con HAP, también actúa como un potente inductor de la actividad de NOS2. Sin embargo, en pacientes con esclerosis sistémica y HAP se ha observado que la concentración de NO no se correlaciona con el incremento de ET-1, manteniéndose en valores normales a pesar del notable aumento de esta última6. Ello se podría justificar por la presencia de algún tipo de polimorfismo en NOS2 con menor capacidad de síntesis de NO. Se ha descrito un polimorfismo situado en la región promotora del gen NOS2 que consiste en la repetición de un pentanucleótido CCTTT7 que parece proteger contra la malaria y además disminuye el riesgo de nefropatía diabética8,9. En pacientes con esclerodermia se pudo comprobar que existía una correlación entre la repetición de este pentanucleótido y el cociente NO/ET-1 sérico, independientemente de que existiera o no HAP, lo que apunta que en presencia de una elevada concentración de ET-1, como sucede en la HAP, este polimorfismo podría ser responsable de la baja producción de NO6 y un importante factor en la patogenia de la enfermedad. Todos estos hallazgos sugieren que este polimorfismo podría tener algún papel en el desarrollo de HAP.
El objetivo de nuestro trabajo fue conocer la distribución de este polimorfismo en pacientes con diversos tipos de HAP y ver la posible relación entre el número de pentanucleótidos y parámetros hemodinámicos y clínicos
Material y métodosSe incluyeron pacientes adultos consecutivos de nuestra unidad diagnosticados de HAP del grupoi y iv de Dana Point que dieron su consentimiento para el estudio tras explicarles los objetivos del mismo. En todos los casos el diagnóstico se basó inicialmente en un ecocardiograma de sospecha y posteriormente un cateterismo derecho en reposo (presión arterial pulmonar media [PAPm] ≥25mmHg, presión de enclavamiento ≤15mmHg). Se recogieron los siguientes datos: edad al diagnóstico, sexo, inicio de los síntomas, tipo de HAP, clase funcional (CF), valores hemodinámicos en ecocardiografía y cateterismo, datos de laboratorio incluyendo autoinmunidad y péptido natriurético cerebral (BNP), distancia recorrida en el test de 6min y respuesta al tratamiento, especialmente inhibidores de fosfodiesterasa5. Como controles se escogieron estudiantes universitarios sin ningún antecedente patológico personal o familiar en relación con HAP. El comité de ética local dio su aprobación al estudio.
MuestrasEl ADN se obtuvo a partir de leucocitos periféricos extraídos de sangre venosa mediante el kit FlexiGene DNA (Qiagen, Alemania), congelándose a –70°C hasta su procesado. La región promotora correspondiente se amplificó mediante PCR con los cebadores siguientes: 5’-ACC CCT GGA AGC CTA CAA CTG CAT-3’ (forward); 5’-GCC ACT GCA CCC TAG CCT GTC TCA-3 (reverse). Los diferentes alelos se obtuvieron por electroforesis capilar mediante un sistema de análisis genético ABI Prism 3100 (Applied Biosystems, California, EE.UU.). El tamaño de los alelos fue calculado usando el programa informático GeneScan Analysis con el sistema de etiquetado de tamaño GeneScanTM-400 ROX (Applied Biosystems, California, EE.UU.).
Análisis estadísticoEl objetivo principal fue conocer las diferencias en la distribución del número de pentanucleótidos CCTTT en pacientes con HAP en relación con la población sana. Dado el tamaño de la muestra, se utilizaron test no paramétricos. Para la comparación entre el número de repeticiones se usó el test de Mann-Whitney. Las variables cualitativas se analizaron usando tablas de contingencia mediante la prueba de chicuadrado o el test de Fisher. El test de Spearman fue utilizado para correlaciones entre el número de nucleótidos y parámetros hemodinámicos. Un valor de p≤0,05 se consideró significativo. Todos los cálculos fueron realizados con el programa SPSS v19.
ResultadosLas características de los 64pacientes incluidos (37mujeres) pueden verse en la tabla 1. Los tipos más frecuentes de HAP fueron: idiopática (19casos, 29,6%), asociada a conectivopatías (17casos, 26,5%) y tromboembólica (14casos, 21,8%). La edad media en el momento del diagnóstico fue 52±16años, con una PAPm de 49±15mmHg.
Características de los pacientes
| Pacientes | 64 |
| Varones/mujeres | 37/27 |
| Edad (años) | 52±16 |
| PAPm (mmHg) | 49±15 |
| PAPs (mmHg) | 77±19 |
| Resistencia vascular pulmonar (U Wood) | 10,7±6 |
| Índice cardíaco (l/min/m2) | 2,3±0,7 |
| Test de 6 min (m) | 338±72 |
| Tipo HAP | |
| Idiopática | 19 |
| Conectivopatías | 17 |
| Tromboembólica | 14 |
| Cardiopatías congénitas | 7 |
| Portopulmonar | 5 |
| VIH | 2 |
HAP: hipertensión arterial pulmonar; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; VIH: virus de la inmunodeficiencia humana.
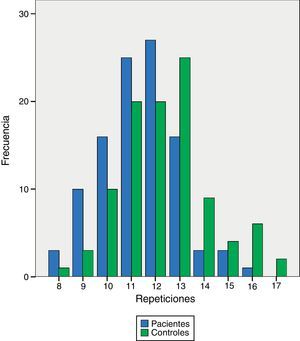
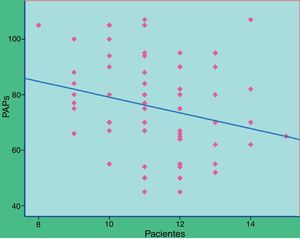
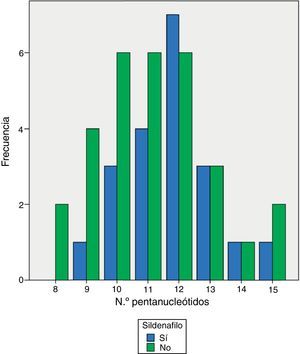
El análisis del polimorfismo CCTTT fue posible en todas las muestras de pacientes y controles. Encontramos 10alelos con un número de pentanucleótidos repetidos entre 8 y 17veces. La distribución fue significativamente diferente entre pacientes y controles (tabla 2), con una mediana de 12veces en los pacientes y 13 en los controles (p<0,0001). Al analizar de forma separada los 50pacientes con HAP del grupoi (fig. 1) las diferencias alcanzaron también el mismo grado de significación estadística (p<0,0001). Para calcular el riesgo que podría suponer tener menos pentanucleótidos dividimos tanto los pacientes como los controles en 2grupos: corto (los dos alelos con un número de repeticiones menor de 12) o largo (12 o más repeticiones), encontrando diferencias claramente significativas (odds ratio [OR]: 3,83; intervalo de confianza [IC] al 95%: 1,19-12,32; p=0,024). Al analizar los parámetros hemodinámicos no se observó una correlación significativa con el número de pentanucleótidos, aunque con la PAP sistólica medida durante el cateterismo diagnóstico alcanzó significación estadística, pero con un valor de r muy bajo (fig. 2). Al comparar el número de pentanucleótidos entre los 3tipos más frecuentes de HAP no se encontraron diferencias significativas. Para evaluar la posible relación entre número de pentanucleótidos y respuesta terapéutica al final del primer año los pacientes se dividieron en 3grupos: mejoría, estabilización o empeoramiento. Se utilizó la clase funcional como medida. No se observaron diferencias significativas (p=0,81). Al agrupar los pacientes en función de tener menos de 12repeticiones o bien 12 o más tampoco se apreciaron diferentes respuestas terapéuticas (p=0,44). Analizamos también la respuesta al tratamiento en los 3primeros meses con inhibidores de la fosfodiesterasa5 en relación con el número de pentanucleótidos. En total, 25pacientes recibieron sildenafilo. En 10casos se consideró buena respuesta (mejoría de al menos una CF y/o más de 50m en el test de 6min), mientras que en los otros 15 no se consiguió. La distribución de pentanucleótidos no fue significativamente diferente (p=0,15) (fig. 3).
Frecuencias de distribución de las repeticiones del pentanucleótido
| Pacientes | Controles | |
| 8 | 3 (2,4%) | 1 (0,8%) |
| 9 | 14 (11%) | 3 (2,4%) |
| 10 | 20 (15,7%) | 10 (7,9%) |
| 11 | 27 (21,3%) | 20 (15,7%) |
| 12 | 31 (24,4%) | 20 (15,7%) |
| 13 | 19 (15%) | 25 (19,7%) |
| 14 | 6 (4,7%) | 9 (7,1%) |
| 15 | 4 (3,1) | 4 (3,1%) |
| 16 | 1 (0,8%) | 6 (4,7%) |
| 17 | 1 (0,8%) | 2 (1,6%) |
Se observa una clara diferencia en las frecuencias de las repeticiones de los pentanucleótidos (p<0,0001), predominando un número menor en los pacientes en comparación con los controles.
Todos los pacientes fueron seguidos un mínimo de 2años. Para ver si existió diferencia en la distribución de alelos entre los fallecidos y supervivientes se excluyeron los pacientes con HAP tromboembólica y asociada a cardiopatías congénitas, por su diferente pronóstico, y los sometidos a trasplante pulmonar. De los 43pacientes incluidos en este análisis, fallecieron 7. No se encontraron diferencias significativas (p=0,67) (tabla 3).
Distribución en función de tener los dos alelos ≥ o<de 12 repeticiones
| Pentanucleótidos (n) | Pacientes | Controles |
| < 12 | 16 | 4 |
| ≥ 12 | 48 | 46 |
El riesgo de padecer la enfermedad siendo portador de menos de 12repeticiones del pentanucleótido se incrementó de forma muy significativa (OR: 3,83; IC95%: 1,19-12,32; p=0,024).
El presente estudio ha mostrado una distribución significativamente diferente en el número de pentanucleótidos CCTTT en el gen de la NOS2 entre pacientes afectos de diferentes tipos de HAP y la población general, correspondiendo a los primeros formas más cortas que se asocian a una menor capacidad transcripcional de la enzima. Este es el primer estudio que valora este polimorfismo en diversos tipos de HAP, incluyendo las formas idiopáticas. Uno de los hallazgos más interesantes ha sido encontrar un incremento del riesgo de desarrollar esta enfermedad superior a 3veces si en los 2alelos el número de pentanucleótidos era inferior a 12. Previamente se había observado que los pacientes con HAP asociada a esclerodermia presentaban también un número menor de repeticiones en comparación con esclerodermia sin HAP, hallazgo que parece demostrar un papel de este polimorfismo en la susceptibilidad para desarrollar HAP en esta enfermedad6. Ese mismo trabajo, mediante un vector que insertó secuencias que contenían entre 6 y 14repeticiones del pentanucleótido en fibroblastos humanos, comprobó un incremento gradual en la actividad transcripcional de la NOS2 a medida que aumentaban los pentanucleótidos.
La vía del NO juega un papel crucial en el control del tono vascular pulmonar. Su principal fuente de producción es el endotelio y epitelio del pulmón, es decir, se trata de una regulación local10. Inicialmente el efecto del NO en el árbol vascular pulmonar se estudió utilizando inhibidores no selectivos de las diferentes isoformas de la NOS, pero posteriormente, al disponer de animales de investigación genéticamente modificados para no expresar alguna isoforma, se pudo conocer mucho mejor el papel que tiene cada una de ellas. Por ejemplo, la depleción de NOS3 produce hipertensión sistémica relevante y solo leve hipertensión pulmonar sin remodelado aparente11. NOS2 está regulada por mediadores inflamatorios y tiene un papel escaso en situaciones no patológicas. Se ha observado un notable incremento de la concentración de NO mediado por NOS2 en el distrés respiratorio, que paradójicamente, debido a la reacción con peroxinitrito, una especie reactiva del oxígeno muy abundante en esta situación, favorece el daño endotelial y la aparición de hipertensión pulmonar12. Lo mismo sucede en animales de experimentación expuestos a humo de tabaco, en los que la NOS2 y el peroxinitrito son fundamentales en la génesis de enfisema y HAP. La inhibición de NOS2 previene la aparición de ambos e incluso revierte parte de las lesiones13, lo que de nuevo indica la importancia de NOS2 en situaciones de estrés o con actividad inflamatoria.
La repetición del pentanucleótido CCTTT es altamente polimórfica, algo que se observa también en nuestro estudio, donde el número de alelos varió entre 8 y 17. Esta variación parece ser relevante en la regulación de la transcripción de la NOS2 y en la protección frente a algunas enfermedades. Por ejemplo, en un estudio irlandés los portadores de 14repeticiones tuvieron un riesgo relativo de padecer retinopatía diabética de 0,21 en comparación con el resto14. Este mismo número de repeticiones también fue claramente superior en diabéticos sin nefropatía en relación con los que sí la tenían9. Diversos trabajos han señalado la importancia que parece tener este polimorfismo en enfermedades inflamatorias. Un estudio en pacientes con artritis reumatoide no encontró diferencias con respecto a la población general en la presencia de 2polimorfismos en el gen de NOS3 y sin embargo sí fue significativamente diferente la repetición CCTTT de la NOS215. Este estudio, de forma parecida al nuestro, mostró un incremento del riesgo de padecer artritis reumatoide, en este caso algo más de 2 veces, si el número de repeticiones era inferior a 12.
No se encontraron diferencias en la distribución de los pentanucleótidos en los tipos más frecuentes de HAP. Ello puede estar influido por el tamaño de la muestra, pero es posible que refleje la realidad. Con los datos disponibles, la patogenia de la HAP parece ser multifactorial, implicando diversas señales celulares, no una en concreto, con complejas interacciones entre ellas. Incluso las mutaciones en el gen del receptor tipo2 de las proteínas morfogenéticas del hueso (BMPR2), uno de los mecanismos más importantes en la aparición de HAP hereditaria, no suponen más del 20% de riesgo de padecer la enfermedad16,17. La vía del NO es muy importante, y se podría teorizar que ante una situación favorecedora de HAP, como una enfermedad del tejido conectivo, hipertensión portal, etc., la presencia de un polimorfismo que altera uno de los más potentes estímulos vasodilatadores pulmonares incrementa el riesgo de padecer la enfermedad. Los resultados de nuestro estudio apoyan esta posibilidad.
No encontramos una correlación entre los parámetros hemodinámicos y el número de pentanucleótidos, salvo débil con la PAP sistólica, a pesar de que una menor producción de NO con peor regulación del tono vascular podría ser un factor que tendiera a elevar las resistencias pulmonares. Dado que el número de test vasodilatadores positivos fue muy pequeño (3pacientes), no se pudo hacer ningún análisis al respecto.
Se podría haber supuesto a priori una mejor respuesta terapéutica a los inhibidores de fosfodiesterasa5 en los pacientes con menos pentanucleótidos, dado que la producción de NO está disminuida, pero los datos del estudio no lo confirmaron. Este tipo de fármacos ha probado su eficacia en el tratamiento de la HAP en numerosos ensayos18,19. Aunque hicimos el análisis en los 25pacientes que tomaron esta clase de fármacos, el estudio no tenía un diseño adecuado para ello, pues se incluyeron tipos diferentes de HAP, y en algo más de la mitad de los casos se trataba de tratamiento combinado tras haber fracaso otro fármaco. Posiblemente la única forma de valorarlo adecuadamente sería con una muestra mucho más homogénea y en tratamiento de inicio, dado que el número de variables confusoras que implica nuestro estudio dificulta sacar conclusiones con un grado de certeza razonable. También se podría especular que si la síntesis de NO está notablemente disminuida, aun inhibiendo en parte la destrucción de su efector, el GMP-c, en muchos la concentración alcanzada no sería suficiente para tener efectos relevantes. Quizá utilizando riociguat, un fármaco aún no comercializado que estimula directamente la guanilato-ciclasa20 y por tanto es independiente de la concentración de NO para ejercer su función, se podrían obtener datos más fiables.
No encontramos diferencias en la distribución del polimorfismo entre fallecidos y supervivientes. Se excluyeron los 2tipos con mejor pronóstico (cardiopatías congénitas y tromboembólica, algunos de estos últimos tratados con endarterectomía) y los que fueron sometidos a trasplante pulmonar para evaluar los pacientes a priori con pronóstico más parecido. Lo idóneo hubiera sido estratificar el análisis en función de la severidad de la enfermedad en el momento del diagnóstico, pero el tamaño de la muestra lo hacía prácticamente imposible. El tiempo de seguimiento, 2años, quizá sea pequeño para obtener resultados relevantes.
En conclusión, en este trabajo se ha encontrado una menor repetición del pentanucleótido CCTTT en la región promotora del gen de la NOS2 en pacientes con HAP de diversos tipos en comparación con población general. Un número de repeticiones inferior a 12 en los 2alelos aumentó de manera muy significativa el riesgo de padecer la enfermedad. Dado que la actividad transcripcional de la NOS2 parece incrementarse con el número de pentanucleótidos, este polimorfismo posiblemente tenga algún tipo de papel patogénico en el desarrollo de la enfermedad y podría ser interesante su estudio en pacientes con enfermedades asociadas a HAP.
FinanciaciónEste estudio fue financiado parcialmente por una beca de investigación de Actelion.
Conflicto de interesesAdolfo Baloira ha recibido becas de investigación de Actelion y ha actuado como consultor de Actelion, GSK, Pfizer, Lilly, Bayer y Ferrer.
El resto de los autores declaran no tener conflicto de intereses.