El objetivo general del estudio es la creación de una cohorte de pacientes con asma con distintos grados de gravedad, que permita incrementar los conocimientos sobre los mecanismos subyacentes a la génesis y evolución de esta patología.
Los objetivos específicos se centran en llevar a cabo diferentes estudios en términos de imagen, de función pulmonar, inflamación e hiperrespuesta bronquial, para determinar los eventos relevantes que dan forma a esta población asmática, los parámetros a largo plazo que pueden determinar los cambios en la gravedad de los pacientes y que tratamientos pueden influir en la progresión de la enfermedad. El estudio también tratará de identificar las causas de las exacerbaciones y cómo esto afecta a la evolución de la enfermedad.
Los pacientes serán contactados a través de las consultas externas de las 8instituciones participantes en el marco del CIBER de Enfermedades Respiratorias. En la visita de inclusión, se realizará una historia clínica estandarizada, un examen clínico exhaustivo, incluyendo la presión arterial, el índice de masa corporal, las pruebas funcionales respiratorias completas y la medición de la FENO, y se administrarán los cuestionarios Test de control del asma (ACT), Morisky Green, Cuestionario de calidad de vida en pacientes con asma (Mini AQLQ), el Cuestionario sino-nasal Outcome Test 22 (SNOT-22) y la escala de ansiedad y depresión (HAD). Para la recogida de los datos se ha diseñado una base de datos electrónica específica. Se recogerán también muestras de aire exhalado condensado, orina y sangre. Al inicio del estudio y cada 24 meses, se realizará una prueba de hiperrespuesta bronquial inespecífica con metacolina y se recogerá una muestra de esputo inducido. Al inicio del estudio se realizarán prick test a neumoalérgenos y una tomografía computarizada torácica que se repetirá a los 5años.
The general aim of this study is to create a cohort of asthma patients with varying grades of severity in order to gain greater insight into the mechanisms underlying the genesis and course of this disease.
The specific objectives focus on various studies, including imaging, lung function, inflammation, and bronchial hyperresponsiveness, to determine the relevant events that characterize the asthma population, the long-term parameters that can determine changes in the severity of patients, and the treatments that influence disease progression. The study will also seek to identify the causes of exacerbations and how this affects the course of the disease.
Patients will be contacted via the outpatient clinics of the 8 participating institutions under the auspices of the Spanish Respiratory Diseases Networking System (CIBER). In the inclusion visit, a standardized clinical history will be obtained, a clinical examination, including blood pressure, body mass index, complete respiratory function tests, and FENO will be performed, and the Asthma Control Test (ACT), Morisky-Green test, Asthma Quality of Life Questionnaire (Mini AQLQ), the Sino-Nasal Outcome Test 22 (SNOT-22), and the Hospital Anxiety and Depression scale (HADS) will be administered. A specific electronic database has been designed for data collection. Exhaled breath condensate, urine and blood samples will also be collected. Non-specific bronchial hyperresponsiveness testing with methacholine will be performed and an induced sputum sample will be collected at the beginning of the study and every 24 months. A skin prick test for airborne allergens and a chest CT will be performed at the beginning of the study and repeated every 5 years.
El asma representa un problema de salud mundial. Se ha producido un incremento en la prevalencia de la enfermedad en las últimas décadas, estimándose que en la actualidad puede llegar a afectar a 358 millones de personas en todo el mundo. Este hecho es particularmente relevante en países industrializados, en los cuales se ha observado un gran aumento de esta enfermedad en los últimos 50 años1,2. El asma afecta actualmente a entre el 1 y el 16% de la población mundial1. En España esta prevalencia oscila entre el 1,5 y el 16,7% en población adulta y se calcula alrededor del 10% en niños3. Los pacientes con asma tienen una peor calidad de vida, un absentismo laboral y escolar elevado, y comorbilidades asociadas. Además, al tratarse de una enfermedad crónica, tiene un elevado coste socioeconómico4.
El asma bronquial se define como una enfermedad inflamatoria de las vías respiratorias que provoca hiperrespuesta bronquial u obstrucción del flujo de aire y que se manifiesta por síntomas tales como tos, sibilancias o disnea1,3. El asma se ha considerado clásicamente como una enfermedad asociada con atopia o enfermedad alérgica, que comienza en la infancia y puede persistir o no en la edad adulta5. Sin embargo, en la actualidad, se considera una enfermedad heterogénea y multifactorial que incluye diferentes fenotipos, cada uno con su propia historia natural y distinta respuesta al tratamiento6,7. En este sentido, además del asma alérgica o extrínseca y asma no alérgica o intrínseca, durante las 2últimas décadas se han definido otros fenotipos basados en características clínicas o fisiológicas (gravedad, edad de inicio, grado de obstrucción, resistencia al tratamiento), en desencadenantes del asma (ejercicio, alérgenos, ocupación, asma inducido por aspirina) o tipo de inflamación (eosinofílica, neutrofílica o paucicelular)8. Estas definiciones se basan en características parciales de la enfermedad y si bien pueden ser de ayuda, no explican la complejidad total del asma. Efectivamente, cuestiones tales como, por ejemplo, las causas del aumento del asma, la susceptibilidad genética o la interacción entre los factores ambientales y el sistema inmunológico, tanto en la génesis del asma como en cuanto a desencadenante de exacerbaciones, no están resueltas.
En los últimos 10 años se han generado 2tipos de estrategias para una mejor comprensión de esta condición. Una primera estrategia trata de clasificar el asma fenotípicamente mediante el análisis de clusters9-11. El análisis de clusters se basa en algoritmos matemáticos multivariantes que cuantifican similitudes entre los individuos de la misma población, siempre con el objetivo de tratar de entender los mecanismos de la enfermedad y, por lo tanto, optimizar el tratamiento de la misma. La segunda estrategia ha consistido en el desarrollo de diferentes cohortes que intentan estudiar la historia natural de la enfermedad. Hasta la actualidad, se han desarrollado 3cohortes europeas12-14 y una americana15. La finalidad de estas cohortes ha sido tratar de optimizar el tratamiento con base en las características particulares de cada paciente. Sin embargo, las cohortes hasta ahora descritas se centran en el estudio de las características del asma grave o refractaria y, según nuestro conocimiento, no existe ningún estudio de cohortes enfocado al análisis de todos los pacientes con asma. Además, ninguna de estas cohortes incluye simultáneamente estudios de función pulmonar y de inflamación. Tampoco ninguna de ellas incluye estudios evolutivos de imagen bronquial.
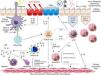
El presente proyecto (proyecto MEGA, acrónimo del inglés Mechanism underlying the genesis and evolution of asthma) tiene como objetivo la generación de una cohorte que englobe la posibilidad de acceder a datos clínicos, fisiológicos, moleculares y genéticos en pacientes con distintos grados de gravedad del asma, y que puede ayudar a establecer las distintas vías fisiopatológicas que originan o condicionan la variada expresión de esta enfermedad y conocer qué porcentaje de pacientes pueden evolucionar hacia la aparición de bronquiectasias u obstrucción bronquial fija y qué factores predisponen o condicionan esta evolución. Se trata de un estudio multicéntrico, enmarcado dentro del CIBER de Enfermedades Respiratorias (CIBERES), a realizar en 8hospitales, en el que por primera vez y con cierta periodicidad se llevarán a cabo diferentes estudios en términos de imagen, de función pulmonar, inflamación e hiperrespuesta bronquial, para determinar los eventos relevantes que dan forma a esta población asmática, los parámetros a largo plazo que pueden determinar los cambios en la gravedad de los pacientes y qué tratamientos pueden influir en la progresión de la enfermedad. El estudio también tratará de identificar las causas de las exacerbaciones y cómo estas afectan a la evolución de la enfermedad. En definitiva, se pretende conocer mejor la historia natural de la enfermedad, no centrándose exclusivamente en el asma grave (fig. 1).
En este artículo se describen los criterios de selección de la cohorte, los datos basales y evolutivos que se recogerán, la metodología que se usará para la obtención de las distintas muestras biológicas, así como el procesado y el almacenamiento de las mismas en el biobanco pulmonar de CIBERES.
MétodosDiseño, población de estudio y variables clínicasEstudio multicéntrico de cohorte prospectiva de una muestra estimada representativa de 525 pacientes adultos con asma y 100 controles sanos. Los sujetos serán reclutados en 8hospitales universitarios en España.
Se procurará un reclutamiento consecutivo (no seleccionado) de pacientes, asumiendo una pérdida en el seguimiento del 12,5%. Se reclutará a los 75 primeros pacientes con asma atendidos durante el periodo del estudio en cada centro, de edades comprendidas entre los 18 y los 75 años con asma intermitente, leve, moderada o grave, según la clasificación de la GINA1, en los cuales el diagnóstico (también basado en los criterios GINA) se haya realizado al menos un año antes de la inclusión. Los pacientes solo serán excluidos si tienen otros trastornos pulmonares agudos o crónicos activos o trastornos psiquiátricos significativos. Todos los pacientes firmarán un consentimiento informado por escrito. Los individuos serán contactados a través de las consultas externas de las instituciones participantes y los participantes serán vistos al inicio del estudio y a los 6 meses durante el primer año y, posteriormente, cada año. Se incluirá un grupo de 100 sujetos sanos, no fumadores, con un porcentaje similar en el sexo y con edades comprendidas entre los 18 y los 75 años. En estos pacientes, se realizaran las mismas determinaciones que en los pacientes con asma.
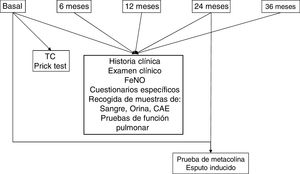
Se establecerá una metodología común de recogida de datos en todos los centros participantes. En cada visita, se completará para cada paciente una historia clínica estandarizada y se administrarán las versiones validadas al castellano de los cuestionarios Test de control del asma (ACT)16,17, Morisky Green18,19, Cuestionario de calidad de vida en pacientes con asma (Mini AQLQ)20,21, el cuestionario Sino-Nasal Outcome Test 22 (SNOT-22)22,23 y la escala de ansiedad y depresión (HAD)24,25. Se realizará un examen clínico exhaustivo incluyendo la presión arterial, el índice de masa corporal, las pruebas funcionales respiratorias completas y la medición de la fracción exhalada de óxido nítrico (FeNO). Se recogerán también muestras de aire exhalado condensado, orina y sangre. Para garantizar la recogida homogénea de las muestras se han diseñado unos protocolos comunes para todos los centros participantes. Al inicio del estudio y cada 24 meses, se realizará una prueba de hiperrespuesta bronquial inespecífica con metacolina y se recogerá una muestra de esputo inducido. Al inicio del estudio y cada 5 años se realizará una tomografía computarizada (TC) torácica y prick test a neumoalérgenos (fig. 2).
Recogida de datosPara la recogida de los datos que se obtendrán durante el proyecto, se ha diseñado una base de datos específica electrónica (CRD). Esta base de datos permitirá recoger, explotar y exportar datos (previamente anonimizados) de los pacientes incluidos en el estudio. Las variables de la base de datos han sido consensuadas entre los investigadores integrantes del proyecto (con marcado carácter multidisciplinar) y el diseño del CRD ha sido realizado por una empresa profesional (Biostatistics and Data Management Core Facility, IDIBAPS, Institut d’Investigacions Biomèdiques August Pi i Sunyer) (anexo 1, suplemento on line). Para garantizar una calidad adecuada de los datos incluidos en la base de datos, la empresa encargada del diseño del CRD realizará, junto con los investigadores del proyecto, una revisión periódica de los datos incluidos. Esta revisión será realizada el primer mes y de forma semestral a partir de ese momento.
AtopiaLa atopia se definirá como la presencia de al menos un prick test o una IgE sérica específica positivos frente a un aeroalérgeno26. Los prick test se realizarán con los aeroalérgenos comunes más prevalentes de cada zona del estudio. Deberán estar incluidos: ácaros (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Lepidoglyphus destructor), pólenes (Cupressus arizónica, Platanus acerifolia, Olea europea), mezcla de gramíneas (Artemisia vulgaris, Parietaria judaica, Salsola kali), epitelios (gato, perro), hongos (Alternaria alternata, Aspergillus fumigatus, Caldosporium herbarum, Penicillium notatum) y cucaracha (Blatella orientalis). Se considerarán positivos si hubiera un habón igual o superior a 3mm de diámetro comparado con el control negativo (suero fisiológico); como control positivo se empleará histamina 10mg/ml26.
La IgE sérica específica frente a aeroalérgenos comunes se determinará por un kit comercial de ImmunoCAP (Thermo Fisher Scientific, Uppsala, Suecia), siguiendo las instrucciones del comerciante. Se considerará positiva una determinación de CAP igual o superior a 0,35 KU/l
Pruebas de función pulmonarLa espirometría forzada será realizada y analizada según la normativa de la SEPAR27. Los valores de referencia utilizados serán los propuestos por Roca et al. para la población mediterránea28. La prueba broncodilatadora se realizará inhalando a través de una cámara expansora 2 inhalaciones de salbutamol (0,1 mg de β2-adrenérgico por inhalación), realizando una espirometría preinhalación y a los 15 min después de esta. Se considerará la prueba positiva cuando se constate un aumento del FEV1 o de la capacidad vital forzada superior a 200ml y que represente más de un 12% del basal29. El estudio de volúmenes pulmonares estáticos se realizará mediante pletismografía y la determinación del test de trasferencia del CO (DLCO) usando el método de respiración única. Estos estudios se realizaran mediante un equipo MasterLab (MasterLab, Jaegger, Alemania) siguiendo la normativa propuesta conjuntamente por la European Respiratory Society (ERS) y la American Thoracic Society (ATS)30,31.
Para determinar el grado de hiperrespuesta bronquial, se realizará una prueba de provocación bronquial inespecífica con metacolina según la normativa ERS/ATS32. Se considerará la prueba positiva cuando se objetive un descenso del FEV1 superior al 20% del valor basal. Si tras la administración de 5inhalaciones de la concentración de 16mg/ml no se observara dicho descenso, la prueba será considerada negativa33. El resultado de la prueba se expresará en forma de PC20 (concentración [mg/ml] de metacolina que produce un descenso del FEV1 del 20%).
Determinación de la fracción exhalada del óxido nítricoLa determinación de la FeNO se realizará usando un analizador de quimioluminiscencia (NiOx; Aerocrine; Solna, Suecia), siguiendo las directrices recientemente propuestas por la ATS34.:
Condesado de aire exhaladoEl condensado de aire exhalado (CAE) será recogido mediante un equipo EcoScreen (Erich JaeggerGmbH; Würzburg, Alemania), siguiendo las directrices establecidas por la ATS y la ERS35. En resumen, se realizará la prueba recomendando al paciente que no ingiera alimentos ni bebidas durante la hora previa a la realización de la prueba. El paciente deberá respirar a volumen corriente conectado al equipo hasta que se hayan recogido un total de 150 l de aire exhalado. Una vez obtenida la muestra, se procederá a realizar una medición del pH tras 10 min de burbujeo con helio. Se prepararán alícuotas de 0,5ml que serán conservadas a –80°C para futuros estudios de biomarcadores.
Esputo inducidoEl esputo será inducido mediante la inhalación durante 7 min de concentraciones crecientes de suero salino hipertónico (3, 4 y 5%) y será procesado y examinado tal como previamente ha estado descrito por Pizzichini et al.36. En todas las muestras de esputo se determinará el contenido celular cuantitativo de células totales y de los distintos tipos celulares. El sobrenadante será congelado a –80°C.
Muestras de sangre y orinaEn todos los individuos se recogerá una muestra de sangre total (10ml) para extracción de ADN, de plasma (10ml) y de orina. Estas muestras serán conservadas para futuros estudios sobre los determinantes genéticos y moleculares.
Tomografía axial computarizadaEn todos los individuos incluidos se realizará una TC torácica al inicio del estudio y posteriormente cada 5 años. En ella se estudiarán la presencia de bronquiolectasias (ratio bronquio/arteria mayor 1), la presencia de bronquiectasias (ratio bronquio arteria mayor de 1,5) y la presencia de bronquios con paredes engrosadas, y se realizará la medición de la pared bronquial del segmento apical del lóbulo superior derecho cerca de su origen (mm)37.
Almacenamiento de muestrasLas muestras de suero, ADN, orina, CAE y el sobrenadante del esputo serán almacenadas a –80° C en cada uno de los centros reclutadores de pacientes. Uno de los objetivos de la creación de la cohorte es disponer de un biobanco de muestras. CIBERES dispone de un biobanco en el cual serán incluidas estas muestras para su custodia y posterior utilización en futuros estudios de biomarcadores.
Consideraciones éticas y legalesEste estudio se ha diseñado siguiendo los principios de la Declaración de Helsinki (18th World Medical Assembly, 1964) y Hong Kong (1989). A cada paciente se le explicará el objetivo del estudio y se pedirá su consentimiento para participar en el mismo. Se les entregará una hoja explicativa acerca de la utilidad y el interés clínico del estudio, así como de los riesgos potenciales del mismo. El proyecto de investigación ha sido aprobado por el comité ético de investigación clínica de todos los hospitales participantes en el estudio de acuerdo con la Ley 15/1999 de Protección de Datos de Carácter Personal, la Ley de Investigación Biomédica 14/2007 y el Real Decreto 1716/2011 de desarrollo de la Ley de Investigación Biomédica.
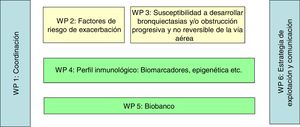
DiscusiónEl objetivo general de la creación de esta cohorte es contribuir a entender la heterogeneidad del asma. En este sentido, se desarrollarán estudios inmunológicos con los que se pretende conocer los mecanismos implicados que condicionan distintas manifestaciones clínicas en distintos individuos, estudios epigenéticos para conocer qué aspectos condicionan la aparición del asma, estudios para identificar los factores de riesgo de exacerbaciones y estudios para establecer qué pacientes son susceptibles de desarrollar bronquiectasias u obstrucción progresiva y no reversible de la vía aérea.
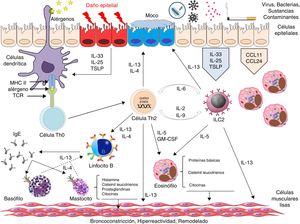
Sin duda, gran parte de la investigación actual en el asma está dirigida a establecer las vías inmunológicas que determinan, no solo los fenotipos y endotipos de la enfermedad, sino también la presencia de determinados biomarcadores que permitan realizar una medicina de precisión38. Si bien existe acuerdo en distinguir 3posibles respuestas inmunitarias en el desarrollo del asma, como son la respuesta inmunitaria tipo 2, la respuesta inmunitaria no tipo 2 y la respuesta inmunitaria mixta tipo Th2/Th1739, los mecanismos íntimos que las generan son, en gran parte, todavía desconocidos. La respuesta tipo 2 es la mejor conocida y en general engloba a aquellos pacientes asmáticos con inflamación eosinofílica40. En esta respuesta se distingue una vía claramente Th2 dirigida a la producción final de IgE específica y cuyas células efectoras fundamentales parecen ser el linfocito Th2 y las células plasmáticas. La IL-4, la IL-5 y la IL-13 son las principales citocinas involucradas41. Paralelamente, la respuesta tipo 2 también engloba a pacientes no atópicos cuya célula directora parece ser el linfocito T innato (ILC2) y la IL-5 la principal citocina efectora42. Ambas vías, previamente a su diferenciación, parecen tener citocinas comunes derivadas del epitelio bronquial, como son la IL-33, la IL-31, la IL-25 y la linfopoyetina estromal tímica, que son foco actual de estudio como posibles dianas terapéuticas43-45 (fig. 3). Se desconoce por qué esta segunda vía de perfil bajo Th2, aunque con inflamación eosinofílica marcada, se asocia a un asma más grave y de peor repuesta a los corticoides.
La respuesta inmunitaria no tipo 2, reconocida también como fenotipo de asma no eosinofílico10,46, parece englobar a pacientes con inflamación neutrofílica, dependiente de un mecanismo Th1747,48, pacientes con inflamación neutrofílica dependiente de una disregulación de la repuesta inmunitaria innata asociada a IL-1b o CXCR249 y a pacientes con inflamación neurogénica básicamente relacionada con los receptores RTPA150,51. Si bien este tipo de respuesta está siendo objeto de diferentes estudios, el papel que puedan desempeñar el factor de necrosis tumoral alfa, la IL-6, la IL-8 la IL-37, la IL-22 o la IL-9 está en discusión39.
Aunque se ha descrito a pacientes que comparten una respuesta mixta Th17/tipo 2, la relación entre ambas vías de respuesta es altamente compleja y poco conocida. En un modelo animal de dermatitis atópica, se ha observado que la IL-17 producida por las células T γ/o por las propias células Th17 en respuesta a un posible daño epitelial puede aumentar la producción de IL-4 e IL-13 de las células ILC2 y Th252. Paralelamente, la IL-4 y la IL-13 parece que pueden amplificar la respuesta Th17 mediante la regulación de la expresión de CD209a en células dendríticas en modelos murinos de esquistosomiasis53. Sin embargo, en modelos murinos de asma, la neutralización de IL-4 o IL-13 resulta en un aumento de células Th17 e inflamación neutrofílica, mientras que la neutralización de la IL-13 y la IL-17 evita la inflamación tanto eosinofílica como neutrofílica y la aparición de hiperrespuesta bronquial54. El mejor conocimiento de estas vías y sus posibles interacciones, a partir de los posibles resultados obtenidos de esta cohorte, puede revertir en una mejor selección de dianas terapéuticas o la implementación de tratamientos conjuntos, como podría ser el doble bloqueo Th2/Th17.
No existen dudas de que el asma es una enfermedad compleja en la que la combinación de factores genéticos y factores ambientales desempeña un papel determinante. Sin embargo, ni los factores genéticos55 ni los factores ambientales56 por sí mismos pueden explicar toda la variabilidad observada en estos pacientes. En este contexto, los estudios epigenéticos pueden contribuir a establecer interacciones genes-ambiente y ayudar a explicar el componente hereditario del asma57,58. Es conocido que mecanismos epigenéticos regulan tanto la expresión de citocinas importantes en la diferenciación de los linfocitos T como de determinados factores de transcripción59,60 y que estos, a su vez, pueden estar influidos por diferentes exposiciones ambientales61. Efectivamente, así, por ejemplo, la exposición a partículas diésel se ha asociado a metilación del ADN tanto en sangre periférica como en las células epiteliales de las vías aéreas y, junto con la exposición a hidrocarburos aromáticos policíclicos, a alteración de la función de las células Treg62,63. Aunque también se ha asociado la exposición a determinados alérgenos a cambios metilatorios del ADN en células epiteliales respiratorias62, apenas existen estudios que evalúen la influencia en cambios epigenéticos de exposiciones múltiples.
Resulta interesante también la interacción entre cambios en el microbioma y cambios epigenéticos. En este sentido, se ha descrito, en estudios epidemiológicos, una menor incidencia de asma en individuos con menor uso de antibióticos en edades precoces de la vida64 o en aquellos nacidos por vía vaginal en relación con niños nacidos por cesárea65. De hecho, existe una intensa relación entre la exposición a microorganismos y la susceptibilidad a presentar asma en fases tempranas de la vida. Son varios los autores que opinan que estas exposiciones precoces pueden condicionar la composición del microbioma del individuo y este, a su vez, generar cambios epigenéticos que conduzcan o no a una mayor susceptibilidad de presentar asma58. Si bien en esta cohorte no está previsto desarrollar de entrada estudios de microbioma, sí que se tendrán en cuenta estos múltiples factores que pueden condicionar cambios epigenéticos y, por tanto, ser responsables de la heterogeneidad del asma.
Existe también desconocimiento con relación a los factores que determinan las exacerbaciones en los pacientes asmáticos. En este sentido, se han involucrado factores como las infecciones respiratorias, sobre todo de origen vírico66-68, la exposición a alérgenos69, el hábito tabáquico70, la falta de adherencia al tratamiento71, la rinosinusitis72, la obesidad73, la intolerancia a fármacos antiinflamatorios no esteroideos74 o factores psicosociales75. Sin embargo, por ejemplo, es un hecho conocido que la sensibilización alergénica varía ampliamente en función de las condiciones ambientales y climáticas76. Así mismo, aunque las infecciones virales parecen ser uno de los mayores desencadenantes de exacerbaciones66-68, la interacción entre estas infecciones y la sensibilización alergénica con relación a una determinada respuesta inflamatoria bronquial no está bien estudiada. Además, tampoco existen estudios que relacionen determinados factores de exacerbación con distintos fenotipos de asma.
Si bien se ha establecido una relación entre el grado de control del asma y el riesgo de exacerbaciones77, existen evidencias de una disociación entre ambos hechos78, avaladas por la demostración de que en pacientes con asma controlada persisten la infamación y la hiperrespuesta bronquial79. Además, en los pacientes con asma grave difícilmente se logra el control de la enfermedad y el tratamiento va esencialmente dirigido a la evitación de las exacerbaciones3. En este sentido, se han propuesto diversos marcadores para intentar establecer el riesgo de presentar una exacerbación como, por ejemplo, el FEV1 o el número de exacerbaciones acontecidas durante el año previo80. Recientemente se ha desarrollado un índice clínico para predecir exacerbaciones81; sin embargo, ha sido definido a partir de análisis retrospectivos, no ha sido completamente validado y no incluye mediciones de aspectos infamatorios como, por ejemplo, el FeNO o el recuento de eosinófilos en esputo inducido, esenciales en esta enfermedad.
Finalmente, es un hecho conocido que algunos pacientes con asma desarrollan bronquiectasias82, mientras que en otros aparece una obstrucción fija de la vía aérea difícil de diferenciar de la que experimentan pacientes con enfermedad pulmonar obstructiva crónica83. Ambos factores condicionan un peor pronóstico de la enfermedad y un mayor consumo de recursos sanitarios84. Clásicamente, se ha asociado la aparición de estos eventos a aquellos pacientes con asma más grave o sin control de la enfermedad y que presentan un mayor número de exacerbaciones85,86; sin embargo, se desconoce qué determina que pacientes con similares características clínicas desarrollen o no estos eventos. Tampoco se conoce si formas menos graves de la enfermedad pueden experimentar esta mala evolución.
En conclusión, la generación de esta cohorte pretende, a partir de un trabajo nacional, prospectivo, multidisciplinar, con un amplio número de pacientes, intentar entender qué mecanismos moleculares influyen en las diferentes presentaciones clínicas de la enfermedad, si existen determinados factores que asociados a determinados mecanismos condicionan las exacerbaciones que presentan los pacientes con asma o la aparición de alteraciones bronquiales, ya sean en forma de bronquiectasias o de obstrucción fija y progresiva de la vía aérea. Así mismo, también se pretende establecer cambios epigenéticos que puedan ser susceptibles de prevención e intentar hallar biomarcadores que permitan determinar el tratamiento más efectivo para cada paciente.
FinanciaciónEstudio financiado por FIS PI15/0190 (Instituto de Salud Carlos III), Fondo Europeo de Desarrollo Regional (FEDER) y SANOFI. MJC es una investigadora financiada por el programa Miguel Servet del Instituto de Salud Carlos III (CP12/03101).
AutoríaTodods los autores del manuscrito han contribuido significativamente a la investigación, preparación, revisión y producción final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.