Introducción
El restablecimiento del flujo sanguíneo en la isquemia-reperfusión incrementa el daño de los tejidos iniciado durante el período isquémico y reproduce algunas de las características de la reacción tisular inflamatoria aguda, que se caracteriza por la infiltración de leucocitos polimorfonucleares (PMN)1. En consecuencia, la aparición de quimioatrayentes leucocitarios en los tejidos, especialmente quimiocinas, es un factor central en la patogenia del síndrome de isquemia-reperfusión y en la disfunción precoz no específica del injerto. Entre las citocinas quimiotácticas (quimiocinas), la interleucina-8 (IL-8) es el principal elemento de una amplia familia y muestra gran selectividad para movilizar el reclutamiento de los PMN desde la sangre periférica a los tejidos.
Por sus características estructurales, el intersticio pulmonar es el lugar donde se desarrollan los componentes fundamentales de la respuesta inflamatoria y el espacio donde se acumulan y activan los PMN neutrófilos, a juzgar por los resultados observados en distintos modelos de daño inflamatorio agudo2-4. Sin embargo, el macrófago alveolar es un elemento celular clave en el desencadenamiento de la respuesta. De este modo, se puede elaborar un esquema patogénico en el que el macrófago generaría factores quimiotácticos que reclutarían a los PMN tras adherirse y migrar a través de las células endoteliales, y éstos se concentrarían en el foco lesional, donde liberarían mediadores inflamatorios, responsables últimos del daño tisular. Estos hechos explican la aparición de daño tisular por isquemia-reperfusión en al menos el 25% de los receptores de trasplante pulmonar4,5.
La IL-8, identificada inicialmente como un quimioatrayente de los PMN, desencadena en estas células 3 respuestas fundamentales: cambios en la forma y migración transendotelial, desgranulación y activación oxidativa6. Por otra parte, la exposición celular a un estrés oxidativo como la isquemia-reperfusión conduce a la inducción de la producción local de IL-87. El esclarecimiento de la secuencia de producción y acción de la IL-8 durante la isquemia-reperfusión pulmonar podría ser de interés para conocer el mecanismo del desarrollo del daño tisular y su posible tratamiento.
Sobre estas bases, este estudio intenta determinar el patrón de producción de la IL-8 y su relación con la presencia de PMN durante la isquemia-reperfusión pulmonar, en un modelo experimental de isquemia-reperfusión pulmonar normotérmica.
Material y métodos
En razón de sus características anatomofisiológicas, las posibilidades de acceso, el coste y la infraestructura, y la experiencia de modelos experimentales previos, se eligió el conejo como animal de experimentación8-10. Se intervinieron quirúrgicamente 16 conejos blancos de raza Nueva Zelanda (rango: 2,5-4 kg) de acuerdo con las normas de un protocolo establecido. Los animales fueron tratados experimentalmente y sacrificados al final del experimento mediante sobredosis de barbitúricos siguiendo las disposiciones legales vigentes (Normativa de la Unión Europea 86/608/EECC y Real Decreto 223/1988).
Diseño experimental
La sedación e hipnosis de los animales se realizó mediante la administración de clorhidrato de ketamina vía intramuscular (30 mg/kg). Se administró una inyección complementaria de atropina (0,12 mg/kg) vía subcutánea. La anestesia general se obtuvo mediante la administración intravenosa de tiopental sódico (10 mg/kg) y bromuro de pancuronio (0,5 mg/kg). Colocado el animal en decúbito supino, se procedió a la realización de cervicotomía media y traqueotomía. El mantenimiento respiratorio intraoperatorio se llevó a cabo con ventilación mecánica (Engstrom Respiratory System 300; tipo ER 311; Engstrom, Bromma, Suecia), con fracción inspiratoria de oxígeno de 0,21 en aire inspirado (35 ml/kg/min) y frecuencia de 30 respiraciones/min. Se canuló la vena yugular interna como vía para la administración de medicación y medición de la presión venosa central. Se canuló la arteria carótida común contralateral para la medición continua de la presión arterial y realización de gasometrías arteriales en distintos momentos del experimento.
Se procedió a la realización de esternotomía media, liberación y separación del timo. Se abrieron ambas pleuras, para proceder a continuación al aislamiento de ambos hilios pulmonares y exclusión vascular y bronquial del lóbulo pulmonar supernumerario central. Se colocó un vessel-loop alrededor del hilio pulmonar derecho y complementariamente del de su lóbulo inferior para facilitar su control y ulterior interrupción. La anticoagulación total del animal se obtuvo mediante la administración de heparina sódica (1 mg/kg).
Isquemia-reperfusión pulmonar
Previa comprobación de la estabilización hemodinámica y respiratoria, se procedió a la realización de isquemia pulmonar derecha mediante la total interrupción bronquial y del flujo vascular pulmonar (bronquio principal, arteria y venas pulmonares y bronquiales). Complementariamente se practicó la interrupción del hilio del lóbulo inferior derecho. De este modo se hizo posible la determinación simultánea en el mismo animal de experimentación de los valores de ARN mensajero (ARNm) de IL-8 y de los hallazgos histológicos tras distintos tiempos: isquemia del lóbulo inferior (1, 2 y 3 h) e isquemia (1 h) y reperfusión (1, 2 y 3 h) de los lóbulos medio y superior.
Grupos de estudio
Para la consecución de los objetivos planteados, se establecieron 3 grupos de estudio:
Basal: extracción de tejido pulmonar sin inducción de isquemia-reperfusión (4 animales).
Isquemia: obtención de tejido pulmonar del lóbulo inferior derecho tras su isquemia de 1, 2 o 3 h (4 animales en cada tiempo del período isquémico).
Reperfusión: obtención de tejido pulmonar de los lóbulos superior y medio derechos tras 1 h de isquemia y 1, 2 o 3 h de reperfusión (4 animales en cada tiempo del período de reperfusión los mismos que en la isquemia).
Determinaciones
Se obtuvieron muestras de tejido pulmonar para estudio de la expresión del ARNm de IL-8 y determinación de los cambios histológicos de los animales en los distintos grupos. De cada muestra se separó un fragmento, que se conservó en formaldehído para el estudio histológico; los fragmentos pulmonares destinados a la determinación del ARNm de IL-8 se sumergieron de forma inmediata en nitrógeno líquido y se conservaron a temperatura constante de 80 ºC hasta su procesamiento.
Determinación de ARNm de IL-8. Para la extracción del ARN celular, el tejido pulmonar se fragmentó mecánicamente con un fragmentador mecánico tipo Polytron (Kinematica AG, Littan-Lucerna, Suiza) durante 30 s, a 4 ºC. El ARN total se extrajo con el método del guanidín-tiocianato. La primera hebra del ADN complementario se sintetizó a partir del ARN total mediante la técnica de la transcripción inversa. La mezcla de la reacción contenía 0,2 μg/μl de ARN total, 2,5 μl de H2O DEPC, 20 U del inhibidor de ribonucleasas RNasin, 4 μl de tampón 5 x, 2 μl de DTT 0,1 M, 4 μl de dNTP 2,5 mM, 1 μl de mezcla de hexanucleótidos 0,1 mM y 200 U de transcriptasa inversa del virus de leucemia de Moloney. La reacción se incubó durante 1 h a 37 ºC en un volumen de 20 μl. El ADN complementario se amplificó mediante reacción en cadena de la polimerasa en una mezcla de reacción que contenía 5 μl de la transcriptasa inversa, 14 μl de H2O, 2,5 μl de tampón 10 x, 0,75 μl de MgCl2 50 mM, 1,0 μl de dNTP 2,5 mM, 1,25 μl de cada cebador y 0,25 μl de Taq-ADN polimerasa 5 U/μl. Dicha solución (25 μl) se colocó en un termociclador. El programa de amplificación incluyó un ciclo de desnaturalización inicial a 94 ºC durante 5 min y 30 ciclos de amplificación: desnaturalización a 94 ºC durante 30 s, anillamiento (annealing) a 59 ºC durante 30 s, elongación a 62 ºC durante 30 s y extensión final a 72 ºC durante 7 min. Los productos de la reacción en cadena de la polimerasa se separaron por electroforesis en gel de agarosa y se cuantificaron por densitometría. La expresión de gliceraldehído-fosfato-deshidrogenasa (GADPH) se utilizó para confirmar la homogeneidad de la carga en las distintas calles y la normalización de los resultados.
Determinaciones histológicas. La existencia de infiltración alveolar de neutrófilos y macrófagos, exudación fibrinosa, infiltración septal, agregación intravascular de neutrófilos, edema y destrucción de la arquitectura pulmonar se investigó en todas las muestras. Su valoración se realizó en distintas áreas, y se desestimaron aquéllas compatibles con hallazgos catalogados como consecuencia de la manipulación quirúrgica del parénquima. Se efectuó el recuento celular por campo visual de 600 μm de diámetro con un microscopio Zeiss, utilizando un objetivo de x40. En las áreas que se consideraron válidas, el resultado estimado como definitivo fue la media porcentual de cada uno de los parámetros estudiados.
Análisis estadístico
Los datos se introdujeron para su estudio estadístico en una base de datos (SPSS versión 11.5). Para la comparación, entre los distintos grupos de estudio, de los valores de ARNm de IL-8 y del número de neutrófilos el análisis estadístico se realizó mediante el test no paramétrico de la U de Mann-Whitney, en razón del pequeño tamaño muestral de los grupos.
Resultados
Determinaciones de ARN mensajero de interleucina-8
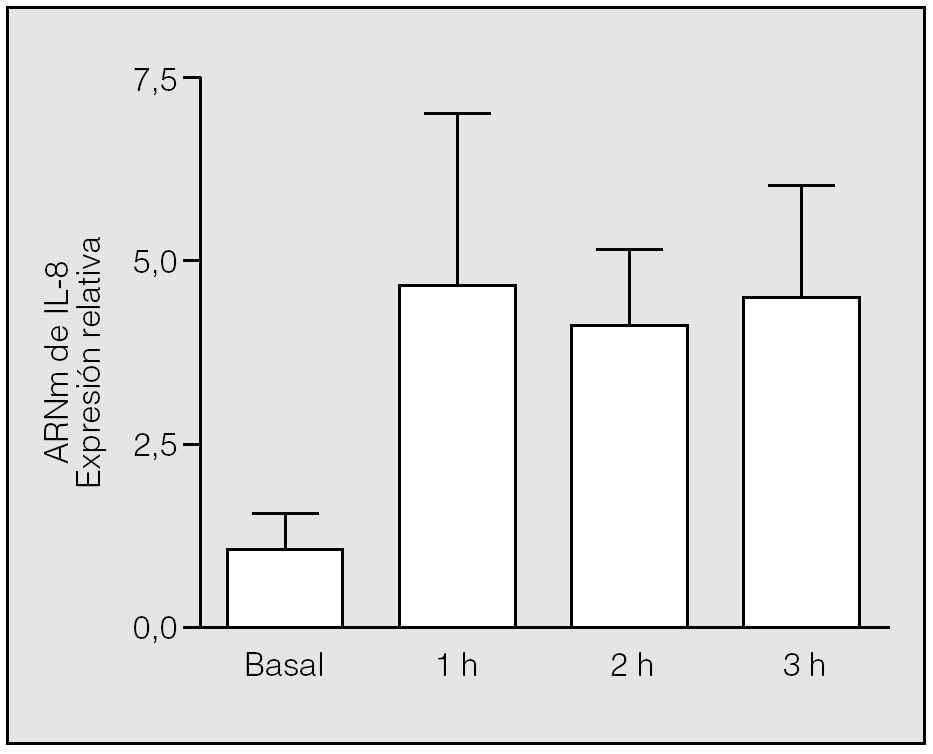
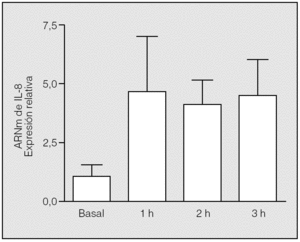
Se constató una elevación significativa (p = 0,0090) de los valores de ARNm de IL-8 al final de la primera hora de isquemia (valor medio ± desviación estándar: 4,75 ± 2,31) respecto a los basales (1 ± 0,57), y se mantuvo a lo largo de las 3 h de este período. No hubo diferencias estadísticamente significativas entre los valores del ARNm de IL-8 observados en los distintos momentos de la isquemia (segunda hora: 4,12 ± 1,02; tercera hora: 4,53 ± 1,56; p = 0,5637 y p = 0,3865, respectivamente) (fig. 1).
Fig. 1. Cambios de la expresión del ARN mensajero (ARNm) de interleucina-8 (IL-8) durante la isquemia. Las muestras de ARN se extrajeron de los pulmones de los conejos en tiempos distintos tras el inicio de la isquemia y se utilizaron para las reacciones de transcripción inversa-reacción en cadena de la polimerasa con cebadores diseñados según las secuencias de la IL-8 y la GADPH (gliceraldehído-fosfato-deshidrogenasa) de conejo. Los cambios en los distintos tiempos se expresan en relación con el valor basal, al que se asignó el valor 1. Se aprecian diferencias significativas entre la primera hora de la isquemia y el valor basal (p = 0,09), pero no entre los distintos períodos de la isquemia (p > 0,05).
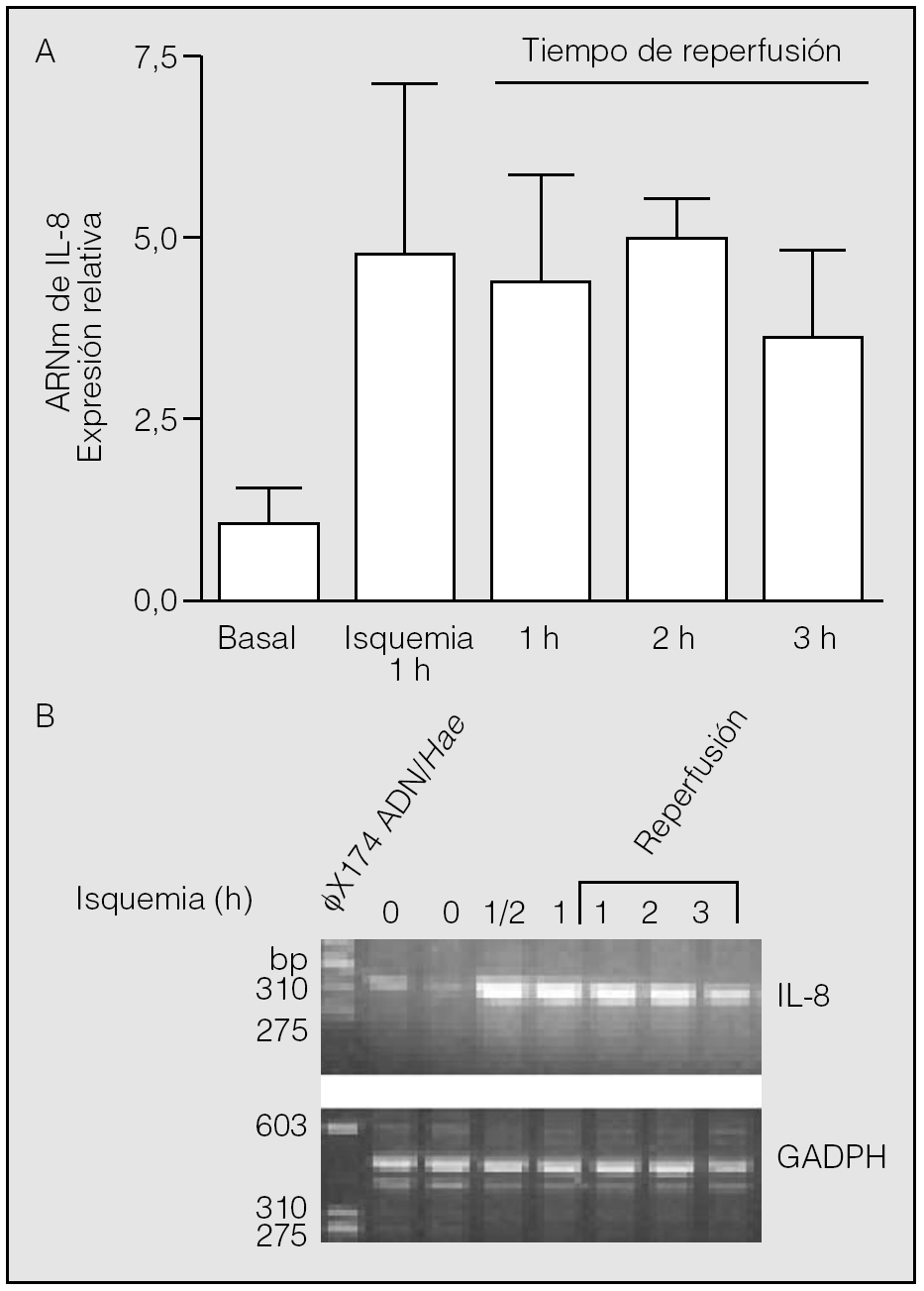
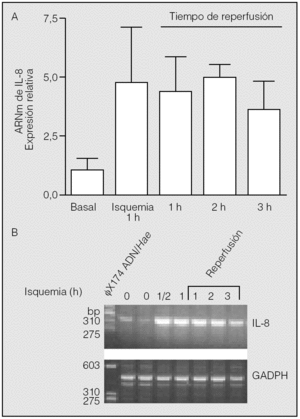
Transcurrida 1 h desde el inicio de la reperfusión, los valores de ARNm de IL-8 (4,42 ± 1,43) resultaron muy semejantes a los observados al final del período de isquemia (p > 0,05). Se constató una segunda elevación de los valores de ARNm de IL-8 al final de la segunda hora de reperfusión (4,97 ± 0,54), seguida de un ligero descenso en la tercera (3,63 ± 1,18). Sin embargo, no se observaron diferencias estadísticamente significativas entre los valores del ARNm de IL-8 hallados en la isquemia y los observados al final de la primera, segunda y tercera horas de la reperfusión (p > 0,05) (fig. 2).
Fig. 2. Expresión del ARN mensajero (ARNm) de la interleucina-8 (IL-8) durante la isquemia-reperfusión. Los pulmones de los animales se mantuvieron durante 1 h en isquemia y posteriormente se reperfundieron durante los períodos indicados. Al final de estos períodos se obtuvo tejido pulmonar para la extracción de ARN y reacciones de transcripción inversa-reacción en cadena de la polimerasa (RT-PCR). No se observan diferencias significativas entre los valores hallados al final de la isquemia y los períodos de reperfusión adicional (p > 0,05). El panel B muestra el resultado del análisis de los productos de las RT-PCR en un experimento típico. La calle de la izquierda muestra la posición de los marcadores de distinto número de pares de bases (bp). GADPH: gliceraldehído-fosfato-deshidrogenasa.
Determinaciones histológicas
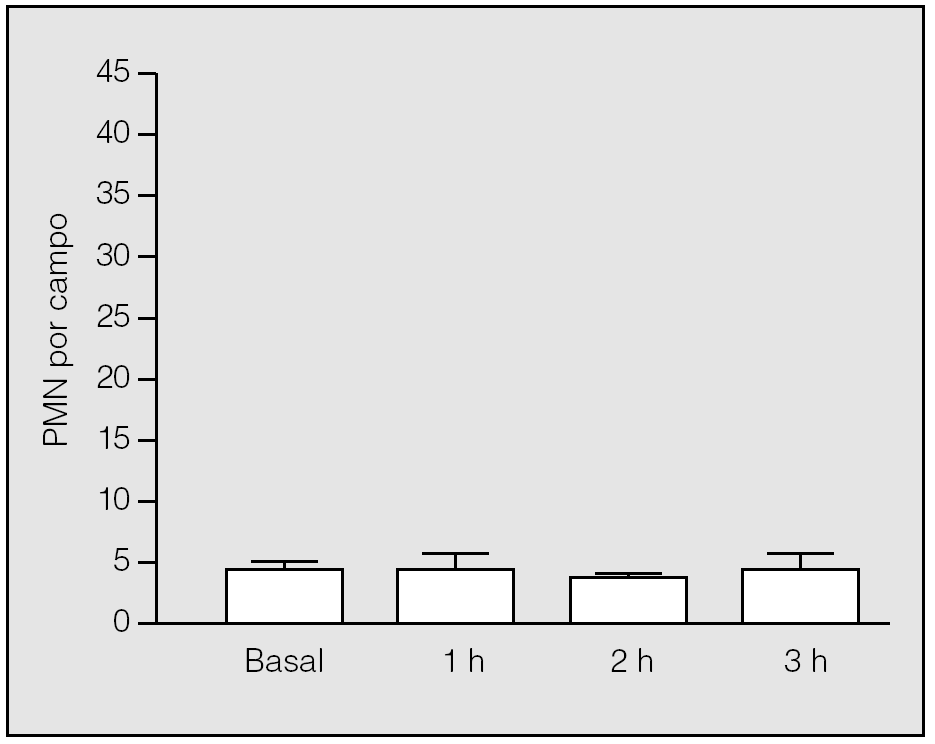
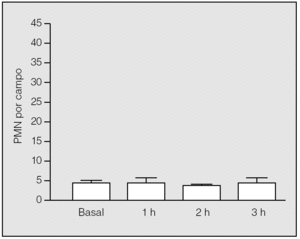
En el grupo basal, el análisis histológico de las muestras pulmonares evidenció un parénquima pulmonar estructurado, con tabiques interalveolares finos y sin edema ni células en el intersticio. La media de PMN y de macrófagos alveolares por campo fue de 3,8 ± 0,84 (rango: 3-5) (fig. 3) y 1,2 ± 0,84 (rango: 0-2), respectivamente.
Fig. 3. Recuento de polimorfonucleares (PMN) en el tejido pulmonar durante la isquemia. No hay diferencias significativas de su valor respecto al basal.
En el período de la isquemia pulmonar se observaron cambios microvasculares y mínima acumulación de PMN en el intersticio. No hubo diferencias significativas en el recuento de PMN entre el período basal y el período de isquemia, ni entre los valores observados al final de la primera, segunda y tercera horas de isquemia (3,75 ± 1,5; 3,33 ± 0,58, y 4 ± 1,41, respectivamente) (p > 0,05) (fig. 3). En lo que se refiere a los macrófagos, no se constataron diferencias significativas entre los observados en el grupo basal y los correspondientes al final de la primera, segunda y tercera horas de isquemia (3,75 ± 1,5; 1 ± 0,81, y 2,25 ± 2,63, respectivamente) (p > 0,05).
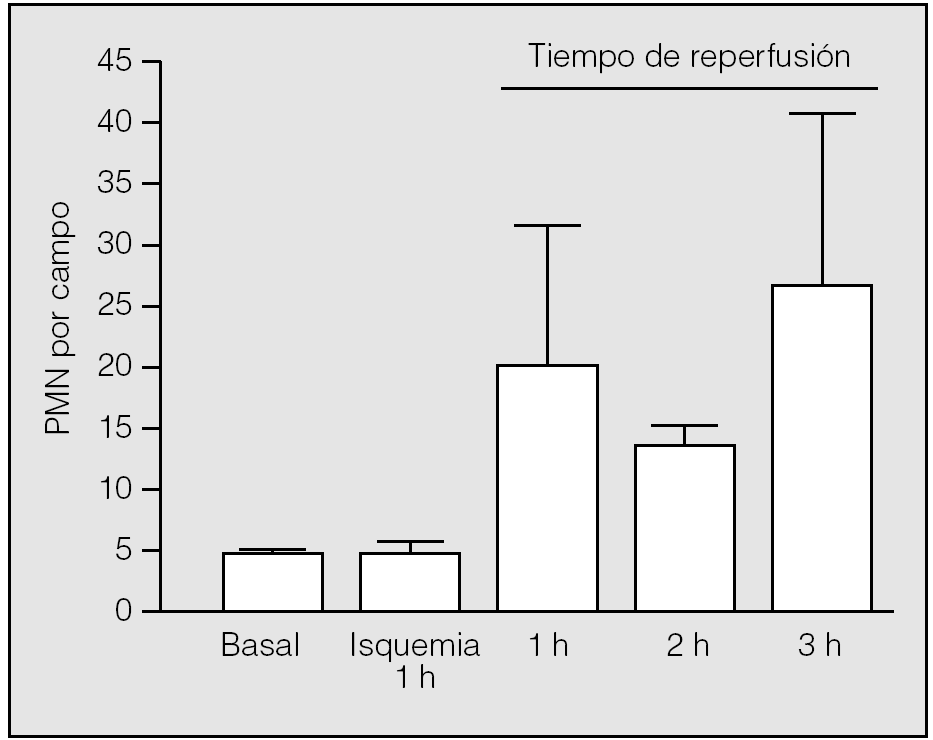
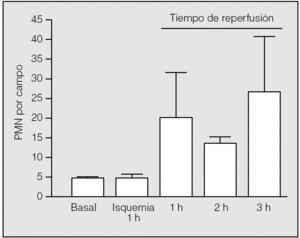
El inicio de la reperfusión se vio acompañado de un reclutamiento rápido de PMN en el intersticio pulmonar. Durante la primera hora de reperfusión su presencia aumentó hasta una media de 20,75 ± 10,87 PMN por campo (rango: 9-30), con diferencias significativas respecto al valor medio basal (p = 0,014) y el observado al final de la primera hora de isquemia (p = 0,018). En la segunda hora de reperfusión se apreció un leve descenso de su número (13 ± 2,65), pero manteniendo diferencias significativas respecto al valor basal (p = 0,013) y el observado al final de la primera hora de la isquemia (p = 0,017). En la tercera hora de reperfusión, tuvo lugar una nueva acumulación de leucocitos en el intersticio (26,75 ± 15,54); no obstante, no hubo diferencias significativas entre los valores medios de neutrófilos observados al final de la primera hora de reperfusión y los correspondientes observados al final de la segunda y tercera horas (p = 0,2454 y p = 0,6631, respectivamente) (fig. 4). Los macrófagos no presentan el mismo comportamiento: sus valores durante la reperfusión fueron muy similares a los observados en el período basal y durante la isquemia (primera hora: 3,25 ± 1,89; segunda hora: 1,25 ± 1,26; tercera hora: 3 ± 2,94).
Fig. 4. Recuento de polimorfonucleares (PMN) durante la isquemia-reperfusión. Se aprecian diferencias significativas entre la primera hora de isquemia y la primera hora de reperfusión (p = 0,018), pero no durante el resto del período de reperfusión.
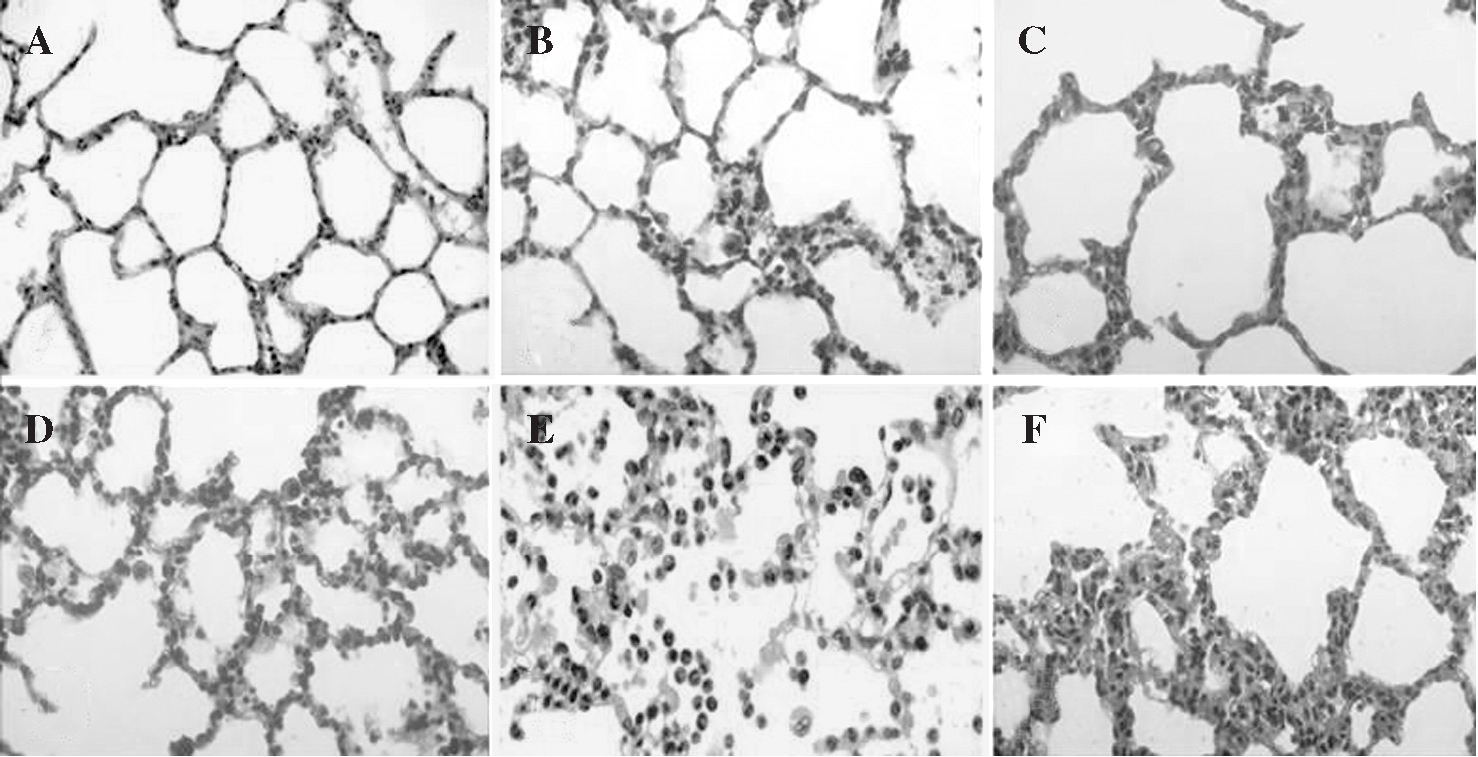
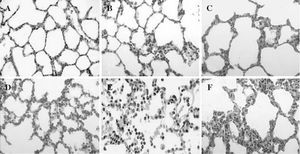
Durante el período de reperfusión, y en relación directa con su progreso en el tiempo, la presencia de engrosamiento de los tabiques interalveolares, congestión vascular y edema fueron hallazgos simultáneos al aumento de PMN en el intersticio. La formación de membranas hialinas se observó sólo en las fases más tardías de la reperfusión (fig. 5).
Fig. 5. Modificaciones histológicas del intersticio pulmonar:A)basal; B)tras 1 h de isquemia; C)tras 3 h de isquemia; D)tras 1 h de reperfusión;E)tras 2 h de reperfusión;F)tras 3 h de reperfusión. Se han elegido muestras significativas en las que se aprecia la aparición progresiva de edema intersticial e infiltración leucocitaria por polimorfonucleares.
Discusión
En los procesos inflamatorios agudos, los PMN infiltran los tejidos tras su adhesión a las células endoteliales siguiendo la señal de un gradiente de concentración de factores quimiotácticos. La reproducción de muchas características de la reacción inflamatoria aguda en la isquemia-reperfusión tisular ha motivado la investigación de la acción de distintos factores quimiotácticos en este proceso. Entre ellos, los más estudiados han sido las citocinas con capacidad quimioatrayente, como el factor de necrosis tumoral alfa (TNF-α), la IL-1 y la IL-8, o citocinas moduladoras negativas como la IL-10 e IL-12, y otros mediadores inflamatorios como el interferón gamma (IFN-γ) y el factor activador de las plaquetas. La IL-8, identificada inicialmente como un quimioatrayente de PMN, produce también cambios en su forma, migración transendotelial, desgranulación y activación oxidativa11. Tanto la determinación de la proteína como la de su ARNm se han estudiado en distintos procesos cirugía de la aorta abdominal12 y trasplante hepático13 en los que las consecuencias de la isquemia-reperfusión tisular adquieren singular importancia.
Puesto que el intersticio pulmonar, por sus características histológicas y estructurales, es el escenario de la reacción inflamatoria, su respuesta a distintos factores quimiotácticos se ha estudiado en distintos modelos de daño inflamatorio agudo2,3. El esclarecimiento de la secuencia de su producción es un factor determinante para ampliar el conocimiento del mecanismo de isquemia-reperfusión pulmonar y la producción del daño tisular.
Comúnmente se acepta que en la isquemia-reperfusión pulmonar el daño tisular inicia su expresión anatomopatológica y funcional tras el comienzo de la reperfusión. Este hecho hace que el problema fundamental de este mecanismo venga determinado por el inicio de la producción de los factores quimiotácticos y de su cinética de acción. Las observaciones realizadas por diversos autores en relación con las concentraciones de la IL-8 durante la isquemia muestran resultados dispares. Los resultados de los estudios experimentales de Sekido et al14 y Sakuma et al15 demuestran un incremento de la IL-8 tras isquemia pulmonar de 2 h; sin embargo, su incremento no fue en ningún caso significativo, ni tan siquiera tras la prolongación del período de isquemia durante 5 h14,15. Por el contrario, De Perrot et al16, en un estudio efectuado en el lavado broncoalveolar (LBA) de donantes de injerto pulmonar, demuestran una elevación significativa de IL-8 y, además, la de otros factores estudiados como el TNF-α, IFN-γ, IL-10, IL-12 e IL-18. Cuando la determinación de este factor se realizó mediante la medición de su ARNm, los resultados también parecieron confirmar su producción en el transcurso del período isquémico. En el ámbito clínico, Fisher et al17 observan en pulmones isquémicos de donantes humanos concentraciones de ARNm de IL-8 significativamente mayores que las halladas en los pulmones de sujetos sanos control. Metinko et al7 demuestran un incremento significativo de la IL-8 en el LBA de pulmones donantes tras isquemia tisular de 3, 6, 9 y 12 h, incremento que se correlaciona con un aumento paralelo en el tejido pulmonar de los valores de ARNm de IL-8 a los 30 y 90 min de isquemia.
En nuestro estudio, el daño producido por la isquemia se corresponde con una elevación significativa durante la primera hora de los valores de ARNm de IL-8 respecto a los basales. Estos valores permanecen elevados desde la primera hasta la tercera hora de isquemia, sin que se observen variaciones significativas durante las 3 h del período isquémico.
La repercusión tisular de la elevación de la IL-8 o su ARNm durante la isquemia ha sido también motivo de estudio. Recientes estudios experimentales demuestran que en el intersticio, tras períodos de isquemia pulmonar de 2 a 5 h, la elevación de este factor tan sólo se acompaña de mínimos cambios tisulares pulmonares14,18-20. En nuestra experiencia, el análisis histológico de las muestras basales evidencia un parénquima pulmonar estructurado, con tabiques interalveolares finos, sin edema y con un número muy escaso de PMN en el intersticio, hallazgos que no indican cambios significativos durante la totalidad del período de isquemia.
La mayor parte de los estudios experimentales realizados muestran un incremento continuo de la síntesis de la IL-8 durante la reperfusión, tanto en tejido pulmonar homogeneizado como en el LBA14. Experiencias clínicas como las del grupo de trasplante pulmonar de Toronto21 concluyen que las concentraciones de IL-8 tienden a incrementarse de forma gradual desde el inicio de la isquemia y posteriormente en la reperfusión; de manera simultánea, los valores de TNF-α, IFN-γ, IL-10, IL-12 e IL-18 se incrementan durante el período isquémico, pero disminuyen tras la reperfusión. Además, la correlación entre mortalidad por fracaso precoz del injerto e incremento de la expresión de estos factores sólo pudo establecerse para el incremento de IL-8 durante la isquemia y su progresión en la reperfusión16,17.
En nuestro estudio, el ARNm de IL-8 se mantiene durante la reperfusión en valores muy semejantes a los observados al final del período de isquemia. Dado su carácter precursor de la síntesis de IL-8, observamos durante la primera hora de reperfusión un discreto descenso de su valor, que se ve seguido ulteriormente de una ligera elevación al final de la segunda hora. A nuestro juicio, este hecho no hace sino poner de manifiesto la existencia de un mecanismo de retroalimentación negativo en la síntesis del mediador tras aumentar la de IL-8 o, alternativamente, la desaparición de la señal inductora.
En cuanto a los cambios histológicos que se han descrito en la reperfusión, la mayor parte de los autores14,16,17,19 coincide en la observación de un reclutamiento rápido de PMN en el intersticio pulmonar. Transcurridas 2 h desde el inicio de la reperfusión, se constató la infiltración moderada de neutrófilos y macrófagos en el intersticio y los alvéolos. En los estudios en los que se realizó además análisis del LBA, los hallazgos estuvieron en consonancia con los constatados histológicamente14.
En nuestra experiencia, durante la primera hora de reperfusión se produce una importante acumulación tisular de PMN. Durante la segunda hora se observa un ligero descenso del número de PMN, que se sigue de la producción de un infiltrado intenso de los septos interalveolares y agregados intravasculares de PMN al final de la tercera hora. No se observó un incremento significativo del número de macrófagos respecto al de los acumulados durante el período isquémico. La acumulación de PMN se acompaña de cambios en el intersticio pulmonar, como edema y engrosamiento de los tabiques interalveolares, congestión de los vasos pulmonares y presencia de membranas hialinas en las fases más tardías de la reperfusión. Estos hallazgos coinciden con los de otros estudios14,22 (incluidos aquellos en los que la determinación del número de PMN se realizó por otros métodos como la determinación de la actividad mieloperoxidasa22) y reafirman la idea de que en el daño tisular pulmonar por isquemia-reperfusión el reclutamiento celular intersticial es fundamentalmente de PMN. Los resultados de experiencias de isquemia-reperfusión tisular realizadas con sangre deplecionada de leucocitos15,18,20 demuestran que, en la magnitud del daño tisular, el papel de la infiltración intersticial por PMN resulta determinante.
Estos hallazgos ponen de manifiesto la importancia que la IL-8, como citocina quimioatrayente de PMN, tiene en el desarrollo del daño intersticial por isquemia-reperfusión. Las variaciones en su concentración a lo largo del proceso indican su producción durante el período isquémico y su progresión durante la reperfusión. La determinación del ARNm de IL-8 se muestra en nuestra experiencia como un marcador fidedigno de la producción de esta citocina que se correlaciona con los hallazgos patológicos.
Incluso en ausencia de cambios histológicos significativos, la elevación al final de la isquemia de los valores de la proteína y/o del ARNm de IL-8 en los alvéolos de los pulmones del donante se asocia con una pobre función inicial y con un incremento de la mortalidad precoz del receptor17. La posibilidad de determinar durante la isquemia un marcador pronóstico que prevea la ulterior presencia de daño tisular puede ser de gran valor a la hora de evitar el comienzo de ese daño. Como exponente de la producción de un potente mediador, el ARNm de IL-8 cumple esa condición.
En definitiva, ha podido demostrarse experimentalmente que la administración de anticuerpos específicos de IL-8 al inicio de la reperfusión pulmonar disminuye de forma notable el daño tisular14. Centrar la investigación en el donante y receptor, y en la cuantificación tisular del ARNm de IL-8 como precursor de esta citocina, y proseguir en la investigación de factores inhibidores de su acción podría contribuir a prevenir y mejorar tanto la función como el pronóstico a corto plazo del injerto pulmonar.
Estudio realizado con el apoyo científico y la financiación de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
Correspondencia: Dr. J.M. Matilla González.
Servicio de Cirugía Torácica. Hospital Clínico Universitario de Valladolid.
Ramón y Cajal, 3. 47005 Valladolid. España.
Correo electrónico: jmmatilla17@hotmail.com
Recibido: 16-8-2004; aceptado para su publicación: 24-10-2006.