Introducción
La sarcoidosis es una enfermedad granulomatosa multisistémica de causa desconocida con un amplio espectro de manifestaciones clínicas. Histopatológicamente se caracteriza por la presencia de granulomas no caseificantes que pueden aparecer en cualquier órgano, aunque su localización más frecuente son los pulmones y los ganglios linfáticos.
El curso natural de la enfermedad es muy variable y difícil de predecir1, existiendo desde casos asintomáticos hasta otros con evolución progresiva hacia la fibrosis pulmonar. Actualmente, a pesar de los avances en imagen y en las determinaciones del proceso inmunitario e inflamatorio que acontece en la sarcoidosis, siguen sin conocerse los factores pronósticos que permitan determinar, en el momento del diagnóstico, la gravedad de la enfermedad. La utilidad de la presentación radiológica de la sarcoidosis, según la clasificación de Siltzbach2, como marcador de actividad o pronóstico no está claramente demostrada3. Por otro lado, a pesar de que el análisis del lavado broncoalveolar (LBA) se usa sistemáticamente para el diagnóstico de la enfermedad, los estudios realizados para evaluar su valor como predictor del curso de la enfermedad ofrecen resultados variados y controvertidos4-9.
El objetivo de este estudio es evaluar si los distintos estadios radiológicos de la sarcoidosis pulmonar presentan un perfil celular característico en el LBA y determinar si el análisis celular del LBA aporta información sobre la evolución de la enfermedad a los 12 meses del diagnóstico.
Pacientes y métodos
Sujetos y protocolo de estudio
Se incluyó a 34 pacientes diagnosticados de sarcoidosis no tratados previamente con corticoides. El diagnóstico de sarcoidosis se obtuvo mediante confirmación histológica en pacientes con manifestaciones clinicorradiológicas compatibles10. En todos los pacientes se realizó una fibrobroncoscopia con toma de biopsia transbronquial y LBA. Los análisis microbiológicos para hongos y micobacterias del LBA excluyeron otras causas de inflamación granulomatosa. En los pacientes con biopsia transbronquial negativa el diagnóstico anatomopatológico se obtuvo mediante biopsia pulmonar, mediastinoscopia, biopsia ganglionar o biopsia de lesión cutánea.
En el momento del diagnóstico se recogieron los siguientes parámetros: edad, sexo, hábito tabáquico, estadio radiológico, cuestionario de síntomas, exploración funcional respiratoria, concentraciones séricas de la enzima de conversión de la angiotensina (ECA), calcemia, calciuria de 24 h y análisis celular del LBA.
Siguiendo la clasificación radiológica de Siltzbach2, se distinguieron 4 estadios radiológicos en el momento del diagnóstico: estadio 0 (sin afectación torácica), estadio I (adenopatías bihiliares), estadio II (adenopatías bihiliares e infiltrados pulmonares) y estadio III (infiltrados pulmonares sin adenopatías).
Para la evaluación de la enfermedad a los 12 meses se consideró la evolución de la función respiratoria y del control radiológico. Para la detección del deterioro de la función respiratoria se usaron los criterios definidos por Hunninghake et al11. Para la capacidad vital forzada (FVC) y el volumen espiratorio forzado en el primer segundo (FEV1) se consideró significativa una disminución de, al menos, un 15% respecto al valor inicial, y para la capacidad pulmonar total (TLC) y la capacidad de difusión del monóxido de carbono corregida por la hemoglobina y por el volumen alveolar (TLCOc/VA) una disminución de, al menos, un 10% del valor inicial obtenido. La evolución radiológica fue examinada por 2 experimentados lectores y, en caso de discordancia, se solicitó la opinión de un tercer lector. La radiografía a los 12 meses de seguimiento se categorizó de la siguiente forma: a) desaparición o mejoría de los hallazgos radiológicos; b) estabilización definida como ausencia de cambios radiológicos, y c) empeoramiento definido por un deterioro de la radiografía. Tras la valoración de la evolución radiológica y funcional de la enfermedad a los 12 meses del diagnóstico, se dividió a los pacientes en 3 grupos: grupo A (curación o mejoría), grupo B (estabilidad) y grupo C (empeoramiento).
El tratamiento con corticoides se instauró según criterio clínico.
Variables del estudio
Cuestionario de síntomas. Se recogieron los siguientes síntomas respiratorios: tos, expectoración, sibilantes y disnea. El grado de disnea se midó siguiendo la escala de disnea del Medical Research Council12.
Exploración funcional respiratoria y pruebas de imagen. Mediante espirometría se obtuvieron los valores de la FVC, FEV1 y la relación FEV1/FVC. La TLC se calculó mediante pletismografía corporal (Master Lab, Erich Jaeger, Wuerzburg, Alemania). La TLCOc/VA se obtuvo mediante el método de respiración única. Las pruebas de función pulmonar se realizaron siguiendo las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)13. Los resultados se expresaron como porcentaje del valor esperado. La gasometría arterial se realizó en reposo y respirando aire ambiente. En todos los pacientes se practicó una tomografía axial computarizada de alta resolución torácica al inicio y a los 12 meses para determinar la evolución radiológica.
Parámetros serológicos y urinarios. Se determinaron en suero las concentraciones de ECA y de calcio. En orina se obtuvo el valor de calcio en una muestra de 24 h.
Lavado broncoalveolar. Siguiendo la normativa SEPAR sobre la técnica del LBA14 se instilaron en la língula o lóbulo medio entre 120 y 200 ml de solución salina al 0,9% en alícuotas15 de 20-50 ml. Se determinaron la celularidad total mediante recuento en cámara de Neubauer y la distribución celular con tinción de May-Giemsa-Grünwald modificada (Diff-Quick®). El estudio de inmunofenotipos se realizó en muestras criopreservadas con el método avidina-biotina-peroxidasa usando anticuerpos monoclonales frente a CD4 y CD8 (Dako Cytomation). Se consideraron elevados valores de linfocitos mayores del 15%, de neutrófilos mayores del 3%, de eosinófilos mayores del 1% y relación CD4/CD8 mayor de 1,5. Estos valores se establecieron siguiendo los resultados de un estudio multicéntrico realizado en sujetos sanos16. Las subpoblaciones linfocitarias (CD4 y CD8) se determinaron en un subgrupo de pacientes con un porcentaje de linfocitos en el LBA mayor del 15%.
Análisis estadístico
Los resultados obtenidos se expresaron mediante la mediana o percentil 50 (P50) y rangos intercuartílicos (P25-P75) al no seguir las variables una distribución nomal. Las diferencias entre los estadios radiológicos y los grupos se obtuvieron mediante la prueba de la χ2 para las variables cualitativas y el test de Kruskal-Wallis para las variables cuantitativas. La correlación entre parámetros se obtuvo mediante el coeficiente de Spearman. Se utilizó para el análisis estadístico el programa estadístico SPSS (SPSS versión 12.0, Chicago, IL, EE.UU.) y se consideró significativo un valor igual o inferior a 0,05.
Resultados
De las características generales cabe destacar el predominio de mujeres (55,9%), una edad media de 44 años y un porcentaje de fumadores de un 52,9% (tabla I). En todos los pacientes se obtuvo confirmación histológica, en 24 de ellos mediante biopsia transbronquial, en 2 por mediastinoscopia, en 6 por biopsia pulmonar, en 1 por biopsia ganglionar y en 1 por biopsia de lesión cutánea.
Los síntomas respiratorios fueron los más frecuentes, con predominio de la tos (60%) y la disnea (48%). Como manifestaciones cutáneas, 3 pacientes presentaron eritema nudoso y uno lupus pernio. Un paciente comenzó con un síndrome confusional secundario a hipercalcemia que fue tratado con éxito. Ningún paciente presentó, durante los 12 meses de seguimiento, otras manifestaciones extratorácicas que pudieran influir en el curso de la enfermedad.
La mediana basal de la FVC, el FEV1, la TLC, la TLCOc/VA y la presión arterial de oxígeno estaba dentro de la normalidad. Los resultados de los parámetros del LBA figuran en la tabla I. En 3 pacientes el análisis del LBA estaba dentro de la normalidad.
En relación con el hábito tabáquico, en los pacientes no fumadores se obtuvo un porcentaje de linfocitos totales, de linfocitos CD4 y de cociente CD4/CD8 del LBA mayor que en los fumadores, aunque las diferencias no alcanzaron la significación estadística. En el resto de los parámetros del LBA tampoco se encontraron diferencias.
Las concentraciones de ECA estaban elevadas en un 93% de los pacientes. Al comparar los valores de la ECA con los parámetros del LBA, se obtuvo una correlación moderada con los linfocitos (r = 0,45; p = 0,03) y con los neutrófilos (r = 0,42; p = 0,04).
A 26 pacientes (76,4%) se les indicó tratamiento corticoide, 2 siguieron tratamiento broncodilatador por síntomas de hiperreactividad bronquial y 6 no siguieron ningún tratamiento. La media (± desviación estándar) de duración del tratamiento corticoide expresada en meses fue de 10,7 ± 2,8.
Estadios radiológicos
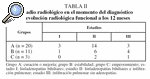
En el momento del diagnóstico, en un 64,7% (22/34) de los pacientes la enfermedad se presentó en estadio radiológico II, en un 11,7% (4/34) en estadio I y en un 23,6%(8/34) en estadio III.
No se hallaron diferencias estadísticas entre los estadios radiológicos en relación con la edad, el sexo o el hábito tabáquico (tabla I) ni en las pruebas de función pulmonar (FVC, FEV1, FEV1/FVC, TLC, TLCOc/VA y presión arterial de oxígeno). Las concentraciones de la ECA (tabla I) y la calcemia fueron mayores en el estadio II, mientras que la calciuria fue mayor en el estadio III, pero las diferencias no alcanzaron significación estadística. Al analizar las características del LBA, no se encontraron diferencias significativas entre estadios, pero destacaba un recuento porcentual de linfocitos mayor en el estadio radiológico I que en el resto de estadios (tabla I).
Evolución radiológica y funcional
A los 12 meses de seguimiento se curaron (grupo A) el 58,8% de los pacientes y empeoró el 8,8% (grupo C). Un 75% de los pacientes en estadio I, un 63,6% en estadio II y un 37,5% en estadio III presentaron remisión o curación de la enfermedad (tabla II). No se obtuvieron diferencias en la edad, sexo y hábito tabáquico entre los 3 grupos evolutivos, si bien el porcentaje de fumadores del grupo C fue mayor que en el resto (tabla III). Los parámetros funcionales estaban dentro de la normalidad excepto en el grupo C, en el que se observaron una hipoxemia leve y una relación FEV1/FVC disminuida, pero las diferencias no fueron significativas. En relación con el análisis celular del LBA, no se encontraron diferencias estadísticas entre los distintos grupos, aunque el porcentaje de linfocitos fue mayor en el grupo A. Las subpoblaciones linfocitarias se determinaron en un total de 22 sujetos (15 pacientes del grupo A, 6 pacientes del grupo B y 1 paciente del grupo C), sin que se observaran diferencias entre los grupos A y B (tabla III). Las concentraciones de ECA estaban más elevadas en el grupo A (p = 0,07) y las de calcio en suero y orina estaban ligeramente elevadas en el grupo B, pero las diferencias no fueron estadísticamente significativas.
Recibieron tratamiento corticoide 14 (70%) pacientes del grupo A, 9 (81,8%) del grupo B y 3 (100%) del grupo C. No se encontraron diferencias estadísticas en relación con la evolución entre los pacientes que recibieron tratamiento corticoide y los que no lo recibieron (p = 0,32). Por estadios radiológicos de presentación no se encontraron diferencias estadísticas en la evolución de los pacientes según hubieran recibido o no tratamiento con corticoides (estadio I, p = 0,24; estadio II, p = 0,75; estadio III, p = 0,80).
Discusión
En el presente estudio el recuento diferencial de las células y de las subpoblaciones linfocitarias en el LBA no mostró características diferenciales según estadios radiológicos en el momento del diagnóstico de la enfermedad, si bien, al analizar los resultados, cabe destacar en el estadio radiológico I un recuento porcentual de linfocitos mayor que en el resto de estadios. Este hallazgo indicaría la presencia de un daño en el parénquima pulmonar con expresión en el LBA en estadios en los que radiológicamente no se detecta alteración intersticial. La clasificación de la enfermedad basada en los hallazgos radiológicos no parece relacionarse con los resultados obtenidos en el análisis de los parámetros celulares del LBA y, por tanto, su utilidad de forma aislada en la valoración de la actividad de la enfermedad o en la toma de decisiones terapéuticas es limitada.
Por otro lado, en 3 pacientes el LBA fue normal, 2 de ellos estaban en estadio II y 1 en estadio III. Esto indica que, ante un paciente con clínica y radiología altamente indicativas de sarcoidosis, un LBA normal no excluye la posibilidad de presentar la enfermedad. Una posible explicación es que en estos casos exista un predominio de la fibrosis con una fase inflamatoria menos evidente y, por tanto, con escasa o nula expresión en el LBA.
Dado el efecto del tabaquismo sobre las poblaciones celulares del LBA, se estudiaron las diferencias entre la distribución celular y de las subpoblaciones y la influencia del hábito tabáquico. Nuestros resultados no difieren de los obtenidos por un estudio multicéntrico realizado en una gran población de sujetos sanos16.
En la evolución a los 12 meses destaca que, aunque un porcentaje elevado (91,2%) de pacientes se curaron o mejoraron, un 8,8% presentó una evolución progresiva. Estos resultados coinciden con los obtenidos en otros estudios y demuestran que, aunque la sarcoidosis es una enfermedad en general de buen pronóstico, entre un 10 y un 30% de los pacientes sigue un curso progresivo e irreversible hacia la fibrosis pulmonar17.
En la exploración funcional, en el grupo C se obtuvo una disminución del índice FEV1/FVC y una leve hipoxemia que podría estar relacionada con la presencia en este grupo de un porcentaje mayor de fumadores. Al analizar los parámetros del LBA, aunque el porcentaje de linfocitos fue ligeramente mayor en el grupo A, las diferencias obtenidas no fueron significativas.
En la bibliografía los datos publicados en relación con el valor pronóstico del análisis celular del LBA son muy dispares. Para algunos autores4, una linfocitosis elevada (> 28%) en pacientes no tratados se relacionaba con un deterioro de la función respiratoria durante los primeros 6 meses. Por el contrario, para Foley et al5 una linfocitosis inicial superior al 28% se acompañaba de una mejoría en la función pulmonar a los 2 años de seguimiento. En un trabajo reciente se observaba que los pacientes con un curso clínico favorable presentaban mayor linfocitosis18. Por último, otros autores6,19 coinciden en que el recuento celular de linfocitos en el momento del diagnóstico no predice el deterioro de la función respiratoria ni ayuda a predecir la respuesta al tratamiento.
También se ha evaluado la utilidad de las subpoblaciones linfocitarias como marcadores pronósticos. En este sentido los resultados también son dispares. Para algunos autores, los pacientes con un índice CD4/CD8 elevado presentaban deterioro de la enfermedad en relación con aquellos con un índice normal7. Para otros, ni el recuento de linfocitos ni el índice CD4/CD8 se relacionaban con el pronóstico de la enfermedad8.
Un estudio reciente concluye que el aumento del porcentaje de neutrófilos (> 3%) y eosinófilos (> 1%) se asocia a un mayor riesgo de necesitar tratamiento con corticoides9. Estos últimos resultados coinciden con los obtenidos por Drent et al20 al determinar que el número de neutrófilos permite diferenciar los pacientes con remisión de la enfermedad de aquellos con evolución grave. Estas conclusiones están en la línea de las obtenidas hace años por Lin et al21, que relacionaron el aumento de neutrófilos con un peor pronóstico.
Las discrepancias entre los resultados parecen estar relacionadas con las diferencias metodológicas de los trabajos y la heterogeneidad de la población estudiada22.
El pequeño tamaño de la muestra del presente estudio no nos permite establecer conclusiones definitivas sobre el valor pronóstico del LBA. Teniendo en cuenta estas consideraciones, se pueden, no obstante, realizar las siguientes observaciones: que la clasificación radiológica de la sarcoidosis, de forma aislada, parece tener actualmente una utilidad práctica limitada al no aportar información sobre la actividad de la enfermedad, y, por otro lado, que aunque el recuento celular del LBA ayuda al diagnóstico23 y permite determinar la intensidad de la respuesta inflamatoria en los pulmones, en el grupo de pacientes estudiados no parece predecir el curso evolutivo de la sarcoidosis durante los primeros 12 meses tras el diagnóstico. En relación con las subpoblaciones linfocitarias (CD4 y CD8) será necesario aumentar el número de pacientes de cada grupo para poder definir mejor su valor como marcador pronóstico.
Los avances en el conocimiento de la patogenia de la sarcoidosis pulmonar pueden permitir, en un futuro, la investigación de nuevos componentes solubles en el LBA cuya determinación como marcadores pronósticos ayudaría al manejo clínico de esta enfermedad y al desarrollo de nuevas estrategias terapéuticas.