Se examinó el efecto de un corticoesteroide inhalado, el propionato de fluticasona (PF), sobre la inflamación pulmonar de cobayas sensibilizados.
Material y métodosSe sensibilizó con ovoalbúmina (OA) a 4 grupos de cobayas (n=8). El grupo de control recibió soluciones similares sin OA. Durante un periodo de 18 días, un grupo sensibilizado fue tratado con 250μg de PF inhalado 2 veces al día durante la sensibilización; el otro grupo después de ella y los otros 2 grupos fueron tratados con placebo, uno durante la sensibilización y otro después de ella. A las 24h del último tratamiento, se examinaron las respuestas traqueales de todos los grupos de animales a metacolina y OA. También se examinaron el recuento total de leucocitos y la fórmula leucocitaria del líquido de lavado pulmonar y la anatomía patológica pulmonar.
ResultadosEn ambos grupos placebo la reactividad traqueal tanto a metacolina como a OA y el recuento de leucocitos fueron significativamente mayores que los del grupo de control (p<0,001 para todos los casos). En los grupos placebo se demostraron cambios anatomopatológicos variables de los pulmones (no significativos hasta p<0,001), comparado con los grupos de control. En los 2 grupos tratados con PF la reactividad traqueal tanto a metacolina como a OA disminuyó significativamente comparado con los grupos placebo (p<0,01 hasta p<0,001). El tratamiento con PF da lugar a una mejora del recuento de leucocitos (p<0,001) y de la fórmula leucocitaria (no significativo p<0,001) al igual que del desprendimiento mucoso (p<0,001), pero no otros cambios anatomopatológicos.
ConclusionesEstos resultados demuestran un efecto protector del PF sobre la reactividad traqueal y la inflamación pulmonar. Además, el presente estudio demostró que el tratamiento con propionato de fluticasona inhalado durante la sensibilización (desarrollo de inflamación y cambios anatomopatológicos) fue más eficaz que después de ella (establecimiento de inflamación y cambios anatomopatológicos).
The effect of an inhaled corticosteroid, fluticasone propionate (FP) lung inflammation of sensitized guinea pig was examined.
Material and methodsFour groups of guinea pigs (n=8) were sensitized (S) with ovalbumin (OA). Control group was given similar solutions without OA. One S group was treated with inhaled 250μg inhaled FP twice/day during, other group after sensitization for 18 days and two groups were treated with placebo, one during, and the other after sensitization. One day after the last treatment, tracheal responses of all animal groups to methacholine and OA were examined. Total and differential white blood cell (WBC) counts of lung lavage and lung pathology were also examined.
ResultsTracheal responsiveness to both methacholine and OA and WBC of both placebo groups were significantly higher than those of control group (P<0.001 for all cases). The lungs of placebo groups showed variable pathological changes (non significant to P<0.001) compared to control group. Tracheal responsiveness in two treated groups with FP to both methacholine and OA were significantly decreased compared to placebo groups (P<0.01 to P<0.001). Treatment with FP leads to improvement in total (P<0.001) and differential WBC counts (non significant to P<0.001) as well as mucosal detachment (P<0.001), but not other pathological changes.
ConclusionsThese results showed a protective effect of FP on tracheal responsiveness and lung inflammation. In addition, this study showed that treatment with inhaled fluticasone propionate, during sensitization (development of inflammation and pathological changes) was more effective than after sensitization (establishment of inflammation and pathological changes).
El asma es una enfermedad inflamatoria de las vías respiratorias1 y esta inflamación puede dar lugar a hiperreactividad de las vías respiratorias a muchos estímulos2. Se ha identificado una correlación directa entre la inflamación de las vías respiratorias, la hiperreactividad de las vías respiratorias y la gravedad de la enfermedad3. En la patogenia de esta inflamación en el asma participan numerosas células inflamatorias, incluidos los eosinófilos, mastocitos, macrófagos y neutrófilos4. Esta inflamación de las vías respiratorias provoca una obstrucción extensa pero variable del flujo aéreo que es reversible de manera espontánea o con el tratamiento. La esosinofilia de las vías respiratorias es el principal factor en el desarrollo de inflamación alérgica de las vías respiratorias5,6.
El asma también se caracteriza por una mayor reactividad de las vías respiratorias a diversos estímulos fisiológicos y ambientales, como el ejercicio, aire frío, ácaros del polvo y pelo de los animales. En esta enfermedad, una de las características anatomopatológicas predominantes es la dehiscencia de la capa epitelial y su desprendimiento en el líquido broncoalveolar7.
Los corticoesteroides son la piedra angular del tratamiento del asma. No obstante, diversas pruebas han demostrado que no mejoran esta patología o incluso que deterioran aún más las células epiteliales de las vías respiratorias8. En algunos estudios se ha demostrado que estos fármacos inducen una apoptosis del epitelio de las vías respiratorias y su denudación adicional y por lo tanto, el desprendimiento desde la membrana basal hasta el líquido de lavado pulmonar9 y por esta razón, este efecto es controvertido.
En el asma el epitelio de las vías respiratorias es una diana de los estímulos inflamatorios y físicos. En los estudios anatomopatológicos de pacientes con asma un hallazgo frecuente es la lesión del epitelio, incluso en los casos cuyo estado clínico es leve. Según lo demostrado en la biopsia endobronquial, se observa lesión epitelial en alrededor de la mitad de pacientes con asma leve y en casi todos aquellos con asma persistente9. Una de las características del remodelado crónico de las vías respiratorias y el sello distintivo del asma persistente, crónica, es el desprendimiento de las células epiteliales y la denudación de la mucosa de las vías respiratorias.
Los corticoesteroides pueden producir efectos inhibidores directos sobre muchas de las células que intervienen en la inflamación de las vías respiratorias en la enfermedad, incluidos los macrófagos, linfocitos T, eosinófilos y células epiteliales de las vías respiratorias10. En cultivos celulares, esta clase de fármacos disminuye la supervivencia de los eosinófilos mediada por citocinas estimulando la apoptosis. Este proceso podría explicar la disminución del número de estos leucocitos en la circulación y vías respiratorias de pacientes con asma durante el tratamiento con esta clase de fármacos, en particular la fracción de eosinófilos de baja densidad. Los corticoesteroides no inhiben la liberación de mediadores de las reacciones alérgicas a partir de los mastocitos, sino que reducen el número de estas células en las vías respiratorias. Además de sus efectos supresores sobre las células inflamatorias, estos fármacos también inhibirían la exudación de plasma y la secreción de moco en las vías respiratorias inflamadas10. También se ha demostrado la ausencia de efecto de los esteroides inhalados en la inflamación pulmonar y la reactividad de las vías respiratorias11.
En el presente estudio, se investigó el efecto de un corticoesteroide inhalado, el propionato de fluticasona (PF), durante y después de la sensibilización de cobayas, sobre los cambios anatomopatológicos del epitelio de las vías respiratorias y las propiedades fisiológicas de estas.
Material y métodosSensibilización de los animales y grupos de animalesLa sensibilización de los animales a OA se efectuó utilizando el método descrito por McCaig12,13. En pocas palabras, los cobayas se sensibilizaron a 10mg de OA (Sigma Chemical Ltd, Reino Unido) y 100mg de Al(OH)3 disueltos en 1ml de suero salino por vía intraperitoneal. Una semana más tarde, recibieron 1mg de OA y 100mg de Al(OH)3 disueltos en 1ml de suero salino por vía intraperitoneal como dosis de recuerdo. Desde el día 17, los animales se expusieron a una solución nebulizada de OA al 4% durante 18±1 día, cada día 4min. El grupo de control recibió soluciones similares sin OA.
El aerosol se administró en una cámara cerrada, cuyas dimensiones eran de 30×20×20cm. Los animales de control fueron tratados de forma similar pero se utilizó una solución de suero salino en lugar de OA. El estudio fue aprobado por el comité de investigación de la Mashad University of Medical Sciences.
El estudio se efectuó en 5 grupos diferentes de cobayas (n=8) del modo siguiente (tabla 1):
- •
Grupo de control (grupo C): recibió Al(OH)3 solo disuelto en 1ml de suero salino normal e inhaló un aerosol de agua en lugar de OA.
- •
Grupo A de tratamiento: animales sensibilizados con OA y Al(OH)3 y, tras un periodo de sensibilización con OA, tratados con 250μg de PF inhalado, 2 veces al día (GlaxoSmithKline Research Triangle, NC), durante 18 días (tratamiento A).
- •
Grupo B de tratamiento: animales sensibilizados con OA y Al(OH)3 y tratados con 250μg de PF inhalado, 2 veces al día, durante el periodo de provocación con OA, durante 18 días (tratamiento B).
- •
Grupo A placebo: animales sensibilizados con OA y Al(OH)3 y tratados con placebo inhalado (compuesto de GlaxoSmithKline Research Triangle, NC; CFC—libre de propelente HFA as4a; 1,1,1,2-tetrafluoroetano), tras el periodo de provocación con OA, durante 18 días (placebo A).
- •
Grupo B placebo: animales sensibilizados con OA y Al(OH)3 y tratados con placebo inhalado durante el periodo de provocación con OA durante 18 días (placebo B).
Vía de administración, período y dosis de las diferentes sustancias administradas en el grupo de control (C) y grupos tratados (T) con fluticasona y placebo (P) después (A) y durante (B) la sensibilización
| Grupos | Día 1 | Día 7 | Días 18–35 | Días 36–53 |
| Inyección IP | Inyección IP | Administración aerosol (4min/d) | ||
| C | Salino (1ml) | Salino (1ml) | Salino | |
| PA | OA (10mg) | OA (1mg) | OA (4%) | Placebo (2 veces al día) |
| TA | OA (10mg) | OA (1mg) | OA (4%) | PF (250μg 2 veces al día) |
| PB | OA (10mg) | OA (1mg) | OA (4%) | |
| Placebo (2 veces al día) | ||||
| TB | OA (10mg) | OA (1mg) | OA (4%) | |
| FP (250μg 2 veces al día) |
IP: intraperitoneal; OA: ovoalbúmina; PF: propionato de fluticasona. El placebo y PF se administraron a partir de un envase usando un espaciador modificado.
El PF y el placebo en aerosol se administraron con un envase de los usados normalmente a través de un espaciador modificado según lo descrito previamente14.
Preparaciones de tejidoSe sacrificó a los cobayas y se extrajo la tráquea. Cada órgano se cortó en 10 anillos (cada uno contenía 2–3 anillos cartilaginosos). Todos los anillos se abrieron en sentido contrario al músculo traqueal y se suturaron formando una cadena traqueal15.
Acto seguido, el tejido se suspendió en 20ml de baño de órgano (baño de órgano de Schuler tipo 809, March-Hugstetten, Alemania), que contenía una solución de Krebs-Henseliet constituida (mM) por: NaCl 120, NaHCO3 25, MgSO4 0,5, KH2PO4 1,2, KCl 4,72, CaCl2 2,5 y glucosa 11. La solución de Krebs se mantuvo a 37°C y se gaseó con un 95% de O2 y 5% de CO2. El tejido se suspendió bajo tensión isotónica de 1g y se permitió que se equilibrara durante al menos una hora al mismo tiempo que se lavaba con una solución de Krebs cada 15min.
Valoración de la respuesta traqueal a metacolinaEn cada experimento se obtuvo el log de las curvas de concentraciónrespuesta acumulativas de la contracción de la cadena traqueal inducida por hidrocloruro de metacolina (Sigma Chemical Ltd, Reino Unido). Cada 3min, se añadieron concentraciones consecutivas (incluidas 10−7–10−2M), registrándose la contracción debida a cada concentración al término de los 3min y el efecto alcanzó una meseta en todos los experimentos. Para obtener la curva, se representó gráficamente el porcentaje de contracción del músculo liso traqueal debido a cada concentración de metacolina en proporción a la contracción máxima obtenida por su concentración final frente al log de la concentración de metacolina.
Se determinó la concentración eficaz de metacolina que causó el 50% de la respuesta máxima (CE50) utilizando la curva de respuesta a metacolina en cada experimento. Además, la contractilidad del músculo traqueal obtenida mediante 100μM de metacolina se convirtió en gramos, de acuerdo con las instrucciones de calibración del transductor electrónico.
Determinación de la respuesta traqueal a ovoalbúminaLa respuesta traqueal de todos los animales a un 0,1% de solución de OA se determinó del modo siguiente: se añadieron 0,5ml de un 4% de solución de OA a 10ml del baño de órgano y se registró el grado de contracción de la cadena traqueal después de 15min y, acto seguido, se expresó como proporción (en porcentaje) a la contracción obtenida mediante 10μM de metacolina.
Todos los experimentos se efectuaron aleatoriamente con un periodo de reposo de una hora de las cadenas traqueales entre cada 2 experimentos mientras cada 15min se lavaron los tejidos con una solución de Krebs. En todos los experimentos las contracciones se determinaron usando un transductor isotónico (Harvard APP LTD, 50-6360 SINO 0210) usando un programa informático mediante registro en un ordenador (modelo Acer n.° G781).
Lavado pulmonar y recuento de leucocitosCoincidiendo con la preparación de la cadena traqueal, la cánula se localizó en un bronquio y el otro bronquio se pinzó para impedir la manipulación de las células epiteliales.
Los pulmones se lavaron con 5ml de suero salino 4 veces (total de 10ml). Se tiñó 1ml de líquido de lavado broncoalveolar (LBA) con solución de Turk y se efectuó un recuento por duplicado en un hemocitómetro (en una cámara de Burker). La solución de Turk consistió en 1ml de ácido acético glacial, 1ml de solución de violeta de genciana al 1% y 100ml de agua destilada.
El LBA restante se centrifugó a 2.500×g a 4°C durante 10min. Se eliminó el sobrenadante. La extensión se preparó a partir de las células y se tiñó con Wright-Giemsa. De acuerdo con los criterios de tinción y morfológicos, el análisis de la fórmula leucocitaria se efectuó con microscopio óptico mediante el recuento de 400 células y el cálculo del porcentaje. El recuento de leucocitos se efectuó mediante cámara de Neubauer utilizando LBA no centrifugado y tinción TORC.
Valoración anatomopatológicaDespués de los exámenes de LBA, se extrajeron los pulmones con la tráquea residual y se introdujeron en una solución de formol neutralizada al 10% (37%, Merck, Alemania). Al cabo de 7 días, se secaron los tejidos mediante pases a través de alcohol al 70–100% y se lavaron mediante pases a través de xilol. Se prepararon bloques de parafina de los tejidos y las muestras se cortaron en secciones de 4μm y se tiñeron con hematoxilinaeosina. Los tejidos se examinaron con microscopio óptico.
Análisis estadísticoPara evaluar la eficacia del tratamiento en cada grupo, se calculó la mejoría porcentual del modo siguiente: los datos obtenidos en el grupo de tratamiento menos los datos obtenido en el grupo placebo correspondiente divididos por los datos obtenidos en el mismo grupo placebo, multiplicado por 100. En los casos los datos obtenidos en el grupo de tratamiento fueron mayores que el grupo placebo correspondiente (es decir, [(tratamientoA1−placeboA1)/placeboA1]100). En los casos, los datos del tratamiento fueron más bajos que el correspondiente placebo, los datos obtenidos en el grupo placebo menos los datos obtenidos en el grupo de tratamiento correspondiente divididos por los datos obtenidos en el mismo grupo de tratamiento, multiplicados por 100 (es decir, [(placeboA1−tratamientoA1)/tratamientoA1]100).
Los datos obtenidos para la respuesta traqueal a metacolina (CE50) y OA, contractilidad traqueal, fórmula leucocitaria y puntuación anatomopatológica del pulmón se documentaron como media±EEM. La distribución normal de los datos se examinó utilizando la prueba de Kolmogorov y Smirnov. Los datos de los grupos placebo y grupos tratados se compararon con el grupo de control utilizando la prueba de la t para muestras independientes. Las diferencias de la mejora en los diferentes parámetros también se examinaron utilizando una prueba de la t para muestras independientes. La comparación de los datos entre los 2 grupos de tratamiento y los 2 grupos placebo se efectuó utilizando un análisis de la varianza de 2 vías (ANOVA) con una prueba post hoc de Bonferroni. Como nivel de significación se aceptó un valor de p<0,05. Todos los análisis estadísticos se efectuaron utilizando el programa Prism.
ResultadosHistologíaSe incluyeron los cambios anatomopatológicos del pulmón de los grupos sensibilizados: desprendimiento epitelial, regeneración epitelial, tapón e inflamación mucosos, que se puntuaron del modo siguiente: sin cambios patológicos=0; cambios dispersos=0,5; cambios locales=1; cambios graves (en la mayoría de regiones del pulmón)=2.
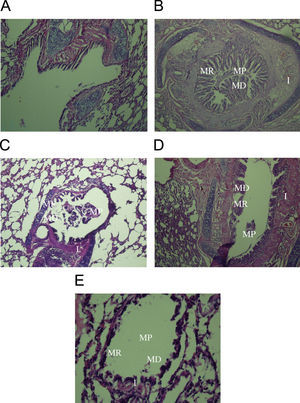
Con respecto a esta puntuación, los cambios anatomopatológicos en el grupo placebo A, incluido el desprendimiento de la mucosa y el tapón mucoso, fueron significativamente mayores que en el grupo control, (p<0,001 para ambos casos), pero la regeneración mucosa e inflamación no fueron significativamente mayores que en el grupo de control. Los cambios anatomopatológicos en el grupo placebo B, incluido el desprendimiento mucoso, regeneración mucosa, inflamación y tapón mucoso, fueron significativamente mayores que en el grupo de control (p<0,05–p<0,001) (fig. 1 y tablas 2 y 3).
A) Fotografías de las muestras de pulmón del grupo de control. B) Grupo placebo A. C) Grupo placebo B. D) Grupo de tratamiento A. E) Grupo de tratamiento B. En las fotografías de ambos grupos placebo son evidentes el desprendimiento mucoso (DM), regeneración mucosa (RM), inflamación (I), incluida la infiltración de eosinófilos y otras células inflamatorias y tapón mucoso (TM). El desprendimiento mucoso se redujo significativamente en ambos grupos de tratamiento. No obstante, otros cambios anatomopatológicos no mejoraron significativamente con el tratamiento PF. DM: desprendimiento mucoso; RM: regeneración mucosa; TM: tapón mucoso; I: inflamación (magnificación 10×10).
Valores medios±EEM del desprendimiento mucoso, regeneración mucosa, inflamación y tapón mucoso en el grupo de control (C) y grupos tratados (T) con fluticasona y placebo (P) después (A) y durante (B) la sensibilización y diferencias significativas entre ambos grupos placebo y de tratamiento (n=8, para cada grupo)
| Parámetros | C | PA | PB | TA | TB |
| Desprendimiento mucoso | 0,07±0,07 | 1,57±0,20+++ | 1,85±0,14+++ | 0,28±0,18* | 0,14±0,14* |
| Regeneración mucosa | 1,00±0,3 | 1,14±0,26 | 1,85±0,14a | 0,85±0,26 | 1,14±0,34 |
| Inflamación | 0,42±0,2 | 0,92±0,07 | 1,71±0,18+++b | 0,71±0,18 | 1,28±0,18+ |
| Tapón mucoso | 0,42±0,2 | 2,14±0,14+++ | 1,85±0,14+++ | 1,57±0,29++ | 1,71±0,18++ |
Los cambios anatomopatológicos en el pulmón del grupo sensibilizado incluyeron: desprendimiento epitelial, regeneración epitelial, tapón mucoso e inflamación que se puntuaron del modo siguiente: sin cambios patológicos=0; cambios dispersos=0,5; cambios locales=1; cambios graves (en la mayoría de regiones del pulmón)=2. Los datos de los grupos placebo y tratados se compararon con el grupo de control mediante una prueba de la t para datos independientes. La comparación de los datos entre los 2 grupos de tratamiento y los 2 de placebo se efectuó utilizando un análisis de la varianza de 2 vías (ANOVA) con una prueba post hoc de Bonferroni.
Diferencia significativa entre los datos del grupo de control frente a los otros grupos: +p<0,05; ++p<0,01; +++p<0,001.
Diferencias significativas entre los datos de cada grupo tratado con propionato de fluticasona frente al correspondiente grupo placebo sensibilizado: *p<0,001.
Diferencia significativa entre los datos de los 2 grupos placebo: ap<0,5, bp<0,01.
Diferencias en la mejora de las respuestas traqueales a metacolina y OA, recuento total de leucocitos y formula leucocitaria en líquido de lavado broncoalveolar y cambios anatomopatológicos en los 2 grupos de tratamiento A y B
| Parámetros | TA | TB | Valor de p |
| Desprendimiento mucoso | 85,71±9,22 | 92,85±7,14 | NS |
| Regeneración mucosa | 28,57±18,44 | 57,14±17,00 | NS |
| Inflamación | 42,85±20,20 | 50,00±10,91 | NS |
| Tapón mucoso | 25,71±14,45 | 21,42±10,10 | NS |
| CE50 | 154,14±21,83 | 288,33±132,00 | NS |
| OVA | 36,71±7,61 | 63,28±9,28 | <0,05 |
| Contractilidad (mg) | 103,33±10,07 | 119,85±24,04 | NS |
| Recuento total de leucocitos | 32,87±2,24 | 56,57±3,44 | <0,001 |
| Eosinófilos % | 49,28±6,44 | 73,28±5,32 | <0,01 |
| Neutrófilos % | 150±55 | 100±56 | NS |
| Monocitos % | 93,14±25,81 | 80,71±45,41 | NS |
| Linfocitos % | 84,85±10,48 | 24,28±3,8 | <0,001 |
NS: no significativo.
Los valores se documentan como media±EEM. Se obtuvieron las mejoras porcentuales siguientes: en los casos, los datos del tratamiento fueron mayores que el correspondiente placebo -los datos obtenidos en el grupo de tratamiento menos los datos obtenidos en el correspondiente grupo placebo dividido por los datos obtenido en el mismo grupo placebo, multiplicado por 100 (es decir, [(tratamientoA1−placeboA1)/placeboA1]100). En los casos, los datos del tratamiento fueron menores que el correspondiente placebo -los datos obtenidos en el grupo placebo menos los datos obtenidos en el correspondiente grupo de tratamiento dividido por los datos obtenidos en el mismo grupo de tratamiento, multiplicado por 100 (es decir, [(placeboA1−tratamientoA1)/tratamientoA1]100). La comparación de los datos entre ambos grupos de tratamiento se efectuó usando una prueba de la t para datos independientes.
El tratamiento con PF mejoró significativamente el desprendimiento mucoso en los grupos A y B de tratamiento comparado con los correspondientes grupos placebo (p<0,001). Sin embargo, el tratamiento con PF no mejoró significativamente los otros cambios anatomopatológicos (fig. 1 y tablas 2 y 3).
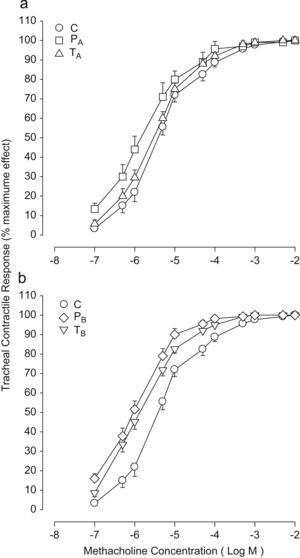
Respuesta traqueal a metacolinaEn ambos grupos placebo las curvas de concentraciónrespuesta a metacolina mostraron una desviación a la izquierda comparado con las curvas del grupo de control. Sin embargo, las curvas de ambos grupos tratados mostraron una desviación a la derecha, comparado con los correspondientes grupos placebo (fig. 2).
Log de las curvas de concentraciónrespuesta acumulativas de la contracción inducida por metacolina de la tráquea aislada en el grupo de control (C) y grupos tratados (T) con fluticasona y placebo (P) después (a) y durante (b) la sensibilización (n=8, para cada grupo). En ambos grupos placebo las curvas de concentraciónrespuesta a metacolina mostraron una desviación a la izquierda en comparación con la curva del grupo de control. No obstante, las curvas de ambos grupos tratados se desviaron a la derecha en comparación con los correspondientes grupos placebo. 1) Respuesta contráctil de la tráquea (% de efecto máximo) 2) Concentración de metacolina (log M).
En las cadenas traqueales del grupo placebo A y las del grupo placebo B el valor medio de CE50 fue significativamente más bajo que el del grupo de control (p<0,001 para ambos grupos placebo) (tabla 4). En las cadenas traqueales del grupo de tratamiento tanto A como B, los valores medios de CE50 fueron significativamente mayores que los de los correspondientes grupos placebo (p<0,001 para ambos casos). No obstante, en las cadenas traqueales de ambos grupos de tratamiento los valores medios de CE50 siguieron siendo significativamente más bajos que los del grupo de control (p<0,001 para ambos casos) (tabla 4).
Valores medios±EEM de la reactividad traqueal a metacolina, ovalbúmina (OA) y contractilidad traqueal en el grupo de control (C) y grupos tratados (T) con fluticasona y placebo (P) después (A) y durante (B) la sensibilización y diferencias significativas entre los 2 grupos placebo y de tratamiento (n=8, para cada grupo)
| Parámetros | C | PA | PB | TA | TB |
| CE50 (μmol) | 4,85±0,35 | 0,87±0,12+++ | 0,46±0,11+++a | 2,1±0,19+++* | 1,48±0,18+++★** |
| OA (%) | 21,98±2,73 | 57,7±1,39+++ | 97,85±6,44+++b | 36,14±2,63++* | 70,7±3,9+++★★** |
| Contractilidad (g) | 0,11±0,03 | 0,38±0,04+++ | 0,48±0,02+++c | 0,20±0,01+* | 0,23±0,02++* |
La reactividad traqueal a metacolina se determinó mediante la concentración de metacolina que causó el 50% de la respuesta máxima (CE50). La reactividad traqueal a OA se determinó mediante contracción porcentual obtenida con una solución del 0,1% de OA comparado con 10μM de metacolina. La contractilidad del músculo traqueal se determinó mediante 100μM de metacolina. Los datos de los grupos placebo y tratados se compararon con el grupo de control mediante una prueba de la t para datos independientes. La comparación de los datos de los 2 grupos de tratamiento y los 2 grupos placebo se efectuó con un análisis de la varianza de 2 vías (ANOVA) con una prueba post hoc de Bonferroni.Diferencia significativa entre los datos del grupo de control frente a los otros grupos: +p<0,05, ++p<0,01, +++p<0,001.
Diferencias significativas entre los datos de cada grupo tratado con propionato de fluticasona frente al correspondiente grupo placebo sensibilizado: *p<0,001.
Diferencia significativa entre los datos de los 2 grupos placebo: bp<0,001; cp<0,5,
Diferencias significativas entre los datos de los 2 grupos tratados: ★★p<0,001.
En el protocolo de tratamiento A la mejora de la reactividad traqueal a metacolina (CE50) no fue significativamente peor que la del protocolo de tratamiento B (tabla 3).
ContractilidadEn el grupo placebo A y en el grupo placebo B, la respuesta de contractilidad de las cadenas traqueales a 100μM de metacolina fue significativamente mayor que la del grupo de control (p<0,001 para ambos grupos placebo) (tabla 4). En el grupo de tratamiento A y en el B las respuestas de contractilidad mejoraron significativamente comparado con las de los correspondientes grupos placebo (p<0,001 para ambos casos) (tabla 4). Sin embargo, se detectaron diferencias significativas en las respuestas de contractilidad entre ambos grupos de tratamiento A o B y también entre ambos grupos de control (p<0,05 y p<0,01, respectivamente) (tabla 4).
El valor absoluto de la contractilidad traqueal a metacolina en el grupo placebo B fue significativamente mayor comparado con el del grupo placebo A (p<0,05) (tabla 4). En el protocolo de tratamiento A la mejora de la respuesta de contractilidad traqueal a 100μM de metacolina fue significativamente peor que en el protocolo de tratamiento B (tabla 3).
Respuesta traqueal a ovoalbúminaLa respuesta traqueal a OA en el grupo placebo A y B fue significativamente mayor que en el grupo de control (p<0,001 para ambos grupos placebo) (tabla 4). En el grupo de tratamiento A y grupo de tratamiento B las respuestas traqueales a OA fueron significativamente peores que las de los correspondientes grupos placebo (p<0,001 y p<0,01, respectivamente) (tabla 4). Sin embargo, las respuestas traqueales de ambos grupos de tratamiento a OA siguieron siendo significativamente mayores que en el grupo de control (p<0,01 para el grupo de tratamiento A y p<0,001 para el grupo de tratamiento B) (tabla 4).
Los valores absolutos de la respuesta traqueal a OA en el grupo placebo B fueron significativamente mayores, comparado con el grupo placebo A (p<0,001) (tabla 4). La mejora de la reactividad traqueal a la OA en el protocolo de tratamiento A fue significativamente peor que la del protocolo de tratamiento B (p<0,05) (tabla 3).
Recuento de leucocitosLos valores medios del recuento de leucocitos en LBA tanto del grupo placebo A como B fueron significativamente mayores que los del grupo de control (p<0,001 para ambos grupos placebo) (tabla 5). En el grupo de tratamiento A y B el número total de leucocitos mejoró significativamente comparado con el de los correspondientes grupos placebo (p<0,001 para ambos grupos de tratamiento) (tabla 5). Sin embargo, en ambos grupos de tratamiento los valores medios del recuento siguieron siendo significativamente mayores que en el grupo de control (p<0,001 para ambos grupos de tratamiento) (tabla 5).
Valores medios±EEM del recuento total (n.° de leucocitos en 1ml) y formula leucocitaria (porcentaje de cada tipo de célula) de leucocitos en líquido de lavado broncoalveolar en el grupo de control (C) y grupos tratados (T) con fluticasona y placebo (P) después (A) y durante (B) la sensibilización y diferencias significativas entre los 2 grupos placebo y de tratamiento (n=8, para cada grupo)
| Parámetros | C | PA | PB | TA | TB |
| Recuento total de leucocitos | 378±34,32 | 2.228±60,6+++ | 2.964,28±168,93+++a | 700±40,82+++** | 1.642±73,54+++★★** |
| Eosinófilos | 8,85±1,43 | 36±2,65+++ | 54,71±3,7+++a | 16,85±1,43+** | 40,28±3,69+++★★* |
| Neutrófilos | 5,14±0,63 | 1,85±0,26+++ | 0,71±0,28+++b | 2,71±0,68++ | 2,00±0,65+++ |
| Linfocitos | 60,14±3,65 | 44±5,23+ | 36,7±4,07+++ | 36,71±3,8+++ | 9,42±1,71+++★★ |
| Monocitos | 7,57±0,65 | 5,42±0,65+ | 2,14±0,67+++c | 3,85±0,5++ | 1,42±0,61+++★ |
Los datos de los grupos placebo y grupos tratados se compararon con el grupo de control utilizando la prueba de la t para datos independientes. La comparación de los datos entre los 2 grupos de tratamiento y los 2 grupos placebo se efectuó utilizando un análisis de la varianza (ANOVA) de 2 vías con una prueba post hoc de Bonferroni.
Diferencia significativa entre los datos del grupo de control frente a los otros grupos: +p<0,05, ++p<0,01, +++p<0,001.
Diferencias significativas entre los datos de cada grupo tratado con propionato de fluticasona frente al correspondiente grupo placebo sensibilizado: *p<0,01, **p<0,001.
Diferencia significativa entre los datos de los 2 grupos placebo: ap<0,001, bp<0,01, cp<0,5.
Diferencias significativas entre los datos de los 2 grupos tratados: ★p<0,05, ★★p<0,001.
En el l del grupo placebo B el valor absoluto del recuento de leucocitos fue significativamente mayor comparado con el grupo placebo A (p<0,001) (tabla 5). En el protocolo de tratamiento A la mejora del recuento de leucocitos en LBA fue significativamente mayor que la del protocolo de tratamiento B (p<0,001) (tabla 3).
Fórmula leucocitaria de leucocitos en líquido de lavado broncoalveolarSe identificó una disminución significativa del porcentaje de neutrófilos, linfocitos y monolitos, pero un aumento significativo del porcentaje de eosinófilos en LBA de ambos grupos placebo comparado con el grupo de control (p<0,05–p<0,001) (tabla 5). El tratamiento con PF disminuyó significativamente el porcentaje de eosinófilos en ambos grupos de tratamiento comparado con los de los grupos placebo (p<0,001 para el grupo de tratamiento A y p<0,01 para el grupo de tratamiento B) (tabla 5). En el grupo de tratamiento B, comparado con el grupo placebo B hubo una diferencia significativa en el porcentaje de linfocitos (p<0,001) (tabla 5). Sin embargo, siguieron detectándose diferencias significativas en el porcentaje de eosinófilos, neutrófilos, linfocitos y monocitos entre los grupos de tratamiento y los grupos de control (p<0,05–p<0,001) (tabla 5).
Los valores absolutos del porcentaje de eosinófilos en el grupo placebo B fueron significativamente mayores comparado con el grupo placebo A (p<0,001). Los valores absolutos de los porcentajes de monocitos en el grupo placebo A fueron mayores comparado con el grupo placebo B (p<0,01) (tabla 5).
Los valores medios de la mejora del porcentaje de eosinófilos en LBA del protocolo de tratamiento A fueron significativamente mayores que los del protocolo B (p<0,05) (tabla 3). En LBA en el protocolo de tratamiento A el valor medio de la mejora del porcentaje de linfocitos fue significativamente menor que el del protocolo de tratamiento B (p<0,001) (tabla 3).
DiscusiónEn el presente estudio, se examinó el efecto de la administración de un corticoesteroide inhalado, el PF, en 2 protocolos de tratamiento sobre reactividad traqueal a metacolina y OA, recuento de leucocitos y fórmula leucocitaria del líquido de LBA y los cambios anatomopatológicos del epitelio de las vías respiratorias de cobayas sensibilizados.
Los resultados demostraron una mayor respuesta traqueal a metacolina y OA, un aumento de la respuesta de contractilidad, un aumento del recuento de leucocitos y porcentaje de eosinófilos, pero una disminución de los porcentajes de neutrófilos, linfocitos y monocitos en LBA de animales sensibilizados comparados con los de control. La evaluación histológica de los tejidos pulmonares también demostró un aumento del desprendimiento mucoso, regeneración mucosa, inflamación de las vías respiratorias y tapón mucoso en animales sensibilizados, que fueron similares a los resultados descritos en los estudios previos16. Además, El-Mezayen demostró que la respuesta inflamatoria se caracterizó por un aumento del número de células inflamatorias y concentración de citocinas Th2 en el líquido de LBA, eosinofilia de las vías respiratorias e hiperplasia de las células caliciformes. Además, estas observaciones coinciden con algunos estudios realizados previamente que, en modelos murinos de asma atópica, revelaron que los eosinófilos, linfocitos, neutrófilos y monocitos invadían los tejidos pulmonares tras sensibilización17,18.
La principal característica anatomopatológica de los pacientes asmáticos es la inflamación de las vías respiratorias y todos los fármacos profilácticos administrados en el tratamiento de esta enfermedad tratan de reducir este fenómeno.
Además, el aumento de la producción de moco por las células caliciformes del epitelio de las vías respiratorias y el aumento de los valores séricos de IgE e IgG1 se asocian con inflamación de las vías respiratorias y asma. Kopf (1993), Cohn (1998) y Zhu (1999) implicaron la IL-4 y la IL-13 en la inducción de un cambio de isotipo de la IgE en los linfocitos B y un aumento de la secreción de moco en las vías respiratorias por las células caliciformes19–21. Por lo tanto, en el presente estudio, la reducción de los linfocitos podría originarse del aumento del número de linfocitos B. En los modelos experimentales de asma estudiados más ampliamente, los linfocitos son reclutados en las vías respiratorias y activados como respuesta a la inhalación de alérgenos específicos22.
En la presente investigación, se administró PF durante y después de la inducción de inflamación de las vías respiratorias con una provocación con alérgeno y fue eficaz en la prevención del desarrollo de inflamación de las vías respiratorias en ambos protocolos de tratamiento. En los estudios previos23,24 también se administró PF durante la inducción de una respuesta inflamatoria, pero Vanacker lo administró durante y después de la inducción de inflamación25.
En el presente estudio también se evaluaron los efectos del tratamiento con PF sobre los cambios anatomopatológicos del epitelio de las vías respiratorias. El tratamiento con el corticosteroide inhibió el desprendimiento mucoso adicional; sin embargo, en el epitelio de las vías respiratorias de los animales tratados no pudo invertir por completo este fenómeno. El tratamiento no inhibió eficazmente la regeneración mucosa, inflamación y secreción mucosa. Aunque la dosis administrada fue comparable o incluso más alta que las dosis terapéuticas administradas en el ser humano (2 inhalaciones de 250μg/día), podría deberse a la insuficiencia del tratamiento (duración o dosis) o a los efectos apoptóticos de esta clase de fármacos sobre el epitelio de las vías respiratorias. Esto fue coherente con los hallazgos del estudio de Vanacker, en el que 0,1mg de PF carecieron de efectos cuantificables sobre los cambios inflamatorios o estructurales, como la hiperplasia de las células caliciformes y el engrosamiento de la pared de las vías respiratorias25. El aumento de la inflamación eosinófila en el líquido de LBA y en la mucosa de las vías respiratorias, al igual que el aumento del depósito de fibronectina inducidos por el alérgeno , fue inhibido mediante el tratamiento con PF a partir de una dosis de 1mg en adelante. La inhibición de la hiperplasia de células caliciformes y el engrosamiento de la pared de las vías respiratorias requirió 10mg de PF inhalado. Con esta dosis, también se observaron efectos sistémicos25. No obstante, entre los 2 protocolos de tratamiento, las diferencias en las mejoras porcentuales de todos los cambios anatomopatológicos no respaldan significativamente que la mejora de estos cambios en los animales sensibilizados tratados se deba exclusivamente al efecto del tratamiento con PF. Algunos estudios también demostraron que los corticoesteroides causan apoptosis en el epitelio de las vías respiratorias, su denudación adicional y por consiguiente, su desprendimiento desde la membrana basal al líquido de lavado pulmonar26.
El efecto profiláctico del PF sobre la reactividad traqueal de animales sensibilizados podría deberse a su efecto supresor sobre la inflamación de las vías respiratorias. Respalda esta conclusión el efecto antiinflamatorio de todos los corticoesteroides, en particular el PF, sobre la reactividad de las vías respiratorias, células inflamatorias del líquido de LBA y cambios anatomopatológicos pulmonares de cobayas sensibilizados. No obstante, en algunos estudios el PF no atenuó la hiperreactividad bronquial inducida por alérgeno , a pesar de inhibir los eosinófilos y linfocitos T de las vías respiratorias y la hiperplasia de las células caliciformes23.
En el líquido de LBA de ambos grupos tratados con PF mejoró el recuento total de leucocitos y los porcentajes de eosinófilos y neutrófilos en comparación con el de animales sensibilizados no tratados. Se ha demostrado que los corticoesteroides inhiben la apoptosis de los neutrófilos de un modo dependiente de la concentración. Además, los corticoesteroides aumentan ligeramente el efecto inhibidor del factor estimulador de colonias de granulocitos-macrófagos sobre la apoptosis de los neutrófilos. Los datos del presente estudio sugieren que el PF prolonga la supervivencia de los neutrófilos humanos inhibiendo la apoptosis a concentraciones clínicamente pertinentes a través de un efecto sobre el receptor glucocorticoide27. Sin embargo, el tratamiento con PF da lugar a una reducción adicional del porcentaje de monocitos y linfocitos en LBA de ambos grupos de tratamiento. Los linfocitos T desempeñan un papel esencial en la inflamación de las vías respiratorias observada en el asma. Su acumulación en el lugar de inflamación se relaciona con un aumento del reclutamiento a partir de la sangre periférica y una supervivencia prolongada. La apoptosis celular es uno de los mecanismos implicados en el control de la homeostasia de los linfocitos T, que provoca la deleción de los linfocitos T autorreactivos. En los estudios in vitro se ha demostrado que el PF podría inducir la apoptosis de los linfocitos en cultivo28. También se ha demostrado que los corticoesteroides reducen el reclutamiento de monocitos en las vías respiratorias29.
Los cambios de los eosinófilos observados en los animales sensibilizados tratados con placebo y PF están respaldados por los estudios que demuestran un aumento de los eosinófilos en el líquido de LBA de cobayas sensibilizados y una reducción en el porcentaje de eosinófilos en LBA y células dendríticas pulmonares en animales sensibilizados tratados con PF comparado con el grupo no tratado sensibilizado30.
Todos los parámetros en el grupo placebo B (animales sensibilizados tratados con placebo inhalado durante la sensibilización, PB) fueron mayores que en el grupo placebo A (animales sensibilizados tratados con placebo inhalado después de la sensibilización, PA), lo que demuestra una mayor sensibilización de PB comparado con PA, que quizás se debe a un periodo libre de alérgeno en PA. Los datos disponibles en la actualidad sugieren que la prevención de alérgenos, incluida la evitación de los alérgenos inhalados, alérgenos alimentarios y humo del tabaco, solo atenuaría los síntomas de asma, es decir, las exacerbaciones, sibilancias e hiperreactividad bronquial31. De forma similar, en el estudio efectuado por Vanacker, tras la interrupción de la exposición a OA durante 2 semanas, el recuento total de leucocitos y la fórmula leucocitaria en LBA recuperaron los valores de control en animales tanto tratados con PF como con placebo25. Sin embargo, en su estudio, al término del intervalo libre de alérgeno de 2 semanas, los animales expuestos a OA mantuvieron una mayor reactividad de las vías respiratorias al carbacol en comparación con el grupo de control25. Los datos del presente estudio también demostraron que, aunque en el grupo placebo con un periodo libre de alérgeno (PA) mejoraron todos los parámetros incluida la reactividad traqueal, siguieron siendo significativamente diferentes de los del grupo de control.
Las mejoras porcentuales de todos lo parámetros excepto el recuento total de leucocitos, eosinófilos y desprendimiento mucoso en el grupo de tratamiento B (animales sensibilizados tratados con PF inhalado durante la sensibilización, TB) fueron mayores que las del grupo de tratamiento A (animales sensibilizados tratados con PF inhalado tras sensibilización, TA), incluida la regeneración mucosa, inflamación, neutrófilos, monocitos y linfocitos. En la mayoría de parámetros del grupo de tratamiento B la causa de la mayor mejora quizás se debe a la administración de PF durante la sensibilización. Estos hallazgos destacan la importancia de administrar un tratamiento antiinflamatorio lo antes posible en pacientes asmáticos. Dichos datos están respaldados por los estudios que demuestran que el tratamiento precoz de la inflamación de las vías respiratorias podría modificar el pronóstico del asma a través de la prevención de la pérdida permanente de la función pulmonar o incluso induciendo una remisión en algunos pacientes32. Sin embargo, la mejora del recuento total de leucocitos, porcentaje de eosinófilos y desprendimiento mucoso en el grupo TA fue mayor en comparación con el grupo TB. Estos hallazgos sugieren que el PF inhalado podría afectar principalmente a la inflamación de las vías respiratorias (reducción del recuento de leucocitos, eosinófilos y desprendimiento mucoso) más que a la reactividad traqueal. La causa del menor grado de mejora de estos datos en el grupo TB posiblemente se debe al mayor cambio producido en este grupo.
En conclusión, los resultados del presente estudio demuestran un efecto protector del PF sobre la reactividad traqueal, inflamación pulmonar y desprendimiento mucoso de los animales sensibilizados. Además, el presente estudio demostró que el tratamiento con un corticoesteroide inhalado, el PF, durante la sensibilización (desarrollo de la inflamación y de los cambios anatomopatológicos) fue más eficaz que después de ella (establecimiento de la inflamación y de los cambios anatomopatológicos). Por lo tanto, los resultados destacan que el tratamiento corticoesteroide debe iniciarse lo antes posible tras el desarrollo de la inflamación de las vías respiratorias de pacientes asmáticos. También indican la importancia de obtener un entorno sin alérgenos en el tratamiento de esta enfermedad. Por lo tanto, en pacientes asmáticos, es preciso investigar con más atención el efecto de un entorno sin alérgenos y de un tratamiento antiinflamatorio precoz y ha de considerarse en el tratamiento de esta frecuente enfermedad. También sería interesante examinar el efecto de la administración de PF durante la sensibilización y determinar los diferentes parámetros tras un cierto periodo de tiempo para estudiar con más precisión el entorno sin alérgenos. Un estudio con un periodo de tratamiento más prolongado también podría dar lugar a un efecto terapéutico más sustancial sobre los diferentes parámetros.
El presente estudio se financió a través del Research Department de la Mashhad University of Medical Sciences.