La investigación de los mecanismos de enfermedad del asma y la identificación de nuevas dianas terapéuticas requieren modelos animales experimentales. En este trabajo presentamos los datos del desarrollo de un modelo murino de asma experimental que permite valorar de forma conjunta parámetros de inflamación y remodelación de las vías respiratorias mediante morfología cuantitativa.
Material y métodosSe sensibilizó a ovoalbúmina a ratones Balb/c y se les realizó broncoprovocación con ovoalbúmina o excipiente 3 veces por semana durante 12 semanas.
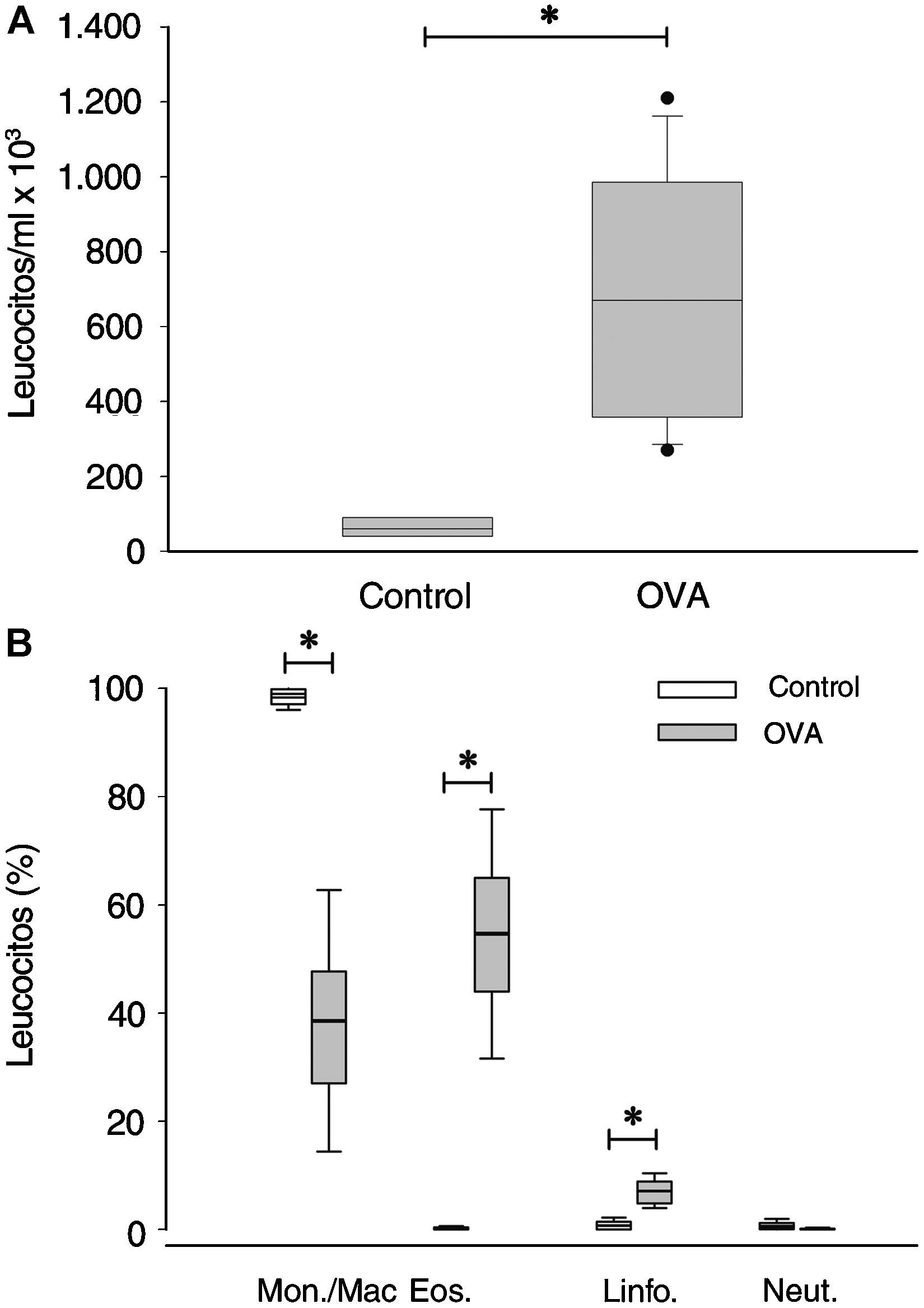
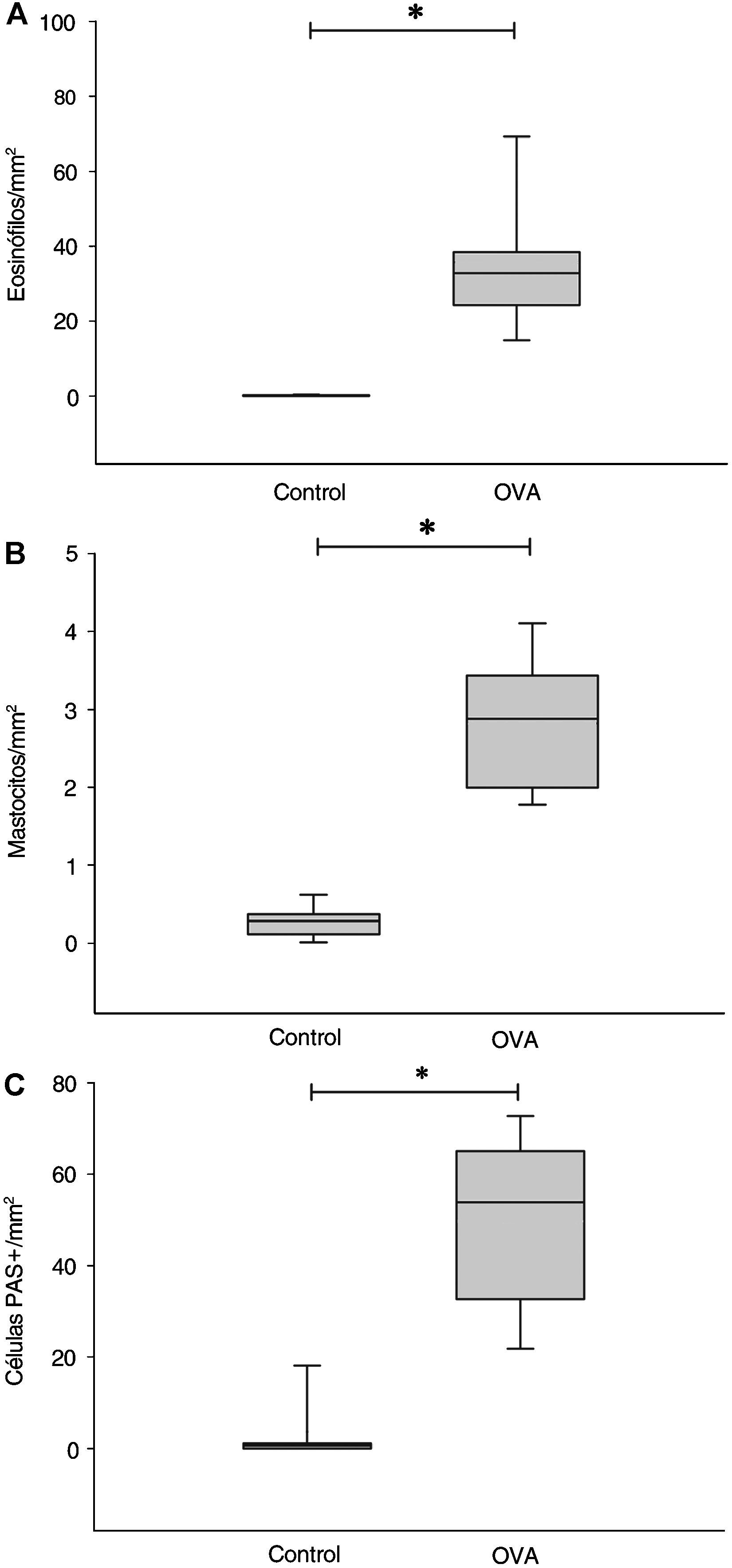
ResultadosEn el lavado broncoalveolar, los ratones del grupo de ovoalbúmina presentaron un incremento significativo de leucocitos totales, con una mediana (cuartiles 25–75) de 670,0células/ml·103 (376,2–952,5), frente a 40,0células/ml·103 (60,0–85,0) en controles (p=0,001), y de las fracciones eosinófila y linfocitaria en recuento diferencial. En secciones sagitales de los pulmones inflados a presión estandarizada, estos ratones mostraron hiperplasia de células caliciformes en el epitelio respiratorio —reacción de ácido peryódico de Schiff: 53,89 (36,26–62,84) frente a 0,66 (0,00–1,06)células/mm2 (p<0,001)—, densa infiltración inflamatoria mononuclear y eosinófila —hematoxilina-eosina: 32,87 (27,34–37,13) frente a 0,06 (0,00–0,20)eosinófilos/mm2 (p=0,002)—, infiltración subepitelial por mastocitos —azul de toluidina: 2,88 (2,00–3,28) frente a 0,28 (0,15–0,35)mastocitos/mm2 (p<0,001)—, incremento de la masa de tejido contráctil —inmunofluorescencia para alfaactina de músculo liso: 2,60 (2,28–2,98) frente a 1,08 (0,93–1,16), adimensional (p<0,001)— e incremento del depósito de matriz extracelular (tricrómico de Masson: 2,18 (1,85–2,80) frente a 0,50 (0,37–0,65), adimensional (p<0,001)—.
ConclusionesLos datos aportados configuran un modelo de asma experimental inducida por exposición alergénica prolongada, con desarrollo y evaluación integrada de inflamación y remodelación de vías respiratorias.
Experimental animal models are necessary for studying asthma disease mechanisms and for identifying new therapeutic targets. We present a murine model of experimental asthma that allows integrated, quantitative assessment of airway inflammation and remodeling.
Material and MethodsBALB/c mice were sensitized to ovalbumin (OVA) and challenged with OVA or vehicle 3 times per week for 12 weeks.
ResultsOn bronchoalveolar lavage, the OVA-sensitized mice had significantly higher total leukocyte counts, with a median (Q25–Q75) of 670.0cells/mL×103 (376.2, 952.5) in comparison with 40.0cells/mL×103 (60.0–85.0) in controls (P=.001), and higher eosinophil and differential lymphocyte counts. In sagittal sections of lungs inflated to a standard pressure, the OVA-sensitized animals showed goblet cell hyperplasia in the respiratory epithelium (periodic acid-Schiff staining, 53.89 [36.26–62.84]cells/mm2 vs 0.66 [0.00–1.06]cells/mm2, P<.001), dense mononuclear and eosinophilic inflammatory infiltrates (hematoxylin-eosin, 32.87 [27.34–37.13]eosinophils/mm2 vs 0.06 [0.00–0.20]eosinophils/mm2, P=.002), subepithelial infiltration by mast cells (toluidine blue, 2.88 [2.00–3.28] mast cells/mm2 vs 0.28 [0.15–0.35] mast cells/mm2, P<.001), increased contractile tissue mass (immunofluorescence analysis for α-smooth-muscle actin, 2.60 [2.28–2.98] vs 1.08 [0.93–1.16], dimensionless, P<.001) and enhanced extracellular matrix deposition (Masson's trichrome, 2.18 [1.85–2.80] vs 0.50 [0.37–0.65], dimensionless, P<.001).
ConclusionsOur dataset describes an experimental model of asthma which is driven by prolonged allergen exposure and in which airway inflammation and remodeling develop and are assessed together.
El asma es un problema creciente debido al aumento sostenido de su prevalencia durante las décadas más recientes y a la morbilidad, mortalidad y carga económica que comporta1, por lo que existe unanimidad en que la dimensión de este problema ha aumentado. A pesar de los tratamientos actualmente disponibles, sigue habiendo una proporción de casos de asma grave y de difícil manejo. Por estas razones, hay un frente activo de investigación para mejorar el conocimiento de sus mecanismos patogénicos e identificar dianas terapéuticas o preventivas que puedan aportar nuevas estrategias al manejo de la enfermedad2.
Los modelos animales representan un recurso esencial para la generación de nuevo conocimiento sobre mecanismos de enfermedad y constituyen parte imprescindible del puente traslacional entre la investigación básica y su proyección clínica. El conocimiento así conseguido revierte en nuevos abordajes terapéuticos, que pasan nuevamente por los modelos animales de enfermedad en su fase de desarrollo preclínico. En el asma, la mayoría de los datos en modelos animales se han generado en el ratón y la rata, con ciertas ventajas y limitaciones en cada especie3–5. El diseño de los protocolos de estudio tiene gran variabilidad y los aspectos de la enfermedad que convenga investigar en cada caso pueden ser diferentes. En el caso del ratón, se ha aprovechado en parte la versatilidad de esta especie para la generación de animales transgénicos, pero en general se ha estudiado el efecto de estas modificaciones genéticas sin inducir respuestas inmunitarias que sirvan de soporte al modelo de la enfermedad4. A pesar de la tecnología disponible, son aún escasas las publicaciones en que se presentan mediciones cuantitativas de variables que valoren conjuntamente los fenómenos de inflamación y remodelación de las vías respiratorias. En este artículo presentamos los datos de la creación en nuestro laboratorio de un modelo murino de asma experimental basado en la exposición antigénica repetida a largo plazo, como modelo de cronicidad y gravedad, con desarrollo de inflamación y remodelación de las vías respiratorias, efectos que pueden medirse de forma cuantitativa. Este modelo general puede trasladarse a la investigación de objetivos específicos en estudios futuros y adaptarse a la utilización de cepas transgénicas.
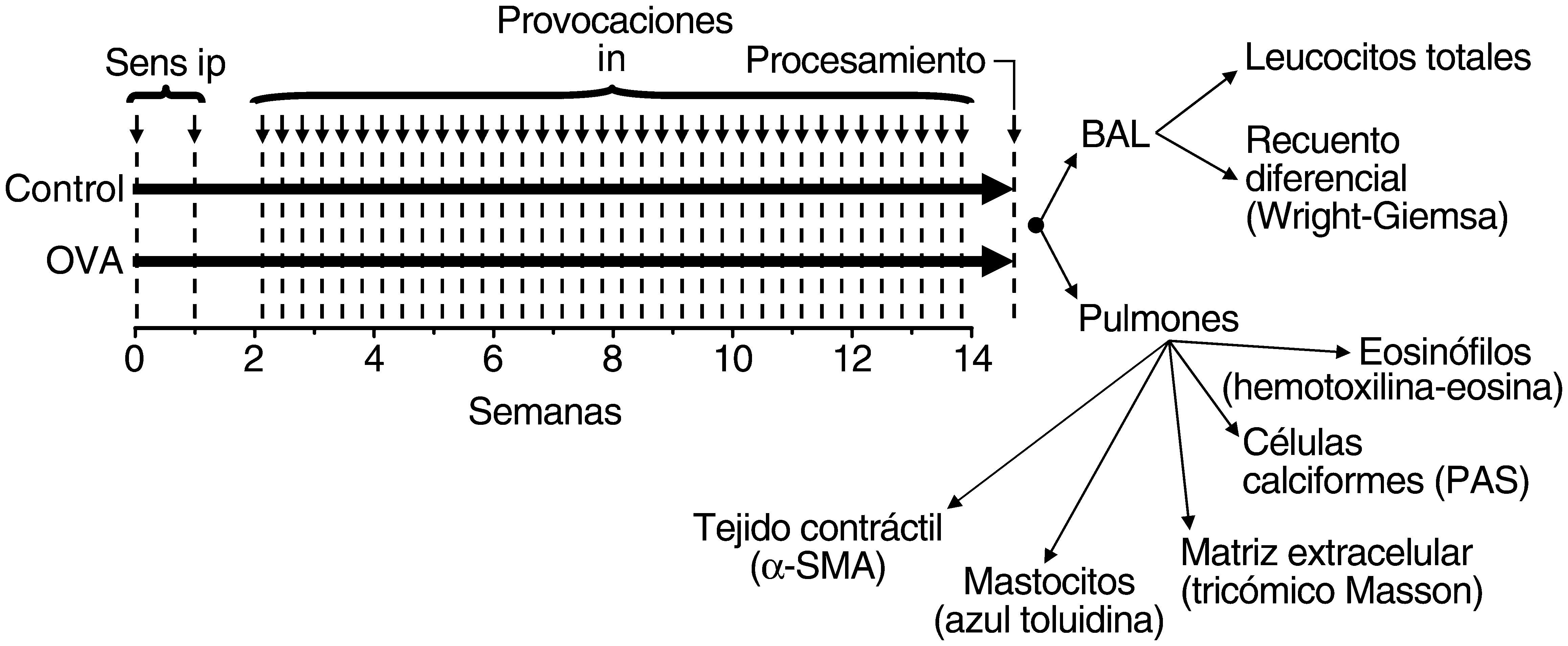
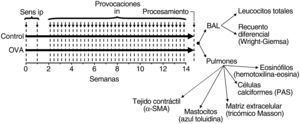
Material y métodosAnimales, sensibilización, broncoprovocación y procesamiento de pulmonesEl diseño experimental se resume en la figura 1. En los días 0 y 7 de cada experimento se sensibilizó a ratones Balb/c hembras (Harlan Interfauna Ibérica, SL, Sant Feliu de Codines, Barcelona, España) mediante la inyección intraperitoneal de 10μg de ovoalbúmina (grado VI, Sigma-Aldrich, Madrid, España) adsorbida en suspensión de hidróxido de aluminio (Pierce Immunochemicals, Cultek SLU, Madrid, España) en suero salino tamponado con amortiguador fosfato salino (PBS). A partir del día 14 se les realizó una broncoprovocación mediante la instilación intranasal de 100μg de ovoalbúmina diluida en PBS (grupo OVA; n=8) o PBS (grupo control; n=8). Se administraron 25μl de solución en cada fosa nasal bajo anestesia ligera con sevofluorano (Sevorane®, Abott Laboratories SA, Madrid, España) 3 veces a la semana durante 12 semanas. A las 48h de la última broncoprovocación, los ratones recibieron anestesia profunda con sevofluorano para efectuarles una traqueostomía e intubarlos con una sonda flexible Fisnar de polipropileno de calibre 20 (Dotest SL, Barcelona, España). Se realizó un lavado broncoalveolar con 5ml de PBS en fracciones de 1ml y se separó la fracción celular para recuentos de leucocitos totales en hemocitómetro y recuento leucocitario diferencial en muestras citocentrifugadas, fijadas con metanol y teñidas con colorante de Wright-Giemsa. Tras recoger el lavado broncoalveolar, se perfundió el circuito vascular pulmonar a través del ventrículo derecho con ácido edético 2mM en PBS y seguidamente se extrajo el bloque cardiopulmonar. Para su fijación los pulmones se inflaron por la cánula traqueal con formaldehído al 4%, a presión estándar de 25cmH2O, que se mantenía constante mediante una bomba y sistema de recirculación, durante 24h. Seguidamente se seccionaron los pulmones en porciones hiliar y periférica mediante un corte sagital medio y se incluyeron en parafina para estudio posterior. El protocolo del estudio fue aprobado por el Comité de Bioética de la Xunta de Galicia por cumplir con la Directiva 86/609 de la Unión Europea y los subsiguientes Real Decreto 1201/2005 y Orde de 15 de septiembre de 2006.
Diagrama del diseño experimental. Se sensibilizó a los ratones por vía intraperitoneal (Sens ip) con ovoalbúmina en los días 0 y 7. A partir del día 14, se les realizó una brocoprovocación por vía intranasal (in) con excipiente (grupo control) u ovoalbúmina (grupo OVA), 3 veces por semana durante 12 semanas. Posteriormente (48h después de la última provocación) se obtuvo el lavado broncoalveolar (BAL) para el recuento leucocitario total y diferencial, y se fijaron los pulmones inflados a presión estandarizada. Se procesaron secciones pumonares para distintas determinaciones, según se indica, y se realizó morfología cuantitativa. α-SMA: alfaactina de músculo liso, detectada mediante inmunofluorescencia; PAS: reacción del ácido peryódico de Schiff.
Se tiñeron con hematoxilina-eosina secciones pulmonares de 4μm de grosor para valoración histopatológica cualitativa. Además se aplicaron las siguientes tinciones: reacción de ácido peryódico de Schiff, para la detección y recuento de células caliciformes productoras de moco; hematoxilina-eosina, para la identificación de eosinófilos; azul de toluidina, para mastocitos, y tricrómico de Masson, para la matriz extracelular. El tejido contráctil de las vías respiratorias (músculo liso y miofibroblastos) se detectó mediante inmunofluorescencia utilizando un anticuerpo monoclonal contra la alfaactina del músculo liso (α-SMA, clon 1A4, Sigma-Aldrich). Para este procedimiento, las preparaciones se desparafinaron, se permeabilizaron con Triton X-100 (Sigma-Aldrich) al 0,2% y se bloquearon con Image-IT Signal Enhancer (Molecular Probes, Invitrogen, Prat de Llobregat, Barcelona, España). El anticuerpo 1A4 se combinó con una f(ab)’ antiinmunoglobulina IgG2a de ratón marcada con el fluorocromo Alexa-488 (Zenon®, Molecular Probes, Invitrogen) y se incubó 30min sobre las preparaciones a una concentración de 2μg/ml. Seguidamente se procedió a la contratinción nuclear con 4’,6-diamidino-2-phenylindol (DAPI; Molecular Probes, Invitrogen), fijación en paraformaldehído al 4% y montaje de las preparaciones con ProLong® Gold (Molecular Probes, Invitrogen).
Morfología cuantitativaEn las preparaciones pulmonares se analizaron las vías respiratorias seccionadas transversalmente, de acuerdo con criterios de muestreo y normalización establecidos6. Se midieron en total una media (± error estándar) de 13,8±1,4 vías respiratorias por animal. Los recuentos celulares (células caliciformes, eosinófilos y mastocitos) se normalizaron dividiendo por el cuadrado del perímetro de la membrana basal (PBM2) de la vía respiratoria y se expresan como células/mm2. El PBM2 se utiliza para la estandarización por tamaño de datos morfológicos en las vías respiratorias por considerarse la dimensión más constante de la vía respiratoria, independientemente de su grado de constricción o relajación6. Para su medición se captaron imágenes digitales calibradas de las vías respiratorias y se trazó el perímetro de la membrana basal utilizando una tableta digital y el programa de análisis de imagen AnaliSISD® (Soft Imaging System GmbH, Olympus España SAU, Barcelona, España). Para la determinación cuantitativa del componente de matriz extracelular en las preparaciones teñidas con tricrómico de Masson, se construyó un algoritmo de extracción de color en el programa AnaliSISD® y se procedió a la detección y medición de la superficie de las partículas resultantes en la pared de la vía respiratoria, mediante el mismo programa. En cada vía respiratoria, el sumatorio de la superficie de las partículas se normalizó dividiendo por PBM2; este índice se denominó “masa de matriz extracelular” (MMEX). Para la medición estandarizada del tejido contráctil se extrajo digitalmente su señal inmunofluorescente y se procedió asimismo a la detección y medición de la superficie de las partículas resultantes, así como a la normalización del sumatorio de superficies por PBM2. Aunque este parámetro se ha venido denominando “masa de músculo liso”, optamos por la propuesta de algunos autores de denominarlo “masa de tejido contráctil” de la vía respiratoria (MTC), debido a que el anticuerpo 1A1, además de las células musculares lisas, detecta miofibroblastos que expresen la isoforma muscular de alfaactina. Los parámetros MMEX y MTC son índices adimensionales.
Análisis estadísticoLos datos se presentan como mediana, cuartiles 25–75 y percentiles 10–90. Las comparaciones entre distribuciones de los grupos control y OVA se realizaron mediante la prueba de la t de Student para muestras independientes. Para la categorización de las vías respiratorias según su tamaño en pequeñas, medianas y grandes, se tomaron los valores de 0,8 y 1,5mm como puntos de corte de la longitud del perímetro de la membrana basal. El análisis de los datos según la categoría de tamaño de las vías respiratorias se efectuó mediante análisis de la varianza de una vía, seguido de prueba post-ANOVA de la diferencia mínima significativa de Fisher. El tamaño del gradiente diferencial a lo largo de las vías respiratorias de distintos tamaños se estimó mediante el intervalo de confianza del 95% de la diferencia media (ΔIC del 95%). Donde correspondía, la fuerza de asociación entre variables se evaluó mediante el coeficiente de correlación r de Pearson. Se consideran estadísticamente significativas las diferencias o asociaciones con un grado de significación p<0,05. Se utilizaron los programas SPSS versión 15.0 y SigmaPlot versión 2000.
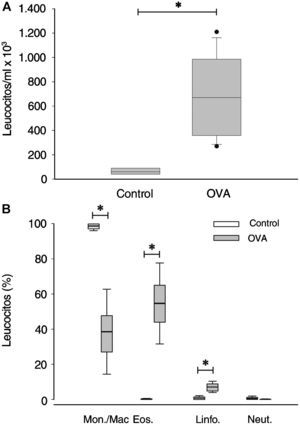
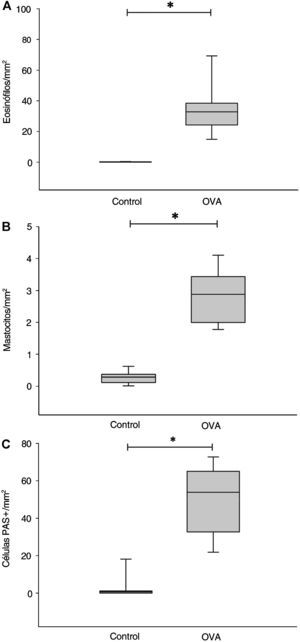
ResultadosInflamación de las vías respiratoriasLa celularidad total en el lavado broncoalveolar de los animales del grupo OVA fue 10,6 veces superior a la del grupo control, y el recuento leucocitario diferencial mostró que el infiltrado era eosinófilo y linfocitario (fig. 2). En las secciones de tejido, los animales del grupo OVA presentaron infiltración inflamatoria mononuclear y eosinófila, de localización principal en la lámina propia y adventicia de la pared de las vías respiratorias, y en los puentes de tejido conjuntivo entre vías respiratorias y vasos adyacentes de la circulación pulmonar (figs. 3A–C). Cuantitativamente (figs. 4A–B), los ratones del grupo OVA presentaron un incremento de eosinófilos en todas estas localizaciones, y de mastocitos en localización preferentemente subepitelial (fig. 3D).
Recuentos celulares en lavado broncoalveolar. A: recuento leucocitario total en hemocitómetro. B: recuento diferencial basado en la tinción de Wright-Giemsa (monocitos/macrófagos, eosinófilos, linfocitos y neutrófilos). Los diagramas de cajas indican la mediana, los percentiles 25 y 75 (extremos de la caja) y los percentiles 10 y 90 (barras de error). OVA: ratones provocados con ovoalbúmina. *p<0,05.
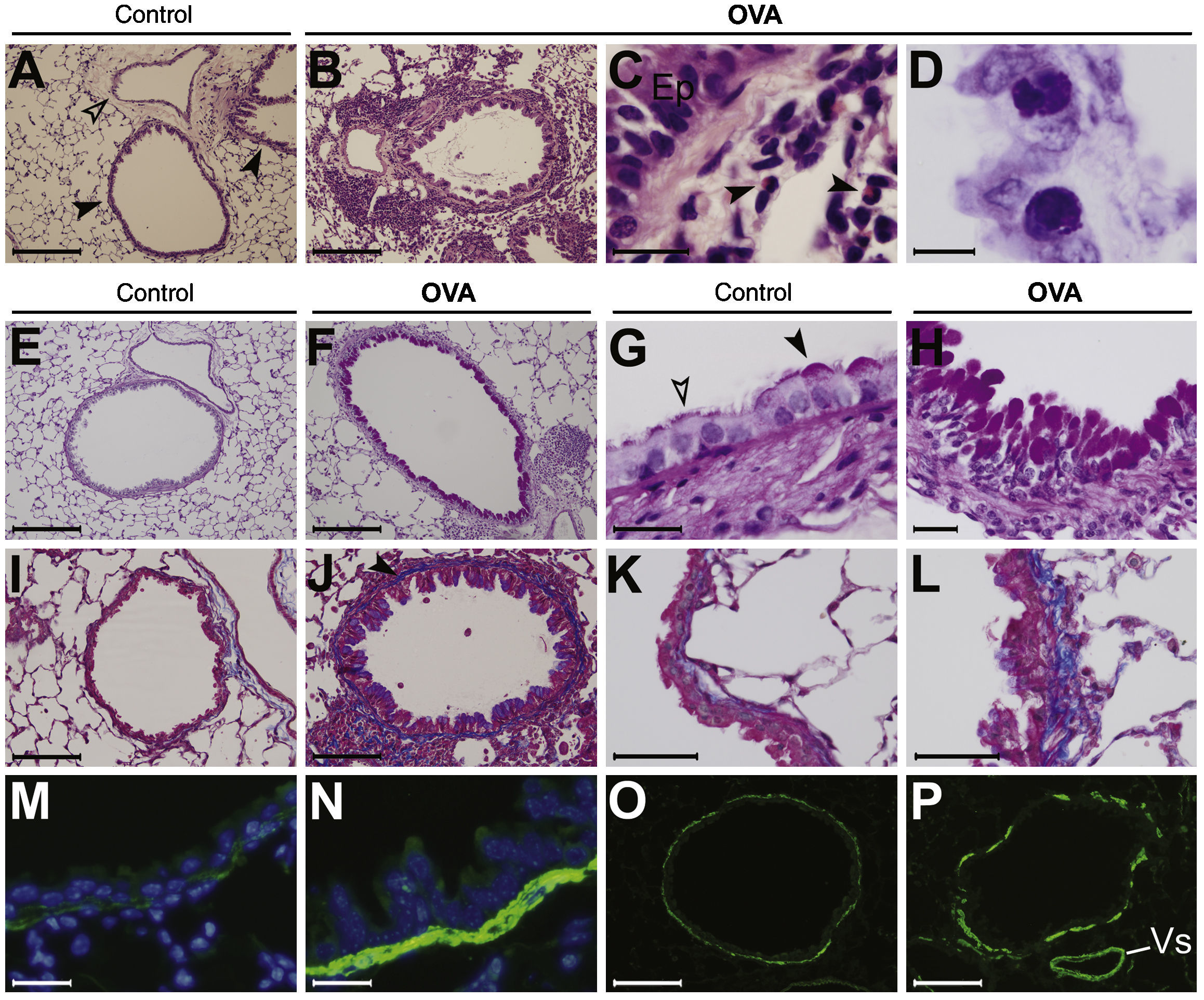
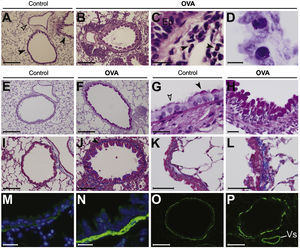
Microscopia. A–C: hematoxilina-eosina. A: imagen correspondiente a un ratón del grupo control, donde se muestran las vías respiratorias (puntas de flecha negras) y una arteria acompañante (punta de flecha transparente). B: vía respiratoria y vaso acompañante en ratón del grupo broncoprovocado con ovoalbúmina (OVA). Se observa un denso infiltrado inflamatorio en la vía respiratoria y perivascular. La pared de la vía respiratoria está engrosada y el lumen contiene restos de moco y detritus celulares. C: detalle que muestra el infiltrado inflamatorio mononuclear y eosinófilo (puntas de flecha). Ep: epitelio respiratorio.
D: azul de toluidina. Se muestran 2 mastocitos en estrecha relación con el epitelio respiratorio, en animal OVA. En su citoplasma se aprecia contenido granular metacromático característico.
E–H: reacción del ácido peryódico de Schiff (PAS). E y F muestran, respectivamente, animales control y OVA; en este último se aprecia el abundante contenido epitelial con positividad PAS. G: detalle del epitelio respiratorio de un animal control. Los gránulos de material mucoso que son positivos a PAS se concentran en el polo apical de las células caliciformes (punta de flecha negra). El material secretado pasa a formar parte del fluido de superficie de las vías respiratorias, pudiendo apreciarse sobre las células ciliadas (punta de flecha transparente). H: en los animales OVA, se observa hiperplasia de células caliciformes con material acumulado positivo a PAS, lo que refleja un estado hipersecretor.
I–L: tricrómico de Masson. El depósito de matriz extracelular fibrilar en el tejido conjuntivo se aprecia en color azul. I: ratón del grupo control; se observa matriz de densidad normal. J: ratón del grupo OVA, en el que se observa fibrosis subepitelial (punta de flecha). K y L: detalles de ratones de los grupos control y OVA; en estos últimos se aprecia el depósito incrementado de matriz extracelular.
M–P: inmunofluorescencia para alfaactina de músculo liso (α-SMA; verde) y contratinción nuclear (azul). M y N: ratones de los grupos control y OVA respectivamente; en el último se observa el engrosamiento de la capa de músculo liso. O y P: extracción de la señal de α-SMA para la medición de la masa de tejido contráctil; ratones de los grupos control y OVA, respectivamente. P: se muestra también músculo liso vascular (Vs), que se excluye de las mediciones.
Barras de escala: 200μm en A, B, E y F; 100μm en I, J, O y P; 50μm en K y L; 25μm en H, M y N; 20μm en C y G, y 10μm en D.
Eosinófilos (A), mastocitos (B) y células caliciformes positivas a la reacción del ácido peryódico de Schiff (C) en la pared de las vías respiratorias. Recuentos celulares normalizados por el cuadrado del perímetro de la membrana basal. Los diagramas de cajas indican en cada grupo del estudio la mediana, los cuartiles 25 y 75 (extremos de la caja) y los percentiles 10 y 90 (barras de error). OVA: grupo provocado con ovoalbúmina. *p<0,001.
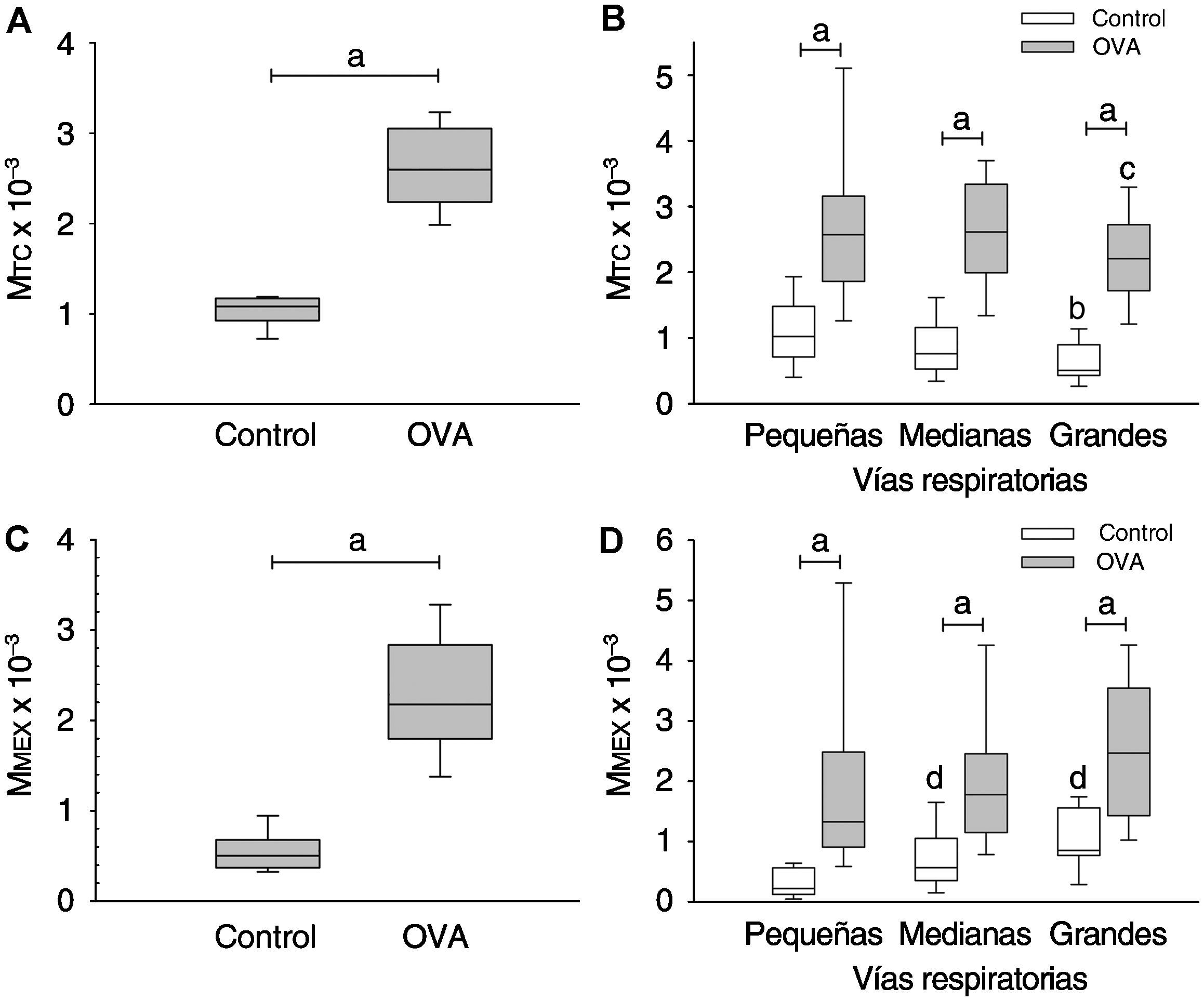
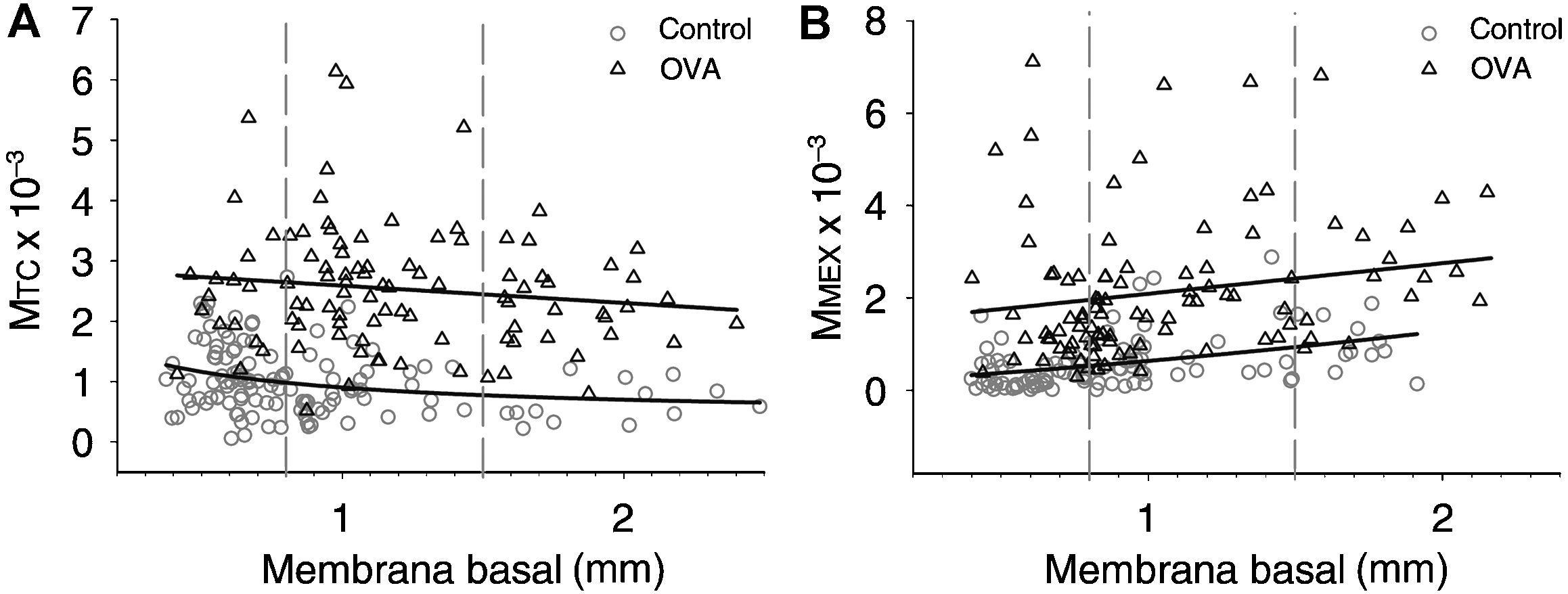
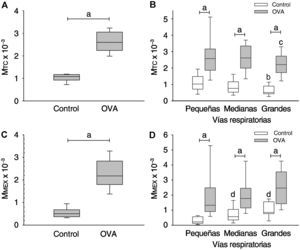
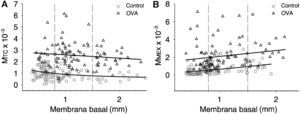
La remodelación estructural de las vías respiratorias (figs. 3E–P) se evaluó mediante el recuento normalizado de células caliciformes positivas para la reacción del ácido peryódico de Schiff en el epitelio bronquial, y mediante los índices MTC y MMEX, que reflejan, respectivamente, los componentes de crecimiento del músculo liso y fibrogénico de la remodelación. En los animales del grupo OVA se observó hiperplasia de células caliciformes, las cuales mostraron morfología indicativa de un estado funcional hipersecretor (figs. 3E–H y 4C). En comparación con el grupo control, los animales del grupo OVA mostraron asimismo un incremento significativo de los índices MTC y MMEX (figs. 3I–P y 5). En condiciones basales (grupo control), se observó a lo largo del árbol bronquial una progresión hacia una MTC ligeramente superior cuanto menor era el tamaño de las vías respiratorias (ΔIC del 95% en las vías grandes frente a las pequeñas, −1,14 a −0,77; correlación de MTC frente a PBM: r=−0,27, p=0,012) (fig. 6A). El incremento de MTC en el grupo OVA, significativo en todas las categorías de tamaño de las vías respiratorias, fue globalmente de 2,56 veces la MTC del grupo control, y se distribuyó de forma aproximadamente homogénea a lo largo del árbol bronquial (p=0,215, ANOVA entre categorías de tamaño de vías respiratorias). En el grupo control, la MMEX fue significativamente mayor en las vías respiratorias grandes y medianas que en las vías pequeñas (ΔIC del 95% en vías grandes frente a pequeñas, 0,35 a 1,02; correlación de MMEX frente a PBM: r=0,42, p=0,002) (fig. 6B), lo que indica que en condiciones fisiológicas el depósito relativo de matriz extracelular es superior en las vías respiratorias de mayor tamaño. El incremento de la MMEX en el grupo OVA fue 4,16 veces la MMEX del grupo control y, al igual que el incremento de la MTC, fue significativo en todas las categorías de tamaño de las vías respiratorias y se distribuyó homogéneamente a lo largo del árbol bronquial (p=0,051 entre categorías de tamaño de vías respiratorias).
Incremento de masa de tejido contráctil (MTC) y masa de matriz extracelular (MMEX) en la remodelación de las vías respiratorias. A y C: MTC y MMEX, respectivamente, en los grupos del estudio. B y D: distribución de MTC y MMEX, respectivamente, según la categoría de tamaño de las vías respiratorias en cada grupo. Los diagramas de cajas indican la mediana, los percentiles 25 y 75 (extremos de la caja) y los percentiles 10 y 90 (barras de error). OVA: grupo provocado con ovoalbúmina.
ap<0,001.
bp=0,005 frente a vías respiratorias pequeñas en el grupo control.
cDiferencia intermedia frente a vías respiratorias pequeñas en el grupo OVA.
dp<0,001 frente a vías respiratorias pequeñas en el grupo control.
Nubes de dispersión de los valores de masa de tejido contráctil (MTC, A) y masa de matriz extracelular (MMEX, B) en las vías respiratorias, según su tamaño, medido por el perímetro de la membrana basal. Las líneas verticales discontinuas indican los puntos de corte de las categorías de tamaño pequeño, mediano y grande de las vías respiratorias. Las líneas de regresión corresponden, respectivamente, a los grupos control (inferior) y broncoprovocado con ovoalbúmina (OVA; superior) en cada panel.
De entre las diversas especies con que se han creado modelos de asma experimental, el ratón es la más utilizada por su coste-efectividad y su versatilidad5. Entre las necesidades actuales en el desarrollo de estos modelos, cabe mencionar la combinación de las tecnologías de modificación genética de organismos con modelos de asma creados a través de mecanismos inmunitarios que reflejen los de la enfermedad humana, y el análisis integrado de inflamación y remodelación, así como de los distintos componentes de la remodelación, con especial atención al músculo liso de las vías respiratorias. En este trabajo presentamos los datos de la creación de un modelo murino con inflamación y remodelación mediante la sensibilización intraperitoneal a ovoalbúmina seguida de provocación intranasal. El modelo dio lugar a una intensa infiltración inflamatoria mononuclear y eosinófila, a un aumento del número de mastocitos y a remodelación con incremento del número de células caliciformes productoras de moco, fibrosis subepitelial, incremento de la MTC y un aumento global del grosor de la pared de las vías respiratorias a expensas de todas sus capas.
La ovoalbúmina es el antígeno más utilizado para inducir asma experimental alérgica. Sin embargo, se ha criticado su empleo sistemático por no ser un aeroalérgeno que produzca enfermedad humana por vía inhalada. Por esta razón, se han desarrollado modelos alternativos utilizando alérgenos tales como ácaros del polvo7,8 y polen9. En el modelo de Johnson et al8, se expuso a los animales a extracto de ácaros por vía intranasal exclusivamente durante un período de 7 semanas, sin sensibilización sistémica previa, con lo cual se reflejaba de manera bastante fiel el proceso de sensibilización a aeroalérgenos en humanos. No obstante, una ventaja especial de la ovoalbúmina es la disponibilidad actual de una cepa de ratones transgénicos (DO11.10) que expresan el receptor de células T específico para este antígeno10 en todos sus linfocitos T CD4+, lo que proporciona una utilísima herramienta para el análisis de los mecanismos inmunológicos específicos de antígeno de las células T en el asma, mediante experimentos de transferencia adoptiva que explotan el modelo aquí presentado. Ésta es la razón fundamental que nos ha conducido a utilizar ovoalbúmina en nuestro modelo, aun asumiendo sus limitaciones.
Los protocolos de los distintos modelos varían según las hipótesis que convenga estudiar. Una simple broncoprovocación tras sensibilización sistémica puede inducir inflamación de las vías respiratorias, y de hecho la mayoría de los modelos desarrollados han sido de corta duración y se han centrado en el aspecto inflamatorio de la enfermedad. Sin embargo, el desarrollo de la remodelación requiere una exposición más prolongada, aspecto este que no se ha abordado en la mayoría de los modelos. En diversos estudios la exposición prolongada a ovoalbúmina dio lugar a un declive de la respuesta inflamatoria en las vías respiratorias, pero se trataba de protocolos basados en exposición primaria inhalada, sin sensibilización parenteral previa11–13. Temelkovski et al14, por su parte, compararon la broncoprovocación prolongada mediante ovoalbúmina con o sin sensibilización intraperitoneal previa. La exposición primaria en el aparato respiratorio ocasionó un declive de la respuesta, resultado que coincidía con lo observado en los estudios anteriores. Sin embargo, la broncoprovocación prolongada tras la sensibilización intraperitoneal condujo a una inflamación sostenida y a cambios estructurales. En esta misma línea, McMillan y Lloyd15 observaron inflamación persistente y remodelación tras un protocolo de sensibilización intraperitoneal y broncoprovocación repetida hasta una duración total de 55 días. Este conjunto de trabajos indica que la exposición primaria a ovoalbúmina en el aparato respiratorio induce tolerancia inmunológica, mientras que la broncoprovocación prolongada tras sensibilización intraperitoneal conduce a enfermedad alérgica con inflamación persistente y remodelación. En nuestro estudio hemos utilizado la sensibilización intraperitoneal y establecido el protocolo de broncoprovocación repetida más prolongado de que tenemos conocimiento, con la finalidad de simular en el ratón la cronicidad de la enfermedad humana y estimar los efectos máximos en un modelo de asma grave. En contraste con el desarrollo de tolerancia observado tras la exposición primaria en tracto respiratorio a ovoalbúmina es interesante que, en el modelo de Johnson et al8, donde se utilizó extracto de ácaro en esta modalidad, se desarrolló inflamación y remodelación. Un aspecto deficiente en todos estos modelos es el estudio integrado de la respuesta alérgica en la vía aérea superior y los pulmones. Algunos autores han subrayado la importancia de desarrollar modelos que permitan analizar la interrelación y evolución conjunta de la rinitis alérgica y el asma, y han creado en este sentido sus propios modelos16,17.
Hay que reseñar algunos aspectos observados en nuestro modelo. Recientemente se ha documentado la microlocalización de mastocitos en el espesor del músculo liso bronquial de los pacientes con asma18 y se ha dado importancia a las potenciales implicaciones fisiopatológicas de este hallazgo. En nuestro modelo los mastocitos, en número incrementado, se distribuyeron en la región subepitelial y ocasionalmente en localización intraepitelial o en la adventicia, pero no observamos mastocitos en la capa de músculo liso o en contacto con ella. La ausencia de este fenómeno debe interpretarse con cautela, dado que en el ratón el tamaño celular está proporcionalmente menos disminuido que el conjunto de estructuras anatómicas. En consecuencia, el espesor de la capa de músculo liso de las vías respiratorias del ratón puede ser insuficiente para albergar mastocitos en su interior, pero la actuación directa sobre el músculo de mediadores de mastocitos situados a corta distancia es aún factible. En segundo lugar, consideramos que la hiperplasia de células caliciformes, concepto reflejado en la literatura médica a partir de tinciones que detectan el moco, puede ser en parte el resultado de un estado hiperfuncional de estas células, las cuales pueden no identificarse fácilmente en animales controles o en personas sin asma. Un examen a una alta magnificación en los animales controles induce a pensar que las células caliciformes, en su estado fisiológico normal, mantienen un flujo equilibrado entre la producción de moco y su secreción, por lo que acumulan muy escasas cantidades de moco en su citoplasma. En los animales con asma experimental las células caliciformes presentan un citoplasma extremadamente distendido e ingurgitado de contenido mucoso, lo que hace que estas células sean particularmente visibles. El elevado número de estas células hipertróficas podría indicar que hay un proceso hiperplásico, pero aún no se ha determinado de forma cuantitativa la contribución de la proliferación celular a la metaplasia mucosa. Por último, respecto de la MTC y su incremento, es interesante comentar que este índice adimensional tiene en los ratones controles el mismo valor que el observado en la rata19 y el caballo20, lo que sugiere que la cantidad de músculo liso normalizada por el tamaño de la vía respiratoria es una constante que se conserva entre especies. La magnitud del incremento de la MTC en los ratones con asma experimental resultó asimismo equiparable al que se observa en la rata y en los caballos con heaves, una enfermedad alérgica obstructiva y crónica que se presenta de forma natural. Respecto de la distribución de la MTC en las vías respiratorias de diferentes tamaños, ésta se aproximó en los controles a una constante, al igual que en el caso de la rata y el caballo. Llama la atención, sin embargo, que el incremento de la MTC en los ratones del grupo OVA se distribuyera de forma homogénea a lo largo del árbol bronquial, mientras que en la enfermedad inducida en un modelo de rata o en la heaves del caballo crece exponencialmente hacia las vías respiratorias más periféricas. Este comportamiento diferente puede estar relacionado con las diferencias anatómicas y probablemente funcionales que hay entre el árbol de las vías respiratorias del ratón y el de especies mamíferas de mayor tamaño4.
En conclusión, los datos aquí presentados corresponden al desarrollo inicial de un modelo de inflamación y remodelación que servirá de base para estudios futuros. La evolución conceptual de la patogenia del asma desde broncoconstricción a inflamación y remodelación, junto con datos clínicos que apuntan a la pertinencia de guiar el manejo del asma “según la remodelación” y la necesidad del desarrollo preclínico de nuevos agentes farmacológicos “antirremodeladores”, demanda la maduración de modelos de enfermedad experimental que se sustenten sobre una base inmunológica y aborden de forma integrada la medición de variables cuantitativas de inflamación y remodelación. Los modelos de estas características deben servir de base para posibilitar la explotación con proyección traslacional de las técnicas de modificación genética de organismos.
FinanciaciónEstudio financiado por el Fondo de Investigación Sanitaria (FIS), Instituto de Salud Carlos III, fondos CP04/00313 y PI05/2478. D. Ramos-Barbón tiene un contrato de investigador del Sistema Nacional de Salud (FIS,CP04/00313). R.FragaIriso y L.Núñez Naveira son perceptoras, respectivamente, de una ayuda predoctoral de formación en investigación (FIS,FI05/00171) y un contrato posdoctoral de perfeccionamiento Sara Borrell(FISCD05/00250).