La medicación inhalada constituye el tratamiento de primera línea de enfermedades como el asma o la enfermedad pulmonar obstructiva crónica. Su efectividad está en relación con la cantidad de fármaco que logre depositarse más allá de la región orofaríngea, con el lugar en que se produzca el depósito y con la distribución uniforme o no del mismo. Otros factores trascendentes son el tamaño de las partículas inhaladas, las condiciones de respiración, la geometría de las vías aéreas y los mecanismos de aclaramiento mucociliar.
Actualmente se están aplicando modelos matemáticos que permiten describir el depósito de fármacos inhalados a partir del tamaño de las moléculas, el flujo inspiratorio y la distribución anatómica del árbol bronquial. El depósito de partículas en las vías aéreas pequeñas recibe la máxima atención de las empresas farmacéuticas y es del máximo interés para poder controlar mejor a los pacientes que reciben estos fármacos.
Inhaled medication is the first-line treatment of diseases such as asthma or chronic obstructive pulmonary disease. Its effectiveness is related to the amount of drug deposited beyond the oropharyngeal region, the place where the deposit occurs and its distribution (uniform or not). It is also important to consider the size of the inhaled particles, the breathing conditions, the geometry of the airways and the mucociliary clearance mechanisms.
Currently, mathematical models are being applied to describe the deposition of inhaled drugs based on the size of the particles, the inspiratory flow and the anatomical distribution of the bronchial tree. The deposition of particles in the small airways gets maximum attention from pharmaceutical companies and is of great interest as it is related with a better control in patients receiving these drugs.
El aire que respiramos no contiene únicamente nitrógeno y oxígeno. Siempre se consideró que, además, existían pequeñas concentraciones de otros gases (ozono, hidrógeno, criptón, argón) y mayor o menor cantidad de vapor de agua en función del medio en que nos encontramos. No sabemos si eso es todo, aunque nos tememos que no. Lo que se denomina «aire» contiene, además, ingentes cantidades de partículas en suspensión, tanto sólidas como líquidas, orgánicas e inorgánicas, bacterias, virus, antígenos, partículas más elementales, volátiles o sólidas, simples o combinadas, que forman nuestro medio externo y en el que desarrollamos nuestra respiración y mantenemos la vida.
Los pulmones son una gran esponja sanguínea y, a la vez, un enorme filtro para purificar el aire que respiramos. Una vez las moléculas de oxígeno y nitrógeno están depositadas en los alvéolos, podríamos decir que prácticamente se han liberado de la mayoría de estos «contaminantes» y que estos sistemas de defensa locales y generales actúan con gran eficacia durante muchos años. Siempre, claro está, que no nos hayamos preocupado de deteriorarlos intencionadamente y de forma muy especial con el hábito tabáquico.
El sistema respiratorio está especialmente diseñado, tanto anatómica como funcionalmente, para que el aire llegue a los territorios más distales en las mejores condiciones de limpieza. Los pelos de la nariz, las turbinas caloríficas de las fosas nasales, las cuerdas vocales, los cilios del epitelio bronquial, los reflejos del estornudo y de la tos, etc., contribuyen a realizar esta labor de la forma más adecuada. Y lo logran en la gran mayoría de las ocasiones. Pero el ser humano está lleno de paradojas. Un sistema tan eficaz, diseñado para evitar que ciertas partículas penetren en el pulmón, es a la vez utilizado para depositar intencionadamente fármacos en las vías aéreas e incluso para que lleguen hasta los alvéolos en las mejores condiciones posibles. Deberemos, pues, sortear los sistemas de defensa, lograr que se burlen arcos reflejos, capas de moco, movimientos ciliares, etc., y que, con el flujo inspiratorio, se depositen en los pulmones aquellas moléculas que contribuirán a la mejoría de nuestras enfermedades. Un sistema que evolucionó con el tiempo para filtrar y limpiar el aire deberá ser sorteado para que se depositen otras sustancias que, intencionadamente, queremos que alcancen el interior del organismo. No hay duda de que el conocimiento de la anatomía y el funcionamiento de las vías aéreas, las leyes físicas que rigen la dinámica de fluidos, el tamaño, la forma y el número de las partículas inhaladas, etc., contribuirán a desarrollar este ámbito del conocimiento, tan cercano a nuestra especialidad y que tanto interés ha despertado y genera, especialmente para el desarrollo de nuevas formas de administrar la medicación.
Factores que afectan al depósito de fármacos aerosolizadosTamaño y forma de las partículasEl tamaño y la forma de las partículas son factores primordiales que van a condicionar su depósito en el pulmón. El tamaño se define mediante lo que se denomina diámetro de la masa media aerodinámica (DMMA) o diámetro de una partícula de masa igual a la mediana de las partículas de una población, es decir, aquel diámetro de la partícula en el que el 50% de la masa del aerosol se encuentra por encima del mismo y el otro 50% por debajo1. En función de su tamaño y de su forma, las partículas se pueden depositar mediante cuatro mecanismos:
- •
Choque. Es el fenómeno físico por el que las partículas de un aerosol tienden a continuar con su trayectoria cuando discurren por la vía aérea, en vez de adecuarse a las curvaturas del tracto respiratorio2. Las partículas que tengan suficiente momento (producto de la masa por la velocidad) se verán afectadas por las fuerzas centrífugas en aquellos puntos en que el flujo de aire cambie de dirección repentinamente, chocando contra la pared de la vía aérea. Esto sucede principalmente en las primeras 10 generaciones bronquiales, en las que la velocidad del aire es elevada y el flujo es turbulento3. Este fenómeno afecta sobre todo a las partículas mayores de 10μm, que van a quedar retenidas principalmente en la región orofaríngea, en especial si el fármaco es administrado empleando inhaladores en polvo (IPS) o inhaladores en cartucho presurizado (ICP)4.
- •
Intercepción. Se da principalmente en el caso de las fibras, en las que, debido a su forma alargada, el depósito se produce en cuanto contactan con la pared de la vía aérea.
- •
Sedimentación. Es el fenómeno físico por el que las partículas con una masa suficiente se depositan por acción de la gravedad cuando el tiempo de permanencia en la vía aérea es suficientemente largo. Predomina en las 5 últimas generaciones bronquiales, en las que la velocidad del aire es baja y, por lo tanto, el tiempo de residencia se prolonga3.
- •
Suspensión. Es el fenómeno por el que las partículas de un aerosol de desplazan de forma errática de un sitio a otro de las vías aéreas. Sucede como consecuencia del movimiento browniano de las partículas y se da en aquellas de tamaño inferior a 0,5μm de DMMA cuando alcanzan los espacios alveolares, en donde la velocidad del aire es prácticamente nula. Estas partículas por lo general no llegan a depositarse y son expulsadas nuevamente al exterior con la espiración.
Las partículas de los fármacos aerosolizados suelen poseer una forma uniforme, con simetría en varios planos, y raramente tienen un tamaño inferior a 1μm, por lo que los mecanismos predominantes van a ser el choque y la sedimentación5.
De modo general puede considerarse que las partículas con DMMA mayor de 10μm se depositan en la orofaringe, las de 5-10μm en las vías aéreas centrales y las de 0,5-5μm en las pequeñas vías aéreas y alvéolos. Por lo tanto, para el tratamiento respiratorio tópico interesa emplear partículas con DMMA comprendido entre 0,5 y 5μm. Es lo que se denomina fracción respirable de un aerosol6.
Velocidad del aireDado que las partículas son transportadas en la vía aérea por una corriente de aire, sus trayectorias se van a ver afectadas por las características de la misma. El flujo de aire en los pulmones está determinado por el volumen corriente y la frecuencia respiratoria. Sbirlea-Apiou et al.7 demostraron que en las 4 primeras generaciones de la vía aérea, para cualquier tamaño de partícula, el depósito aumenta según lo hace el flujo inspiratorio. Sin embargo, lo contrario sucede en las últimas generaciones de la vía aérea, en donde el depósito de partículas es inversamente proporcional a este flujo. Esto es debido a que el incremento del flujo inspiratorio disminuye el tiempo de permanencia de las partículas en la vía aérea, por lo que los efectos de la gravedad y del movimiento browniano van a verse muy reducidos. Evidentemente, se precisa un flujo inspiratorio «mínimo» capaz de arrastrar las partículas hacia el interior del árbol bronquial.
Geometría de las vías aéreasLas probabilidades de depósito de las partículas por choque aumentan cuanto mayor es el tamaño de las propias partículas, cuanto mayor sea el flujo de aire inspirado, cuanto mayor sea el ángulo de separación entre dos ramas y cuanto más estrecha sea la vía aérea8.
En patologías como la bronquitis crónica o el asma, que pueden alterar la arquitectura del pulmón por aparición de broncoconstricción, inflamación o acumulación de secreciones, se modifica el depósito de los fármacos aerosolizados. La disminución del calibre de la vía aérea aumenta la velocidad del aire, produciendo turbulencia en lugares en los que el flujo es normalmente laminar. La obstrucción de la vía aérea también hace que el aire tienda a desplazarse a zonas sin obstruir, por lo que el fármaco inhalado también tenderá a depositarse mayoritariamente en las zonas sanas del pulmón9.
Grado de humedadLas partículas de fármaco de los aerosoles pueden ser higroscópicas en mayor o menor medida. La higroscopicidad es la propiedad de algunas sustancias de absorber y exhalar la humedad según el medio en que se encuentran. Esto hace que puedan aumentar o disminuir de tamaño al penetrar en la vía aérea, con la consiguiente modificación del patrón de depósito respecto a lo esperado inicialmente. El diámetro que alcanza una partícula después de su crecimiento higroscópico depende de su diámetro inicial, de las propiedades intrínsecas de la partícula y de las condiciones ambientales de las vías aéreas. La fracción molar de vapor de agua contenida en la vía aérea ha demostrado ser un factor importante en relación con el aumento del DMMA de las partículas del aerosol10. En general se considera que el crecimiento higroscópico afecta poco a las partículas con DMMA inferior a 0,1μm, mientras que es muy intenso en las partículas con DMMA superior a 0,5μm11.
La higroscopicidad de las moléculas puede ser empleada para intentar favorecer el depósito de fármacos inhalados. Se han desarrollado estudios en los que se administraba un aerosol con DMMA submicrométrico o nanométrico para reducir las pérdidas extratorácicas, aprovechando su crecimiento posterior debido a la higroscopicidad para facilitar la retención dentro de los pulmones12,13.
Mecanismos de aclaramiento mucociliarUna vez depositadas en las vías aéreas, las partículas pueden ser arrastradas por el sistema mucociliar, degradadas o absorbidas a la circulación sistémica o a los conductos linfáticos9. El primer mecanismo se da en las vías aéreas de conducción (desde la tráquea hasta los bronquiolos terminales), tapizadas por epitelio ciliado, el cual está cubierto por moco en el que se distinguen dos capas: una capa periciliar de baja viscosidad, o sol, y una capa que cubre a esta, más espesa, o gel. Esta capa bifásica de moco protege al epitelio de la deshidratación, ayuda a humidificar el aire y proporciona una barrera protectora al atrapar las partículas inhaladas14. Las partículas insolubles quedan atrapadas en el gel y se desplazan hacia la región faringolaríngea por el movimiento de los cilios del epitelio, donde va a ser expectorado o deglutido15,16. La velocidad de aclaramiento va a depender del número de células ciliadas y de la frecuencia con que batan los cilios, y puede verse afectada por factores que actúen sobre el funcionamiento de los cilios o sobre la cantidad y la calidad del moco. Por ejemplo, en la fibrosis quística (FQ) se produce un moco muy espeso que no se desplaza correctamente por el movimiento de los cilios, debido a una mutación en el gen que codifica el receptor CFTR que regula el paso del ión cloruro a través de la superficie de las células epiteliales17.
Las partículas solubles son eliminadas por mecanismos absortivos. Las moléculas liposolubles atraviesan el epitelio respiratorio por transporte pasivo; las moléculas hidrosolubles pueden atravesar la barrera epitelial bien a través de los espacios intercelulares o bien por transporte activo (por mecanismos de endocitosis y exocitosis)18. Una vez ubicadas en la región submucosa, las partículas pueden pasar a la circulación sistémica, a la circulación bronquial o al sistema linfático9. Las partículas que alcanzan a depositarse en los alvéolos pueden ser fagocitadas y eliminadas por los macrófagos alveolares, en el caso de que sean partículas insolubles (mecanismo no absortivo)19, o bien ser absorbidas hacia la circulación sistémica si son solubles20.
Lugares óptimos de depósito de fármacos en el tratamiento de algunas enfermedades respiratoriasLa vía inhalada presenta una serie de ventajas sobre la vía sistémica que la hacen preferible para el tratamiento de enfermedades locales: pueden administrarse dosis elevadas de fármaco que serán rápidamente absorbidas a través del epitelio de las vías aéreas, produciendo un rápido inicio de acción y minimizándose los efectos secundarios sistémicos. Si un fármaco aerosolizado se deposita en una dosis subóptima o en una región del pulmón no afectada por la patología a tratar, la efectividad del tratamiento se verá comprometida21. Los receptores para los fármacos agonistas adrenérgicos β2 (salbutamol, terbutalina) y para los fármacos antagonistas de los receptores muscarínicos M3 (bromuro de ipratropio) no se distribuyen de manera uniforme por el pulmón. Más del 90% de los receptores β se localizan en la pared alveolar, y concretamente los receptores β2 se localizan en alta densidad en el epitelio de la vía aérea comprendida entre los bronquios principales y los bronquiolos terminales22. Los receptores M3 se encuentran en alta densidad en las glándulas submucosas y ganglios del pulmón, y en menor proporción en el músculo liso de las vías aéreas, en los nervios que inervan a los bronquios y en la pared alveolar23. La localización de estos receptores en el pulmón sugiere que el bromuro de ipratropio debería depositarse en las vías aéreas de conducción para alcanzar una mayor efectividad, mientras que el salbutamol debería depositarse de manera más periférica (en las medianas y pequeñas vías aéreas) para producir un adecuado efecto terapéutico. En el caso de los corticoides inhalados, el tratamiento parece ser más beneficioso cuanto más se disperse el fármaco por los pulmones, ya que las células inflamatorias tales como eosinófilos, linfocitos y macrófagos se encuentran presentes a lo largo de las vías respiratorias y los alvéolos en pacientes asmáticos24,25. El lugar óptimo para el depósito de antibióticos aerosolizados va a depender de la enfermedad a tratar. En el caso de la FQ existe una colonización crónica por Pseudomonas aeruginosa, que tiende a crecer en la luz de las vías aéreas, con una invasión limitada del parénquima pulmonar. La infección se inicia en los bronquiolos y se va desplazando hacia vías más proximales26, por lo tanto el sitio ideal de depósito de los antibióticos inhalados sería a lo largo de todas las vías aéreas de conducción. Las acumulaciones de moco en determinadas zonas pueden obstaculizar el depósito del antibiótico en regiones posteriores a la obstrucción, las cuales son presumiblemente las zonas más infectadas, viéndose entonces comprometida la eficacia del tratamiento9,27.
Dispositivos para la administración de fármacos inhaladosEl tratamiento de las infecciones respiratorias mediante vahos se viene realizando tradicionalmente desde tiempos inmemorables. En 1828, Schneider y Waltz desarrollaron un pulverizador cuya finalidad eran las duchas con aguas minerales, pero que fue utilizado también como inhalador. El primer inhalador portátil fue creado en 1856 por Sales-Giron, médico de balneario, y se trataba de un pulverizador de líquidos manual que permitía que los enfermos realizaran en su domicilio sesiones inhalatorias de infusiones balsámicas. El descubrimiento de la adrenalina en 1901 por Takamine y Aldrich, y su administración de forma inhalada por primera vez en 192928, abrieron la puerta a la búsqueda y administración de nuevos fármacos inhalados, y al perfeccionamiento de los dispositivos para su administración29.
Los dispositivos empleados en la actualidad para la administración de fármacos inhalados pueden dividirse en tres tipos: nebulizadores, inhaladores con cartucho presurizado e inhaladores de polvo.
NebulizadoresLos nebulizadores son básicamente de dos tipos, los jet y los ultrasónicos. Los nebulizadores tipo jet se basan en el efecto Bernouilli, según el cual un gas comprimido que pasa a través de un orificio estrecho crea una zona de baja presión a la salida del mismo. Si en este punto de baja presión se une el extremo de un conducto que contiene una fina capa de líquido, la baja presión originada hará que este líquido sea aspirado formándose pequeñas gotas. Los nebulizadores ultrasónicos emplean un cristal piezoeléctrico que vibra a una frecuencia elevada dentro de la cámara nebulizadora, transmitiendo la energía vibratoria al líquido en contacto con él y convirtiendo dicho líquido en aerosol30. Los nebulizadores en jet por lo general pueden aerosolizar la mayor parte de las soluciones de fármacos, y los ultrasónicos pueden que no sean eficaces si se emplean soluciones o suspensiones viscosas31.
Los nebulizadores permiten administrar dosis elevadas de fármacos en pacientes sin capacidad de coordinación o de cooperación y permiten la administración de varias sustancias mezcladas en una misma solución. El flujo inspiratorio mínimo necesario para que el aerosol producido por un nebulizador alcance los pulmones es de 6-8l/min2. Sin embargo, se producen elevadas pérdidas de fármaco al quedar retenida gran parte de la medicación en el nebulizador en forma de espacio muerto o al perderse en el aire ambiente durante la espiración. Se ha estimado que tan solo el 10% de la dosis colocada inicialmente en el nebulizador va a depositarse eficazmente en los pulmones32. Las gotas grandes van a quedar depositadas en la orofaringe, mientras que las demasiado pequeñas penetran en los pulmones y vuelven a ser expulsadas durante la espiración.
El depósito pulmonar puede aumentarse modificando el modo de inhalación del paciente. La mayoría de los pacientes inhalan empleando el volumen circulante propio. Si se realizan inhalaciones profundas seguidas de una apnea, la cantidad de fármaco retenida en los pulmones puede incrementarse hasta un 14-17%8. Probablemente la manera más práctica de modificar el patrón de depósito sea disminuir el tamaño de las gotas generadas. Esto puede producirse en los nebulizadores ultrasónicos haciendo vibrar al cristal piezoeléctrico a una mayor frecuencia, y en los de tipo jet aumentando el flujo del gas comprimido33.
Inhaladores con cartucho presurizadoLos inhaladores con cartucho presurizado (ICP) son dispositivos para la administración de fármacos aerosolizados que emiten una dosis fija de fármaco en cada pulsación. Disponen de una cámara metálica con una suspensión o solución del fármaco en un propelente en fase líquida que, a temperatura ambiente y a presión atmosférica, pasa a fase gaseosa. Una pieza clave en este sistema es la válvula dosificadora, pieza que permite liberar en cada pulsación una dosis controlada y reproducible del fármaco. El fármaco sale a una velocidad muy elevada, de más de 30m/s, a través de una boquilla, y en forma de partículas con DMMA comprendida entre 2 y 4μm34. Los ICP tienen una serie de ventajas, como su pequeño tamaño, que les hace muy manejables, la exactitud de la dosificación, la capacidad de acoplarlos a cámaras espaciadoras, el hecho de no precisar de flujos altos para ser inhalados o su coste en general reducido. Los principales inconvenientes son la dificultad para la sincronización activación-inhalación y la baja dosis que alcanza los pulmones, que se ha estimado en aproximadamente el 10-20% de la dosis emitida35,36. La elevada velocidad de salida y el gran tamaño de las partículas generadas ocasionan que más de la mitad impacte contra la región orofaríngea36. Otro inconveniente de los ICP es la posible variación en la dosis liberada en cada pulsación si el dispositivo no se agita correctamente34.
Tradicionalmente el propelente empleado eran los clorofluorocarbonos (CFC), pero debido a su efecto nocivo sobre la capa de ozono han sido prohibidos por la Organización de las Naciones Unidas. El sustituto empleado actualmente en los ICP son los hidrofluoroalcanos (HFA)37. Los HFA pasan a estado gaseoso a una temperatura superior que los CFC38, lo cual reduce el efecto freón-frío, que consiste en la interrupción de la inspiración al chocar las partículas contra la pared posterior de la orofaringe. Actualmente se encuentran comercializados ICP-HFA de salbutamol, fluticasona, beclometasona, anticolinérgicos y la combinación salmeterol-fluticasona34. El desarrollo de ICP con HFA también ha permitido reducir el tamaño de las gotas del aerosol y, por tanto, mejorar el depósito pulmonar del fármaco. En el caso de la beclometasona-HFA, con un DMMA de 1,1μm, se han demostrado depósitos de hasta el 56% de la dosis inicial39–41.
Las condiciones óptimas para la inhalación de un aerosol empleando un ICP son empezar a respirar desde capacidad residual funcional, activando en ese momento el inhalador, inspirar empleando un flujo inspiratorio inferior a 60l/min y hacer al final de la inspiración una apnea de 10s42. De este modo se incrementa el depósito por sedimentación en las zonas más periféricas de la vía aérea. El flujo inspiratorio mínimo necesario para su uso es de aproximadamente 20l/min2.
Una manera de evitar la falta de coordinación entre el paciente y el dispositivo son las cámaras de inhalación, que se acoplan a la boquilla del ICP. El aerosol pasa al interior de la cámara y las partículas demasiado grandes chocan contra sus paredes quedando retenidas en ella, mientras que las partículas más pequeñas permanecen en suspensión dentro de la cámara hasta que son inhaladas por el paciente. Además, el espacio que proporciona la cámara entre el ICP y la boca del paciente permite que el aerosol reduzca su velocidad, disminuyendo el choque contra la orofaringe. De este modo se reducen los efectos adversos locales y se aumenta el depósito pulmonar del fármaco43. Se ha demostrado que los ICP empleados con cámara de inhalación son tan eficaces como los nebulizadores en el tratamiento de los ataques agudos de asma44.
También, con el objetivo de evitar la descoordinación activación-inhalación se han desarrollado ICP que se disparan automáticamente con la inspiración del paciente, como el Autohaler® y el Easybreath®, que han demostrado mejorar el depósito pulmonar del fármaco en pacientes con dificultad de coordinación45. Además requieren de un menor flujo inspiratorio que los ICP convencionales, en torno a 18-30l/min, lo que los hace más adecuados para pacientes con limitaciones físicas, niños y ancianos34,46.
Inhaladores de polvoLos inhaladores de polvo (IPS) fueron desarrollados con el objetivo de eliminar las dificultades de coordinación propias de los ICP. Permiten administrar dosis individuales de fármaco en forma de polvo contenido en cápsulas que deben pincharse antes de su administración (sistemas unidosis), o en blísteres que se desplazan en el dispositivo y reservorios de polvo (sistemas multidosis).
Otras ventajas de los IPS son que no requieren de propelentes para su administración, lo que los hace más respetuosos con el medio ambiente, y que muchos de ellos disponen de un indicador de dosis restantes. Como principales inconvenientes cabe destacar que el paciente percibe en menor medida la introducción del fármaco en la vía aérea, lo cual puede perjudicar el cumplimiento del tratamiento, y su precio en general es más elevado que el de los ICP. Deben conservarse en un ambiente seco, ya que la humedad favorece la formación de aglomerados de polvo que pueden obstruir el sistema de inhalación37.
La dosis que llega al pulmón es similar a la de los ICP, y menos del 20% de la dosis inicial alcanza los pulmones. Se ha demostrado que si la técnica inhalatoria es la adecuada, no existe diferencia entre la administración de un determinado fármaco mediante IPS o ICP47. El empleo de un bajo flujo inspiratorio, la humedad y los cambios en la temperatura son factores que han demostrado empeorar el depósito pulmonar del fármaco en los IPS48.
En los IPS el aerosol se produce por el esfuerzo inspiratorio del paciente47. Es necesario un flujo inspiratorio de por lo menos 30l/min para que el fármaco en polvo se disperse y alcance los pulmones, lo cual puede ser difícil de conseguir en ancianos, niños o pacientes con un trastorno respiratorio grave49. El aire se dirige hacia el contenedor con polvo suelto, el cual por lo general consta de partículas demasiado grandes para poder penetrar en la vía aérea debido a la formación de aglomerados de polvo o a la presencia de partículas de transporte del fármaco de gran tamaño, como por ejemplo la lactosa. La dispersión del polvo en partículas que entren en la fracción respirable se produce por la formación de flujos turbulentos de aire en el contenedor de polvo, rompiendo los aglomerados de polvo en partículas de menor tamaño y separando las partículas de transporte del fármaco50. Las partículas generadas finalmente tienen un DMMA que oscila entre 1 y 2μm51,52. Cada IPS tiene una resistencia al flujo aéreo distinta que determina el esfuerzo inspiratorio necesario para dispersar el polvo. Cuanto mayor sea la resistencia del dispositivo, más difícil va a ser generar el esfuerzo inspiratorio, pero mayor va a ser el depósito del fármaco en los pulmones53,54.
Métodos para estudiar el depósito pulmonar de partículasLos primeros modelos de depósito de aerosoles en el pulmón se basaban en morfologías pulmonares muy simples y empleaban un pequeño número de condiciones de respiración y un rango limitado de tamaños de partículas. Solían ser modelos confinados a una zona de las vías respiratorias en vez de modelos de todo el tracto respiratorio. Además se limitaban a aerosoles generados en entornos industriales, como la minería.
El primer modelo matemático de depósito de partículas fue realizado en 1935 por Findeisen. Este autor, basándose en los conocimientos anatómicos de la época, dividió el tracto respiratorio en únicamente 9 generaciones, llegando hasta los ductos y sacos alveolares. En este modelo se asumían una serie de dimensiones, velocidades de flujo, tiempos de tránsito y modos de ramificación para cada generación, y se establecieron fórmulas para el cálculo del depósito de partículas en cada generación en función de los 3 mecanismos fundamentales de depósito: choque, sedimentación y difusión. Las principales limitaciones de este modelo son que no se tuvieron en cuenta las vías aéreas superiores a la tráquea, así como la simplicidad anatómica de la vía aérea inferior. Sin embargo, este modelo pionero estableció las normas básicas para el desarrollo de otros modelos posteriores55.
Otro modelo destacable fue el de Landhal de 1950, que añadió al de Findeisen dos nuevos compartimentos: la boca y la faringe56. Posteriormente Beekmans presentó en 1965 un nuevo modelo en el que se asumían los 3 mecanismos básicos de depósito, intentando corregir las dimensiones de la vía aérea ocasionadas por la expansión de la misma durante la inspiración. Además tuvo en consideración el papel de la mezcla entre aire corriente y residual en las 3 últimas generaciones de la vía aérea. En este modelo, Beekmans estableció tiempos inspiratorios y espiratorios iguales, y después de cada fase estableció una pausa en la que se producía el depósito por difusión y sedimentación57.
Un modelo de las vías aéreas más detallado anatómicamente fue el de Davies, con 15 generaciones, comenzando en la boca y finalizando en los sacos alveolares. Sin embargo, no fue este el esquema empleado para el desarrollo de un modelo matemático de cálculo del depósito de partículas58. El modelo anatómico más empleado con este fin fue el de Weibel. En este modelo se indican los modos de bifurcación, designando a la tráquea como la primera vía aérea (orden 0) y presumiendo que cada vía aérea da origen a dos ramificaciones (dicotomía regular). Weibel describió un mínimo de 23 generaciones bronquiales hasta los conductos alveolares59.
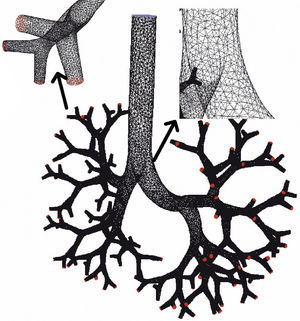
Existen otros muchos estudios teóricos posteriores sobre el comportamiento del flujo en las vías aéreas60–69. El enfoque de dichos estudios se ha venido centrando, por lo general, en secciones aisladas del pulmón, como la tráquea y las primeras generaciones de la vía aérea o los conductos y sacos alveolares. Actualmente los estudios que predominan se basan en la dinámica computacional de fluidos (CFD, computational fluid dynamics). La CFD es la técnica que intenta utilizar los ordenadores para la simulación del movimiento de los fluidos y busca resolver las ecuaciones matemáticas que gobiernan su movimiento (ecuaciones de Navier-Stokes). De este modo se puede simular el comportamiento de un fluido y de las partículas que viajen en él. Mediante la CFD es posible desarrollar un modelo de las vías aéreas, con el grado de detalle que se desee, a fin de simular el comportamiento del aire y de las partículas de aerosol en su interior (figs. 1 y 2)70. Pueden emplearse imágenes de tomografía computarizada (TC) torácica de un paciente para desarrollar un modelo personalizado y comprobar el depósito de fármacos inhalados en ese paciente71.
Modelo teórico de la vía aérea humana hasta la séptima generación para cálculo de la dinámica computacional de fluidos (CFD). Puede observarse que está compuesto por múltiples celdas con forma de tetraedro dentro de cada una de las cuales el programa de CFD calculará el comportamiento del aire.
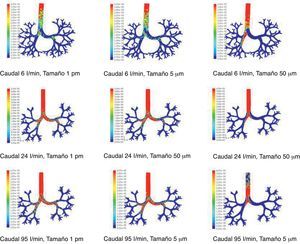
Resultados de la simulación mediante dinámica computacional de fluidos (CFD) del comportamiento de partículas de distintos tamaños (1pm, 5μm y 50μm) que son arrastradas por caudales de 6, 24 y 95l/min. Las zonas en rojo indican alta densidad de partículas atrapadas. Puede observarse que conforme aumenta el tamaño de las partículas y el caudal, tienden a quedar atrapadas en mayor cantidad en regiones más centrales de la vía aérea debido al comportamiento de choque.
A la vez que fueron surgiendo estos modelos matemáticos, se desarrollaron numerosos estudios experimentales de depósito de partículas, como los realizados por Drinker, Brown, Patterson, etc.72–74, cuyos resultados, en términos generales, no diferían de los modelos matemáticos. Estos estudios experimentales por lo general calculaban el depósito total del aerosol midiendo la cantidad del mismo que entraba y salía del tracto respiratorio75.
En la actualidad las técnicas más empleadas para determinar la distribución de fármacos inhalados son la gammagrafía y la tomografía computarizada por emisión de fotones individuales (SPECT, single photon emission computarized tomography) en 3 dimensiones (3D), aunque otras técnicas, como la tomografía por emisión de positrones (PET) y la resonancia magnética (RM), están cobrando fuerza. Estas técnicas se emplean en combinación con fármacos o moléculas marcados radiactivamente76.
El isótopo más empleado en la gammagrafía y en el 3D SPETC es el tecnecio-99m (99mTc), que se asocia al fármaco en estudio pero sin formar parte del mismo. La gammagrafía proporciona imágenes planas del pulmón, es decir, en 2 dimensiones (2D), y se ha empleado frecuentemente para comparar la eficiencia del depósito pulmonar de aerosoles empleando distintos dispositivos de inhalación, así como los efectos de diferentes parámetros respiratorios y de la enfermedad pulmonar sobre el depósito. La distribución del fármaco por lo general se estudia según zonas de interés, es decir, comparando la región apical con la basal, o una distribución central con la periférica76.
El SPECT permite obtener imágenes 2D acumulativas del tórax del paciente, lo cual permite conseguir imágenes más precisas para la evaluación del patrón de depósito de fármaco en los pulmones. Sin embargo, esto no es posible si no se dispone de un marcador radiactivo directo y no absorbible para el fármaco en estudio. Sí es útil, en cambio, para el estudio de variables secundarias a la inhalación de fármacos, como la ventilación y la perfusión pulmonar, el aclaramiento mucociliar o la permeabilidad epitelial pulmonar76.
En el caso del PET, los marcadores empleados suelen ser el carbono, el flúor, el nitrógeno y el oxígeno, átomos constituyentes de cualquier molécula orgánica, por lo que resulta más sencillo marcar el fármaco en estudio. Los marcadores más habitualmente empleados con el C11 y el F18. Las imágenes obtenidas por PET pueden dividirse en zonas de más centrales a más periféricas y correlacionarlo con el grado de radiactividad detectado y, por lo tanto, con la dosis de fármaco depositado en cada región76.
DiscusiónLa medicación inhalada constituye el tratamiento de primera línea de enfermedades como el asma o la EPOC. Los laboratorios estudian continuamente nuevos dispositivos de inhalación que permitan un mayor depósito de fármaco en el pulmón. Para lograr que un fármaco aerosolizado sea efectivo debe conseguirse que una cantidad adecuada del mismo sea capaz de depositarse más allá de la región orofaríngea. El lugar en que se produzca el depósito (vías aéreas centrales o periféricas) y la distribución uniforme o no uniforme del fármaco inhalado también juegan un importante papel en su efectividad.
El efecto de las terapias en aerosol depende tanto de la dosis depositada como de su distribución en el pulmón. Si un aerosol se deposita en una dosis subóptima o en una región del pulmón no afectada por la patología a tratar, la efectividad del tratamiento se verá comprometida.
Factores como el tamaño de las partículas del aerosol, las condiciones de respiración, la geometría de las vías aéreas o los mecanismos de aclaramiento mucociliar juegan un papel fundamental en el depósito pulmonar de los fármacos aerosolizados.
Estas peculiaridades de cada individuo hacen que resulte interesante disponer en la práctica clínica de algún método que permita individualizar las terapias aerosolizadas. Un modo de lograr una mayor individualización de los tratamientos sería la elaboración de modelos de la vía aérea exclusivos de cada paciente mediante técnicas CFD. En los hospitales se dispone cada vez de escáneres más potentes con una alta resolución y softwares que permiten la reconstrucción tridimensional del árbol bronquial. Estas imágenes constituirían una importante fuente de datos para la construcción de un modelo que permita el análisis del flujo y el depósito de partículas mediante las técnicas de CFD. Las posibilidades de la TC para el estudio de la vía aérea están infravaloradas.
En la fase actual de los conocimientos, estos modelos matemáticos, calculados aplicando técnicas de CFD sobre información de la TACAR, deberán ser contrastados y evaluados a partir de la aproximación clásica que aportan las imágenes de la gammagrafía o el PET. Creemos que la aplicación de estos modelos teóricos permitirá el estudio de depósito de fármacos y el diseño de nuevos dispositivos de inhalación que contribuyan a mejorar a nuestros pacientes. En cualquier caso, una buena fuente de «inspiración» podría ser la forma con que se produce la «inspiración» en cualquiera de nuestros fumadores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.