El objetivo del presente documento es actualizar el consenso previo publicado en 2013, en relación con 12 áreas controvertidas en el manejo de la tromboembolia de pulmón (TEP). Para cada área se realizó una exhaustiva revisión bibliográfica y una propuesta de recomendación, sometida a un proceso de debate interno en dos teleconferencias sucesivas. En relación con el diagnóstico, recomendamos no utilizar la escala Pulmonary Embolism Rule Out Criteria (PERC) de forma aislada para descartar la TEP y, cuando haya indicación de dímero D, recomendamos emplear un punto de corte ajustado a la edad. Sugerimos utilizar la angiotomografía computerizada de tórax como prueba de imagen para el diagnóstico de la mayoría de los pacientes con sospecha de la enfermedad. Se recomienda utilizar anticoagulantes de acción directa (en vez de antagonistas de la vitamina K) para el tratamiento de la mayoría de los pacientes con TEP, y se sugiere utilizar anticoagulación para la mayoría de los pacientes con TEP subsegmentaria. Se recomienda no colocar un filtro de vena cava inferior en la mayoría de los pacientes. Si se indica tratamiento de reperfusión, el panel recomienda utilizar fibrinolisis sistémica a dosis completas. La duración de la anticoagulación está condicionada principalmente por la presencia (o ausencia) y el tipo de factor de riesgo para enfermedad tromboembólica venosa, y recomendamos no realizar estudios de trombofilia para decidir la duración de la anticoagulación a la mayoría de los pacientes con TEP. Finalmente, sugerimos no realizar cribado extendido de cáncer oculto en pacientes con TEP.
We have updated recommendations on 12 controversial topics that were published in the 2013 National Consensus on the diagnosis, risk stratification and treatment of patients with pulmonary embolism (PE). A comprehensive review of the literature was performed for each topic, and each recommendation was evaluated in two teleconferences. For diagnosis, we recommend against using the Pulmonary Embolism Rule Out Criteria (PERC) rule as the only test to rule out PE, and we recommend using a D-dimer cutoff adjusted to age to rule out PE. We suggest using computed tomography pulmonary angiogram as the imaging test of choice for the majority of patients with suspected PE. We recommend using direct oral anticoagulants (over vitamin K antagonists) for the vast majority of patients with acute PE, and we suggest using anticoagulation for patients with isolated subsegmental PE. We recommend against inserting an inferior cava filter for the majority of patients with PE, and we recommend using full-dose systemic thrombolytic therapy for PE patients requiring reperfusion. The decision to stop anticoagulants at 3 months or to treat indefinitely mainly depends on the presence (or absence) and type of risk factor for venous thromboembolism, and we recommend against thrombophilia testing to decide duration of anticoagulation. Finally, we suggest against extensive screening for occult cancer in patients with PE.
El presente consenso para el manejo de la tromboembolia de pulmón (TEP) ha sido elaborado gracias a la colaboración de expertos de las siguientes sociedades científicas: Sociedad Española de Cardiología (SEC), Sociedad Española de Medicina de Urgencias y Emergencias (SEMES), Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Radiología (SERAM), Sociedad Española de Trombosis y Hemostasia (SETH) y Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
Como método de trabajo, los coordinadores identificaron 12 preguntas críticas, cada una de las cuales fue asignada a dos miembros del panel. Cada pareja realizó una revisión sistemática y una propuesta de recomendación, sometida a un proceso de debate interno en dos teleconferencias sucesivas. Posteriormente, las recomendaciones fueron votadas de forma anónima, requiriéndose un consenso de más del 80% para su aprobación final. Entonces, los coordinadores elaboraron un documento conjunto a partir de los borradores efectuados por cada una de las parejas. Este borrador fue sometido a una revisión crítica final por parte de todos los miembros del panel. La graduación de la fuerza de la recomendación se realizó de acuerdo con el sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE) y se apoyó no solo en la calidad de la evidencia, sino en otros factores como el balance entre riesgos y beneficios, los valores y preferencias de pacientes y profesionales, y el consumo de recursos o costes.
1.¿Es seguro el uso aislado (sin necesidad de ninguna otra prueba adicional) de la escala PERC para descartar la TEP en el Servicio de Urgencias?Se recomienda no utilizar la escalaPulmonary Embolism Rule Out Criteria(PERC) de forma aislada (sin necesidad de ninguna otra prueba diagnóstica adicional) para descartar la TEP en el Servicio de Urgencias.
La escala PERC (tabla 1) fue desarrollada con el objeto de disminuir el número de exámenes adicionales en el proceso diagnóstico de los pacientes con sospecha de TEP aguda sintomática. Los pacientes con una escala negativa no requerirían ninguna otra prueba adicional (ni siquiera dímero D) para descartar el diagnóstico de la enfermedad.
Escala PERC
| Edad < 50 años |
| Frecuencia cardiaca < 100 |
| SaO2 > 94% respirando aire ambiente |
| No historia previa de TVP o TEP |
| No trauma o cirugía recientes |
| No hemoptisis |
| No uso de estrógenos |
| No inflamación unilaterial de una pierna |
| La escala es negativa si el paciente cumple TODOS los criterios anteriores |
SaO2: saturación arterial de oxígeno; TEP: tromboembolia de pulmón; TVP: trombosis venosa profunda.
En una revisión sistemática reciente, se observó una sensibilidad global del 95% y una razón de probabilidad negativa de 0,211. La calidad de la evidencia fue de muy baja a baja: 1) la escala fue calculada retrospectivamente en la mayoría de estos estudios; 2) varios de ellos presentaban un riesgo alto de sesgo; 3) el diagnóstico de referencia de TEP fue diferente en cada uno; y 4) incluyeron pacientes con sospecha baja para TEP.
En un ensayo clínico que incluyó 1.916 pacientes, la escala PERC redujo la necesidad de angiotomografía computarizada (angioTC) de tórax un 10%, la estancia media en el servicio de urgencias en 36 minutos y la necesidad de ingreso hospitalario (13 vs. 16%), sin diferencias significativas en el fracaso diagnóstico (0,1 vs. 0%) o en la mortalidad en los primeros tres meses de seguimiento (0,3 vs. 0,2%)2. La calidad de la evidencia proporcionada por este ensayo es de muy baja a baja: 1) presentaba un riesgo alto de sesgo de inclusión; 2) las características basales de los pacientes del grupo asignado a la escala PERC fueron distintas a las del grupo control; 3) hubo un riesgo alto de imprecisión; y 4) la prevalencia de TEP en el grupo control fue muy baja (3%).
En función de esta evidencia, y dado que la prevalencia de TEP en los pacientes que acuden a los servicios de urgencias españoles por sospecha de TEP aguda sintomática es más elevada3, el panel recomienda el uso de escalas clínicas bien validadas (escala de Wells [tabla S1 del anexo A]) que requieren la solicitud adicional de dímero D y/o pruebas de imagen.
2. En el algoritmo diagnóstico de la TEP, ¿se debe usar un punto de corte fijo o un punto de corte ajustado (a la edad o a la clínica)?Se recomienda utilizar el dímero D con un punto de corte ajustado a la edad en pacientes con probabilidad clínica baja o moderada de TEP, o con TEP clínicamente improbable.
Se sugiere utilizar el dímero D con un punto de corte ajustado a la clínica (estrategia YEARS) en pacientes (incluidas embarazadas) con sospecha de TEP.
Se sugiere utilizar el dímero D con un punto de corte ajustado a la probabilidad clínica (escala de Wells) en pacientes con probabilidad clínica baja o moderada de TEP o con TEP clínicamente improbable.
Se sugiere no utilizar el dímero D con un punto de corte ajustado a la edad o a la clínica en pacientes con cáncer o insuficiencia renal.
En los últimos años, se han evaluado nuevas estrategias para el diagnóstico de la TEP basadas en el uso de puntos de corte ajustados de dímero D. La primera consiste en el uso de un punto de corte ajustado a la edad (edad multiplicada por 10) en pacientes de más de 50 años4. La segunda (estrategia YEARS) consiste en el uso de un punto de corte de dímero D de 1.000 ng/mL en pacientes sin ninguno de los criterios siguientes: 1) síntomas o signos de trombosis venosa profunda (TVP), 2) hemoptisis y 3) TEP como diagnóstico más probable; y de un punto de corte de 500 ng/mL en caso de presentar uno o más de los criterios anteriores5. La tercera consiste en el uso de un punto de corte de dímero D de 1.000 ng/mL en pacientes con probabilidad clínica baja de TEP (según la escala de Wells); y de 500 ng/mL en aquellos con probabilidad clínica moderada6.
Varios estudios han analizado la seguridad (es decir, la tasa de fracaso definida como la incidencia de eventos trombóticos a tres meses entre los pacientes no anticoagulados por un resultado negativo de la estrategia aplicada) y la eficiencia (es decir, la diferencia absoluta de angioTC realizadas) para la población global y para subgrupos concretos de pacientes con sospecha de TEP (tabla 2). Se observa que en la población global, las nuevas aproximaciones presentan tasas de fracaso similares o inferiores a la estrategia clásica (como el punto de corte fijo de dímero D), pero que tienen una eficiencia mayor. En el subgrupo de pacientes embarazadas, un estudio reciente ha demostrado la seguridad y la eficiencia de la estrategia YEARS7. Sin embargo, en pacientes con cáncer o con insuficiencia renal estas estrategias aún requieren validaciones externas antes de que pueda recomendarse su uso rutinario.
Seguridad y eficiencia del uso de puntos de corte fijos o ajustados de dímero D4-6
| Dímero D fijo | Dímero D ajustado a la edad | Dímero D ajustado a la clínica (YEARS) | Dímero D ajustado a la probabilidad clínica | |
|---|---|---|---|---|
| Población global | ||||
| Tasa de fracaso | 0,65 (0,30-1,11) | 0,94 (0,58-1,5) | 0,61 (0,36-0,96) | 0 (0,00-0,29) |
| Eficiencia | - | 4,6 (4,3-4,8) | 13 (10-15) | 17,6 (15,9-19,2) |
| Gestantes | ||||
| Tasa de fracaso | - | - | 0,21 (0,04-1,2) | - |
| Eficiencia | - | - | - | - |
| Cáncer | ||||
| Tasa de fracaso | - | 3,8 (3,1-4,4) | 7,4 (5,0-11) | - |
| Eficiencia | 2,6 (0,57-11) | 1,4 (0,15-12,6) | 2,6 (1,3-5,2) | - |
| Insuficiencia renal | ||||
| Tasa de fracaso | - | - | - | - |
| Eficiencia | - | - | - | - |
Se sugiere no utilizar la gammagrafía ventilación/perfusión (V/Q) en lugar de la angioTC de tórax como prueba de imagen para el diagnóstico de la mayoría de los pacientes con sospecha de TEP aguda sintomática.
Se recomienda emplear la gammagrafía V/Q como prueba de imagen para el diagnóstico de los pacientes estables hemodinámicamente con sospecha de TEP aguda sintomática y alergia a los contrastes iodados o insuficiencia renal grave (es decir, aclaramiento de creatinina < 30 mL/min).
La V/Q ha sido sustituida por la angioTC de tórax multidetector como prueba de imagen para el diagnóstico de la mayoría de los pacientes con sospecha de TEP aguda sintomática8. A diferencia de la gammagrafía V/Q, la angioTC de tórax está disponible en la mayoría de los hospitales, requiere menos tiempo para su realización e interpretación, tiene una alta sensibilidad y especificidad, ofrece un porcentaje menor de resultados no concluyentes, aporta información pronóstica y es capaz de proporcionar un diagnóstico alternativo a la TEP hasta en un 50% de los casos9,10.
En el momento actual, la gammagrafía V/Q se reserva principalmente para pacientes con alergia documentada a los contrastes iodados y para aquellas con insuficiencia renal grave que no se encuentren en un programa de diálisis8. En las embarazadas con sospecha de TEP, tanto la gammagrafía como la angioTC exponen a la madre y al feto a una dosis de radiación muy por debajo del umbral de peligro (100 mGy)11. Si se indica una gammagrafía para una embarazada con sospecha de TEP, la radiografía de tórax debe ser normal y solo se debe realizar una gammagrafía Q (sin V). Aunque la rentabilidad de la ecografía de compresión de miembros inferiores es menor en las embarazadas que en los demás pacientes con sospecha de TEP12, parece razonable indicarla como primera prueba en el algoritmo diagnóstico.
En las figuras S1 y S2 del anexo A se presentan algoritmos diagnósticos para pacientes con sospecha de TEP y para embarazadas con sospecha de TEP, respectivamente.
4. ¿Es seguro el tratamiento ambulatorio de pacientes seleccionados con TEP aguda sintomática? ¿Cómo se identifican estos pacientes?Se sugiere el tratamiento ambulatorio (en las primeras 24 horas después del diagnóstico) de los pacientes de riesgo bajo con TEP aguda sintomática.
Se sugiere utilizar de forma indistinta la escalaPulmonary Embolism Severity Indexsimplificada (PESIs) o los criterios de Hestia para identificar a los pacientes de riesgo bajo subsidiarios de tratamiento ambulatorio.
El tratamiento domiciliario (alta en las primeras 24 horas después del diagnóstico) de un subgrupo de pacientes de riesgo bajo con TEP aguda sintomática disminuye las complicaciones relacionadas con el ingreso hospitalario, mejora su calidad de vida y reduce el gasto sanitario asociado. Un metaanálisis que incluyó 11 estudios con 1.258 pacientes con TEP tratados ambulatoriamente encontró una tasa de recurrencia trombótica venosa de 1,47% durante los tres primeros meses de seguimiento13. La tasa de TEP fatal fue de 0,47%, mientras que las tasas de hemorragia mayor e intracraneal fatal fueron de 0,81 y 0,29%, respectivamente.
El uso clínico creciente de los anticoagulantes orales de acción directa y la validación de distintas herramientas para la identificación de pacientes con riesgo bajo de complicaciones a corto plazo han facilitado el alta precoz o, incluso, el tratamiento domiciliario de un subgrupo de pacientes con TEP aguda sintomática. Las guías de práctica clínica de la Sociedad Europea de Cardiología8 recomiendan el uso de escalas pronósticas (como la escala PESIs o los criterios de Hestia [tabla S2 del anexo A]) para la identificación de pacientes con TEP de riesgo bajo que podrían beneficiarse del tratamiento domiciliario. El ensayo clínico HOME-PE demostró que ambas escalas pueden ser usadas indistintamente para la identificación de estos pacientes14. Mientras que la concordancia interobservador de la escala PESIs es mayor que la de los criterios de Hestia (haciéndola más útil para su uso por médicos no experimentados en el manejo de la TEP)15, requiere la consideración de criterios adicionales que garanticen la seguridad del tratamiento ambulatorio de la TEP (sangrado activo o riesgo alto de sangrado, trombopenia inducida por heparina, insuficiencia renal grave, falta de adherencia al tratamiento anticoagulante pautado, entorno domiciliario inadecuado, etc.) (fig. S3 del anexo A).
5. ¿Son los ACODs el tratamiento anticoagulante de elección para la TEP? ¿Con qué excepciones?Se recomienda utilizar anticoagulantes orales de acción directa (ACODs) en lugar de antagonistas de la vitamina K (AVK) para el tratamiento anticoagulante de la mayoría de los pacientes con TEP aguda sintomática.
Se recomienda no emplear ACODs para el tratamiento anticoagulante de los pacientes con diagnóstico conocido de síndrome antifosfolípido triple positivo, embarazadas y lactantes, o con insuficiencia renal grave.
Actualmente, disponemos de cuatro ACODs aprobados para el tratamiento de los pacientes con TVP y/o TEP: tres inhibidores del factor Xa (apixabán, edoxabán y rivaroxabán) y un inhibidor directo de la trombina (dabigatrán). Varios ensayos clínicos han comparado la eficacia y seguridad de los ACODs con la de los AVK para el tratamiento de los pacientes con enfermedad tromboembólica venosa (ETEV). Un metaanálisis de seis ensayos clínicos que incluyó 27.023 pacientes con ETEV demostró la no inferioridad de los ACODs respecto a los AVK en términos de eficacia (recurrencias trombóticas fatales o no fatales) (riesgo relativo [RR], 0,90; intervalo de confianza del 95% [IC 95%], 0,77 a 1,06)16. Comparados con el tratamiento anticoagulante convencional, los ACODs redujeron significativamente el riesgo de sangrados mayores (RR, 0,61; IC 95%, 0,45 a 0,83), sangrados intracraneales (RR, 0,37; IC 95%, 0,21 a 0,68), sangrados fatales (RR, 0,36; IC 95%, 0,15 a 0,84) y sangrados no mayores clínicamente relevantes (RR, 0,73; IC 95%, 0,58 a 0,93). A diferencia de los AVK, los ACODs tienen una biodisponibilidad y farmacocinética predecibles, por lo que no necesitan monitorización y son más fáciles de usar. La figura S4 en el anexo A muestra la posología de los ACODs para el tratamiento de los pacientes con ETEV.
Hay algunas situaciones clínicas en las que los ACODs están contraindicados: síndrome antifosfolípido triple positivo, insuficiencia renal con aclaramiento de creatinina < 15 mL/min (apixabán, edoxabán o rivaroxabán) o < 30 mL/min (dabigatrán), embarazo y lactancia. Deben usarse con precaución si hay riesgo de interacciones medicamentosas (inhibidores/inductores de la glicoproteína P [gp-P] y del citocromo P450 3A4 [CYP3A4]) o de malabsorción; y hay poca experiencia clínica sobre su uso en pacientes con trombosis de localización inusual (TVP de miembros superiores, trombosis asociada a catéter, trombosis de senos venosos o trombosis esplácnicas). La tabla 3 proporciona una guía para la elección del tratamiento anticoagulante oral en distintas situaciones clínicas.
Anticoagulantes orales para el tratamiento de la tromboembolia de pulmón
| Factor | AVK | Apixabán | Dabigatrán | Edoxabán | Rivaroxabán |
|---|---|---|---|---|---|
| Necesidad de tratamiento de reperfusión* | X | X | X | ||
| No necesidad de anticoagulación parenteral | X | X | |||
| Administración una vez al día | X | X | X | ||
| RGE o uso de IBP | X | X | X | X | |
| Mala adherencia al tratamiento | X | ||||
| Posibilidad de administración fuera de las comidas | X | X | X | X | |
| Desnutrición, déficit de vitamina K | X | X | X | X | |
| Administración disueltos en líquido | X | X | X |
AVK: antagonistas de la vitamina K; IBP: inhibidores de la bomba de protones; RGE: reflujo gastroesofágico.
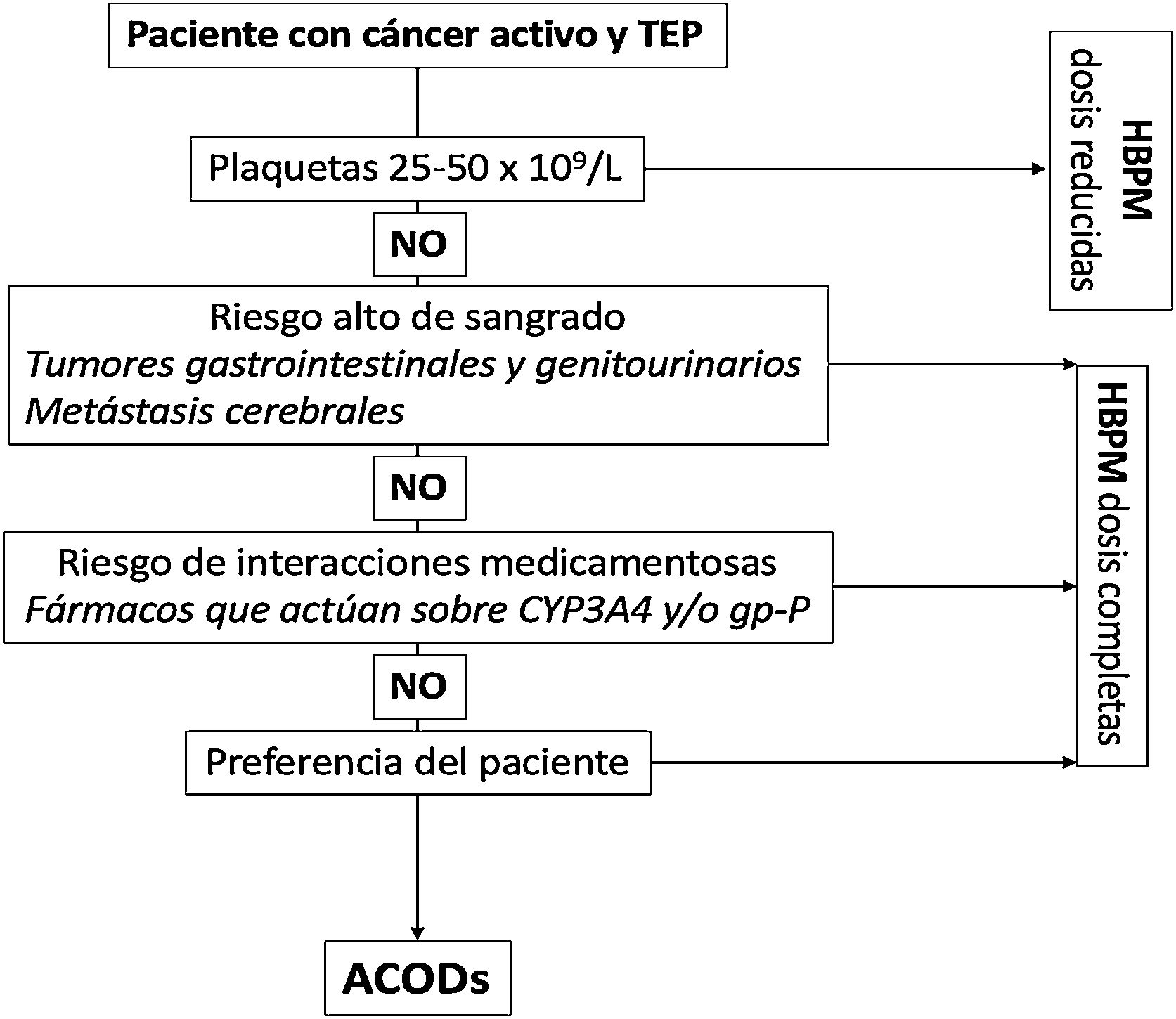
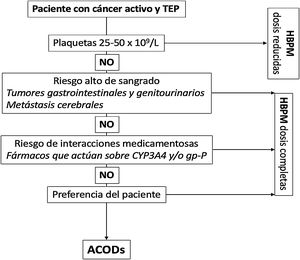
Se recomienda utilizar heparinas de bajo peso molecular (HBPM), apixabán, edoxabán o rivaroxabán en lugar de AVK para el tratamiento anticoagulante de los pacientes con TEP secundaria a cáncer.
Las HBPM en monoterapia han sido tradicionalmente el tratamiento de elección de la TEP secundaria al cáncer. Comparadas con los AVK, se asocian con una reducción estadísticamente significativa de las recurrencias trombóticas (RR, 0,58), sin diferencias significativas en los sangrados mayores o menores, o en la mortalidad17.
Hasta la fecha, se han publicado cuatro ensayos clínicos que han comparado dalteparina con alguno de los ACODs (apixabán [dos], edoxabán y rivaroxabán). En contraste con los ACODs, la dalteparina se vinculó con un aumento significativo de recurrencias trombóticas (RR, 1,55; IC 95%, 1,19 a 2,03) y a una disminución significativa de los sangrados no mayores clínicamente relevantes (RR, 0,68; IC 95%, 0,54 a 0,86), fundamentalmente asociados con tumores gastrointestinales18. No hubo diferencias estadísticamente significativas en los sangrados mayores (RR, 0,74; IC 95%, 0,52 a 1,06).
En la figura 1 mostramos un algoritmo para la elección del tratamiento anticoagulante en los pacientes con TEP asociada a cáncer.
Anticoagulación en pacientes con TEP asociada a cáncer.
ACODs: anticoagulantes orales de acción directa; CYP3A4: citocromo P450 3A4; gp-P: glicoproteína P; HBPM: heparina de bajo peso molecular; TEP: tromboembolia de pulmón.
Para pacientes con recuentos plaquetarios < 25 x 109/L se sugiere la inserción de un filtro recuperable de vena cava inferior sobre la transfusión de plaquetas y tratamiento anticoagulante.
Se sugiere utilizar tratamiento anticoagulante para la mayoría de los pacientes con TEP subsegmentaria.
NOTA: Para los pacientes con TEP subsegmentaria y riesgo de sangrado alto (aun sin contraindicación formal para la anticoagulación), se puede considerar no emplear terapia anticoagulante, siempre que se reúnan todos los criterios: afectación de una sola arteria subsegmentaria, ausencia de TVP concomitante por prueba de imagen, reserva cardiopulmonar adecuada y ausencia de un factor de riesgo permanente para ETEV.
Dado que la angioTC de tórax multidetector permite una mejor visualización de las arterias pulmonares periféricas, el uso generalizado de esta técnica ha supuesto un incremento en la detección de TEP subsegmentarias (sin afectación de arterias más proximales), que en la actualidad suponen aproximadamente el 10 al 15% del total de TEP diagnosticadas19.
Sin embargo, no se ha aclarado completamente si las TEP subsegmentarias son hallazgos falsos positivos («artefactos» radiológicos) ni su significado clínico (si representan formas más benignas de la enfermedad). En un metaanálisis de 14 estudios, la tasa de sangrados entre los pacientes anticoagulados por TEP subsegmentaria fue de 8,1% (sin información para el grupo de pacientes que no recibieron anticoagulación). La tasa de recurrencias trombóticas a 90 días entre los pacientes anticoagulados fue de 5,3 vs. 3,9% entre los no anticoagulados; y la mortalidad de 2,1 vs. 3,0%, respectivamente20. Por el contrario, un análisis de dos estudios prospectivos que incluyeron un total de 116 pacientes con TEP subsegmentaria (16% del total de TEP) encontró una tasa de recurrencias trombóticas de 3,6% en el grupo de TEP subsegmentaria vs. 2,5% en pacientes con TEP más proximales21.
Ante la falta de evidencia robusta sobre el mejor manejo de la TEP subsegmentaria, el panel valoró especialmente el bajo riesgo de sangrado mayor asociado a tres meses de anticoagulación (particularmente con los ACODs [recomendación 5]). No obstante, este es uno de los escenarios que requiere una valoración individualizada del riesgo de recurrencia, del riesgo de sangrado y de las preferencias del paciente. Por este motivo, particularmente en los pacientes con un riesgo de sangrado percibido por el clínico mayor del habitual (escala RIETE [tabla S3 del anexo A]), se puede considerar no utilizar tratamiento anticoagulante si el riesgo de trombosis es bajo (es decir, afectación de una sola arteria subsegmentaria, ausencia de TVP concomitante por prueba de imagen, reserva cardiopulmonar adecuada y ausencia de un factor de riesgo permanente para ETEV).
8. ¿Cuáles son las indicaciones para insertar un filtro de vena cava inferior?Se recomienda no colocar un filtro de vena cava recuperable en la mayoría de los pacientes con TEP aguda sintomática.
Se recomienda colocar un filtro de vena cava recuperable en pacientes con TEP aguda sintomática y contraindicación absoluta para la anticoagulación.
Los resultados de los ensayos clínicos sugieren que la colocación de un filtro de vena cava inferior en pacientes con ETEV disminuye el riesgo de recurrencia en forma de TEP, aumenta el riesgo de recurrencia en forma de TVP y no modifica la mortalidad22,23. En función de estos hallazgos y de los datos procedentes de estudios observacionales24, el panel recomienda su colocación en pacientes con contraindicación absoluta para la anticoagulación. Siempre que sea posible, se deberá colocar un filtro recuperable, y este deberá ser retirado tan pronto como se pueda iniciar la anticoagulación.
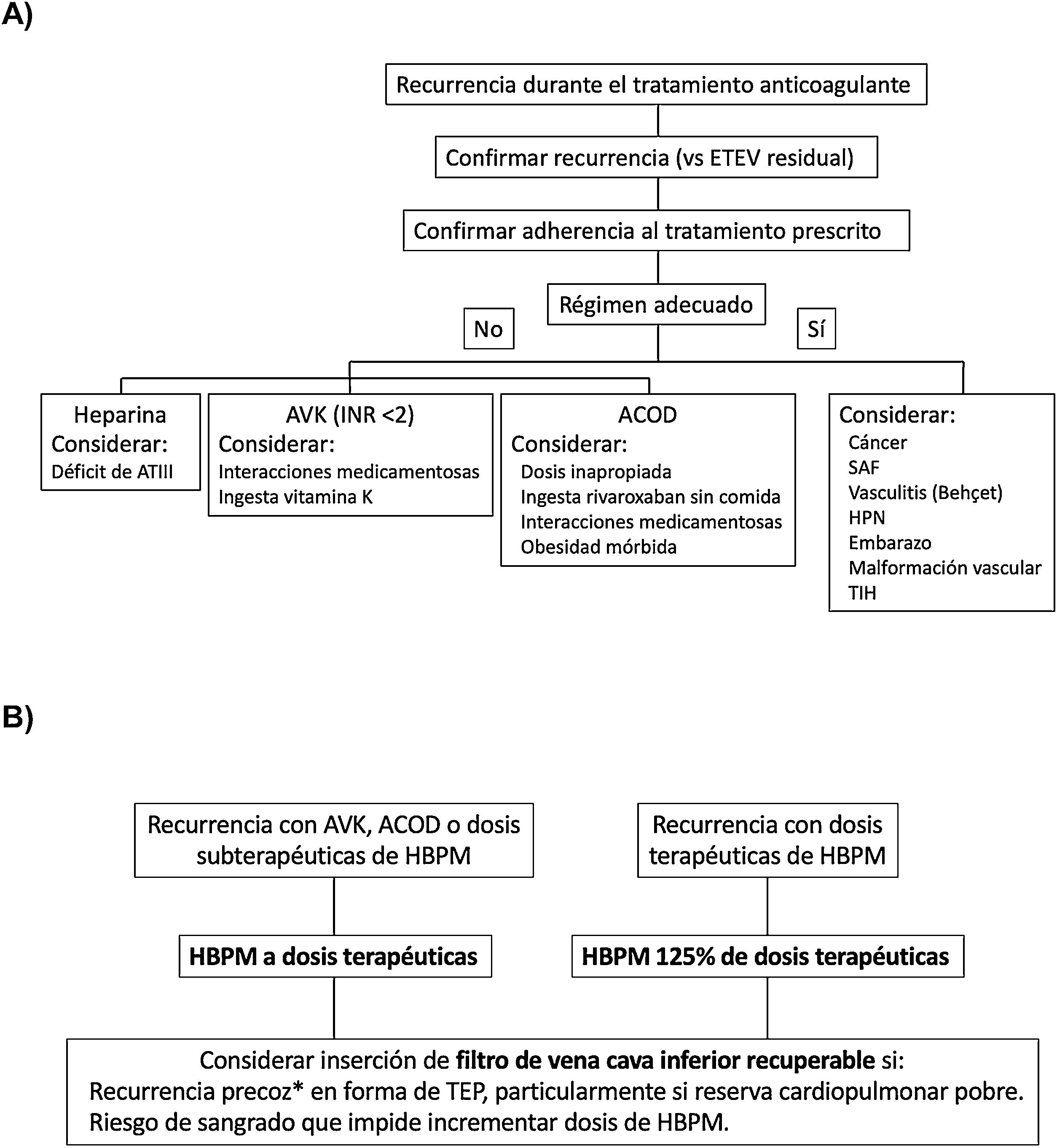
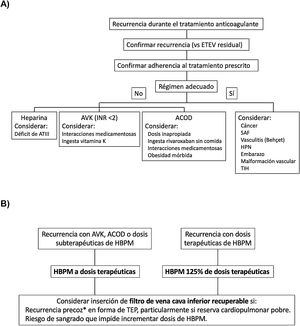
En un ensayo clínico que incluyó 399 pacientes con TEP aguda sintomática, TVP concomitante y mala reserva cardiopulmonar, la colocación de un filtro de vena cava inferior no redujo de manera significativa las recurrencias trombóticas en los tres primeros meses de seguimiento (RR, 2.0; IC 95%, 0,5 a 7,9), por lo que no se recomienda su empleo rutinario en este escenario25. Las recomendaciones de las guías de práctica clínica discrepan sobre la colocación de un filtro de vena cava inferior en pacientes con recurrencias trombóticas a pesar de anticoagulación adecuada. En la figura 2 mostramos un algoritmo para el manejo de los pacientes con recurrencias trombóticas durante el tratamiento anticoagulante.
A) Investigación y B) manejo de los pacientes con recurrencias trombóticas durante el tratamiento anticoagulante.
* En los primeros 14 días después del evento índice.
ACOD: anticoagulante oral de acción directa; ATIII: antitrombina III; AVK: antagonistas de la vitamina K; ETEV: enfermedad tromboembólica venosa; HBPM: heparina de bajo peso molecular; HPN: hemoglobinuria paroxística nocturna; INR: índice internacional normalizado; SAF: síndrome antifosfolípido; TIH: trombopenia inducida por heparina; TEP: tromboembolia de pulmón.
Se recomienda utilizar fibrinolisis sistémica a dosis completas para la mayoría de los pacientes con TEP aguda sintomática e indicación de tratamiento de reperfusión.
Se sugiere utilizar tratamiento percutáneo dirigido por catéter (trombectomía percutánea, fibrinolisis local o ambas) o fibrinolisis sistémica a dosis reducidas para los pacientes con TEP aguda sintomática, indicación de tratamiento de reperfusión y contraindicaciones relativas para el uso de la fibrinolisis sistémica a dosis completas.
Se sugiere usar embolectomía quirúrgica o tratamiento percutáneo dirigido por catéter (trombectomía percutánea) para los pacientes con TEP aguda sintomática, indicación de tratamiento de reperfusión y contraindicación absoluta para el uso de la fibrinolisis sistémica a dosis completas.
El tratamiento de reperfusión está indicado en pacientes con TEP aguda sintomática de riesgo alto (inestables hemodinámicamente) y en pacientes de riesgo intermedio-alto que se deterioran hemodinámicamente tras el inicio de la terapia anticoagulante8 (tabla S4 del anexo A). Los tratamientos de reperfusión de los que disponemos actualmente son: sistémicos (fibrinolisis sistémica a dosis completas o a dosis reducidas), locales dirigidos por catéter (trombectomía percutánea, fibrinolisis local o ambas) y quirúrgicos (embolectomía quirúrgica).
Para los pacientes con TEP aguda sintomática e indicación de tratamiento de reperfusión, el panel recomienda el uso de fibrinolisis sistémica a dosis completas. Esta recomendación se basa en: 1) los resultados de un ensayo clínico en 34 pacientes con TEP masiva que demostró que la administración local de activador tisular del plasminógeno recombinante (rTPA) no ofrece un beneficio significativo sobre la sistémica26, y 2) la acumulación de evidencia robusta sobre los beneficios clínicos de la fibrinolisis sistémica a dosis completas27 y la escasez de evidencia (débil) sobre los beneficios clínicos de la fibrinolisis sistémica a dosis reducidas, los tratamientos percutáneos dirigidos por catéter o la embolectomía quirúrgica28,29.
No obstante, entre un tercio y la mitad de los pacientes con TEP aguda presentan alguna contraindicación para la fibrinolisis sistémica a dosis completas, y hasta en un 10% de los casos no es efectiva. Para los pacientes con contraindicaciones absolutas para la fibrinolisis (tabla 4), las opciones terapéuticas son la embolectomía quirúrgica o la trombectomía percutánea (sin fibrinolisis local), en función de la experiencia y disponibilidad locales. Para aquellos sin contraindicación absoluta para la fibrinolisis sistémica a dosis completas, pero con un riesgo percibido de sangrado alto, un metaanálisis en red sugirió que la fibrinolisis sistémica a dosis reducidas y el tratamiento local dirigido por catéter se asociaban al mejor balance riesgo/beneficio30. De nuevo, la experiencia y la disponibilidad locales condicionan la elección de uno u otro procedimiento. La escala BACS ha sido derivada y validada para identificar a los pacientes con TEP aguda que presentan un riesgo aumentado de sangrado con el tratamiento fibrinolítico31 (tabla S5 del anexo A).
Posología de los trombolíticos y contraindicaciones para su uso
| Fármaco | Régimen | Contraindicaciones |
|---|---|---|
| rTPA | Dosis completa: 100 mg en 2 hDosis reducidas: 0,6 mg/kg (máximo de 50 mg) | AbsolutasAntecedentes de ictus hemorrágico o criptogénicoIctus isquémico en los 6 meses previosCáncer del SNCTraumatismo mayor, cirugía o TCE en las 3 semanas previasDiátesis hemorrágicaSangrado activoRelativasAIT en los 6 meses previosAnticoagulación oralEmbarazo o puerperioPunciones en lugares no compresiblesRCP traumáticaHipertensión refractaria (TAS > 180 mmHg)Hepatopatía avanzadaEndocarditis infecciosaÚlcera péptica activa |
| Estreptoquinasa | Dosis de carga de 250.000 UI en 30 min, seguidas de 100.000 UI/h en 12-24 hRégimen acelerado: 1,5 millones de UI en 2 h | |
| Uroquinasa | Dosis de carga de 4.400 UI/kg en 10 min, seguidas de 4.400 UI/kg/h en 12-24 hRégimen acelerado: 3 millones de UI en 2 h |
AIT: accidente isquémico transitorio; RCP: reanimación cardiopulmonar; rTPA: activador tisular del plasminógeno recombinante; SNC: sistema nervioso central; TAS: tensión arterial sistólica; TCE: traumatismo craneoencefálico.
Se recomienda suspender la anticoagulación a los 3 meses de un primer episodio de TEP provocada por un factor de riesgo transitorio, mayor y resuelto.
Se recomienda el tratamiento anticoagulante indefinido para los pacientes con un factor de riesgo permanente mayor (ej., cáncer activo, síndrome antifosfolípido, historia de dos o más episodios trombóticos idiopáticos).
Se recomienda el tratamiento anticoagulante indefinido para los hombres con TEP idiopática.
Se sugiere utilizar herramientas adicionales (ej., características clínicas, dímero D, escalas predictoras, estudios de trombofilia) para decidir la duración del tratamiento anticoagulante en a) mujeres con TEP idiopática, b) pacientes con TEP secundaria a un factor de riesgo transitorio, menor y resuelto, c) pacientes que desean suspender la anticoagulación (con independencia de su riesgo de recurrencia) y d) pacientes con una relación incierta riesgo/beneficio para el uso de tratamiento anticoagulante indefinido (ej., hombres con TEP idiopática y riesgo alto de sangrado).
Después de un episodio de TEP aguda sintomática, los pacientes necesitan un mínimo de tres meses de tratamiento anticoagulante32. En ese momento, la decisión sobre la duración de la terapia debe combinar el riesgo de recurrencia, el riesgo de sangrado y las preferencias del paciente. Aunque la anticoagulación reduce el riesgo de recurrencias un 90% aproximadamente, su uso multiplica por dos a seis veces el riesgo de sangrados mayores. Además, los anticoagulantes «protegen» a los pacientes únicamente mientras los usan8, por lo que la decisión no consiste en establecer un período definido de tratamiento, sino en suspender la anticoagulación o indicarla de manera indefinida.
La presencia (o ausencia) y el tipo de factor de riesgo para la ETEV es la variable más importante para decidir la duración de la anticoagulación (tabla 5). Los pacientes diagnosticados de una TEP secundaria a un factor de riesgo transitorio, mayor y resuelto tienen un riesgo de recurrencia muy bajo al suspender la anticoagulación33, y el panel recomienda suspenderla después de tres meses de tratamiento. En el otro extremo del espectro, se encuentran los pacientes con un factor de riesgo permanente mayor (por ejemplo: cáncer activo, síndrome antifosfolípido, historia de dos o más episodios trombóticos idiopáticos). Estos tienen un riesgo muy alto de recurrencia al suspender la anticoagulación y deberían recibirla de forma indefinida, o hasta que el factor de riesgo haya desaparecido. Los hombres con TEP idiopática tienen un riesgo de recurrencia intermedio entre los dos grupos anteriores, y 2,2 veces mayor que las mujeres, por lo que recomendamos anticoagulación indefinida para ellos34.
Factores de riesgo para TEP
| Factor de riesgo |
|---|
| Transitorio |
| Mayor |
| Cirugía mayor (anestesia general > 30 min) |
| Encamamiento hospitalario de causa médica durante ≥ 3 días |
| Traumatismo con fracturas |
| Cesárea |
| Menor |
| Cirugía menor (anestesia general < 30 min) |
| Encamamiento domiciliario de causa médica durante ≥ 3 días |
| Encamamiento hospitalario de causa médica durante < 3 días |
| Uso de estrógenos/anticoncepción |
| Embarazo o puerperio |
| Viajes prolongados |
| Lesión en la pierna (sin fractura) asociada con movilidad reducida durante ≥ 3 días |
| Permanente* |
| Mayor |
| Cáncer activo |
| Síndrome antifosfolípido |
| Historia de dos o más episodios trombóticos idiopáticos |
| Menor |
| Enfermedad inflamatoria intestinal |
| Enfermedad autoinmune activa |
Fuente: modificada de Konstantinides8.
Algunos subgrupos de pacientes se podrían beneficiar de información adicional (características clínicas, dímero D, escala HERDOO2 y estudios de trombofilia) para evaluar mejor el riesgo de recurrencia al suspender la anticoagulación (tabla S6 del anexo A):
- 1.
Mujeres con TEP idiopática.
- 2.
Pacientes con TEP secundaria a un factor de riesgo transitorio, menor y resuelto (por ejemplo: uso de estrógenos, viajes prolongados, inmovilización y cirugía menor) (tabla 5).
- 3.
Pacientes que desean suspender la anticoagulación (con independencia de su riesgo de recurrencia).
- 4.
Pacientes en los que percibimos una relación incierta riesgo/beneficio para el uso de tratamiento anticoagulante indefinido (por ejemplo, hombres con TEP idiopática y riesgo alto de sangrado).
Se recomienda no realizar estudios de trombofilia para decidir la duración de la anticoagulación a la mayoría de los pacientes con TEP.
Se recomienda no realizar una determinación de anticuerpos antifosfolípido antes de iniciar anticoagulación con ACODs por un episodio de TEP aguda sintomática.
No se han publicado ensayos clínicos que hayan evaluado el beneficio de los estudios de trombofilia para decidir la duración de la anticoagulación en pacientes con TEP35, y los datos epidemiológicos ofrecen resultados poco concluyentes sobre el riesgo de recurrencia asociado a un estudio de trombofilia hereditaria positivo36.
Para pacientes con TEP secundaria a un factor de riesgo transitorio, mayor y resuelto, la duración del tratamiento anticoagulante es de tres meses (recomendación 10), y un estudio de trombofilia positivo no debe modificar esta duración37. Los pacientes con un factor de riesgo permanente mayor (por ejemplo, cáncer o historia de dos o más episodios trombóticos idiopáticos) deben recibir anticoagulación indefinida o hasta que el factor de riesgo haya desaparecido, y tampoco hay indicación de un estudio de trombofilia38.
Algunos pacientes presentan una relación incierta riesgo/beneficio para el uso de tratamiento anticoagulante indefinido, y el clínico puede apoyar su decisión sobre la duración de la anticoagulación en el empleo de ciertas herramientas pronósticas (tabla S6). De ellas, los estudios de trombofilia son los que tienen un valor menor de forma aislada.
Aunque se desaconseja el uso de ACODs en pacientes con síndrome antifosfolípido triple positivo (anticoagulante lúpico, anticuerpos anticardiolipina y anti-beta-2 microglobulina)39, en ninguno de los ensayos clínicos que evaluaron la eficacia y seguridad de los ACODs para el tratamiento de la ETEV se realizó un cribado previo a su uso. El panel recomienda no efectuar una determinación de anticuerpos antifosfolípido antes de iniciar anticoagulación con ACODs por un episodio de TEP aguda sintomática, aunque se podría considerar su determinación en pacientes jóvenes con TEP idiopática, si se sospecha la presencia de una conectivopatía subyacente.
La tabla S7del anexo A presenta información relativa a los estudios de trombofilia hereditaria y adquirida.
12. ¿Está indicada la búsqueda de un cáncer oculto en pacientes con TEP?Se recomienda no realizar un cribado extendido (más allá de la historia clínica, exploración física, pruebas de laboratorio básicas y pruebas de imagen torácica realizadas para el diagnóstico del episodio de TEP) de cáncer oculto en pacientes con TEP provocada.
Se sugiere no realizar un cribado extendido de cáncer oculto en pacientes con TEP idiopática.
Aproximadamente el 5% de los pacientes con ETEV idiopática será diagnosticado de cáncer oculto (es decir, no aparente en el momento del diagnóstico de la ETEV) en el año posterior al episodio trombótico40. Desde un punto de vista teórico, el cribado de cáncer oculto podría detectar tumores en estadios precoces y disminuir la mortalidad asociada al propio cáncer. Sin embargo, los estudios publicados hasta la fecha no han demostrado un beneficio clínico del cribado extendido comparado con el cribado limitado (historia clínica, exploración física, pruebas de laboratorio básicas [hemograma, bioquímica con determinación de enzimas hepáticas y calcio, hemostasia y análisis de orina] y pruebas de imagen torácica realizadas para el diagnóstico del episodio de TEP) en pacientes con ETEV.
Un metaanálisis de datos individuales incluyó 2.316 pacientes con ETEV idiopática procedentes de 10 estudios, seguidos un mínimo de 12 meses después del episodio trombótico40. Inicialmente, la prevalencia de cáncer oculto fue dos veces mayor (IC 95%, 1,2 a 3,4) en los pacientes sometidos a un cribado extendido (habitualmente con tomografía computarizada [TC] o tomografía por emisión de positrones [PET]) que en aquellos sometidos a un cribado limitado; aunque no hubo variaciones significativas a los 12 meses (OR, 1,4; IC 95%, 0,9 a 2,1). Además, no hubo diferencias estadísticamente significativas en la proporción de pacientes con cáncer en estadios precoces ni en la mortalidad asociada al cáncer, aunque la mayoría de los estudios no proporcionó datos sobre la mortalidad a largo plazo.
En función de la evidencia disponible, los pacientes con ETEV solo deben recibir cribado limitado y el que corresponda por razón de su edad y sexo (mama, colon, próstata y útero).
FinanciaciónEste consenso no ha recibido financiación.
Conflicto de interesesJosé Luis Lobo, Sergio Alonso, Juan Arenas, Pere Domènech, Pilar Escribano, Sonia Jiménez, María Lázaro y Manuel Monreal declaran no tener conflicto de intereses.
Carmen Fernández-Capitán ha recibido honorarios por conferencias de Bayer, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer, Rovi y Sanofi; honorarios por consultoría de Bayer, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer, Rovi y Sanofi.
Luis Jara-Palomares ha recibido honorarios por conferencias de Actelion Pharmaceuticals, Bayer, Leo Pharma, Menarini, Pfizer y ROVI; honorarios por consultoría de Actelion Pharmaceuticals, Bayer, Leo Pharma, Menarini, Pfizer y ROVI.
Ramón Lecumberri ha recibido honorarios por conferencias de Boehringer Ingelheim, Daiichi-Sankyo, Leo-Pharma, Rovi y Sanofi; honorarios por consultoría de Bayer, Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma y Sanofi; y ayudas a la investigación de Rovi.
Pedro Ruiz-Artacho ha recibido honorarios por conferencias de Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer y Rovi; honorarios por consultoría de Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer y Rovi.
David Jiménez ha recibido honorarios por conferencias de Bayer, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer, Rovi y Sanofi; honorarios por consultoría de Bayer, Boehringer Ingelheim, Bristol-Myers Squibb, Daiichi-Sankyo, Leo-Pharma, Pfizer, Rovi y Sanofi; y ayudas a la investigación de GSK, Daiichi-Sankyo, Rovi y Sanofi.
Sergio Alonso, Albert Antolín-Santaliestra, Juan Arenas, Antonio Castro-Fernández, Carlos Israel Chamorro-Fernández, Pere Domènech, Pilar Escribano, Carmen Fernández-Capitán, María Fernández-Velilla, Alberto García-Ortega, Olga Gavín, José Ramón González-Porras, Luis Jara-Palomares, David Jiménez, Sonia Jiménez, María Lázaro, Ramón Lecumberri, José Luis Lobo, Alicia Lorenzo-Hernández, Manuel Monreal, Ana Moretó, Raquel Morillo, Remedios Otero, Jorge Pedraza-García, Pascual Piñera-Salmerón, Juan Plasencia-Martínez, Ramón Puchades-Rincón-de Arellano, Pedro Ruiz-Artacho, Giorgina Salgueiro-Origlia, Teresa Sancho-Bueso, Carmen Trinidad-López, Yale Tung-Chen y María Teresa Velázquez-Martín.