La inflamación del endotelio vascular y el aumento del estrés oxidativo son factores patogénicos importantes del síndrome de apnea obstructiva del sueño (SAOS). El objetivo de este estudio fue determinar las concentraciones de las proteínas de estrés (HSP) 27, HSP70 y HSP90, L-arginina y dimetilarginina simétrica (ADMA) en pacientes con SAOS y establecer su relación con factores de riesgo cardiovascular (CV).
Material y métodosEn el estudio se incluyó a 40 pacientes con SAOS, 26 de los cuales presentaban factores de riesgo CV tradicionales (obesidad, hipercolesterolemia, diabetes, hipertensión y tabaquismo) y 14 no los presentaban, y 20 sujetos de control que no padecían SAOS. A todos los pacientes se les realizó una evaluación polisomnográfica completa y se extrajeron muestras de sangre en la mañana siguiente al estudio diagnóstico.
ResultadosNo se observaron diferencias significativas entre grupos en las concentraciones séricas de HSP27 y HSP70. En los pacientes con SAOS, con o sin factores de riesgo CV, se observaron aumentos significativos de las concentraciones de HSP90 y ADMA y disminuciones significativas de las concentraciones de L-arginina, en comparación con los sujetos de control, aunque no hubo diferencias entre los subgrupos. En todos los pacientes con SAOS, las concentraciones séricas de HSP70 se correlacionaron positivamente con porcentajes de tiempo con saturación <90% (r=0,349; p=0,027). Las concentraciones séricas de L-arginina se correlacionaron negativamente con el número de desaturaciones (r=−0,360; p=0,022) y el índice de apnea-hipopnea (r=−0,354; p=0,025) y positivamente con la saturación de oxígeno media (r=0,328; p=0,039).
ConclusiónLas concentraciones séricas de HSP90 y ADMA aumentaron y las de L-arginina disminuyeron en pacientes con SAOS, independientemente de los factores de riesgo CV que presentasen. Estos resultados indican la presencia de estrés oxidativo y disfunción endotelial en pacientes con SAOS.
Vascular endothelial inflammation and enhanced oxidative stress are important factors in the pathogenesis of obstructive sleep apnea syndrome (OSAS). The aim of this study was to determine the levels of heat shock protein (HSP) 27, HSP70, HSP90, L-arginine, and asymmetric dimethylarginine (ADMA) in patients with OSAS and determine their relationship with cardiovascular (CV) risk factors.
Material and methodsForty patients with OSAS, comprising 26 with and 14 without traditional CV risk factors (obesity, hypercholesterolemia, diabetes, hypertension, and smoking), and 20 control subjects without OSAS were included. All patients underwent a full polysomnographic evaluation, and blood samples were obtained in the morning after the night the diagnostic study was performed.
ResultsNo significant differences were found in serum HSP27 and HSP70 levels between the groups. HSP90 and ADMA levels increased significantly, whereas L-arginine levels decreased significantly in patients with OSAS, both with and without CV risk factors, compared with controls, but were not different among the subgroups. In all patients with OSAS, serum HSP70 levels were positively correlated with a percent time with saturation<90% (r=.349, P=.027). Serum L-arginine levels were negatively correlated with desaturation number (r=−.360, P=.022) and apnea-hypopnea index (r=−.354, P=.025) and positively correlated with mean oxygen saturation (r=.328, P=.039).
ConclusionSerum levels of HSP90 and ADMA increased, whereas those of L-arginine decreased in patients with OSAS regardless of CV risk factors. These findings indicate the presence of oxidative stress and endothelial dysfunction in patients with OSAS.
El síndrome de apnea obstructiva del sueño (SAOS) es un problema de salud frecuente causado por episodios repetidos de colapso de las vías respiratorias superiores durante el sueño. Los episodios de SAOS producen excitación cerebral, cambios en la presión intratorácica y episodios intermitentes de hipoxemia y reoxigenación1.
Las proteínas de shock térmico (heat shock proteins [HSP]) son proteínas de estrés muy preservadas en diversos organismos, desde bacterias hasta mamíferos, y su producción se desencadena por agresiones de naturaleza variada tales como las altas temperaturas, la inflamación, la isquemia, las toxinas, el tabaquismo, el estrés oxidativo o la hipoxia2. En las áreas de inflamación hay concentraciones relativamente altas de HSP y las células las liberan al espacio extracelular en situaciones de estrés3. Las HSP intracelulares tienen un potente efecto protector como chaperonas moleculares. Sin embargo, las HSP extracelulares actúan en el marco del sistema inmunitario como proteínas asociadas a daño y modulan la secreción de citocinas proinflamatorias4.
La L-arginina es un aminoácido esencial necesario para la producción de óxido nítrico (NO) por parte de la óxido nítrico sintetasa endotelial (NOS). La administración de L-arginina mejora la función endotelial en humanos con hipercolesterolemia y aterosclerosis, algo también observado en modelos animales5. El NO derivado del endotelio es un importante mediador que regula el tono vasomotor. Participa en una amplia gama de mecanismos reguladores, que comprenden la inhibición de la adhesión y la agregación plaquetaria, la inhibición de la adhesión de monocitos y la proliferación de células musculares lisas. Por consiguiente, el NO tiene una acción fundamental en la homeostasis vascular6. La dimetilarginina asimétrica (asymmetric dimethylarginine [ADMA]) es un potente inhibidor competitivo de la NOS que deriva del catabolismo de proteínas que contienen residuos metilados de arginina. Se excreta por vía renal o es metabolizada por la dimetilarginina dimetilaminohidrolasa, cuya actividad inhibe la homocisteína7. Las concentraciones plasmáticas de ADMA se elevan en pacientes con hipercolesterolemia, hipertensión o hiperglucemia y en sujetos expuestos al tabaco8.
El SAOS incrementa de manera significativa el riesgo de enfermedades cardiovasculares (CV) como la hipertensión, la insuficiencia cardíaca, las arritmias o las enfermedades coronarias9. La inflamación del endotelio vascular y el estrés oxidativo endotelial son el punto de partida para dilucidar los mecanismos que median la conocida asociación entre el SAOS y las enfermedades CV. Los episodios repetitivos de hipoxia y reoxigenación estimulan la producción de mediadores de la inflamación en pacientes con SAOS. Los despertares repetitivos propios del SAOS y la consecuente fragmentación crónica del sueño pueden exacerbar los efectos adversos de la hipoxia/reoxigenación sobre la función endotelial de los pacientes con SAOS10.
El objetivo de este estudio fue determinar las concentraciones de HSP (HSP27, HSP70 y HSP90), L-arginina y ADMA en pacientes con SAOS, establecer si existe una asociación entre estos marcadores y la presencia de factores de riesgo CV e investigar su relación con los datos polisomnográficos.
Materiales y métodosSujetos del estudioEvaluamos a 40 pacientes con SAOS, 26 con y 14 sin factores de riesgo CV tradicionales (obesidad [índice de masa corporal −IMC− ≥ 30kg/m2], hipercolesterolemia [colesterol total ≥ 220mg/dl o colesterol LDL ≥ 140mg/dl], diabetes, hipertensión y tabaquismo)11.
Todos los pacientes referían ronquidos, apneas presenciadas, somnolencia diurna y frecuentes despertares nocturnos. Como grupo de referencia, incluimos a 20 sujetos de control no obesos ni fumadores, sintomáticos pero sin indicios de SAOS en la evaluación polisomnográfica de una noche. Evaluamos la calidad del sueño y el exceso de somnolencia diurna mediante la Escala de calidad del sueño de Pittsburgh (Pittsburgh Sleep Quality Index [PSQI]) y la Escala de somnolencia de Epworth (Epworth Sleepiness Scale [ESS]). Todos los estudios del sueño se efectuaron en el Laboratorio de trastornos del sueño del Hospital Universitario Firat, entre octubre de 2013 y mayo de 2014.
Registro polisomnográficoTodos los pacientes acudieron al laboratorio para que se les realizara una polisomnografía de una noche completa mediante un sistema de registro de 44 canales (Compumedics E series, Melbourne, Australia). Con la polisomnografía se monitorizó la actividad cerebral (electroencefalograma con electrodos colocados en C3A2, C4A1, O1A2, O2A1, F3A2 y F4A1), el tono muscular (electromiograma del mentón y ambas piernas), los movimientos oculares (electrooculograma), la frecuencia cardíaca (electrocardiograma), la saturación de oxígeno (SaO2; pulsoxímetro digital), el movimiento de las paredes torácica y abdominal (cinturones torácico y abdominal), el flujo aéreo (termistor y transductor de presión de la cánula nasal) y los ronquidos (micrófono).
Calificación de la polisomnografíaLos registros se calificaron según los criterios normalizados de la Academia Americana de Medicina del Sueño12. La apnea se definió como una caída en la elevación máxima del sensor térmico ≥ 90% del valor inicial durante ≥ 10 s. La hipopnea se definió como una reducción en la señal de presión nasal ≥ 30% del valor inicial durante ≥ 10 s, causante de un descenso ≥ 3% en la SaO2 desde la situación anterior al episodio o de un despertar. La desaturación se definió como una reducción en la SaO2 de un 3% del valor inicial. La SaO2 media se definió como la SaO2 media de la noche. La SaO2 mínima se definió como el valor más bajo de SaO2 registrado durante la noche. El índice apnea-hipopnea (AHI) se definió como el número medio de episodios apneicos e hipopneicos por hora de sueño. Un AHI>5/h se consideró diagnóstico de SAOS. Los sujetos que presentaron un AHI ≤ 5/h se asignaron al grupo control.
Ningún participante padecía enfermedades crónicas (enfermedad pulmonar obstructiva crónica, cirrosis hepática, disfunción tiroidea, artritis reumatoide, insuficiencia renal crónica o enfermedades psiquiátricas) ni tomaba medicación. Se protegieron los derechos y se obtuvo el consentimiento informado de todos los participantes en cumplimiento de la Declaración de Helsinki. El Comité de Ética del centro aprobó el protocolo de estudio.
Extracciones de sangreEn la mañana siguiente a la noche del estudio diagnóstico se obtuvieron muestras de sangre de una vena periférica. La sangre venosa se centrifugó a 2.000rpm y las muestras de suero se conservaron a −80°C hasta su análisis.
Determinación de las concentraciones de proteínas de estrés y dimetilarginina simétricaLas concentraciones séricas de HSP27 (Assaypro LLC, St. Charles, MO, EE. UU.; n.° de catálogo: EH5001-1), HSP70 (USCN Life, Hubei, China; n.° de catálogo: E0873h) y HSP90 (USCN Life, n.° de catálogo: E0863h) se determinaron mediante kits comerciales de un ensayo de inmunoadsorción enzimática y de acuerdo a las instrucciones del fabricante. Los valores se registraron en ng/ml. Las concentraciones séricas de L-arginina y ADMA se determinaron mediante un kit de cromatografía líquida de alta resolución (HPLC) (n.° de catálogo: Z58010; EUREKA srl-Lab Division, Chiaravalle, Italia), de conformidad con los procedimientos del estudio. La L-arginina y ADMA se separaron con la ayuda de un monitor de fluorescencia. Las longitudes de onda del detector de fluorescencia para excitación y emisión se establecieron en 420nm y 483nm, respectivamente. La sensibilidad de detección de ADMA fue<0,05μmol/l y la linealidad>16μmol/l.
Análisis estadísticoSe utilizó el programa informático IBM Statistical Product and Service Solutions, versión 21.0 (IBM SPSS Statistics 21 program, código de autorización: d91314f638c364094170; Armonk, NY, EE. UU.). Para el análisis se emplearon la prueba de la U de Mann-Whitney, el análisis de varianza de Kruskal-Wallis y los análisis de correlación de Spearman y de Pearson, según procediera. Los resultados se expresan con la mediana±desviación estándar. Para el análisis multivariante se usaron modelos de regresión lineal múltiple con los valores de HSP90, L-arginina y ADMA como variables dependientes, y la edad, IMC, AHI, número de desaturaciones y porcentaje de tiempo con saturación<90% (TC 90%) como variables independientes. Los valores de p<0,05 se consideraron significativos.
ResultadosEvaluamos a 26 pacientes con SAOS y factores de riesgo CV, 14 con SAOS pero sin factores de riesgo CV y 20 sujetos de control. De los sujetos con SAOS y factores de riesgo, 19 presentaban más de un factor de riesgo, 2 solo padecían hipertensión arterial, 4 eran obesos y uno era diabético.
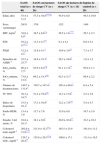
Las características demográficas y los resultados polisomnográficos basales de los pacientes con SAOS y de los sujetos del grupo control se muestran en la tabla 1. Por definición, los parámetros del sueño de los pacientes con SAOS eran anormales, mientras que estas variables eran normales en los sujetos de control. El IMC, el AHI, el índice de despertares, las puntuaciones de ESS y PSQI, las SaO2 media/mínima, el número de desaturaciones, la TC 90% y el tiempo de estadio 3 del sueño (%) difirieron significativamente entre los pacientes con SAOS y los sujetos del grupo control. No se observaron diferencias entre los pacientes con SAOS y los sujetos de control en cuanto a sexo, edad o colesterol total. Las concentraciones de colesterol LDL fueron significativamente más altas en los pacientes con factores de riesgo CV que en los sujetos sanos y los pacientes sin factores de riesgo CV.
Datos demográficos y antropométricos y resultados polisomnográficos de los pacientes con síndrome de apnea obstructiva del sueño (SAOS) y los sujetos de control
| SAOS total (n=40) | SAOS con factores de riesgo CV (n=26) | SAOS sin factores de riesgo CV (n=14) | Sujetos de control (n=20) | |
|---|---|---|---|---|
| Edad, años | 53,4±11,5 | 57,5±10,8****,b | 45,9±8,8 | 49,3±10,9 |
| Sexo, varón/mujer | 29/11 | 17/9 | 12/2 | 14/6 |
| IMC, kg/m2 | 34,9±8,5* | 38,5±8,6*,a | 28,5±1,6**** | 26,7±2,3 |
| ESS | 10,2±4,7*** | 11,3±4,7** | 8,1±4,1 | 6,8±4,1 |
| PSQI | 12,2±4,1* | 12,8±4,1* | 10,9±3,8** | 7,3±1,7 |
| Episodios de AHI/h−1 | 32,5±23,7* | 34,8±23,3* | 28,3±24,6* | 1,9±1,2 |
| SaO2 media, % | 86,4±7,7* | 83,9±8,4*,b | 91,1±1,9** | 93,0±1,3 |
| SaO2 mínima, % | 73,8±13,5* | 69,2±14,3*,b | 82,5±5,1* | 88,4±2,2 |
| Número de desaturaciones | 140,7±131,4* | 159,7±147,4* | 105,4±89,4* | 6,4±5,4 |
| TC 90% | 38,3±34,7* | 51,2±35,8*,b | 14,3±13,9* | 2,5±3,8 |
| Índice de despertares | 15,5±10,1* | 17,3±10,8* | 12,2±7,9*** | 5,4±4,7 |
| Sueño REM, % | 13,4±7,9 | 13,7±7,6 | 13,0±8,8 | 16,7±5,9 |
| Estadio 3 del sueño, % | 18,8±10,1* | 18,1±9,9* | 20,0±10,8** | 32,3±10,2 |
| Colesterol total, mg/dl−1 | 202,6±31,9**** | 211,9±32,3**,c | 185,5±23,9 | 191,0±11,2 |
| Colesterol LDL, mg/dl−1 | 126,7±28,4** | 135,8±29,3**,b | 109,8±17,1 | 111,4±10,5 |
AHI: índice de apnea-hipopnea; Colesterol LDL: colesterol de las lipoproteínas de baja densidad; ESS: escala de sueño de Epworth; IMC: índice de masa corporal; PSQI: índice de calidad del sueño de Pittsburgh; SaO2 media: saturación de oxígeno media; SaO2 mínima: saturación de oxígeno mínima; TC 90%: tiempo con SaO2<90%.
No se observaron diferencias significativas entre los 3 grupos en las concentraciones séricas de HSP27 o HSP70. Las concentraciones séricas de HSP90 fueron significativamente más altas en los pacientes con SAOS, con o sin factores de riesgo, en comparación con los sujetos sanos (p<0,001; p=0,001). Contrariamente, estos valores no difirieron significativamente entre los 2 grupos de pacientes con SAOS. Respecto a la ADMA, se observó un patrón similar, debido a que las concentraciones séricas de ADMA de los pacientes con SAOS con o sin factores de riesgo CV fueron similares y significativamente más altas que las detectadas en los sujetos de control (p=0,002; p=0,005). Las concentraciones séricas de L-arginina fueron significativamente más bajas en los pacientes con SAOS, con o sin factores de riesgo CV, que en los sujetos de control (p<0,001; p=0,003). Sin embargo, no se observaron diferencias en las concentraciones séricas de L-arginina entre los pacientes con SAOS, con o sin factores de riesgo CV, y los sujetos de control. En la tabla 2 se muestra la media±desviación estándar de las concentraciones séricas de HSP, ADMA y L-arginina de los 3 grupos de sujetos.
Concentraciones medias de proteínas de estrés, L-arginina y dimetilarginina asimétrica en pacientes con síndrome de apnea obstructiva del sueño (SAOS), con y sin factores de riesgo cardiovascular, y en sujetos de control
| SAOS con factores de riesgo CV (n=24) | SAOS sin factores de riesgo CV (n=16) | Sujetos de control (n=20) | |
|---|---|---|---|
| HSP27 (ng/ml) | 8,06±2,34 | 8,49±1,51 | 7,15±2,59 |
| HSP70 (ng/ml) | 2,80±0,85 | 2,67±1,47 | 2,88±1,47 |
| HSP90 (ng/ml) | 16,72±7,92a | 16,83±7,75b | 8,72±3,39 |
| L-arginina (μmol/l) | 81,83±9,47a | 82,96±10,74b | 91,62±5,60 |
| ADMA (μmol/l) | 0,64±0,12b | 0,67±0,13c | 0,47±0,19 |
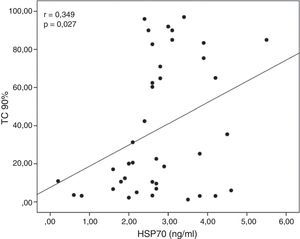
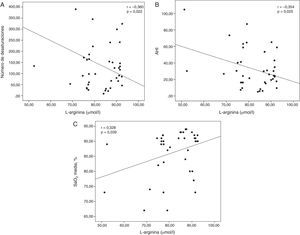
Las concentraciones séricas de HSP70 se correlacionaron positivamente con la TC 90% (r=0,349; p=0,027; fig. 1). Las concentraciones séricas de L-arginina se correlacionaron negativamente con el número de desaturaciones (r=−0,360; p=0,022) y con el AHI (r=−0,354; p=0,025) y mostraron una correlación positiva con la SaO2 media (r=0,328; p=0,039; fig. 2). No se observaron correlaciones significativas entre las concentraciones de HSP, ADMA y L-arginina.
En el análisis de regresión lineal múltiple en el que el HSP90 fue la variable dependiente y la edad, IMC, AHI, número de desaturaciones y TC 90% las variables independientes, el número de desaturaciones (β=0,341; p=0,034) fue un factor predictivo independiente del HSP90 (R2=0,183), y no se observaron otras relaciones respecto a estas variables.
DiscusiónNuestros resultados mostraron que, independientemente de los factores de riesgo CV, los pacientes con SAOS presentan más estrés oxidativo (mayores concentraciones de HSP90) y daño de la función endotelial (descenso de las concentraciones de L-arginina y elevación de las de ADMA). Estos marcadores indican la presencia de una disfunción del endotelio vascular y estrés oxidativo en las etapas tempranas del SAOS en pacientes sin factores de riesgo CV tradicionales, por lo que podrían ser útiles en la práctica clínica.
Las concentraciones circulantes de mediadores de la inflamación se incrementan en pacientes con SAOS y esta elevación es independiente de las enfermedades comórbidas, como la obesidad, que con frecuencia se asocian a este síndrome. La magnitud de la respuesta inflamatoria sistémica parece guardar una relación con la gravedad del SAOS evaluada a partir del AHI13. Los episodios repetitivos de hipoxia/reoxigenación que experimentan los pacientes con SAOS durante el cese transitorio de la respiración promueven el estrés oxidativo sistémico y la inflamación10. La exposición a factores generadores de estrés, como altas temperaturas, la inflamación, la isquemia, las toxinas, el tabaquismo, el estrés oxidativo o la hipoxia desencadena la producción de HSP2 y sus concentraciones séricas se elevan en pacientes con diversas enfermedades inflamatorias, como la enfermedad pulmonar obstructiva crónica, el síndrome coronario agudo o la nefropatía crónica del injerto14–16. Estudios experimentales previos han demostrado que la producción de HSP se incrementa en respuesta a la anoxia y se cree que el aumento de HSP estabiliza y protege la estructura y la función de las proteínas17,18. Los modelos sensibles a la anoxia, que demostraron mayor respuesta al shock térmico durante los estados de baja oxigenación, apoyan el papel protector de las HSP frente al daño causado por dicho estrés19,20.
Hasta la fecha, pocos estudios han demostrado la existencia de una relación entre las HSP y el SAOS. Noguchi et al.21 demostraron mayor disminución de los niveles de expresión de HSP72 basal durante el sueño en células mononucleares de sangre periférica de pacientes con SAOS, en comparación con los niveles de expresión de los sujetos de control antes del sueño. En otro estudio, las concentraciones de HSP70 fueron mayores en pacientes con SAOS que en sujetos de control. En este estudio, las concentraciones de HSP70 se elevaron al aumentar la gravedad de la enfermedad, y se correlacionaron de manera significativa y positiva con el AHI y el índice de desaturación de oxígeno. Además, se ha observado que las concentraciones de HSP70 de los pacientes con SAOS no obesos son más altas que las de los sujetos de control no obesos22. Lavie et al.23 observaron que la secreción basal de HSP70 era 1,8 veces mayor en los monocitos de pacientes con SAOS en comparación con los de los sujetos de control. También observaron una correlación positiva significativa entre el HSP70 y el AHI, la TC 90% y los marcadores sistémicos del estrés oxidativo. Asimismo, las concentraciones de HSP70 inducidas por el estrés térmico en pacientes con SAOS fueron más bajas, y se observó una correlación negativa entre las concentraciones de HSP70 inducidas por el estrés térmico y el AHI, TC 90% y el índice de desaturación de oxígeno. En nuestro estudio no se observaron diferencias en las concentraciones de HSP27 o HSP70 entre los pacientes con SAOS y los sujetos de control y las concentraciones de HSP90 fueron significativamente más altas en pacientes con SAOS, con o sin factores de riesgo CV, en comparación con los sujetos de control. En el análisis de regresión lineal múltiple, el número de desaturaciones fue un factor predictivo independiente del HSP90 y, además, las concentraciones séricas de HSP70 mostraron una correlación positiva con la TC 90%. Estos resultados indican que, en pacientes con SAOS, los HSP estarían desencadenados por la hipoxia nocturna. Aunque los pacientes con o sin los factores de riesgo CV tradicionales mostraron niveles medios de SaO2 más bajos y niveles de TC 90% más altos, las diferencias en las concentraciones de HSP entre los 2 grupos no fueron significativas. Nuestros resultados apuntan a que las concentraciones de HSP90 se relacionan con la frecuencia de las desaturaciones y no con los niveles de saturación.
El estrés oxidativo y la inflamación, al igual que la mayor adhesión leucocitaria por la expresión de moléculas de adhesión, promueven el daño y la disfunción endotelial. Como consecuencia, es típico que los pacientes con SAOS presenten un deterioro de la vasodilatación dependiente del endotelio, que se puede revertir parcialmente con terapia de presión positiva en la vía aérea (CPAP), lo que indica la relación fisiopatológica crucial que existe entre la disfunción endotelial y la hipoxemia intermitente de estos pacientes24. El NO se sintetiza en las células endoteliales a través de la conversión de la L-arginina en L-citrulina, con una estrecha regulación de la actividad de la NOS endógena25. La ADMA es un nuevo factor de riesgo de desarrollo de disfunción endotelial y enfermedad CV, al ser un inhibidor endógeno competitivo de la NOS26. La elevación crónica de las concentraciones hemáticas de ADMA puede contribuir a la progresión de la enfermedad vascular a través del daño endotelial. Este efecto parece involucrar algo más que la disponibilidad reducida de NO secundaria a la inhibición de la NOS27. Asimismo, la ADMA también puede promover la disociación de la eNOS, lo que contribuiría directamente a aumentar el estrés oxidativo28.
Las concentraciones elevadas de ADMA se asocian a varias enfermedades, como la enfermedad coronaria, la enfermedad arterial periférica, la hipercolesterolemia, la hipertensión o la insuficiencia renal29–33. Los resultados del estudio multicéntrico CARDIAC indicaron que una concentración elevada de ADMA es un factor de riesgo independiente de enfermedad coronaria29.
Algunos estudios han cuantificado las concentraciones de ADMA en los pacientes con SAOS. Ohike et al.34 demostraron que las concentraciones plasmáticas de ADMA de pacientes con SAOS se reducen al mejorar la vasodilatación mediada por el flujo tras la terapia CPAP, pero la diferencia entre las concentraciones de ADMA anteriores y posteriores al tratamiento no fue significativa. Otro estudio indicó que las concentraciones séricas de ADMA de pacientes con síndrome de solapamiento y SAOS son más bajas después del tratamiento CPAP35. No se detectaron diferencias en las concentraciones de ADMA entre los pacientes con SAOS y los sujetos de control de un estudio en el que se evaluó la variación diurna entre los marcadores de disfunción endotelial y factores hemostáticos en pacientes con SAOS, aunque los resultados de este estudio apuntaron una relación significativa entre la concentración de ADMA y el índice de despertares36. De igual modo, Ozkan et al.37 no observaron diferencias en las concentraciones plasmáticas de ADMA entre pacientes con SAOS y sujetos de control. En otro estudio se evaluaron las concentraciones de CD40 soluble y de ADMA: las concentraciones plasmáticas de ADMA fueron significativamente más altas en el grupo de SAOS, independientemente de los factores de riesgo CV, en comparación con sujetos de control; además, este estudio indicó una relación significativa entre las concentraciones plasmáticas de CD40 y de ADMA38. Yüksel et al. evaluaron la actividad de la arginasa y las concentraciones de NO en pacientes con SAOS y observaron que la actividad de la arginasa era alta en pacientes con SAOS, mientras que las concentraciones de NO fueron bajas en comparación con los sujetos de control. Asimismo, la actividad de la arginasa fue inferior en los pacientes con factores de riesgo CV que en aquellos que no presentaban factores de riesgo39.
Nosotros observamos concentraciones séricas de ADMA significativamente más altas y concentraciones de L-arginina significativamente más bajas en el grupo con SAOS, con o sin factores de riesgo CV, en comparación con los sujetos de control. La incidencia de enfermedad CV aumenta en pacientes con SAOS, al igual que la tasa de mortalidad por enfermedad CV. No es sorprendente que las funciones endoteliales (elevación de las concentraciones de ADMA y disminución de las de L-arginina) estén afectadas en pacientes con SAOS y factores de riesgo CV tradicionales. No obstante, la alteración de estos marcadores en pacientes con SAOS sin factores de riesgo CV tradicionales se puede interpretar como el resultado del desarrollo de una disfunción endotelial por episodios repetidos de apnea, hipoxia o despertares en ausencia de dichos factores de riesgo. Los episodios de hipoxia nocturna de los pacientes con SAOS podrían haber causado una disminución en las concentraciones de L-arginina y un aumento en las concentraciones de ADMA. Sin embargo, nuestro estudio no indicó una relación lineal con este incremento. Es posible que otros factores que en nuestro estudio no analizamos hayan influido en las concentraciones de ADMA y de L-arginina. Estudios anteriores habían indicado una mayor actividad de la arginasa39 y el incremento de la actividad de la arginasa como consecuencia de la hipoxia nocturna podría haber afectado la disminución de la concentración de L-arginina en pacientes con SAOS.
Una posible limitación de nuestro estudio es que las concentraciones séricas de HSP, L-arginina y ADMA solo se determinaron antes del tratamiento CPAP. Únicamente se definieron factores de riesgo tradicionales y no se incluyeron otros factores de riesgo CV, como los antecedentes familiares, la inactividad física, la dieta poco sana, el estrés, el abuso del alcohol y el tabaquismo pasivo. Algunos casos de SAOS podrían haber presentado otros factores de riesgo CV que no consideramos y que podrían haber influido en los resultados del estudio.
En conclusión, observamos concentraciones séricas elevadas de HSP90 y ADMA y concentraciones significativamente bajas de L-arginina en pacientes con SAOS, independientemente de los factores de riesgo CV tradicionales que presentaran. Estos resultados podrían indicar la presencia de estrés oxidativo y disfunción endotelial en pacientes con SAOS, incluso en ausencia de factores de riesgo CV tradicionales. La ADMA sérica puede ser un biomarcador práctico para el diagnóstico precoz de la disfunción del endotelio vascular y la aterosclerosis en pacientes con SAOS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.