Estudiar el impacto de un programa simple de rehabilitación respiratoria domiciliario, comparado con uno intensivo hospitalario, sobre la capacidad de esfuerzo y la calidad de vida relacionada con la salud (CVRS) de los pacientes con enfermedad pulmonar obstructiva crónica.
Pacientes y métodosSe ha realizado un estudio prospectivo y multicéntrico en el que se aleatorizó a pacientes con EPOC grave en 2 grupos: hospital (GH) o domicilio (GD). En ambos los pacientes recibieron 2 sesiones de educación y 4 de fisioterapia. Los del GH realizaron un programa estructurado de ejercicio en el hospital y los del GD, un programa de ejercicio de baja intensidad en el domicilio, sin supervisión.
ResultadosSe aleatorizó a 28 pacientes en el GH y a 23 en el GD. Ambos grupos mostraron una mejoría similar en la prueba de la marcha de 6 min (diferencia media de 8,7 m; p=0,61). A pesar de que en ambos grupos mejoró la CVRS, medida con el Cuestionario de Enfermedad Respiratoria Crónica (CRQ), se objetivó un incremento mayor en el área de función emocional para el GH (diferencia media entre grupos: 0,58, en una escala donde un valor de 0,5 representa la diferencia mínima importante). Los beneficios del programa se mantuvieron en ambos grupos hasta 6 meses después de finalizarlo.
ConclusionesEl estudio muestra que un programa domiciliario de rehabilitación respiratoria sin supervisión produce una mejoría similar en la capacidad de esfuerzo de los pacientes con EPOC que un programa intensivo hospitalario. Sin embargo, éste alcanza mayores beneficios en el área de la función emocional de la CVRS.
To compare the effects of a simple home pulmonary rehabilitation program and an intensive hospital-based program in terms of the exercise tolerance and health-related quality of life (HRQL) of patients with severe chronic obstructive pulmonary disease (COPD).
Patients and methodsPatients in this prospective, multicenter trial were randomized to 2 groups to receive hospital or home pulmonary rehabilitation. Patients in both groups attended 2 informative sessions about the disease and 4 physical therapy sessions. Patients in the hospital group then carried out a structured exercise program while home group patients performed low intensity exercises at home without supervision.
ResultsTwenty-eight patients were randomized to the hospital rehabilitation group and 23 to the home group. Both groups showed a similar improvement on the 6-minute walk test (mean difference, 8.7m; P=.61). HRQOL measured with the Chronic Respiratory Questionnaire also improved in both groups, but the change was greater on the emotional function domain in the hospital rehabilitation group (mean difference between groups, 0.58 on a scale for which the smallest clinically relevant difference is 0.5 points). The benefits were maintained in both groups 6 months after the programs ended.
ConclusionsThis study demonstrates that the improvement in exercise tolerance achieved by COPD patients with an unsupervised home pulmonary rehabilitation program is similar to the gains of patients in an intensive hospital-based program. However, the hospital program afforded greater benefit on the HRQOL emotional function domain.
Revisiones sistemáticas de un gran número de estudios aleatorizados con grupo control han demostrado que la rehabilitación respiratoria (RR) produce una mejoría li gera o moderada de la capacidad de ejercicio y la calidad de vida relacionada con la salud (CVRS) de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC)1–3. También se ha demostrado que la RR tiene un impacto positivo en los gastos sanitarios, fundamentalmente reduciendo el número de agudizaciones y hospitalizaciones4–8. Los programas de RR para los pacientes con EPOC realizados en el hospital, ya sea en régimen de hospitalización como ambulatorio, tienen un coste elevado1-3,6,9. Además, en general tienen una capacidad limitada, lo que impide aceptar a todos los pacientes que potencialmente podrían beneficiarse de ellos.
En los últimos años se ha asistido al desarrollo de los programas de RR realizados en el domicilio. La evidencia pone de manifiesto que los beneficios alcanzados con estos programas domiciliarios son similares a los obtenidos con los programas hospitalarios10–14. Sin embargo, en la mayor parte de estos estudios los programas domiciliarios utilizaban métodos y sistemas intensivos de alto coste, que podrían no ser aplicables en algunos medios.
El objetivo de este trabajo ha sido contrastar la hipótesis de que un programa simple de RR domiciliaria, sin supervisión, permite alcanzar los mismos resultados que un programa hospitalario de RR estructurado e intensivo. Para ello se diseñó un estudio aleatorizado en el que se compararon los beneficios de ambos tipos de programa en términos de capacidad de esfuerzo y CVRS en pacientes con EPOC.
Pacientes y métodosPacientesSe incluyó de forma consecutiva a pacientes diagnosticados de EPOC grave o muy grave15, remitidos para un programa de RR en 4 hospitales españoles (Barcelona, Bilbao, Madrid y Sevilla). Los criterios de inclusión fueron: edad de 50–75 años, exfumadores o con intención de dejar el hábito, volumen espiratorio forzado en el primer segundo (FEV1) entre el 30 y el 50% del valor de referencia y estabilidad clínica, sin exacerbaciones en las últimas 4 semanas. Se excluyó a los pacientes con respuesta significativa al broncodilatador (incremento del FEV1 > 15% del valor basal después de 200 μg de salbutamol inhalado), hipoxemia intensa (presión arterial de oxígeno < 60 mmHg), diagnóstico de asma bronquial, enfermedad coronaria grave o alteración ortopédica que comprometiera la movilidad. Todos los pacientes firmaron un consentimiento informado. El comité ético de cada hospital aprobó el protocolo.
Diseño del estudioSe distribuyó a los pacientes de forma aleatoria en 2 grupos: hospital (GH) o domicilio (GD). La aleatorización se realizó mediante sobres cerrados.
Todos los pacientes recibían un tratamiento farmacológico estandarizado (salmeterol, bromuro de ipratropio y budesonida inhalados a las dosis convencionales), que se mantuvo durante todo el período de estudio. Durante las agudizaciones se añadían al tratamiento antibióticos, si se sospechaba infección respiratoria como causa de la exacerbación, y/o corticoides orales (prednisona) para el tratamiento de la disnea.
Se realizaron a todos los pacientes las exploraciones complementarias necesarias para su inclusión en el estudio y la evaluación de resultados en 3 momentos: en situación basal, al final de las 9 semanas del programa de RR y a los 6 meses de finalizar éste. Los técnicos que llevaban a cabo las exploraciones no conocían el grupo al que había sido asignado cada paciente.
Programa de rehabilitación respiratoriaPeríodo del programa estructurado. En la primera semana del programa todos los pacientes asistieron a 2 sesiones de educación, en las que se planteaba un debate sobre un vídeo (el mismo para los 4 hospitales) con información básica sobre la EPOC e instrucciones para el correcto manejo de la medicación. Además, durante esa primera semana todos los pacientes realizaron y fueron instruidos en técnicas de fisioterapia respiratoria llevadas a cabo en régimen ambulatorio en el hospital. La fisioterapia respiratoria, dirigida por un fisioterapeuta, constaba de 4 sesiones que incluían técnicas de reeducación respiratoria y drenaje de secreciones si estaba indicado. En estas sesiones se daban instrucciones sobre las técnicas de entrenamiento de los músculos respiratorios con dispositivo umbral y de las extremidades superiores con pesas. El fisioterapeuta también instruía a los pacientes del GD en el ritmo de paseo como forma de entrenamiento de las extremidades inferiores.
En el período comprendido entre las semanas 2 y 9 los pacientes realizaron el programa de entrenamiento muscular. El GH acudía al hospital 3 veces a la semana. El entrenamiento de los músculos respiratorios consistía en 2 sesiones de 15 min con el dispositivo umbral (Threshold IMT-Respironics®, Cedar Grove, New Jersey, Estados Unidos). La presión inspiratoria se situaba al 40% de la presión inspiratoria máxima (PImáx). El entrenamiento de brazos consistía en sesiones de 30 min de elevación de pesas; se comenzaba con 1/2 kg en cada brazo y el peso se incrementaba progresivamente 1 kg cada semana hasta donde toleraran los pacientes. El entrenamiento de las piernas consistía en sesiones de 30 min de cicloergómetro. Para determinar el grado de esfuerzo adecuado para el entrenamiento, los pacientes realizaron una prueba progresiva de esfuerzo limitada por síntomas, según el protocolo propuesto por Jones16. Al principio el entrenamiento se realizaba con una carga que suponía el 60% de la carga máxima alcanzada en esta prueba y progresivamente se hacían incrementos de 10 W según la tolerancia, que se evaluaba por la estabilidad en la frecuencia cardíaca, la saturación de oxígeno y la presión arterial, además de la sensación subjetiva de tolerancia.
El GD siguió el mismo protocolo para el entrenamiento de músculos respiratorios y de brazos que el GH. El entrenamiento de las piernas consistía en caminar diariamente por la calle sin supervisión a un ritmo marcado por un podómetro, con una velocidad de 4 km/h y siguiendo este protocolo: 15 min en la primera semana, 30 min de la segunda a la cuarta semanas, y 45 min a partir de la quinta semana hasta la novena. Los pacientes, además, subían y bajaban escaleras durante 5 min antes y después de la sesión de caminar.
Período de seguimiento posprograma. Al final de las 9 semanas se indicó a los pacientes de ambos grupos que continuaran con el mismo protocolo de entrenamiento de forma independiente, sin supervisión. En este momento se proporcionaron las pesas a los pacientes del GH, lo que se había hecho con el GD al principio del programa. Este período abarcó 6 meses.
Medidas de evaluaciónTodos los estudios se realizaron una semana antes de iniciar el programa de RR, al finalizarlo (período del programa estructurado) y a los 6 meses (período del seguimiento posprograma).
Función de los músculos respiratorios. La presión inspiratoria espiratoria máxima (PImáx y PEmáx) se midieron por el método de Black y Hyatt17 utilizando como valores de referencia los de la población mediterránea18. Se evaluó asimismo la resistencia de los músculos respiratorios según el método propuesto por Dekhuijzen et al19, en el que se registra el tiempo durante el que los pacientes son capaces de mantener una presión inspiratoria que representa el 70% de la PImáx (TPImáx70).
Prueba de esfuerzo de los brazos. En primer lugar los pacientes alzaron pesas con 2,5 kg en cada brazo tantas veces como pudieron, y posteriormente mantuvieron este peso tanto tiempo como les fue posible (técnica de Ries et al20 modificada). Se analizaron el número de elevaciones como medida de fuerza y el tiempo de mantenimiento del peso como medida de resistencia.
Prueba de esfuerzo de las piernas. La prueba de la marcha de 6 min (PM6M) se realizó de acuerdo con la normativa de la American Thoracic Society21. La prueba se repitió 3 veces en situación basal para evitar los efectos de entrenamiento, con 30 min de descanso entre cada prueba. Se escogió la distancia recorrida en la tercera prueba como el valor basal. Se consideró clínicamente relevante un incremento de la distancia igual o mayor que 54 m22.
Calidad de vida relacionada con la salud. Para evaluar la CVRS se utilizó el Cuestionario de Enfermedad Respiratoria Crónica (CRQ), traducido y validado al español23. El cuestionario, administrado con entrevistador, se compone de 20 preguntas distribuidas en 4 áreas: disnea (5 preguntas), fatiga (4 preguntas), factor emocional (7 preguntas) y control de la enfermedad (4 preguntas). Cada pregunta está graduada con una escala de Likert de 7 puntos. Definimos como la diferencia clínicamente relevante un cambio de 0,5 por área24.
Análisis estadísticoLos resultados se expresan mediante su media y desviación estándar en las variables numéricas, y como frecuencias y porcentajes en las variables categóricas. Ambos grupos se compararon en el momento basal mediante la prueba de la t de Student en todas las variables numéricas. Los cambios observados en las sucesivas revisiones respecto a las mediciones basales se estudiaron con la prueba de la t de Student de medidas repetidas. Para comparar ambos grupos durante el seguimiento se realizó un análisis de la covariancia (9 semanas después del programa de RR y a los 6 meses) ajustado por sus valores basales. Este tipo de análisis permite estudiar las diferencias entre ambos grupos y además tener en cuenta la correlación respecto a sus valores basales.
Las variables categóricas se compararon con la prueba de la χ2 de Pearson o la prueba exacta de Fisher.
En todas las pruebas se consideró significativo un valor de p ≤ 0,05. Se analizaron los pacientes con datos disponibles en los grupos a los que fueron asignados. El análisis estadístico se realizó con el programa SPSS versión 14 (SPSS Inc., Chicago. Illinois, EE.UU).
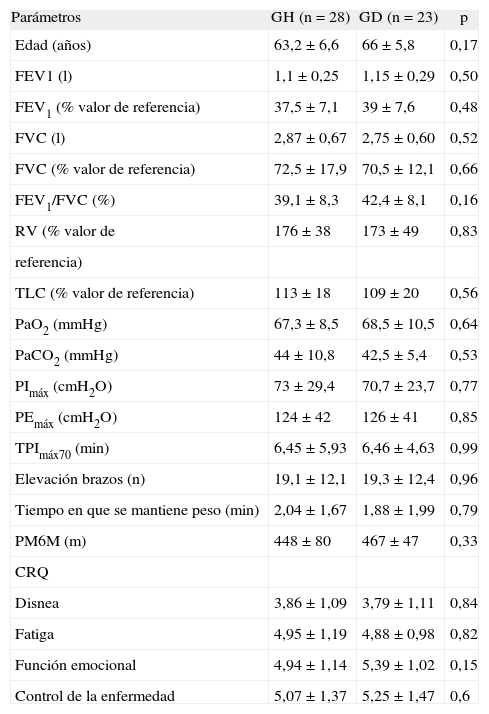
ResultadosSe incluyó a 57 pacientes, todos ellos de sexo masculino, con el diagnóstico de EPOC grave (estadio III según la clasificación GOLD15; media ± desviación estándar del FEV1: 38,5 ± 6,9% del valor de referencia), de los que 29 fueron asignados aleatoriamente al GH y 28 al GD. De los 57 pacientes, 6 abandonaron el estudio durante el período del programa estructurado: uno del GH por falta de motivación y 5 del GD (4 fue por falta de motivación y el quinto por presentar angina). Se excluyó a 8 pacientes durante el período sin seguimiento: 5 en el GH (3 por falta de colaboración y 2 por exacerbaciones) y 3 en el GD, todos ellos por falta de colaboración. Por lo tanto, 51 pacientes (28 del GH y 23 del GD) completaron el período estructurado y 43 (23 del GH y 20 del GD) completaron el estudio hasta el final de los 6 meses. En la tabla I se exponen los valores basales de la población estudiada. Ambos grupos eran similares y no había diferencias significativas entre ellos.
Valores basales de los pacientes incluidos en los grupos hospital (GH) y domicilio (GD)
| Parámetros | GH (n = 28) | GD (n = 23) | p |
| Edad (años) | 63,2 ± 6,6 | 66 ± 5,8 | 0,17 |
| FEV1 (l) | 1,1 ±0,25 | 1,15 ±0,29 | 0,50 |
| FEV1 (% valor de referencia) | 37,5 ±7,1 | 39 ± 7,6 | 0,48 |
| FVC (l) | 2,87 ± 0,67 | 2,75 ± 0,60 | 0,52 |
| FVC (% valor de referencia) | 72,5 ± 17,9 | 70,5 ± 12,1 | 0,66 |
| FEV1/FVC (%) | 39,1 ± 8,3 | 42,4 ±8,1 | 0,16 |
| RV (% valor de | 176 ±38 | 173 ± 49 | 0,83 |
| referencia) | |||
| TLC (% valor de referencia) | 113 ± 18 | 109 ±20 | 0,56 |
| PaO2 (mmHg) | 67,3 ± 8,5 | 68,5 ± 10,5 | 0,64 |
| PaCO2 (mmHg) | 44 ± 10,8 | 42,5 ± 5,4 | 0,53 |
| PImáx (cmH2O) | 73 ± 29,4 | 70,7 ± 23,7 | 0,77 |
| PEmáx (cmH2O) | 124 ± 42 | 126 ±41 | 0,85 |
| TPImáx70 (min) | 6,45 ± 5,93 | 6,46 ± 4,63 | 0,99 |
| Elevación brazos (n) | 19,1 ± 12,1 | 19,3 ± 12,4 | 0,96 |
| Tiempo en que se mantiene peso (min) | 2,04 ± 1,67 | 1,88 ± 1,99 | 0,79 |
| PM6M (m) | 448 ± 80 | 467 ± 47 | 0,33 |
| CRQ | |||
| Disnea | 3,86 ±1,09 | 3,79 ± 1,11 | 0,84 |
| Fatiga | 4,95 ± 1,19 | 4,88 ± 0,98 | 0,82 |
| Función emocional | 4,94 ± 1,14 | 5,39 ± 1,02 | 0,15 |
| Control de la enfermedad | 5,07 ± 1,37 | 5,25 ± 1,47 | 0,6 |
Valores expresados como media ± desviación estándar. CRQ: Cuestionario de Enfermedad Respiratoria Crónica; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; PaCO2: presión arterial de anhídrido carbónico; PaO2: presión arterial de oxígeno; PEmáx: presión espiratoria máxima; PImáx: presion inspiratoria máxima; PM6M: prueba de la marcha de 6 min; RV: volumen residual; TLC: capacidad pulmonar total; TPImáx70: tiempo en que los pacientes eran capaces de mantener el 70% de la PImáx.
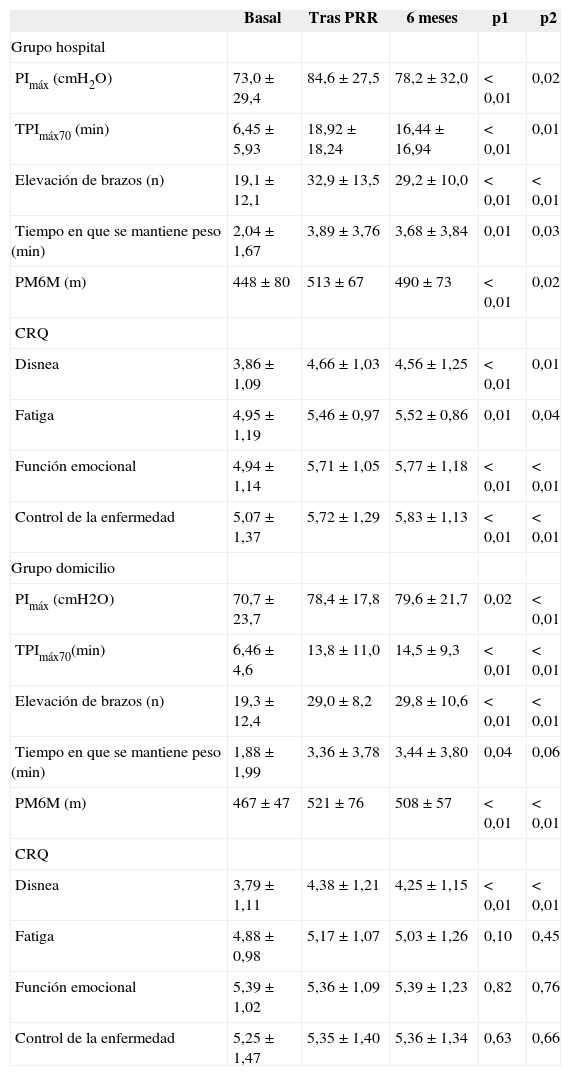
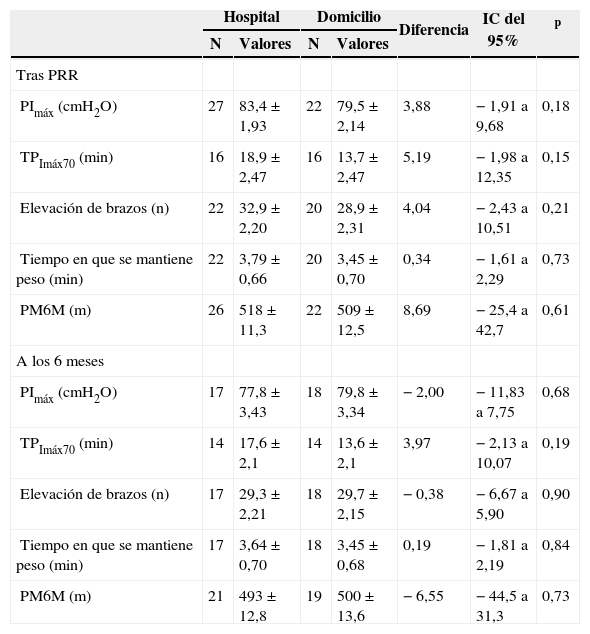
En la tabla II se muestran los cambios en todos los parámetros para ambos grupos después del programa de RR estructurado y a los 6 meses. En las tablas III y IV se comparan los cambios que experimentaron los grupos GH y GD en todas las variables del estudio, tanto al final del programa como a los 6 meses de seguimiento. Para cada período se presentan las medias de cada grupo y las diferencias entre ellos, después de ajustar por los valores basales, con sus intervalos de confianza del 95%.
Cambios observados en la función de los músculos respiratorios, en la prueba de la marcha de 6 min (PM6M) y en la calidad de vida relacionada con la salud
| Basal | Tras PRR | 6 meses | p1 | p2 | |
| Grupo hospital | |||||
| PImáx (cmH2O) | 73,0 ± 29,4 | 84,6 ± 27,5 | 78,2 ± 32,0 | < 0,01 | 0,02 |
| TPImáx70 (min) | 6,45 ± 5,93 | 18,92 ± 18,24 | 16,44 ± 16,94 | < 0,01 | 0,01 |
| Elevación de brazos (n) | 19,1 ± 12,1 | 32,9 ± 13,5 | 29,2 ± 10,0 | < 0,01 | < 0,01 |
| Tiempo en que se mantiene peso (min) | 2,04 ± 1,67 | 3,89 ± 3,76 | 3,68 ± 3,84 | 0,01 | 0,03 |
| PM6M (m) | 448 ± 80 | 513 ±67 | 490 ± 73 | < 0,01 | 0,02 |
| CRQ | |||||
| Disnea | 3,86 ± 1,09 | 4,66 ± 1,03 | 4,56 ± 1,25 | < 0,01 | 0,01 |
| Fatiga | 4,95 ± 1,19 | 5,46 ± 0,97 | 5,52 ±0,86 | 0,01 | 0,04 |
| Función emocional | 4,94 ± 1,14 | 5,71 ± 1,05 | 5,77 ± 1,18 | < 0,01 | < 0,01 |
| Control de la enfermedad | 5,07 ± 1,37 | 5,72 ± 1,29 | 5,83 ± 1,13 | < 0,01 | < 0,01 |
| Grupo domicilio | |||||
| PImáx (cmH2O) | 70,7 ± 23,7 | 78,4 ± 17,8 | 79,6 ±21,7 | 0,02 | < 0,01 |
| TPImáx70(min) | 6,46 ± 4,6 | 13,8 ± 11,0 | 14,5 ±9,3 | < 0,01 | < 0,01 |
| Elevación de brazos (n) | 19,3 ± 12,4 | 29,0 ± 8,2 | 29,8 ± 10,6 | < 0,01 | < 0,01 |
| Tiempo en que se mantiene peso (min) | 1,88 ± 1,99 | 3,36 ± 3,78 | 3,44 ± 3,80 | 0,04 | 0,06 |
| PM6M (m) | 467 ± 47 | 521 ± 76 | 508 ± 57 | < 0,01 | < 0,01 |
| CRQ | |||||
| Disnea | 3,79 ± 1,11 | 4,38 ± 1,21 | 4,25 ± 1,15 | < 0,01 | < 0,01 |
| Fatiga | 4,88 ± 0,98 | 5,17 ± 1,07 | 5,03 ± 1,26 | 0,10 | 0,45 |
| Función emocional | 5,39 ± 1,02 | 5,36 ± 1,09 | 5,39 ± 1,23 | 0,82 | 0,76 |
| Control de la enfermedad | 5,25 ± 1,47 | 5,35 ± 1,40 | 5,36 ± 1,34 | 0,63 | 0,66 |
Valores expresados como media ± desviación estándar. CRQ: Cuestionario de Enfermedad Respiratoria Crónica; PImáx: presion inspiratoria máxima; PMGM: prueba de la marcha de 6 min; PRR: programa de rehabilitación respiratoria; TPImáx70: tiempo en que los pacientes eran capaces de mantener el 70% de la PImáx.
Prueba de la t de Student para medidas repetidas. p1: diferencias entre la situación basal y tras PRR; p2: diferencia entre la situación basal y a los 6 meses de seguimiento.
Presiones respiratorias, resistencia de los músculos de los brazos y tolerancia al ejercicio después del programa de rehabilitación respiratoria (PRR) y a los 6 meses de seguimiento
| Hospital | Domicilio | Diferencia | IC del 95% | p | |||
| N | Valores | N | Valores | ||||
| Tras PRR | |||||||
| PImáx (cmH2O) | 27 | 83,4 ± 1,93 | 22 | 79,5 ±2,14 | 3,88 | −1,91 a 9,68 | 0,18 |
| TPImáx70 (min) | 16 | 18,9 ±2,47 | 16 | 13,7 ±2,47 | 5,19 | −1,98 a 12,35 | 0,15 |
| Elevación de brazos (n) | 22 | 32,9 ± 2,20 | 20 | 28,9 ± 2,31 | 4,04 | −2,43 a 10,51 | 0,21 |
| Tiempo en que se mantiene peso (min) | 22 | 3,79 ± 0,66 | 20 | 3,45 ± 0,70 | 0,34 | −1,61 a 2,29 | 0,73 |
| PM6M (m) | 26 | 518 ± 11,3 | 22 | 509 ± 12,5 | 8,69 | −25,4 a 42,7 | 0,61 |
| A los 6 meses | |||||||
| PImáx (cmH2O) | 17 | 77,8 ± 3,43 | 18 | 79,8 ± 3,34 | −2,00 | −11,83 a 7,75 | 0,68 |
| TPImáx70 (min) | 14 | 17,6 ±2,1 | 14 | 13,6 ±2,1 | 3,97 | −2,13 a 10,07 | 0,19 |
| Elevación de brazos (n) | 17 | 29,3 ±2,21 | 18 | 29,7 ±2,15 | −0,38 | −6,67 a 5,90 | 0,90 |
| Tiempo en que se mantiene peso (min) | 17 | 3,64 ± 0,70 | 18 | 3,45 ± 0,68 | 0,19 | −1,81 a 2,19 | 0,84 |
| PM6M (m) | 21 | 493 ± 12,8 | 19 | 500 ± 13,6 | −6,55 | −44,5 a 31,3 | 0,73 |
Valores expresados como media ± desviación estándar. Medias ajustadas por los valores en situación basal (ANCOVA). IC: intervalo de confianza; PImáx: presión inspiratoria máxima; PM6M: prueba de la marcha de 6 min; TPImáx70: tiempo en que los pacientes eran capaces de mantener el 70% de la PImáx.
Tras el período estructurado los pacientes de ambos grupos (GH y GD) mostraron un incremento estadísticamente significativo de la PImáx y TPImáx70, que se mantuvo hasta el final del período de seguimiento, a los 6 meses (tabla II). Ajustado por los valores basales, no se observaron diferencias significativas entre los 2 grupos en ninguno de los 2 períodos del estudio (tabla III).
Prueba de esfuerzo de los brazosAl final del período estructurado los pacientes de ambos grupos experimentaron una mejoría en la fuerza y resistencia de los músculos de los brazos -número de elevaciones (p < 0,01) y tiempo de mantenimiento del peso (p = 0,03)-. Esta mejoría se mantuvo durante el período de seguimiento (tabla II). No se observaron diferencias entre GH y GD ninguno de los 2 períodos del estudio (tabla III).
Prueba de esfuerzo de las piernasLa distancia recorrida en la PM6M se incrementó de forma significativa en los grupos GH y GD, tanto después del período estructurado como tras el período de seguimiento (tabla II). Ajustando por los valores basales, no se observaron diferencias entre los grupos en la distancia recorrida en ninguno de los 2 períodos (tabla III). La media del incremento alcanzado sobrepasó el umbral de la diferencia clínicamente relevante en el GH (66,6 m) y casi lo alcanzó en el GD (52,2 m).
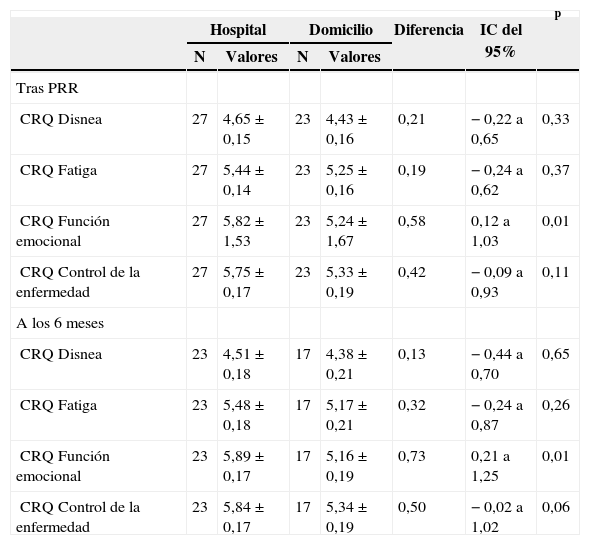
Calidad de vida relacionada con la saludEn el grupo GH se observó una mejoría significativa en todas las áreas del CRQ tanto después del período estructurado como del período de seguimiento, a los 6 meses. Los pacientes del GD mostraron una mejoría significativa únicamente en el área de disnea en ambos momentos del análisis (tabla II). Todos los incrementos fueron uniformemente mayores en el GH que en el GD, pero las diferencias entre ambos grupos alcanzaron la significación estadística únicamente en el área de función emocional (tabla IV).
Calidad de vida relacionada con la salud después del programa de rehabilitación respiratoria (PRR) y a los 6 meses de seguimiento
| Hospital | Domicilio | Diferencia | IC del 95% | p | |||
| N | Valores | N | Valores | ||||
| Tras PRR | |||||||
| CRQ Disnea | 27 | 4,65 ±0,15 | 23 | 4,43 ±0,16 | 0,21 | −0,22 a 0,65 | 0,33 |
| CRQ Fatiga | 27 | 5,44 ±0,14 | 23 | 5,25 ±0,16 | 0,19 | −0,24 a 0,62 | 0,37 |
| CRQ Función emocional | 27 | 5,82 ± 1,53 | 23 | 5,24 ± 1,67 | 0,58 | 0,12 a 1,03 | 0,01 |
| CRQ Control de la enfermedad | 27 | 5,75 ±0,17 | 23 | 5,33 ±0,19 | 0,42 | −0,09 a 0,93 | 0,11 |
| A los 6 meses | |||||||
| CRQ Disnea | 23 | 4,51 ±0,18 | 17 | 4,38 ±0,21 | 0,13 | −0,44 a 0,70 | 0,65 |
| CRQ Fatiga | 23 | 5,48 ±0,18 | 17 | 5,17 ±0,21 | 0,32 | −0,24 a 0,87 | 0,26 |
| CRQ Función emocional | 23 | 5,89 ±0,17 | 17 | 5,16 ±0,19 | 0,73 | 0,21 a 1,25 | 0,01 |
| CRQ Control de la enfermedad | 23 | 5,84 ±0,17 | 17 | 5,34 ±0,19 | 0,50 | −0,02 a 1,02 | 0,06 |
Valores expresados como media ± desviación estándar. Valores medios ajustados por los valores basales (ANCOVA). CRQ: Cuestionario de Enfermedad Respiratoria Crónica; IC: intervalo de confianza.
En el GH la media de incremento en las 4 áreas del CRQ fue mayor que el valor de la diferencia clínicamente relevante tanto al final del período estructurado como del período de seguimiento (disnea: 0,87-0,66; fatiga: 0,56-0,57; función emocional: 0,76-0,75; control de la enfermedad: 0,6-0,6). En el GD únicamente lo fue para el área de disnea (0,56-0,55).
DiscusiónNuestro estudio demuestra la utilidad de la RR en pacientes con EPOC. Con los 2 tipos de programas (domiciliario y hospitalario) se consigue una mejoría similar en la capacidad de esfuerzo y los síntomas (disnea). Sin embargo, se ha observado una mayor mejoría en la CVRS y, en concreto, en el área de función emocional cuando el programa se realiza en el hospital.
A pesar de que el entrenamiento específico de los músculos respiratorios es objeto de controversia, los hallazgos de 2 metaanálisis25,26 y estudios aleatorizados con grupo control más recientes27,28 indican que, cuando se asegura una adecuada presión en boca, la fuerza y la resistencia de los músculos respiratorios pueden mejorar. En nuestro estudio encontramos en ambos grupos una mejoría significativa en la función de los músculos respiratorios tanto en términos de fuerza (PImáx) como de resistencia (TPImáx70), lo que está de acuerdo con los resultados previamente reseñados. También algunos estudios han puesto de manifiesto que este tipo de entrenamiento puede mejorar la CVRS y la capacidad de esfuerzo, si bien esto se consigue cuando se combina con un entrenamiento general, lo que hace difícil asignar los resultados al efecto exclusivo del entrenamiento de los músculos respiratorios26. Recientemente el consenso de la American Thoracic Society/European Respiratory Society recomienda que la incorporación del entrenamiento de los músculos respiratorios a los programas de RR cuando haya evidencia de debilidad de dichos músculos29. Nuestros pacientes realizaron un entrenamiento estructurado, con una presión en boca adecuada, dentro de un programa de entrenamiento general de los músculos de los brazos y las piernas, y también por lo que se refiere a la CVRS y la tolerancia al esfuerzo nuestros hallazgos están en consonancia con los descritos en la literatura médica, si bien, como se acepta en general, estos resultados no serían directamente imputables al entrenamiento de los músculos inspiratorios y sí al programa en su conjunto.
Son escasos los estudios que han analizado los beneficios del entrenamiento de los brazos, a pesar de que este ejercicio tiene importantes consecuencias metabólicas y ventilatorias30. Tras realizar un entrenamiento específico de los músculos de los brazos, nuestros pacientes experimentaron una mejoría estadísticamente significativa tanto en la fuerza como en la resistencia de los brazos, resultados que coinciden con lo comunicado en estudios previos1–3,29,30.
Los pacientes de ambos grupos mostraron una mejoría estadísticamente significativa en la capacidad de esfuerzo, tal como se ha demostrado en múltiples estudios previos1–3,10,13,14. La mejoría en la distancia recorrida en la PM6M alcanzó (GH) o casi alcanzó (GD) el umbral en el que los pacientes pueden percibir la diferencia en su capacidad de caminar22. Estudios anteriores han analizado los efectos del entrenamiento de las piernas en el domicilio, pero en general han aplicado programas con alta intensidad de trabajo y una estrecha supervisión10,13,14. Únicamente Puente Maestu et al31 utilizaron el caminar como programa de entrenamiento al comparar a un grupo supervisado por un fisioterapeuta en el hospital con otro no supervisado que utilizaba un podómetro. Los autores encontraron incrementos de la capacidad de esfuerzo en ambos grupos, aunque fueron menores en el grupo sin supervisión.
Diversos estudios aleatorizados con grupo control realizados en domicilio han demostrado mejorías significativas en la CVRS de los pacientes con EPOC10,11,13. En el de Strijbos et al13, que compararon los beneficios de un programa de RR hospitalario con uno domiciliario, se observó mejoría en la capacidad de ejercicio, la disnea y la sensación de bienestar en ambos grupos. La mejoría objetivada en la disnea y la distancia recorrida en la PM6M de nuestro GD indica que los pacientes siguieron adecuadamente el programa de entrenamiento. Podríamos especular que la falta de mejoría en otras dimensiones de la CVRS entre los pacientes que realizaron el programa en el domicilio sin supervisión es el resultado de un insuficiente apoyo psicoemocional por parte del equipo de RR, apoyo que sí recibieron los pacientes del GH. Al comparar nuestros resultados con los de otros programas domiciliarios se observan diferencias en el método utilizado. Wijkstra et al10 y Strijbos et al13 realizaron programas domiciliarios mucho más intensos, que incluían la supervisión, ya fuese por un fisioterapeuta o por un médico, al menos una vez por semana. Otros programas más simples, como los publicados por Hernández et al14, Puente-Maestu et al31 y Boxal et al32, que también obtuvieron mejorías en la CVRS, proporcionaban mayor apoyo emocional a los pacientes que nuestro programa, ya que en todos ellos se ofrecía al menos una visita semanal en el domicilio del paciente o en el hospital. Hernández et al14 presentaban un modelo de programa que, aunque simple, era más estructurado que el de nuestro estudio y, además, los pacientes acudían cada 2 semanas al hospital para valorar el incremento del ejercicio realizado en términos de intensidad o tiempo. Por otro lado, Wedzicha et al33 no encontraron cambios en la CVRS de los pacientes con EPOC intensa que realizaron un programa de RR en el domicilio, a pesar de que contaban con la supervisión de un fisioterapeuta. Los autores atribuyen la falta de beneficios a la corta duración del programa, a la gravedad de la enfermedad y a la baja intensidad del ejercicio realizado.
Finalmente queremos remarcar que los beneficios del programa se mantuvieron en ambos grupos hasta 6 meses después de finalizar el programa. Son pocos los estudios que han analizado este aspecto y la mayoría demuestra que los beneficios de un programa de RR, ya sea hospitalario o domiciliario, no se mantienen más allá de uno o 2 años34,35.
Una limitación de nuestro estudio es el reducido tamaño de la muestra de pacientes, lo que podría repercutir en una falta de potencia estadística. Sin embargo, este hecho no ha impedido encontrar diferencias estadísticamente significativas entre grupos, por lo que no creemos que dicha limitación reste validez a los resultados. Otra limitación es el alto porcentaje de abandonos del programa: un 10,5% en el período estructurado y un 25% adicional en el período de seguimiento de 6 meses. Estos resultados son similares a los publicados por otros autores10,13,14. Es remarcable que el número de abandonos en el GD fue mayor que en el GH. Este elevado número de abandonos en el GD parecería previsible y podría deberse, en nuestra opinión, a la falta de una supervisión específica y de apoyo psicoemocional que animen a un mayor cumplimiento del tratamiento.
En conclusión, los beneficios de los programas de RR realizados tanto en el hospital como en el domicilio con un método simple y sin supervisión son similares en términos de capacidad de esfuerzo. Sin embargo, la mejoría en la CVRS parece ser más importante cuando el programa se efectúa en el hospital, sobre todo por lo que se refiere a la función emocional. Pese a la limitación que supone el escaso número de pacientes, estos resultados indican que la RR domiciliaria es una alternativa a los programas clásicos de rehabilitación, lo que permitiría su aplicación en un mayor número de pacientes.
AgradecimientosLos autores agradecen a Coloma Sotomayor, Mercé Sangenis, Fátima Morante y Araceli González su trabajo y dedicación a los pacientes.
Trabajo realizado con apoyo parcial de RTIC-ISCIII-Red Respira.