Introducción
El carcinoma bronquioloalveolar (CBA) es una estirpe histológica diferenciada dentro del grupo del cáncer de pulmón no microcítico (CBNM)1. En noviembre de 2004 se celebró en Nueva York la International Consensus Conference on Bronchioloalveolar Carcinoma2,3. En esta reunión se consideraron las evidencias del incremento relativo de su diagnóstico en paralelo a la disminución de los CBNM escamosos y la abundante información sobre las formas clinicorradiológicas, las clasificaciones histológicas (CBA puro o mezcla con adenocarcinoma) y los tratamientos más específicos.
El objetivo del presente trabajo es describir una serie de CBA tratados quirúrgicamente en los 19 hospitales del Grupo Cooperativo de Carcinoma Broncogénico de la Sociedad Española de Neumología y Cirugía Torácica (GCCB-S) entre 1993 y 1997.
Pacientes y métodos
Pacientes
Todos los pacientes incluidos en el estudio presentaban carcinoma broncogénico con toracotomía realizada en los hospitales pertenecientes al GCCB-S4. Se incluyó de forma prospectiva a todos los tratados quirúrgicamente entre 1993 y septiembre de 1997, ambos inclusive. El número acumulado de casos anuales era cercano al 50% de los casos quirúrgicos que se operan en España. Los centros participantes tienen una amplia variedad de actividades, con un rango representativo en cuanto al número de camas, su carácter docente o investigador, su patrimonio público o privado y el número de intervenciones por año. La muestra es completa, ya que se verificó la inclusión en el registro de todos los pacientes en quienes se efectuaba cirugía de esta enfermedad, que incluye las resecciones completas y la toracotomía exploradora.
La mortalidad operatoria incluía todos los fallecimientos directamente relacionados con la cirugía, con independencia del tiempo en que ocurriera (menos o más de 30 días) y del lugar (dentro o fuera del hospital). El número inicial de casos incluidos en este estudio fue de 2.994. Después de una nueva evaluación se retiraron 3 casos, dado que en una revisión patológica uno de los casos fue carcinosarcoma y los otros 2 registros correspondían a un mismo paciente operado de diferentes tumores en cada lado en 1994 y 1996. Por tanto, el número final de casos es 2.991. Dado que el último caso de esta serie se operó el 30 de septiembre de 1997, se tiene, en el momento de efectuar el último corte de seguimiento (diciembre de 2004), una experiencia de supervivencia global por todas las causas de 7 a 11 años.
Para los objetivos del presente estudio se han seleccionado los casos con diagnóstico de CBA en la pieza quirúrgica y los casos de CBNM distinto de CBA en la misma muestra, para la comparación de sus características clínicas y de la supervivencia. Se ha excluido, por tanto, a 47 pacientes con carcinoma broncogénico microcítico.
Métodos
Para la estadificación de esta serie de casos se utilizó la clasificación TNM de 19975. La estadificación clínica se define como la clasificación obtenida por cualquier método, incluso de carácter quirúrgico, antes de realizar el procedimiento terapéutico definitivo. La estadificación patológica se define como la clasificación obtenida con los signos observados durante la toracotomía y con los datos recogidos después de la evaluación de la pieza quirúrgica en conjunción con los datos conocidos con la estadificación clínica. En todos los centros del GCCB-S se utilizaron criterios similares para el estudio de la operabilidad funcional de los pacientes y para la operabilidad oncológica del tumor6.
En el registro del GCCB-S cada componente clasificatorio incluido dentro de cada grupo de la categoría Tc --clasificación "clínica" (pretoracotomía) del apartado T de la estadificación TNM-- se consideraba de forma diferenciada para cada paciente. Los métodos diagnósticos se registraban según una codificación previamente acordada y el procedimiento que alcanzaba la mejor resolución era el que se identificaba en el registro prospectivo.
El grado de certeza de la clasificación de los estadios TNM depende del método diagnóstico utilizado. De acuerdo con algunas organizaciones internacionales, el estudio autópsico tiene la máxima certeza, y los datos clínicos, la mínima. Por consenso entre los miembros del Grupo Coordinador del GCCB-S (2 cirujanos torácicos y un neumólogo), se establecieron los métodos para afirmar la certeza máxima clasificatoria para cada componente (máxima certeza clínica posible ajustada por cada problema)7. Las categorías ganglionares (N) se evaluaban usando diferentes criterios diagnósticos de certeza clasificatoria. Para confirmar una clasificación N0c, se precisaba la ausencia de adenopatías, o de un tamaño menor de 1 cm, en la tomografía computarizada en las regiones 4, 7 y 10, como mínimo8. En los tumores de localización izquierda en el lóbulo superior o bronquio principal, además era necesaria la ausencia de estas adenopatías patológicas en la ventana aortopulmonar o en la prevascular (áreas 5 y 6). Si no se cumplían estos criterios, se requería la negatividad a través de una mediastinoscopia o mediastinotomía o una punción aspirativa con aguja fina por cualquier vía. La clasificación N1c --clasificación "clínica" (pretoracotomía) del apartado N de la estadificación TNM-- se alcanzaba por evidencia citohistológica por cualquier sistema. Para confirmar una clasificación N2c --clasificación "clínica" (pretoracotomía) del apartado T de la estadificación TNM--, se requería la presencia de evidencia citohistológica por mediastinoscopia, mediastinotomía, punción aspirativa con aguja final por cualquier vía, videotoracoscopia, etc. Para clasificar la situación N0 quirúrgico-patológica (N0p) --clasificación "patológica" (postoracotomía) del apartado N de la estadificación TNM--, se necesitaba una disección ganglionar sistemática del mediastino o un muestreo sistemático de, al menos, 4 áreas ganglionares, 2 (solamente en el lado derecho), 4, 7 y 10 del mismo lado del tumor. Además, si el cáncer de pulmón se localizaba en el lado izquierdo (lóbulo superior o bronquio principal) era necesario explorar con la misma seguridad clasificatoria el área mediastínica anterior y la ventana aortopulmonar (áreas 5 y 6). Para este propósito de clasificar la presencia o ausencia de afectación ganglionar mediastínica, un estudio aleatorizado demostró que el muestreo sistemático tenía un valor similar al de la disección ganglionar sistemática9. Estos requisitos mínimos (muestreo sistemático o disección ganglionar mediastínica) son indispensables para clasificar N0p, dada la observación de diferencias pronósticas en relación con la realización de sólo un muestreo ganglionar aleatorio10.
Se efectuaron auditorías internas y externas para evaluar la relación entre el número de pacientes con cirugía y los casos incluidos en el registro (estándar superior al 95%), la presencia y validez de los datos registrados por cada caso (estándar sobre el 70%), incluyendo la consistencia de la estadificación tumoral11,12. El criterio para la validez de los datos de supervivencia se estableció como la existencia de un seguimiento conocido del 85% o más de los casos registrados en cada hospital. En los hospitales que no alcanzaban todas estas condiciones, los casos correspondientes al período con problemas se excluían. Finalmente, se verificaba que lo datos se trasladaban correctamente desde el registro en papel a las bases de datos computarizadas en una oficina central de gestión de la información.
Todos estos procedimientos se diseñaron para intentar el control de los sesgos de selección de casos quirúrgicos, de casos registrados sobre el número total de casos quirúrgicos, el tamaño de la muestra, el tipo de hospital, la migración pronóstica debida a un prolongado período de reclutamiento de casos, clasificaciones con grados de certeza bajos o deficientes, contaminación por datos de series incompletas o con datos erróneos, y por la pérdida de seguimiento a largo plazo.
Dado que este trabajo se centra en casos de cáncer de pulmón con tratamiento quirúrgico y que la concordancia entre los estadios clínicos y patológicos en nuestra experiencia es muy deficiente13, este artículo muestra solamente los análisis en relación con los estadios patológicos.
Análisis estadístico
Los datos pronósticos se muestran como probabilidad de supervivencia a los 5 años, con intervalos de confianza del 95% y en mediana en meses. Se utilizó el método de Kaplan-Meier considerando como evento la muerte por cualquier causa. El tiempo 0 es la fecha de la cirugía. Para comparar las curvas de supervivencia se utilizó el test de rangos logarítmicos. Se consideró una diferencia estadísticamente significativa cuando p < 0,05.
Resultados
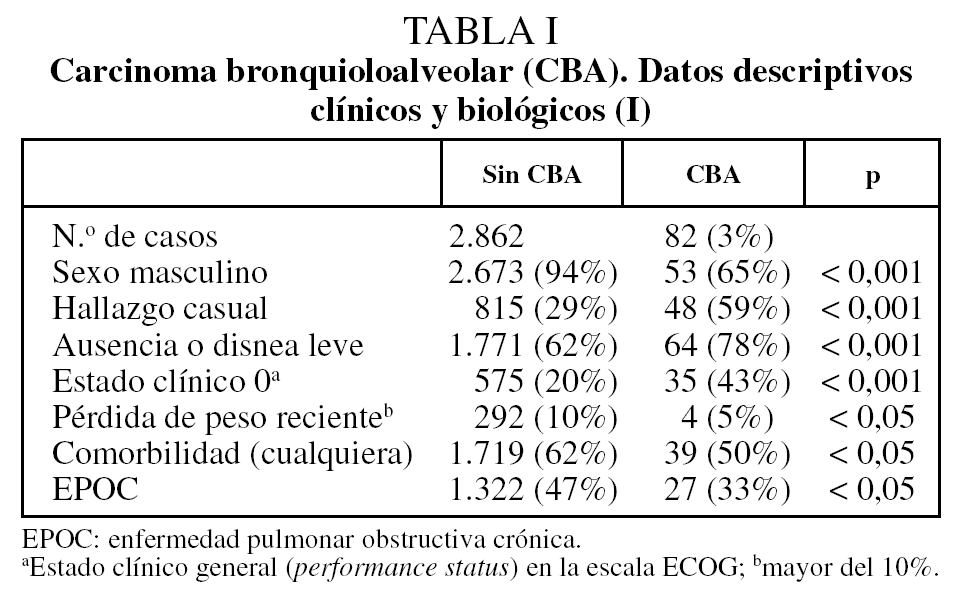
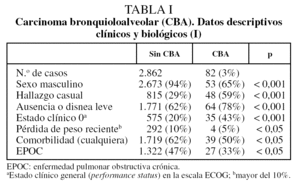
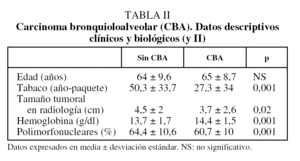
De los 2.944 casos de CBNM, 82 pacientes (3%) tenían una estirpe de CBA en la pieza quirúrgica. Al comparar a ésos con los 2.862 CBNM restantes, se observa que existen diferencias significativas en relación con el sexo y la posibilidad de que se trate de un hallazgo casual (tabla I). También se detectan diferencias en los diferentes grados de disnea, en el estado clínico general (escala ECOG), en la presencia de pérdida de peso significativa (más del 10% del habitual) y en la presencia de cualquier comorbilidad, en general, o de enfermedad pulmonar obstructiva crónica (EPOC) en particular (tabla I).
La edad no es diferente entre ambos grupos (tabla II). Existen, sin embargo, diferencias significativas en relación con el hábito tabáquico, el tamaño tumoral radiológico y los parámetros hematológicos (tabla II). El porcentaje de fumadores o ex fumadores es del 90% en los CBNM distintos de CBA y del 55% en el grupo de CBNM-CBA (p < 0,001).
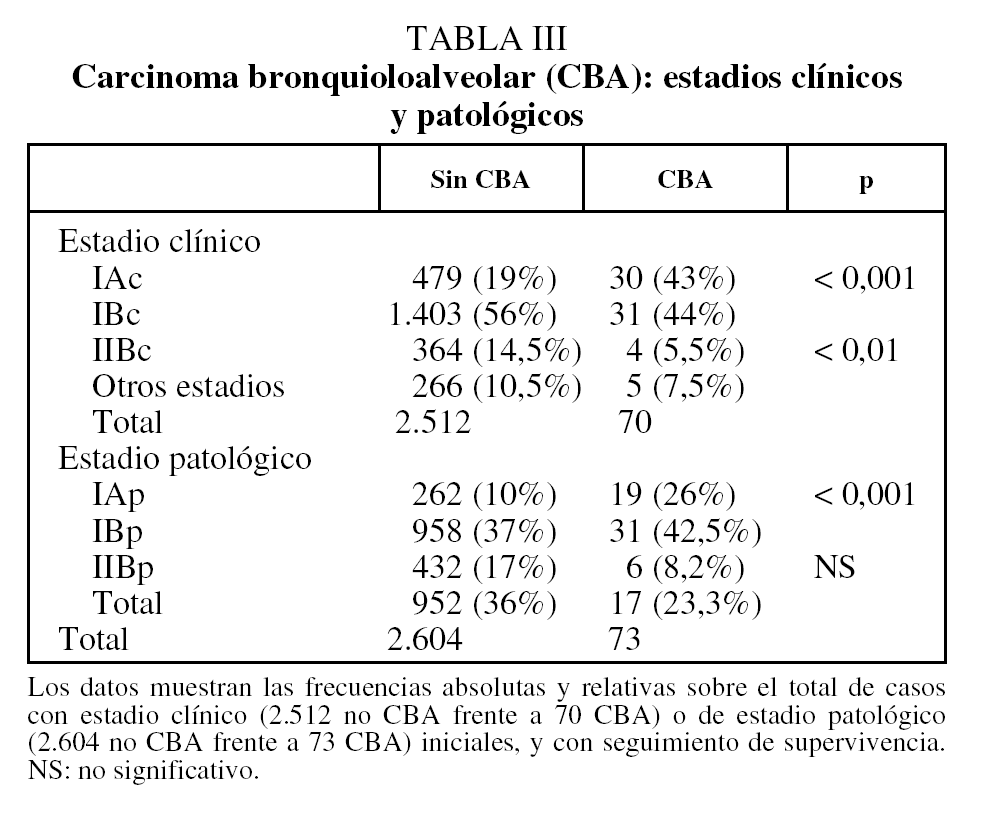
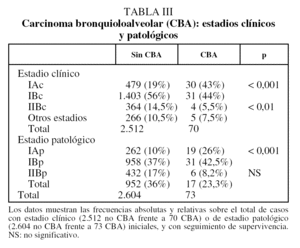
El 87% de los CBA están en estadio I clínico, en comparación con el 75% de los CBNM no CBA (p < 0,001) (tabla III). Esta diferencia del 12% de frecuencia relativa entre los 2 grupos se duplica (22%) cuando se la comparación se realiza en estadio I patológico (el 69 frente al 47%) (tabla III).
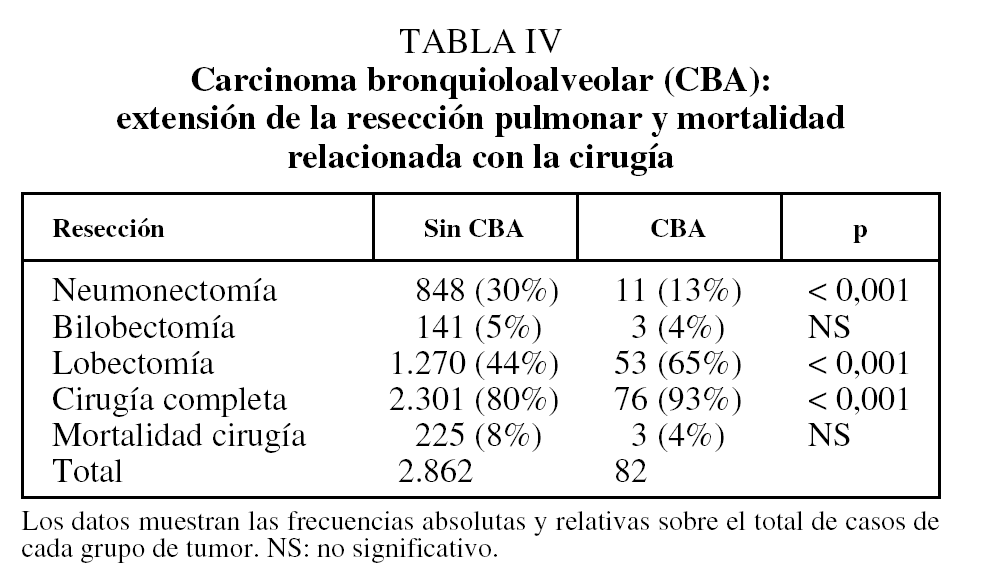
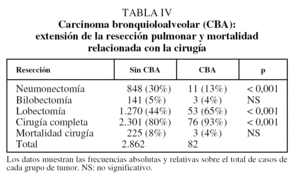
En relación con el tratamiento quirúrgico, la neumonectomía es significativamente más frecuente en los CBNM distintos de CBA y la resección completa en los CBA (tabla IV). La mortalidad relacionada con la cirugía es del 8% en los 2.862 casos de CBNM no CBA y del 4% en los 82 CBA (p = 0,2; test exacto de Fisher).
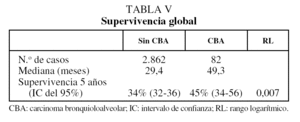
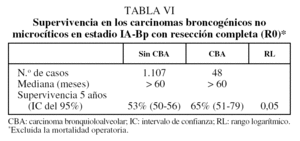
En las tablas V y VI se describen los datos de supervivencia comparativos entre ambas poblaciones (CBNM no CBA frenta a CBA) de forma global y para el estadio Ip-R0 (R0: resección completa), excluida la mortalidad operatoria, respectivamente. En nuestra experiencia, la supervivencia a los 5 años del estadio IAp en CBA es del 79%.
Discusión
En esta serie de CBNM operados en España por el GCCB-S se han encontrado 82 CBA (3%). Algunas de las características del paciente y del tumor son diferentes entre los CBA y los restantes CBNM. Desde el punto de vista de su neoplasia, el CBA se presenta más frecuentemente como estadio Ic (un 12% más) o patológico (un 22% más), es más probable la cirugía completa (el 93 frente al 80%) y la supervivencia a los 5 años es mayor, aun considerando únicamente a la población más seleccionada (Ip-R0) (el 65 frente al 53%). El estudio confirma la baja frecuencia del CBA en nuestro medio; sólo representa un 3% y, además, sobre una población quirúrgica, por lo que sobre el total de CBNM diagnosticado supondría alrededor del 1%. Además, en este estudio se ha considerado un amplio criterio de diagnóstico de CBA, que incluye los adenocarcinomas con rasgos de CBA.
Aunque algunos trabajos consideran la existencia de un incremento significativo de la frecuencia relativa del CBA dentro del grupo del CBNM3,14, otros autores no encuentran esos incrementos. En un trabajo realizado en EE.UU. en 2004 que analizó una base de datos de casos reclutados entre 1979 y 1998, se observa que el CBA está por debajo del 4% de todos los CBNM diagnosticados en cualquiera de los períodos estudiados15. Sin embargo, esto no ocurre en todos los continentes. Como se analizó en la reciente conferencia internacional sobre el CBA de Nueva York2, este tipo de CBNM es mucho más frecuente en Japón que en EE.UU. o Europa. Esta diferente frecuencia de presentación entre continentes es difícil de explicar, por lo que son varias las teorías que se han planteado, como la infecciosa16,17, el hecho de que esto sea debido a la extendida política de cribado poblacional de CBNM por tomografía computarizada en Japón o la posibilidad de que haya diferencias genético-ambientales2.
Las características clínicas de nuestros pacientes con CBA (mayor frecuencia del sexo femenino, no fumadores) coinciden con los datos de la bibliografía14. Nuestros casos con CBA tienen una menor frecuencia de comorbilidad y, en concreto, de EPOC (tabla I). Dado que la comorbilidad con EPOC puede ser un factor pronóstico perjudicial, se ha calculado la supervivencia de las poblaciones más seleccionadas por estadio y radicalidad de la cirugía (CBNM-IAp-IBp-R0) (tabla VI), excluyendo los casos con mortalidad operatoria y a los pacientes con EPOC asociada. Los resultados de la supervivencia a los 5 años no se modifican de forma sustancial (el 53 frente al 68%, para CBNM distintos de CBA y para CBA, respectivamente).
La mayor frecuencia relativa de estadios más iniciales en los CBA puede explicar parte de las diferencias encontradas en la distribución por estadios entre la experiencia española y la japonesa18.
En nuestro trabajo los CBA en estadio Ip representan el 69% del total, en comparación con el 47% del resto de CBNM, cifra que coincide con la frecuencia observada en los trabajos de Albertine et al19 (un 70% de estadio Ip), Dumont et al20 (73%) y Daly et al21 (72%), e inferior a la comunicada por Okubo et al22 (77%) y Grover y Piantadosi23 (84%). Sin embargo, en otros casos la frecuencia era aún menor (un 53% de estadio Ip)24.
En nuestro estudio la supervivencia de los CBNM de estirpe CBA era significativamente superior al resto de CBNM, tanto globalmente (tabla V) como considerando sólo los casos con estadios iniciales (Ip) y con resección completa (R0), y una vez excluida la mortalidad operatoria (tabla VI). En esta última población nuestra experiencia de supervivencia a los 5 años es del 65% (intervalo de confianza del 95%, 51-79%), igual que la comunicada por Dumont et al20 (65%), pero diferente de la excepcional de Ebright et al25 (84%) o de la inferior (56%) de Regnard et al24. En nuestra experiencia la supervivencia a los 5 años del estadio IAp en CBA es del 79%, superior a la de Grover y Piantadosi23 (69%) e inferior a la de Daly et al21 (91%). En resumen, la supervivencia de los CBA de nuestro estudio se sitúa en una zona intermedia de pronóstico en relación con las observadas en otras experiencias para este tipo de tumor.
Esta variabilidad puede deberse, entre otras razones, a las limitaciones de nuestro trabajo, que es posible que existan también en otros estudios. La primera limitación es si la clasificación como CBA, según la última norma publicada, es o no correcta1. Es obvio que la gran mayoría de nuestros casos son adenocarcinomas con rasgos bronquioloalveolares, como es habitual fuera de Japón2. La distinción entre esta entidad y el CBA puro no siempre es fácil14 y se necesita mayor consenso entre patólogos, clínicos e investigadores, como recientemente se ha concluido2. Ésta es una importante limitación para el intercambio de información entre diferentes centros, grupos y países.
Las subclasificaciones de adenocarcinoma frente a CBA parecen tener sentido pronóstico. En la clásica clasificación de 1995 efectuada por Noguchi et al26 en Japón, en el nódulo periférico con CBA puro la supervivencia era del 100%, en el mixto adenocarcinoma con CBA del 75% y en el CBA invasivo del 5%. Sin embargo, en otro trabajo fuera de Japón no se observaron diferencias de supervivencia entre el CBA puro, el adenocarcinoma con signos de CBA y el CBA con invasión focal25. Las características clínicas, tumorales y pronósticas del CBA, y sus limitaciones, pueden explicar algunas de las diferencias entre las diversas experiencias en CBNM y entre países. Estas apreciaciones deben considerarse en la evaluación de las bases de datos mundiales27. Finalmente, su conocimiento puede permitir decidir tratamientos coadyuvantes específicos tras el adecuado estudio mutacional.
Addendum
Grupo Cooperativo de Carcinoma Broncogénico de la Sociedad Española de Neumología y Cirugía Torácica (GCCB-S)
Coordinadores: José Luis Duque (Hospital Universitario, Valladolid); Ángel López Encuentra (Hospital Universitario 12 de Octubre, Madrid); Ramón Rami Porta (Hospital Mútua de Terrassa, Barcelona).
Responsables locales: Julio Astudillo y Pedro López de Castro (Hospital Germans Trias i Pujol, Barcelona); Emilio Canalís (Hospital Clínic, Barcelona); Antonio Cantó y Antonio Arnau (Hospital General Universitario, Valencia); Juan Casanova (Hospital de Cruces, Bilbao); Manuel Castanedo y Jorge Quiroga (Hospital Universitario, Valladolid); Antonio Fernández de Rota y Ricardo Arrabal (Hospital Carlos Haya, Málaga); Federico González Aragoneses y Nicolás Moreno (Hospital Gregorio Marañón, Madrid); Jorge Freixinet y Pedro Rodríguez (Hospital Nuestra Señora del Pino, Las Palmas); Nicolás Llobregat (Hospital Universitario del Aire, Madrid); Nuria Mañes y Helena Hernández (Fundación Jiménez Díaz, Madrid); Mireia Serra Mitjans y José Belda Sanchís (Hospital Mutua de Terrassa, Barcelona); José Luis Martín de Nicolás (Hospital Universitario 12 de Octubre, Madrid); Nuria Novoa (Complejo Hospitalario, Salamanca); Jesús Rodríguez (Complejo Hospitalario, Oviedo); Antonio José Torres García y Ana Gómez (Hospital Universitario San Carlos, Madrid); Mercedes de la Torre (Hospital Juan Canalejo, La Coruña); Abel Sánchez-Palencia y Javier Ruiz Zafra (Hospital Virgen de las Nieves, Granada); Andrés Varela Ugarte, María del Mar Córdoba (Clínica Puerta de Hierro, Madrid); Yat Wah Pun (Hospital de la Princesa, Madrid).
Análisis de datos: Agustín Gómez de la Cámara y Francisco Pozo Rodríguez (Unidad de Epidemiología Clínica, Hospital 12 de Octubre, Madrid).
Estudio parcialmente financiado por una beca FIS 97/0011, beca FEPAR-2002, RTIC-03/11-ISCIII-Red-Respira, beca FIS 03/46 y con aportaciones de la Comunidad Autónoma de Castilla y León y de la Fundación Menarini.
*En el addendum figura la lista completa de los miembros del GCCB-S.
Correspondencia: Dr. A. López Encuentra.
Servicio de Neumología. Hospital Universitario 12 de Octubre.
Avda. Córdoba, 5. 28041 Madrid. España.
Correo electrónico: lencuent@h12o.es
Recibido: 26-10-2005; aceptado para su publicación: 17-1-2006.