Investigar si los pacientes con apneas obstructivas del sueño (AOS) sin somnolencia diurna excesiva (SDE) presentan problemas cardiovasculares y características clínicas diferentes de los AOS con SDE.
MétodosSe compararon retrospectivamente dos grupos de pacientes con AOS, uno de ellos sin SDE (Epworth <11) y otro control con SDE (Epworth>10), ajustados por sexo, edad, índice de masa corporal (IMC) e índice de apneas-hipopneas (IAH). Se analizaron síntomas diurnos y nocturnos de AOS, variables polisomnográficas, prevalencia de hipertensión arterial, diabetes mellitus, hiperlipemia y antecedentes de eventos cardiovasculares previos. Se realizó una regresión logística ajustada por múltiples factores de confusión para identificar variables asociadas al AOS sin SDE.
ResultadosSe estudiaron 166 pacientes sin SDE (Epworth 7,2±2,4) y 295 con SDE (Epworth 14,5±2,5). En la regresión logística multiajustada, el AOS sin SDE se asoció de forma independiente con sensación de sueño reparador (IC95% 1,70 a 3,93), menor deterioro intelectual (IC95% 0,30 a 0,95) y menor eficacia del sueño (IC95% 0,96 a 0,99). No se encontraron diferencias en cuanto a prevalencia de comorbilidades cardiovasculares, eventos cardiovasculares previos, estructura de sueño o clínica nocturna de AOS. Cuando se analizaron los pacientes que se encontraban en los cuartiles extremos del Epworth, los resultados obtenidos fueron superponibles a los del total de la serie, desapareciendo únicamente el deterioro intelectual del modelo final.
ConclusionesTras ajustar por variables de confusión, el AOS sin SDE tiene una prevalencia similar de comorbilidades cardiovasculares y menor sintomatología diurna que el AOS con SDE.
To investigate whether patients with obstructive sleep apnoea (OSA) without excessive daytime sleepiness (EDS) have cardiovascular problems and different clinical characteristics from OSA with EDS.
MethodsTwo groups of patients were compared retrospectively, one without EDS (Epworth <11) and another control group with EDS (Epworth>10), adjusted for sex, age, body mass index (BMI) and apnoea-hypopnoea index (AHI). The diurnal and nocturnal symptoms of OSA were analysed along with, polysomnography variables, prevalence of hypertension, diabetes mellitus, hyperlipaemia and history of previous cardiovascular events. A logistic regression was performed adjusted for multiple confounding factors to identify the variables associated with OSA without EDS.
ResultsA total of 166 patients without EDS were studied (Epworth 7.2±2.4) and 295 with EDS (Epworth 14.5±2.5). In the adjusted multivariate logistic regression, OSA without EDS is independently associated with a feeling of restful sleep (95% CI: 1.70 to 3.93), less intellectual deterioration (95% CI: 0.30 to 0.95) and less effective sleep (95% CI: 0.96 to 0.99). No differences were found as regards prevalence of cardiovascular comorbidity, previous cardiovascular events, sleep structure or nocturnal clinical symptoms of OSA. When the patients who were in the extreme quartiles of the Epworth scale were analysed, the results obtained were equivalent to those of the whole series, with only intellectual deterioration disappearing from the final model.
ConclusionsAfter adjusting for confounding variables, OSA without EDS has a similar prevalence of cardiovascular comorbidities and less diurnal symptoms than OSA with EDS.
La definición del síndrome de apneas-hipopneas del sueño se basa en la presencia de episodios recurrentes de obstrucción de la vía aérea superior que desestructuran el sueño, provocando somnolencia diurna excesiva (SDE) y complicaciones cardiovasculares1. De hecho, la SDE no es solo uno de los principales síntomas que definen esta enfermedad sino que es uno de los pilares en los que se basa la decisión de instaurar tratamiento con presión positiva (CPAP)2. Sin embargo, la SDE no ocurre de manera universal en todos los pacientes, y de hecho, solo el 40% de los casos moderados-graves de la cohorte del Sleep Heart Health Study3 y menos del 30% de los casos procedentes de una extensa cohorte española presentaban SDE4. Aunque diversos estudios clínicos y epidemiológicos5,6 han demostrado una correlación entre la gravedad de la apnea del sueño y la presencia de SDE, en otros trabajos no se ha encontrado dicha asociación7,8. Además, parece que la SDE se relaciona más estrechamente con depresión o desórdenes metabólicos que con los trastornos respiratorios del sueño9, y en un reciente trabajo se ha comprobado como aparte de estos factores, el índice de masa corporal (IMC), el consumo de etanol, o comorbilidades como el ictus pueden justificar diferencias en el grado de hipersomnia en pacientes con esta patología del sueño10.
La mayoría de trabajos publicados en pacientes sin SDE se han centrado en identificar los mecanismos por los que este trastorno de sueño provoca hipersomnia en unos casos y no en otros, postulándose el grado de hipoxemia nocturna y la desestructuración del sueño como los mecanismos fundamentales que explicarían estas diferencias11,12. Sin embargo, varias revisiones recientes13,14 han señalado una alarmante falta de información respecto a las manifestaciones y consecuencias cardiovasculares de la apnea del sueño sin SDE, y los escasos trabajos que hay disponibles se han focalizado en analizar la respuesta al tratamiento con CPAP de la hipertensión arterial (HTA), según los pacientes presenten o no SDE asociada, con resultados contradictorios15,16.
El objeto del presente trabajo es analizar la comorbilidad cardiovascular y características clínicas en un grupo de pacientes con apneas obstructivas del sueño (AOS) sin SDE comparándolo con una serie de pacientes AOS con SDE ajustados por diversas variables de confusión.
MétodosDiseño y pacientesSe realizó un estudio retrospectivo de casos y controles. Todos los datos se obtuvieron de las historias clínicas de los pacientes. Se incluyeron aquellos pacientes diagnosticados de AOS (índice apnea-hipopnea [IAH] ≥10/h, <50% apneas centrales) mediante una polisomnografía convencional entre enero 2004 y diciembre 2006. Todos los casos procedían de la consulta de trastornos respiratorios de sueño de nuestra unidad, donde habían sido derivados por sospecha clínica de AOS, basada en la presencia de, al menos, dos de los siguientes síntomas: ronquidos, pausas observadas, crisis asfícticas nocturnas o SDE. La somnolencia diurna se evaluó mediante la escala de Epworth (ESS) y se estableció que un paciente presentaba SDE cuando la puntuación era >1017,18. Todos aquellos pacientes AOS sin SDE detectados de forma consecutiva durante el periodo de inclusión formaron el grupo de estudio. Posteriormente, se constituyó un grupo control compuesto por pacientes AOS con SDE, ajustados por sexo, edad (±5 años), IMC (±1kg/m2) e IAH (±5/h) con el grupo de estudio.
Se excluyeron aquellos casos en los que el estudio de sueño no se leyó manualmente, el tiempo total de sueño fue <3h, no se estableció la SDE mediante ESS, o no se disponía de observador de sueño. El estudio fue aprobado por el comité de ética del hospital.
Evaluación clínicaA todos los pacientes se les realizó inicialmente una historia clínica estructurada y protocolizada, exploración física y análisis de sangre sistemáticos.
Los síntomas y signos de AOS se evaluaron utilizando una versión modificada basada en dos cuestionarios validados; el cuestionario de Berlín19 y el cuestionario desarrollado por Ballester et al20. El cuestionario contenía las siguientes preguntas: ronquido habitual (≥3 veces/semana), pausas observadas habituales (≥3veces/semana), n.o despertares nocturnos por noche, crisis asfícticas nocturnas en el último mes (sí/no), nicturia (≥2veces/noche), cefalea matutina (≥1veces/semana), sueño no reparador (≥3veces/semana), dificultad de concentración por encontrarse cansado o somnoliento (sí/no) y pérdida reciente de memoria (sí/no). Se consideró que un paciente presentaba deterioro intelectual si contestó afirmativamente al menos a una de estas dos últimos preguntas.
Para determinar los antecedentes de eventos cardiovasculares previos y la prevalencia de comorbilidades cardiovasculares que presentaban los pacientes, se realizó una investigación rigurosa basada en la entrevista clínica y los datos obtenidos de la historia clínica. Los pacientes fueron clasificados como hipertensos (HTA), diabéticos (DM) o hiperlipémicos (HLP) si estaban diagnosticados previamente de cualquiera de estas enfermedades, realizaban tratamiento específico para alguna de ellas, o presentaban presión arterial (PA) sistólica o diastólica >140/90 en 2 o más mediciones ambulatorias, niveles de glucosa en ayunas >110mg/dl en 2 o más determinaciones, o niveles de colesterol y/o triglicéridos en ayunas >200mg/dl respectivamente. Se consideró que un paciente había sufrido un evento cardiovascular previo si presentaba antecedentes de al menos uno de los siguientes: ictus, fallo cardiaco, arritmia o cardiopatía isquémica. Asimismo, se interrogó sobre el consumo habitual de fármacos potencialmente sedantes (antihistamínicos, benzodiacepinas, sedantes no benzodiacepínicos, antipsicóticos y barbitúricos), ingesta de etanol (g/d) y hábito tabáquico.
Estudio de sueñoEl diagnóstico de AOS se estableció en todos los casos mediante polisomnografía convencional completa (Compumedics PS®, Melbourne, Australia) durante una noche en laboratorio de sueño. Se registró electroencefalograma, electrooculograma, electromiograma, flujo y presión oronasal, esfuerzo torácico y abdominal, electrocardiograma y saturación arterial de oxígeno (SaO2). Todos los estudios fueron leídos manualmente por facultativos expertos, de acuerdo a criterios estándar21. El flujo aéreo se registró con un termistor más catéter oronasal y los movimientos respiratorios con bandas de esfuerzo. Se definió la apnea como la ausencia de flujo oronasal >10 segundos, clasificándose como obstructiva o central en función de la presencia o ausencia de movimientos respiratorios. Se definió la hipopnea como una reducción del 30 al 90% en el flujo oronasal >10 segundos asociada a una desaturación ≥3% o un arousal. Se utilizaron la SaO2 mínima (SaO2min) y el porcentaje de tiempo con SaO2 <90% (CT90) como marcadores de hipoxia nocturna.
Análisis estadísticoSe utilizó el paquete SPSS 16.0 (SPSS Inc. Chicago, IL, EE.UU.) para el procesamiento de los datos y el análisis estadístico. Las variables continuas se expresaron como media±DE y las cualitativas como porcentajes. La normalidad en la distribución de los datos se estableció mediante el test de Kolmogorov. La comparación de medias se realizó con el test t de Student no pareado, mientras que para las variables cualitativas se utilizó el test Chi cuadrado con corrección de Yates.
En una primera fase, ambos grupos se compararon mediante un análisis bivariante. En una segunda fase, para identificar que variables se asociaban de forma independiente al AOS sin SDE, se practicó un análisis de regresión logística hacia adelante incluyendo aquellas variables con p<0,15 en el análisis bivariado. Con la intención de corregir por potenciales factores de confusión, también se incluyeron en la regresión logística las siguientes variables: sexo, edad, IMC, IAH, CT90, consumo de fármacos con efecto sedante, ingesta de etanol y hábito tabáquico. Se consideró significativo un valor de p≤0,05. Finalmente, para investigar si los pacientes con valores extremos del ESS presentaban diferencias que no se hubiesen puesto de manifiesto al utilizar un único punto de corte, se dividió la serie en cuartiles del ESS (ESS<9, 104 casos; ESS 9–12, 144 casos; ESS 13–15, 109 casos; y ESS>15, 99 casos) y se realizó un análisis adicional, comparando los cuartiles extremos (ESS <9 vs. ESS >15), mediante análisis bivariado y regresión logística, tal y como se ha indicado previamente para el total de la serie.
Para calcular un tamaño muestral, se asumió que el 35% de los pacientes habrían experimentado un evento cardiovascular previo y que el 50% serían hipertensos22. El tamaño muestral se calculó para detectar una diferencia del 10% en la prevalencia de HTA o eventos cardiovasculares previos entre ambos grupos. Según este cálculo, eran necesarios al menos 136 pacientes en cada grupo considerando un error α de 0,05 y una potencia de 0,8.
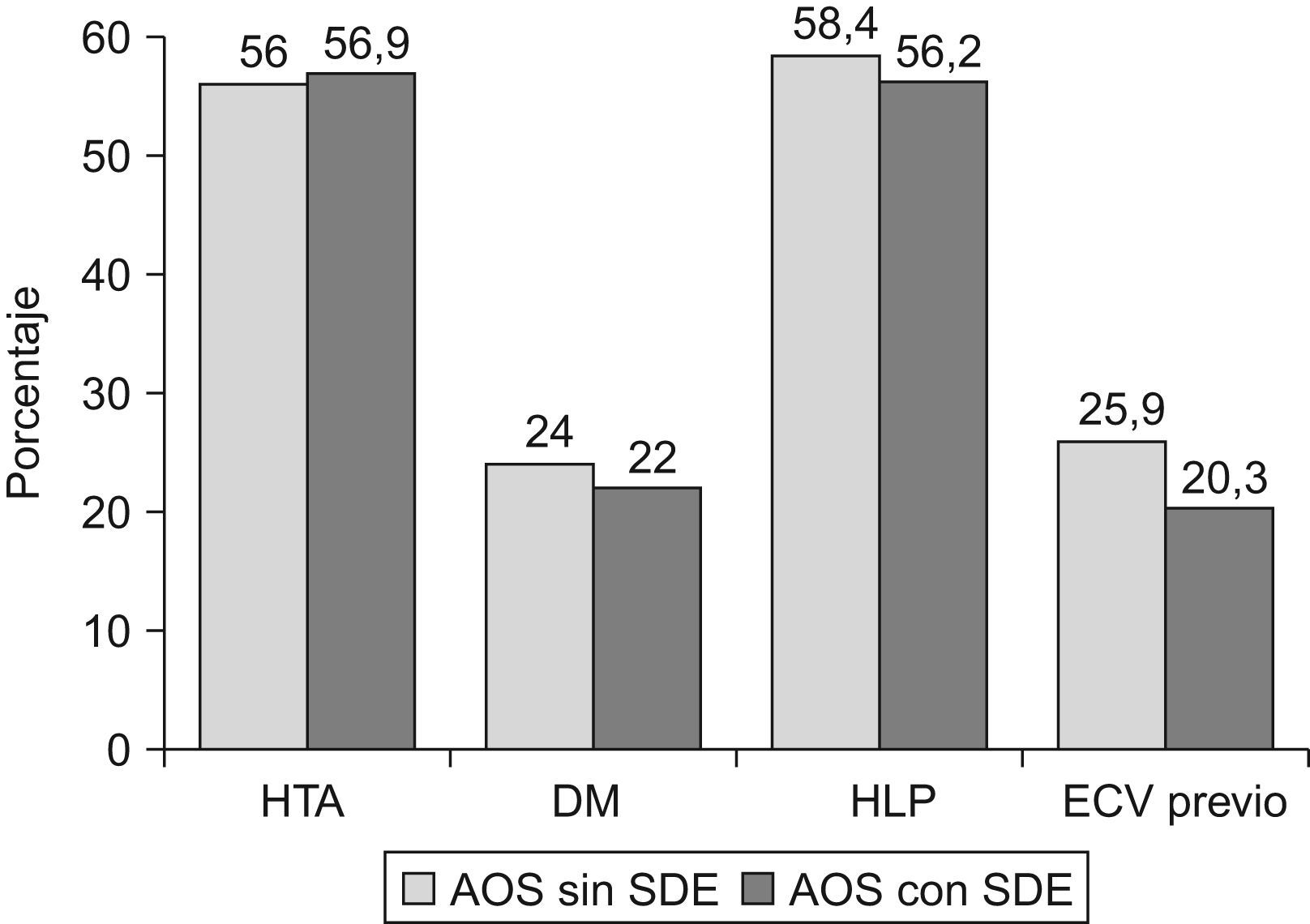
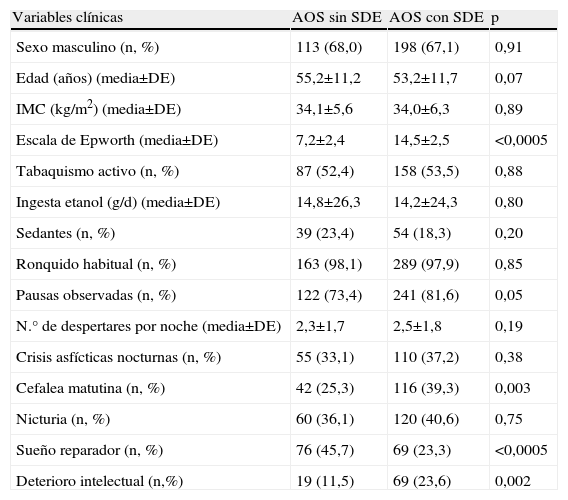
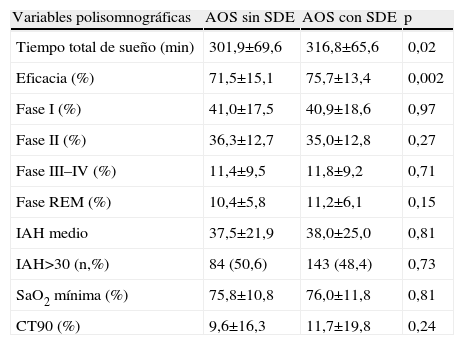
ResultadosDurante el periodo de estudio se incluyeron 181 casos con AOS sin SDE y 318 con AOS y SDE, tras ajustar por sexo, edad, IMC e IAH. Se excluyeron 10 pacientes con lectura automática del estudio de sueño, 5 con <3h de sueño, 5 en los que no se había establecido el ESS y 18 sin observador del sueño. Finalmente, se analizaron 166 AOS sin SDE y 295 con SDE. Las características clínicas, polisomnográficas y cardiovasculares de ambos grupos se muestran en las tablas 1, 2 y la figura 1.
Características clínicas de los pacientes con AOS sin SDE y con SDE
| Variables clínicas | AOS sin SDE | AOS con SDE | p |
| Sexo masculino (n, %) | 113 (68,0) | 198 (67,1) | 0,91 |
| Edad (años) (media±DE) | 55,2±11,2 | 53,2±11,7 | 0,07 |
| IMC (kg/m2) (media±DE) | 34,1±5,6 | 34,0±6,3 | 0,89 |
| Escala de Epworth (media±DE) | 7,2±2,4 | 14,5±2,5 | <0,0005 |
| Tabaquismo activo (n, %) | 87 (52,4) | 158 (53,5) | 0,88 |
| Ingesta etanol (g/d) (media±DE) | 14,8±26,3 | 14,2±24,3 | 0,80 |
| Sedantes (n, %) | 39 (23,4) | 54 (18,3) | 0,20 |
| Ronquido habitual (n, %) | 163 (98,1) | 289 (97,9) | 0,85 |
| Pausas observadas (n, %) | 122 (73,4) | 241 (81,6) | 0,05 |
| N.° de despertares por noche (media±DE) | 2,3±1,7 | 2,5±1,8 | 0,19 |
| Crisis asfícticas nocturnas (n, %) | 55 (33,1) | 110 (37,2) | 0,38 |
| Cefalea matutina (n, %) | 42 (25,3) | 116 (39,3) | 0,003 |
| Nicturia (n, %) | 60 (36,1) | 120 (40,6) | 0,75 |
| Sueño reparador (n, %) | 76 (45,7) | 69 (23,3) | <0,0005 |
| Deterioro intelectual (n,%) | 19 (11,5) | 69 (23,6) | 0,002 |
AOS: apneas-hipopneas obstructivas del sueño; IMC: índice de masa corporal; SDE: somnolencia diurna excesiva.
Características polisomnográficas de los pacientes con AOS sin SDE y con SDE
| Variables polisomnográficas | AOS sin SDE | AOS con SDE | p |
| Tiempo total de sueño (min) | 301,9±69,6 | 316,8±65,6 | 0,02 |
| Eficacia (%) | 71,5±15,1 | 75,7±13,4 | 0,002 |
| Fase I (%) | 41,0±17,5 | 40,9±18,6 | 0,97 |
| Fase II (%) | 36,3±12,7 | 35,0±12,8 | 0,27 |
| Fase III–IV (%) | 11,4±9,5 | 11,8±9,2 | 0,71 |
| Fase REM (%) | 10,4±5,8 | 11,2±6,1 | 0,15 |
| IAH medio | 37,5±21,9 | 38,0±25,0 | 0,81 |
| IAH>30 (n,%) | 84 (50,6) | 143 (48,4) | 0,73 |
| SaO2 mínima (%) | 75,8±10,8 | 76,0±11,8 | 0,81 |
| CT90 (%) | 9,6±16,3 | 11,7±19,8 | 0,24 |
Todas las variables se expresan como media±DE, salvo donde se indica. AOS: apneas-hipopneas obstructivas del sueño; CT90: tiempo con saturación arterial de oxígeno por debajo del 90%; IAH: índice de apnea-hipopnea; SDE: somnolencia diurna excesiva; SaO2min: saturación arterial de oxígeno mínima.
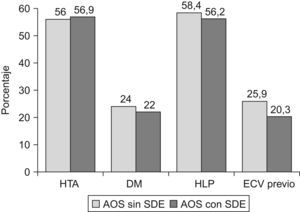
Ambos grupos eran comparables en cuanto a sexo, edad, IMC y gravedad del AOS (medido por IAH, SaO2 min o CT90). En el análisis bivariante, los casos sin SDE mostraron menos apneas observadas, (73,4% vs. 81,6%, p=0,05), cefalea matutina (25,3% vs. 39,3%, p=0,003), deterioro intelectual (11,5% vs. 23,6%, p=0,002), tiempo total de sueño (301,9±69,6 vs. 316,8±65,6min, p=0,02) y eficacia de sueño (71,5±15,1% vs. 75,7±13,4%, p=0,002), y más sueño reparador (45,7% vs. 23,3%, p<0,0005) en comparación al grupo con SDE (tablas 1 y 2). No se encontraron diferencias en la prevalencia de HTA, DM, HLP o antecedentes de eventos cardiovasculares previos entre ambos grupos (fig. 1).
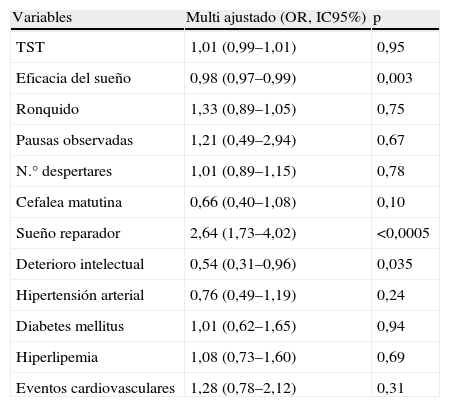
Los resultados del análisis de regresión logística ajustado por múltiples factores de confusión se muestran en la tabla 3. Tras ajustar por sexo, edad, IMC, IAH, CT90, hábito tabáquico, ingesta de etanol y uso de fármacos con efecto sedante, las variable asociadas de forma independiente al AOS sin SDE fueron una menor eficacia del sueño (OR 0,98, IC95% 0,97 a 0,99), menor deterioro intelectual (OR 0,54, IC95% 0,31 a 0,96) y sueño más reparador (OR 2,64, IC95% 1,73 a 4,02). No se encontró asociación significativa con ninguna de las variables cardiovasculares analizadas.
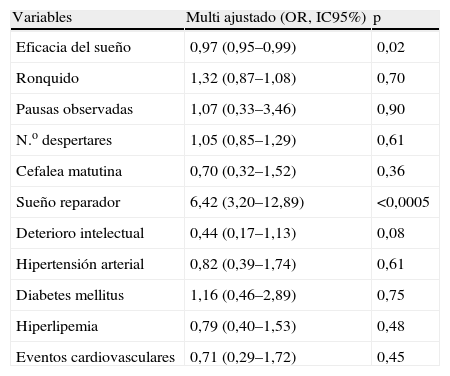
Variables predictoras de AOS sin SDE. Resultado del análisis de regresión logística ajustado por sexo, edad, IMC, IAH, CT90, tabaquismo, consumo de etanol y consumo de fármacos sedantes
| Variables | Multi ajustado (OR, IC95%) | p |
| TST | 1,01 (0,99–1,01) | 0,95 |
| Eficacia del sueño | 0,98 (0,97–0,99) | 0,003 |
| Ronquido | 1,33 (0,89–1,05) | 0,75 |
| Pausas observadas | 1,21 (0,49–2,94) | 0,67 |
| N.° despertares | 1,01 (0,89–1,15) | 0,78 |
| Cefalea matutina | 0,66 (0,40–1,08) | 0,10 |
| Sueño reparador | 2,64 (1,73–4,02) | <0,0005 |
| Deterioro intelectual | 0,54 (0,31–0,96) | 0,035 |
| Hipertensión arterial | 0,76 (0,49–1,19) | 0,24 |
| Diabetes mellitus | 1,01 (0,62–1,65) | 0,94 |
| Hiperlipemia | 1,08 (0,73–1,60) | 0,69 |
| Eventos cardiovasculares | 1,28 (0,78–2,12) | 0,31 |
Tras dividir la serie en cuartiles del ESS, se procedió a comparar los cuartiles inferior (ESS<9, 104 pacientes) y superior (ESS>15, 99 pacientes) de la misma. En el análisis bivariante, los casos con AOS y ESS<9 mostraron menos cefalea matutina (24,0% vs. 39,3%, p=0,02), deterioro intelectual (8,7% vs. 24,2%, p=0,005) y eficacia de sueño (72,2±15,2% vs. 76,4±12,4%, p=0,03), y más sueño reparador (50% vs. 14,1%, p<0,0005) en comparación al grupo con AOS y ESS>15. Los resultados del análisis de regresión logística se muestran en la tabla 4. Tras ajustar por múltiples factores de confusión, las variable asociadas de forma independiente al cuartil inferior del ESS fueron una menor eficacia del sueño (OR 0,97, IC95% 0,95 a 0,99) y sueño más reparador (OR 6,42, IC95% 3,20 a 12,89). No se encontró asociación significativa con ninguna de las variables cardiovasculares analizadas.
Variables asociadas al grupo de AOS con ESS<9. Resultado del análisis de regresión logística ajustado por sexo, edad, IMC, IAH, CT90, tabaquismo, consumo de etanol y consumo de fármacos sedantes
| Variables | Multi ajustado (OR, IC95%) | p |
| Eficacia del sueño | 0,97 (0,95–0,99) | 0,02 |
| Ronquido | 1,32 (0,87–1,08) | 0,70 |
| Pausas observadas | 1,07 (0,33–3,46) | 0,90 |
| N.o despertares | 1,05 (0,85–1,29) | 0,61 |
| Cefalea matutina | 0,70 (0,32–1,52) | 0,36 |
| Sueño reparador | 6,42 (3,20–12,89) | <0,0005 |
| Deterioro intelectual | 0,44 (0,17–1,13) | 0,08 |
| Hipertensión arterial | 0,82 (0,39–1,74) | 0,61 |
| Diabetes mellitus | 1,16 (0,46–2,89) | 0,75 |
| Hiperlipemia | 0,79 (0,40–1,53) | 0,48 |
| Eventos cardiovasculares | 0,71 (0,29–1,72) | 0,45 |
Los resultados de este trabajo indican que cuando se ajusta por variables confusoras, los pacientes con AOS sin y con SDE tienen una prevalencia similar de comorbilidades cardiovasculares en el momento del diagnóstico. Los casos sin SDE mostraron menor sintomatología diurna derivada de su apnea del sueño respecto al grupo con SDE, a pesar de presentar una sintomatología nocturna semejante. Estos resultados se mantuvieron prácticamente sin variaciones cuando se compararon los pacientes con grados extremos del ESS.
En este estudio se ha intentado analizar si los pacientes con AOS sin SDE presentan características diferenciales respecto al paciente típico con SDE, especialmente si la ausencia de hipersomnia se asociaba a una menor prevalencia de comorbilidad cardiovascular, como algunos autores sugieren15,16. Para investigar este punto, se compararon dos grupos de pacientes similares en cuanto a sexo, edad, IMC e IAH, ajustándose posteriormente por estas y otras variables que también podrían influir sobre los aspectos clínicos y cardiovasculares analizados. Finalmente, no se encontraron diferencias en la prevalencia de HTA, DM, HLP o antecedentes de eventos cardiovasculares previos, independientemente de la presencia o ausencia de SDE. Los resultados no se modificaron cuando se compararon los pacientes que se encontraban en los cuartiles extremos del ESS. Estos datos sugieren que la ausencia de SDE en la AOS no confiere una especial protección frente a las principales comorbilidades cardiovasculares ni el riesgo de sufrir un evento cardiovascular, ni siquiera en aquellos pacientes con valores muy bajos del ESS.
Aunque los trabajos que han comparado directamente las complicaciones cardiovasculares en AOS con y sin SDE asociada son escasos, nuestros resultados coinciden con algunos autores que han demostrado que la SDE no es un factor determinante en la aparición de enfermedades cardiovasculares en estos pacientes. El estudio prospectivo de la cohorte de Wisconsin23 encontró una mortalidad cardiovascular 5 veces superior en AOS grave respecto al grupo control, independiente de la presencia de hipersomnia. Kohler et al24, en un ensayo que comparó 64 pacientes con AOS moderada sin SDE y 15 controles sanos, demostró disfunción endotelial y aumento de la rigidez arterial en el grupo de AOS, lo que sugiere un aumento del riesgo cardiovascular, aún en casos moderados y sin SDE asociada. Kaneko et al25 demostró que el tratamiento con CPAP en pacientes con AOS sin hipersomnia diurna y fallo cardiaco mejoraba la fracción de eyección del ventrículo izquierdo.
Por el contrario, dos autores han obtenido resultados discordantes, en ambos casos al analizar el efecto de la CPAP sobre la PA en pacientes con AOS sin SDE. Barbe et al15 estudió 55 pacientes con AOS grave sin SDE durante 6 semanas en un estudio multicéntrico y controlado con placebo, encontrando que la CPAP no reducía la PA respecto a sham-CPAP. Robinson et al16 ha encontrado resultados similares en un estudio de 35 pacientes con AOS sin hipersomnia e HTA leve. Aunque este último autor sugiere que la fragmentación del sueño sería el principal mecanismo implicado en la fisiopatología de la HTA en estos pacientes, siendo la SDE un marcador de la misma, en este estudio los pacientes no fueron diagnosticados mediante polisomnografía convencional, y por lo tanto no se pudo comprobar esta hipótesis. En contraste con estos dos autores, varios metanálisis no han encontrado que el grado de somnolencia diurna en pacientes con AOS e HTA sea un factor predictor del descenso en la PA26,27, y un reciente trabajo multicétrico que estudió a 359 pacientes hipertensos con AOS grave sin SDE (ESS<11), ha demostrado que 1 año de tratamiento con CPAP redujo significativamente las cifras de PA, a pesar de la ausencia de SDE, detectándose un efecto dosis respuesta, con mayores reducciones tensionales en pacientes con elevada cumplimentación del tratamiento (>5,6h/d)28.
Otro aspecto interesante y poco estudiado es la caracterización clínica de estos pacientes. En ausencia de SDE, sería interesante disponer de otros síntomas diurnos que actuasen como marcadores de esta enfermedad, y que pudiesen ayudarnos a establecer qué pacientes deberían ser sometidos a estudio de sueño o precisar tratamiento con CPAP. Hemos encontrado que los pacientes con AOS sin SDE tienen, en general, menor sintomatología diurna derivada de su apnea del sueño respecto al grupo con SDE. Estos pacientes se quejan de menos deterioro intelectual y sueño más reparador, a pesar de tener un nivel equivalente de severidad de AOS y similar clínica nocturna en cuanto a ronquidos, nicturia, número de despertares nocturnos o crisis asfícticas nocturnas. Al comparar los cuartiles extremos del ESS, los pacientes con menor SDE siguen presentando mayor sensación de sueño reparador respecto al grupo con mayor SDE de la serie. Estos resultados indican que este grupo de pacientes no solo presentan menor somnolencia diurna, sino que en general tiene menos síntomas subjetivos derivados de su trastorno del sueño. Aunque el objetivo y diseño del estudio no pretendía analizar los motivos que explican las diferencias en la percepción de la SDE u otros síntomas diurnos entre ambos grupos, según nuestros resultados, estas no parecen atribuibles a diferencias en la macro estructura del sueño o la gravedad de la AOS.
Finalmente, hemos encontrado que los pacientes sin SDE tienen significativamente menor eficacia del sueño que aquellos con SDE, aspecto este que ya ha sido comunicado previamente29,30. Se ha sugerido que los pacientes sin SDE estarían más somnolientos a lo largo de todo el ciclo circadiano, y por tanto, que la desestructuración del sueño debido a las apneas no sería la causa primaria de la SDE, al menos en todos los pacientes con esta patología.
Nuestro trabajo presenta principalmente dos limitaciones. La primera se refiere al carácter retrospectivo del estudio. Sin embargo, las variables clínicas y cardiovasculares se investigaron en la visita inicial, previa al diagnóstico de AOS, y se basaron en una entrevista estructurada y en datos procedentes de la historia clínica, analítica basal y mediciones de PA. Estos datos no se modificaron posteriormente. Es más, puesto que se trata de una serie clínica estudiada con el propósito de diagnosticar o excluir AOS, incluso en el caso de que existiesen errores en la recogida de datos, no creemos que supongan un sesgo, ya que no es probable que afectasen más a un grupo que a otro. La segunda limitación se refiere a un posible sesgo de selección. Se podría argumentar que los casos sin SDE se habrían derivado preferentemente por comorbilidad cardiovascular mientras los casos típicos se habrían derivado por SDE. Obviamente, este sesgo es inherente a cualquier serie clínica, en la que los pacientes son enviados con diversos grados de sospecha clínica de AOS, precisándose una cohorte poblacional para evitar por completo este sesgo. En cualquier caso, en nuestro trabajo se exigió como criterio de inclusión que los pacientes presentasen al menos dos de los síntomas más comunes de AOS, como son ronquidos, pausas observadas, crisis asfícticas nocturnas o SDE, para evitar este problema en la medida de lo posible. Finalmente, al incluir un grupo control superior al grupo de estudio se podría haber incurrido en un sobremuestreo. Sin embargo, no consideramos que esto haya influido en los resultados finales, como lo demuestran los resultados obtenidos al comparar los cuartiles extremos del ESS, donde el tamaño de ambos grupos era similar.
En conclusión, los resultados de este estudio indican que cuando se ajusta por múltiples variables de confusión, la prevalencia de comorbilidades cardiovasculares en pacientes AOS con y sin SDE asociada son similares, presentado además estos últimos una menor sintomatología diurna derivada de su trastorno del sueño. Serán necesarios estudios prospectivos que confirmen que los pacientes sin SDE tienen un riesgo similar de complicaciones cardiovasculares que aquellos con SDE.
FinanciaciónEl presente estudio no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.