La base genética del asma bronquial es compleja y es probable que en su desarrollo contribuyan diversos genes a través de sus efectos principales e interacciones génicas. Las citocinas participan en diferentes aspectos del asma, determinando el tipo, la gravedad y los resultados patogénicos. Durante las crisis, los asmáticos alérgicos muestran concentraciones significativamente más altas de citocinas proinflamatorias, tales como interleucinas y quimiocinas. En los últimos años, se ha observado que las citocinas y sus receptores son muy polimórficos, por lo que investigamos los polimorfismos del gen promotor de la interleucina 6 en las posiciones −174G/C (rs1800795) y −572G/C (rs1800796) en el asma infantil.
MétodosAnalizamos los polimorfismos del gen promotor de la interleucina 6 en pacientes con asma bronquial y niños sanos mediante el análisis de polimorfismos en la longitud de los fragmentos de restricción amplificados por reacción en cadena de la polimerasa.
ResultadosSe observó una asociación significativa entre el polimorfismo en −174G/C y el asma bronquial (OR=3,4; IC 95%: 2,045-5,638; p<0,001). En pacientes atópicos se observó mayor asociación del polimorfismo del IL-6 −174G/C (OR=4,1; IC 95%: 2,308-7,280; p<8,10−7).
ConclusionesEl polimorfismo de la interleucina 6 se asocia con el asma bronquial, especialmente con el fenotipo atópico. En pacientes asmáticos, la expresión y la secreción de interleucinas pueden resultar afectadas por polimorfismos génicos, lo que podría tener efectos modificadores de la enfermedad en la vía aérea y modificar la respuesta terapéutica.
The genetic background of bronchial asthma is complex, and it is likely that multiple genes contribute to its development both directly and through gene-gene interactions. Cytokines contribute to different aspects of asthma, as they determine the type, severity and outcomes of asthma pathogenesis. Allergic asthmatics undergoing an asthmatic attack exhibit significantly higher levels of pro-inflammatory cytokines, such as interleukins and chemokines. In recent years, cytokines and their receptors have been shown to be highly polymorphic, and this prompted us to investigate interleukin 6 promoter polymorphisms at position −174G/C (rs1800795) and at −572G/C (rs1800796) in relation to asthma in children.
MethodsInterleukin 6 promoter polymorphisms were analyzed in bronchial asthma patients and healthy children using polymerase chain reaction-restriction fragment length polymorphism analysis.
ResultsWe observed a significant association between polymorphism at −174G/C and bronchial asthma (OR=3.4, 95% CI: 2.045-5.638, P<.001). Higher associations between polymorphism at IL-6 −174G/C and bronchial asthma were observed in atopic patients (OR=4.1, 95% CI: 2.308-7.280, P<8.10−7).
ConclusionsInterleukin 6 polymorphism is associated with bronchial asthma, particularly its atopic phenotype. Expression and secretion of interleukins in asthmatic patients may be affected by genetic polymorphisms, and could have a disease-modifying effect in the asthmatic airway and modify the therapeutic response.
Los polimorfismos pueden ser responsables de cambios en la expresión de los genes (aumento, disminución o ningún efecto). Ciertas variaciones genéticas en la producción de citocinas podrían tener un efecto sobre enfermedades complejas, como el asma bronquial (AB) y explicar, en parte, algunas características específicas del AB y de la predisposición individual a desarrollar esta enfermedad. La inflamación es uno de los componentes básicos y un pilar crítico del desarrollo de diversas enfermedades, incluida el AB, por lo que los genes que codifican a citocinas pro- y antiinflamatorias son candidatos a estar asociados al desarrollo del AB, incluyendo la predisposición individual o el riesgo a desarrollarla. El AB es una enfermedad respiratoria multifactorial que produce inflamación crónica de las vías aéreas, regulada por una red de citocinas y elementos inflamatorios que interaccionan entre sí y que podrían estar determinados por factores genéticos o ambientales. Las citocinas contribuyen a diferentes aspectos del asma, y pueden determinar su tipo, gravedad y resultados patogénicos. La base genética de la enfermedad es compleja y es probable que en su etiología, desarrollo y persistencia no participe el polimorfismo de nucleótido único (PNU) de un gen, sino de varios genes, y que esto también modifique la eficacia del tratamiento. La enfermedad es consecuencia de una combinación de interacciones gen-gen y factores ambientales, y los aspectos inmunológicos del AB todavía se están investigando.
La interleucina 6 (IL-6) es una citocina multifactorial proinflamatoria pleiotrópica precoz con funciones clave en la defensa del huésped. Existen sólidos indicios de su papel fundamental en la respuesta inflamatoria1. Muchos tipos celulares, tales como células epiteliales de las vías aéreas, monocitos, macrófagos, fibroblastos, células endoteliales, linfocitos T, mastocitos o adipocitos producen IL-6 y median en la respuesta inflamatoria y en la respuesta al estrés. Esta citocina regula la producción de moléculas de adhesión e induce la secreción de importantes mediadores de la liberación de otras citocinas, como el factor de necrosis tumoral o la IL-1, que posteriormente amplifican la cascada inflamatoria2,3. El gen IL-6 humano tiene una longitud de 5kb, está ubicado en el área 15-21 del brazo corto del cromosoma 7 (7p15-21) y contiene 5 exones y 4 intrones4. La señalización de la IL-6 se produce por 2vías: la vía clásica y la transeñalización. En el caso de la vía clásica, la IL-6 se une al receptor de membrana de IL-6 (IL-6R) y a la subunidad de transducción de la señal del receptor común de citocinas, la glucoproteína 130 (gp130). Esta asociación desencadena la dimerización de la gp130 y la activación de las cinasas. En la vía de transeñalización, la IL-6 se une al receptor soluble de la IL-6 (sIL-6R) y, a continuación, a la gp130. La unión al receptor de la IL-6 conlleva la activación de tirosinacinasas de la familia JAK, que estimulan múltiples vías en las que participan la ERK/MAPK, PI3K/AKT y JAK/STAT y otras proteínas señalizadoras5,6.
Es probable que diversos factores ambientales y genéticos, que incluyen sitios polimórficos del gen IL-6, influyan en la concentración de IL-6. Los polimorfismos de nucleótidos únicos del promotor del gen IL-6 pueden producir variaciones individuales en la expresión, concentración y actividad funcional de esta IL2 y tener un rol crítico en la inmunopatogenia de diversas enfermedades inflamatorias crónicas. Las citocinas proinflamatorias, como la IL-6, tienen una importante función en la compleja patogenia del AB. Se ha demostrado que los PNU del gen IL-6 afectan a la expresión génica y las concentraciones séricas de la proteína2,4,7. En el esputo o líquido del lavado bronquioalveolar de pacientes asmáticos y asmáticos atópicos se han observado concentraciones elevadas de IL-68–11. Estudios en animales han demostrado que la IL-6 es importante para que las células dendríticas capten alérgenos e inicien la inflamación de las vías aéreas mediada por Th2/Th17, y su rol en el desarrollo del asma alérgica es fundamental12.
En la región promotora de IL-6 se han detectado 3variantes independientes, si bien la transición G/C en posición −174 (rs1800795) del gen IL-6 es el polimorfismo más estudiado. Diversos estudios han señalado que el genotipo GG (natural) se asocia con mayor producción de IL-6, e inicialmente se había observado que la variante que más expresa la IL-6 es el alelo mayor (G) de rs18007954.
Nos propusimos analizar 2PNU en el promotor, en las posiciones −174G/C (rs1800795) y −572G/C (rs1800796). Planteamos la hipótesis de que estos PNU en IL-6 podrían influir la transcripción del gen y las concentraciones séricas, plasmáticas o tisulares de IL-6, afectar a la magnitud de la respuesta inflamatoria y tener un rol en ciertos fenotipos del AB. El objetivo del estudio fue determinar la asociación que existe entre los polimorfismos del gen IL-6 y el AB en un grupo de niños eslovacos.
Materiales y métodosSujetosEn el presente estudio de casos y controles se incluyó a 264 niños con diagnóstico de AB y a 250 niños de control que presentaban características básicas comparables, pero no AB ni otras enfermedades. Los pacientes se reclutaron de forma sistemática en los consultorios ambulatorios de alergia e inmunología clínica del Departamento de Pediatría de la Universidad Comenius de Bratislava y en el de la Facultad de Medicina de Jessenius de Martin durante el periodo 2008–2015. En las historias clínicas de los niños asmáticos se registraron aspectos estándares del cuestionario: edad, sexo, exposición a humo del tabaco y antecedentes familiares de asma, sibilancias y alergia. Los niños asmáticos que participaron en el estudio se caracterizaron por presentar obstrucción recurrente de las vías aéreas, manifestada por sibilancias y disnea, cuyo alivio espontáneo o con tratamiento broncodilatador (de acuerdo con la definición de la Iniciativa Global para el Asma [Global Initiative for Asthma]) había sido verificado por un médico especialista. Se excluyó del estudio a los niños que padecían alguna otra enfermedad grave además del AB. También se excluyó a aquellos que presentaban una infección respiratoria aguda o antecedentes de infección en las 4últimas semanas. Ninguno de los pacientes era fumador, y a aquellos que habían estado expuestos pasivamente a humo se les excluyó. Las pruebas de función pulmonar se efectuaron con arreglo a los criterios de estandarización de las pruebas de función pulmonar del grupo de trabajo de la Sociedad Respiratoria Europea y la Sociedad Torácica Americana (European Respiratory Society y American Thoracic Society Task Force: Standardization de lung function testing)13. La capacidad vital forzada (FVC), el volumen espiratorio forzado en el primer segundo (FEV1) y el flujo espiratorio máximo (PEF) se determinaron con un espirómetro Koko DigiDoser-Spirometry (nSpire Health Inc., Louisiana, EE. UU.). Practicamos a todos los niños pruebas intraepidérmicas (PIE) de alérgenos inhalados frecuentes (Dermatophagoides pteronyssinus, Dermatophagoides farinae, caspa de gato, caspa de perro, mezcla de cereales, mezcla de céspedes, mezcla de mohos y mezcla de árboles; ALK-ABELLO, Hørsholm, Dinamarca). Las PIE se consideraron positivas si la media de sus diámetros mayores y de los diámetros perpendiculares a estos y a su punto medio eran ≥3mm. El mismo profesional con experiencia practicó todas las pruebas. Los niños que presentaron al menos una PIE positiva se consideraron atópicos. El grupo de control estuvo formado por voluntarios sanos (apareados por sexo y edad) que fueron elegidos por no presentar antecedentes de alergia ni de otras enfermedades crónicas. Los voluntarios se reclutaron al azar durante visitas ordinarias en consultorios de medicina general. El Comité de Ética de la Universidad Comenius de Bratislava y el de la Facultad de Medicina de Jessenius de Martin aprobaron el estudio, y los padres de todos los niños participantes otorgaron y firmaron el consentimiento informado.
GenotipadoSe recogió sangre venosa en tubos recubiertos de ácido etilendiaminotetraacético, que se utilizó para la preparación del ADN genómico mediante el Wizard® Genomic DNA purification Kit (Promega) y se conservó a −20°C hasta el análisis de genotipado. Se determinaron 2polimorfismos del gen IL-6 (rs1800795 y rs1800796) mediante análisis de polimorfismos en la longitud de los fragmentos de restricción amplificados mediante reacción en cadena de la polimerasa (PCR-RFLP, por sus siglas en inglés). A continuación, los fragmentos de ADN que contenían polimorfismos de nucleótido único en sitios de unión de enzimas de restricción se amplificaron en 12μl de una mezcla de reacción que contenía: 1μl de ADN genómico A, 0,5μl de cada cebador (25μmol/μl), 6μl de Green Taq Master Mix y 4μl de agua sin DNasa. Las secuencias de cebador utilizadas para la detección de IL-6 −174G/C fueron las siguientes: rs1800795F 5′-ATG CCA AGT GCT GAG TCA CTA-3′ y rs180095R 5′-GGA AAA TCC CAC ATT TGA TA-3′ y para IL-6 −572G/C fueron: rs180096F 5′- GAG ACG CCT TGA AGT AAC TG-3′ y rs180096R 5′- AAC CAA AGA TGT TCT GAA CTG-3′. Tras desnaturalización inicial a 94°C durante 5min, se efectuaron 40ciclos de PCR para IL-6 −174G/C durante 30s a 94°C, 45s a 52,8°C y 1min a 72°C, con extensión final a 72°C durante 7min. Estos pasos amplificaron un fragmento de ADN PCR de 226bp que contenía la posición −174. A continuación, el producto de la PCR se digirió con NlaIII (Fermentas) durante 15min a 37°C. Si la posición −174 contenía el alelo C, el producto de PCR de 226 pb se cortó en 2fragmentos de 117 y 109bp mediante NlaIII. Si se trataba del alelo G, no se cortó el fragmento de 226bp. Las condiciones de PCR para el polimorfismo IL-6 −572G/C fueron las siguientes: 95°C durante 5min, 35 ciclos de 30s a 95°C, 30s a 54°C y 45s a 72°C, con una extensión final a 72°C durante 7min. La digestión de los productos de la PCR con BsrBI (Fermentas) durante 15min a 37°C dio lugar a fragmentos de 121bp+61bp (GG) y a fragmentos de 182bp+121bp+61bp (GC). Si se trataba del alelo C, el fragmento de 182bp no se cortó. Los productos de la digestión se separaron mediante electroforesis en gel de agarosa al 2% y se visualizaron con bromuro de etidio.
Análisis estadísticoSe estimaron las frecuencias genotípicas de los pacientes y de los niños sanos. Los resultados de ambos grupos se compararon mediante ANOVA, la prueba de la t de Student y la prueba de chi-cuadrado (χ2). La asociación de los polimorfismos IL-6 −174G/C y −572G/C con el AB se determinó con la prueba de χ2 de Pearson o la prueba exacta de Fisher. Se examinó la desviación de la distribución de genotipos respecto al equilibrio de Hardy-Weinberg. Las frecuencias de los genotipos de la IL-6 en los pacientes con AB en comparación con los niños sanos se analizaron mediante odds ratios (OR) y sus intervalos de confianza (IC 95%). Se evaluaron modelos dominantes y codominantes. Los valores de p se consideraron estadísticamente significativos si eran <0,05. Para el análisis estadístico se utilizó la versión 2.7.0.2 del paquete estadístico StatsDirect.
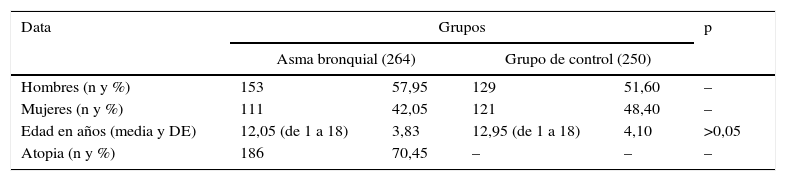
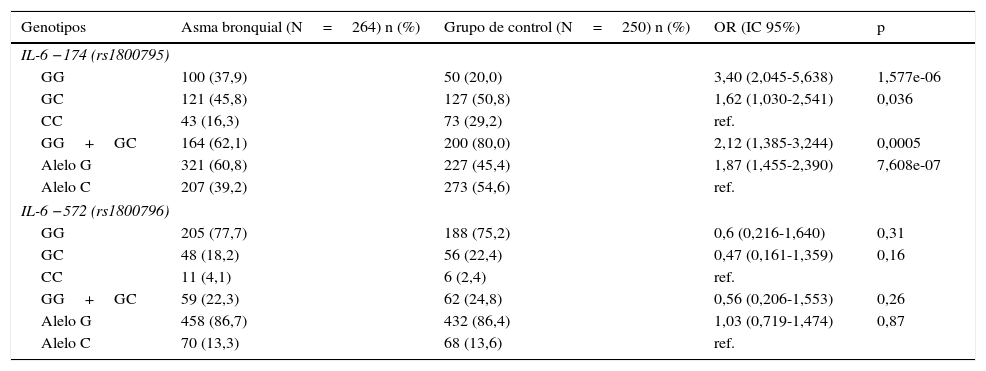
ResultadosLas características básicas de los participantes, incluyendo edad y sexo, se presentan en la tabla 1. El ADN genómico de los pacientes con AB (n=264) y de los niños sanos (n=250) se utilizó para evaluar la presencia de 2polimorfismos en el promotor del gen IL-6, −174G/C (rs1800795) y −572G/C (rs1800796) (tabla 2). Las frecuencias de los genotipos mostraron estar en equilibrio de Hardy-Weinberg. Entre los pacientes asmáticos, los genotipos IL-6 −174G/C GG, GC y CC se observaron en un 37,9; 45,8 y 16,3%, y en los sujetos sanos en un 20,0; 50,8 y 29,2%, respectivamente. El genotipo GG dominante fue un 17,9% más frecuente en los pacientes asmáticos que en los sujetos sanos, y representa un factor de riesgo de AB (OR=3,4; IC 95%: 2,045-5,638; p<0,001). También observamos una asociación estadísticamente significativa del alelo G dominante con el desarrollo de AB (OR=1,87; IC 95%: 1,455-2,390; p<0,001). El genotipo GC es más frecuente en sujetos sanos que en asmáticos, por lo que no parece constituir un factor de riesgo de AB. La comparación de este genotipo con los homocigotos (dominante o variante) no mostró ninguna asociación en los asmáticos (OR=1,22; IC 95%: 0,863-1,726; p=0,30).
Características de los participantes: niños con asma bronquial y niños sanos
| Data | Grupos | p | |||
|---|---|---|---|---|---|
| Asma bronquial (264) | Grupo de control (250) | ||||
| Hombres (n y %) | 153 | 57,95 | 129 | 51,60 | – |
| Mujeres (n y %) | 111 | 42,05 | 121 | 48,40 | – |
| Edad en años (media y DE) | 12,05 (de 1 a 18) | 3,83 | 12,95 (de 1 a 18) | 4,10 | >0,05 |
| Atopia (n y %) | 186 | 70,45 | – | – | – |
DE: desviación estándar; n: número de participantes.
Distribución de genotipos y alelos IL-6 -174G/C (rs1800795) e IL-6 -572G/C (rs1800796) y relación con el riesgo de asma bronquial
| Genotipos | Asma bronquial (N=264) n (%) | Grupo de control (N=250) n (%) | OR (IC 95%) | p |
|---|---|---|---|---|
| IL-6 −174 (rs1800795) | ||||
| GG | 100 (37,9) | 50 (20,0) | 3,40 (2,045-5,638) | 1,577e-06 |
| GC | 121 (45,8) | 127 (50,8) | 1,62 (1,030-2,541) | 0,036 |
| CC | 43 (16,3) | 73 (29,2) | ref. | |
| GG+GC | 164 (62,1) | 200 (80,0) | 2,12 (1,385-3,244) | 0,0005 |
| Alelo G | 321 (60,8) | 227 (45,4) | 1,87 (1,455-2,390) | 7,608e-07 |
| Alelo C | 207 (39,2) | 273 (54,6) | ref. | |
| IL-6 −572 (rs1800796) | ||||
| GG | 205 (77,7) | 188 (75,2) | 0,6 (0,216-1,640) | 0,31 |
| GC | 48 (18,2) | 56 (22,4) | 0,47 (0,161-1,359) | 0,16 |
| CC | 11 (4,1) | 6 (2,4) | ref. | |
| GG+GC | 59 (22,3) | 62 (24,8) | 0,56 (0,206-1,553) | 0,26 |
| Alelo G | 458 (86,7) | 432 (86,4) | 1,03 (0,719-1,474) | 0,87 |
| Alelo C | 70 (13,3) | 68 (13,6) | ref. | |
n: número de participantes.
No se observaron diferencias significativas entre pacientes asmáticos y sujetos sanos en la frecuencia de genotipos o alelos en el polimorfismo de IL-6 −572G/C. La prevalencia de los genotipos GG, GC, CC fue de un 77,7; 18,2 y 4,1% en los pacientes y de un 75,2; 22,4 y 2,4% en los sujetos sanos, respectivamente (tabla 2).
Con relación a estos 2polimorfismos, los genotipos de los pacientes no mostraron una asociación significativa con el porcentaje previsto de FEV1 ni con las concentraciones séricas totales de IgE (resultados no presentados).
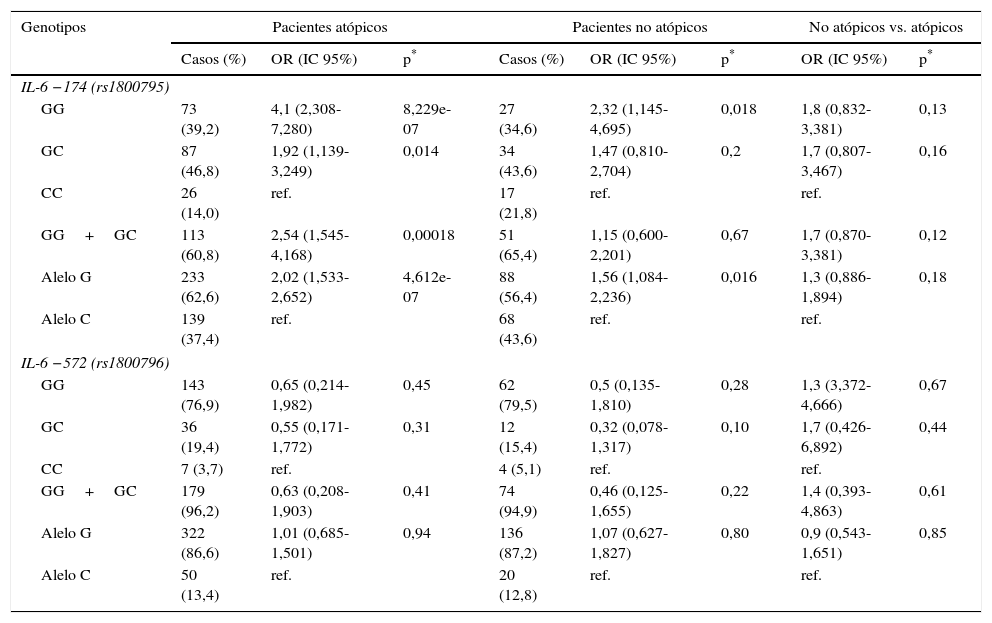
Analizamos la asociación entre los polimorfismos del gen IL-6 y la atopia (tabla 3). El genotipo GG de IL-6 −174G/C (rs1800795) fue más frecuente entre los pacientes atópicos (39,2%), en comparación con los no atópicos (34,6%) o los sujetos sanos (20%), pero solo se observó una diferencia significativa cuando los genotipos GG, GC y CC se compararon con los de los sujetos sanos. El alelo G también fue más frecuente en los pacientes atópicos (62,6%) que en los no atópicos (56,4%) o en los sujetos sanos (45,5%). El riesgo potencial de asociación entre el polimorfismo IL-6 −572G/C fue mayor en los pacientes asmáticos con atopia (tabla 3). Sin embargo, no hubo diferencias significativas entre los pacientes asmáticos atópicos y no atópicos en las frecuencias de genotipos o alelos en el gen IL-6 −572G/C.
Asociación entre genotipos y alelos IL-6 -174G/C (rs1800795) e IL-6-572G/C (rs1800796) y atopia en pacientes con asma bronquial
| Genotipos | Pacientes atópicos | Pacientes no atópicos | No atópicos vs. atópicos | |||||
|---|---|---|---|---|---|---|---|---|
| Casos (%) | OR (IC 95%) | p* | Casos (%) | OR (IC 95%) | p* | OR (IC 95%) | p* | |
| IL-6 −174 (rs1800795) | ||||||||
| GG | 73 (39,2) | 4,1 (2,308-7,280) | 8,229e-07 | 27 (34,6) | 2,32 (1,145-4,695) | 0,018 | 1,8 (0,832-3,381) | 0,13 |
| GC | 87 (46,8) | 1,92 (1,139-3,249) | 0,014 | 34 (43,6) | 1,47 (0,810-2,704) | 0,2 | 1,7 (0,807-3,467) | 0,16 |
| CC | 26 (14,0) | ref. | 17 (21,8) | ref. | ref. | |||
| GG+GC | 113 (60,8) | 2,54 (1,545-4,168) | 0,00018 | 51 (65,4) | 1,15 (0,600-2,201) | 0,67 | 1,7 (0,870-3,381) | 0,12 |
| Alelo G | 233 (62,6) | 2,02 (1,533-2,652) | 4,612e-07 | 88 (56,4) | 1,56 (1,084-2,236) | 0,016 | 1,3 (0,886-1,894) | 0,18 |
| Alelo C | 139 (37,4) | ref. | 68 (43,6) | ref. | ref. | |||
| IL-6 −572 (rs1800796) | ||||||||
| GG | 143 (76,9) | 0,65 (0,214-1,982) | 0,45 | 62 (79,5) | 0,5 (0,135-1,810) | 0,28 | 1,3 (3,372-4,666) | 0,67 |
| GC | 36 (19,4) | 0,55 (0,171-1,772) | 0,31 | 12 (15,4) | 0,32 (0,078-1,317) | 0,10 | 1,7 (0,426-6,892) | 0,44 |
| CC | 7 (3,7) | ref. | 4 (5,1) | ref. | ref. | |||
| GG+GC | 179 (96,2) | 0,63 (0,208-1,903) | 0,41 | 74 (94,9) | 0,46 (0,125-1,655) | 0,22 | 1,4 (0,393-4,863) | 0,61 |
| Alelo G | 322 (86,6) | 1,01 (0,685-1,501) | 0,94 | 136 (87,2) | 1,07 (0,627-1,827) | 0,80 | 0,9 (0,543-1,651) | 0,85 |
| Alelo C | 50 (13,4) | ref. | 20 (12,8) | ref. | ref. | |||
*En comparación con sujetos sanos.
En el análisis génico doble, IL-6 −174G/C con IL-6 −572G/C, también observamos diferencias significativas en las frecuencias de genotipos. Se observó una asociación entre los PNU y el AB en la combinación de los genotipos GG+GG (OR=5,769; IC 95%: 2,114-15,742; p<0,001); el genotipo CC del polimorfismo −174G/C (rs1800795) podría ser protector, puesto que en el genotipo CC+GG identificamos una asociación positiva significativa (OR=0,506; IC 95%: 0,363-0,869; p<0,01).
DiscusiónLos estudios han mostrado que las IL tienen funciones fundamentales en la inflamación y la respuesta inmunológica, y que están relacionadas con varios aspectos del AB. La expresión génica de las citocinas está regulada por diversos factores que se unen a la región promotora. Esto puede producir variaciones en la expresión, concentración y actividad de proteínas que pueden afectar a la sensibilidad a diferentes enfermedades inflamatorias. La combinación de varios polimorfismos de genes de IL y sus receptores produce cambios en esta red de señalización y su microentorno. En nuestro estudio, se investigó la asociación entre 2polimorfismos del promotor de la IL-6 y el AB en pacientes eslovacos. Se observó una asociación significativa entre el polimorfismo IL6 −174G/C y el AB, y una mayor prevalencia del genotipo de riesgo entre los pacientes asmáticos atópicos. Asimismo, se pudo observar una combinación de polimorfismos con efecto protector.
Constatamos una asociación significativa del genotipo GG (rs1800795) y el alelo G con el AB. El genotipo GG de IL-6 −174G/C también fue el más frecuente en pacientes asmáticos brasileños14 y en niños de Macedonia15 y de Egipto16. Settin et al. observaron correlaciones positivas entre el polimorfismo de IL-6 −174, el genotipo GG y los antecedentes familiares y la gravedad del asma16. Solo se ha efectuado un metaanálisis sobre el polimorfismo IL-6 −174G/C y la sensibilidad al AB, en el que se analizaron 6estudios. El genotipo GG aumentó el riesgo de asma y el genotipo CC podría ser un factor de protección frente al AB17, por lo que los resultados de este metaanálisis coinciden con los nuestros. En poblaciones de pacientes asmáticos iraníes se observaron resultados diferentes. Mahdaviani et al. observaron diferencias significativas en los genotipos de genes IL-6 y Daneshmandi et al. no las encontraron18,19. No obstante, los pacientes iraníes que presentan el genotipo GG muestran concentraciones elevadas de IgE (no significativas)19. En cuanto a las pruebas de función pulmonar, el FEV1, la FVC, el cociente FEV1/FVC y el PEF no se correlacionaron con los genotipos de IL-6 −174G/C o −572G/C. Daneshmandi et al. tampoco observaron cambios en las pruebas de función pulmonar, excepto una diferencia significativa en el flujo espiratorio forzado entre un 25 y un 75% de la capacidad vital en IL-6 −174C frente al alelo G (49,51±20,4 vs. 65,86±36,42; p=0,045)19. He at al. observaron una asociación del PNU IL-6 −174G/C con una reducción rápida del FEV1 y sensibilidad a la enfermedad pulmonar obstructiva crónica (EPOC); pese a ello, no hallaron asociación entre el polimorfismo y la concentración sérica de IL-620. Gruber-Jaworska et al. describieron una relación entre la concentración de IL-6 y el FEV1 y entre la concentración de IL-6 y el cociente FEV1/FVC en 16 pacientes asmáticos11. En cambio, no observaron que la concentración de IL-6 y el deterioro de la función pulmonar de pacientes con EPOC estuvieran asociados11. En pacientes asmáticos obesos también se observó un descenso significativo del FEV1 con concentraciones aumentadas de IL-6 y, en mujeres con asma persistente, la concentración de IL-6 se asoció con el tejido adiposo visceral21,22. El conflicto entre los resultados podría deberse a las etnias de las poblaciones, al tamaño de las muestras y a endotipos de AB y de EPOC. La predisposición genética a la enfermedad tampoco es invariable a nivel interindividual. Es posible que diferentes combinaciones de genotipos de la IL sean los responsables de los diferentes efectos en la función pulmonar. Puede que un PNU no tenga ningún efecto, pero en combinación con uno o más PNU pueda afectar a la función pulmonar. La IL-6 es una IL multifactorial y su producción depende de diferentes estímulos genéticos y ambientales. Los diferentes cambios también podrían estar mediados por mecanismos epigenéticos. Sin embargo, existen varios endotipos de asma con diferentes bases genéticas, grados y tipos de inflamación de las vías aéreas. En pacientes con dermatitis atópica se observó un aumento significativo del genotipo GG de IL-6 −174, y los autores apuntaron que, en estos pacientes, la producción de IL-6 es mayor23. En nuestros pacientes atópicos, las frecuencias del alelo G y el genotipo GG son más altas que en los sujetos sanos y los pacientes asmáticos no atópicos. En una población del sur de Finlandia se observó una asociación significativa del PNU IL-6 rs1800797 con el riesgo de asma del adulto, especialmente con el asma atópica del adulto24. Estos resultados apoyan nuestros hallazgos.
No observamos cambios significativos en IL-6 −572G/C (rs1800796) entre los sujetos con AB y los sujetos sanos, aunque el análisis doble de PNU en IL-6 −174G/C e IL-6 −572G/C mostró que existía mayor riesgo de asma en los sujetos con la combinación de genotipos GG+GG (de OR 3,4 a OR 5,8). El genotipo GG de IL-6 −572G/C puede ser un factor promotor en combinación con el polimorfismo IL-6 −174G/C o con otros PNU de IL, a pesar de que por sí solo no aumenta el riesgo de desarrollar AB. Por lo tanto, los polimorfismos simultáneos en varias IL pueden hacer variar la concentración de IL-6 y no solamente aumentar la sensibilidad al asma, sino también participar en la respuesta Th2. La IL-6 es responsable de la diferenciación de los linfocitos T hacia Th2 y Th17. Puede participar de forma activa en la patogenia del AB y ser un modulador clave del conjunto de la respuesta inmunitaria y de la función de las células no inmunológicas25. Se ha observado una asociación positiva entre el polimorfismo en el gen del receptor de la IL-6 y el AB26. Hawkins et al. (2012) vieron que el PNU de IL-6R se asocia con la función pulmonar en pacientes asmáticos y que la transeñalización de IL-6R podría tener un rol patogénico en las vías aéreas que se relacionaría con la gravedad del asma27. Por otro lado, Corvol et al. no observaron ninguna asociación significativa entre el polimorfismo de la IL-6 y el asma, pero mostraron la existencia de una significativa interacción farmacogenética gen-gen entre los genes IL-6 e IL-6R y la respuesta a fármacos broncodilatadores en el asma28. Debido a la señalización de la IL-6 a través de PNU en ambos genes del receptor de la IL-6, las interacciones gen-gen pueden ser responsables de que aparezca mayor inflamación, de que la eficacia del tratamiento en pacientes asmáticos sea menor y de que se acumulen daños diversos, que incluyen modificaciones oxidativas de biomoléculas.
Las modificaciones oxidativas se producen por el aumento de la producción de especies reactivas de oxígeno, producidas durante la inflamación y que se acumulan especialmente en procesos inflamatorios de repetición. Además, las especies reactivas de oxígeno estimulan la producción de citocinas proinflamatorias, como la IL-6. En nuestros estudios previos en niños asmáticos, observamos mayor daño oxidativo y asociaciones con polimorfismos en genes antioxidantes29,30.
Uno de los objetivos de la investigación del tratamiento del AB son las moléculas capaces de reducir la secreción de citocinas proinflamatorias. Es necesario confirmar nuestros resultados mediante otros estudios para mejorar la fiabilidad de nuestros hallazgos.
Sin embargo, debemos mencionar algunas limitaciones de este estudio. En primer lugar, el número de pacientes asmáticos (n=264) y de niños sanos (n=250) incluidos fue relativamente pequeño, lo que afectó a la potencia estadística del estudio. Aun así, por lo que sabemos, la muestra de este estudio es la más grande que se ha analizado hasta 2015 y la mayor muestra pediátrica jamás estudiada. Otra limitación es que no cuantificamos la concentración de IL-6 en los pacientes con AB. Consideramos que este trabajo fue un estudio piloto que conviene ampliar.
Para concluir, este estudio prueba la asociación significativa que existe entre los polimorfismos funcionales del gen de la IL-6 y el AB. Estos PNU pueden tener un efecto sobre los parámetros clínicos de los pacientes. Es importante efectuar otros estudios que permitan repetir estas asociaciones en diferentes poblaciones étnicas y con muestras más grandes, para aclarar el mecanismo bioquímico causal del efecto de la IL-6 en la etiología, el desarrollo y los endotipos del AB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a J. Bencatova y a Z. Cetlova su asistencia en tareas de laboratorio. El estudio ha sido financiado mediante la beca VEGA 1/0252/14 y el proyecto “Centro de medicina traslacional” cofinanciado por fuentes de la UE y por el Fondo Social Europeo.