El proyecto «Estadificación clínica y molecular del cáncer de pulmón estadios I-IIp», tiene por objetivo la identificación de variables moleculares que mejoren la capacidad pronóstica y predictiva de la clasificación TNM en el cáncer de pulmón no célula pequeña (NSCLC) estadio I/IIp. Para ello se han creado tres cohortes de pacientes de los que se recoge información clínica y muestras biológicas pulmonares y de sangre. En las muestras se validará una firma pronóstica proteica, y se analizarán micro-RNA, ALK, Ros1, Pdl-1, y niveles de expresión de TKT, TKTL1 y G6PD. Asimismo se analizarán marcadores de inflamación en tejido y marcadores de estroma. Se determinará la metilación de los genes p16, DAPK, RASSF1a, APC y CDH13 en la muestra tisular y se analizarán marcadores inflamatorios en sangre periférica. Este amplio panel analítico puede permitir la identificación de variables que mejoren la capacidad pronóstica y predictiva del TNM en el NSCLC mediante la estadificación molecular.
The aim of the Clinical and Molecular Staging of Stage I-IIp Lung Cancer Project is to identify molecular variables that improve the prognostic and predictive accuracy of TMN classification in stage I/IIp non-small cell lung cancer (NSCLC). Clinical data and lung tissue, tumor and blood samples will be collected from 3 patient cohorts created for this purpose. The prognostic protein signature will be validated from these samples, and micro-RNA, ALK, Ros1, Pdl-1, and TKT, TKTL1 y G6PD expression will be analyzed. Tissue inflammatory markers and stromal cell markers will also be analyzed. Methylation of p16, DAPK, RASSF1a, APC and CDH13 genes in the tissue samples will be determined, and inflammatory markers in peripheral blood will also be analyzed. Variables that improve the prognostic and predictive accuracy of TNM in NSCLC by molecular staging may be identified from this extensive analytical panel.
El cáncer de pulmón (CP) es la primera causa de mortalidad asociada a cáncer1,2, y su supervivencia a los cinco años no supera el 18%3. Solo una minoría de los casos se diagnostican en estadio localizado, cuando la resección quirúrgica es el tratamiento indicado4. La detección precoz mejora el pronóstico, pero la falta de sintomatología en los estadios iniciales limita esta posibilidad3. Aproximadamente el 80% de los casos de CP son de tipo célula no pequeña (non-small cell lung cancer [NSCLC])5, con adenocarcinoma y carcinoma escamoso como subtipos predominantes. La clasificación según extensión del tumor primario (T), afectación linfática (N) y presencia de metástasis (M), es fundamental para el pronóstico, que también depende de la comorbilidad4.
La identificación y el desarrollo de marcadores tumorales en CP en esta última década ha sido exponencial, con la identificación de factores predictivos o pronósticos como las mutaciones del receptor del factor de crecimiento epidérmico6–11, y las translocaciones del gen ALK (Anaplastic Large Cell Lymphoma Gene)12–14. La adición de determinantes pronósticos y predictivos a la clasificación TNM es una prioridad para identificar subgrupos de pacientes candidatos a terapia dirigida6,7,15–17. Para un número significativo de marcadores, sin embargo, los resultados disponibles aún no son concluyentes. La lentitud en la obtención de resultados clínicos relevantes es atribuible tanto a la complejidad de la enfermedad como a la metodología analítica utilizada4.
El Proyecto «Estadificación clínica y molecular del cáncer de pulmón estadios I-IIp», es parte del Proyecto Estratégico en Cáncer de Pulmón del Centro de Investigación en Red de Enfermedades Respiratorias (CIBERES), y se ha planteado como una acción colaborativa con la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y la Red Temática de Investigación Colaborativa en Cáncer (RTICC). El Proyecto recoge información clínica y muestras biológicas, tejido pulmonar tumoral, no tumoral y sangre, en cohortes de pacientes con NSCLC, enfermedad localizada y tratamiento quirúrgico (estadio I-IIp). Los grupos de investigación participantes en el proyecto analizarán marcadores genéticos, epigenéticos y proteómicos potencialmente pronósticos y/o predictivos, integrando esta información con las características clínicas del paciente, para alcanzar una clasificación multidimensional del NSCLC en estadio I/IIp, en la que los elementos de extensión anatómica constituyan un componente más de un conjunto validado de determinantes pronósticos y predictivos.
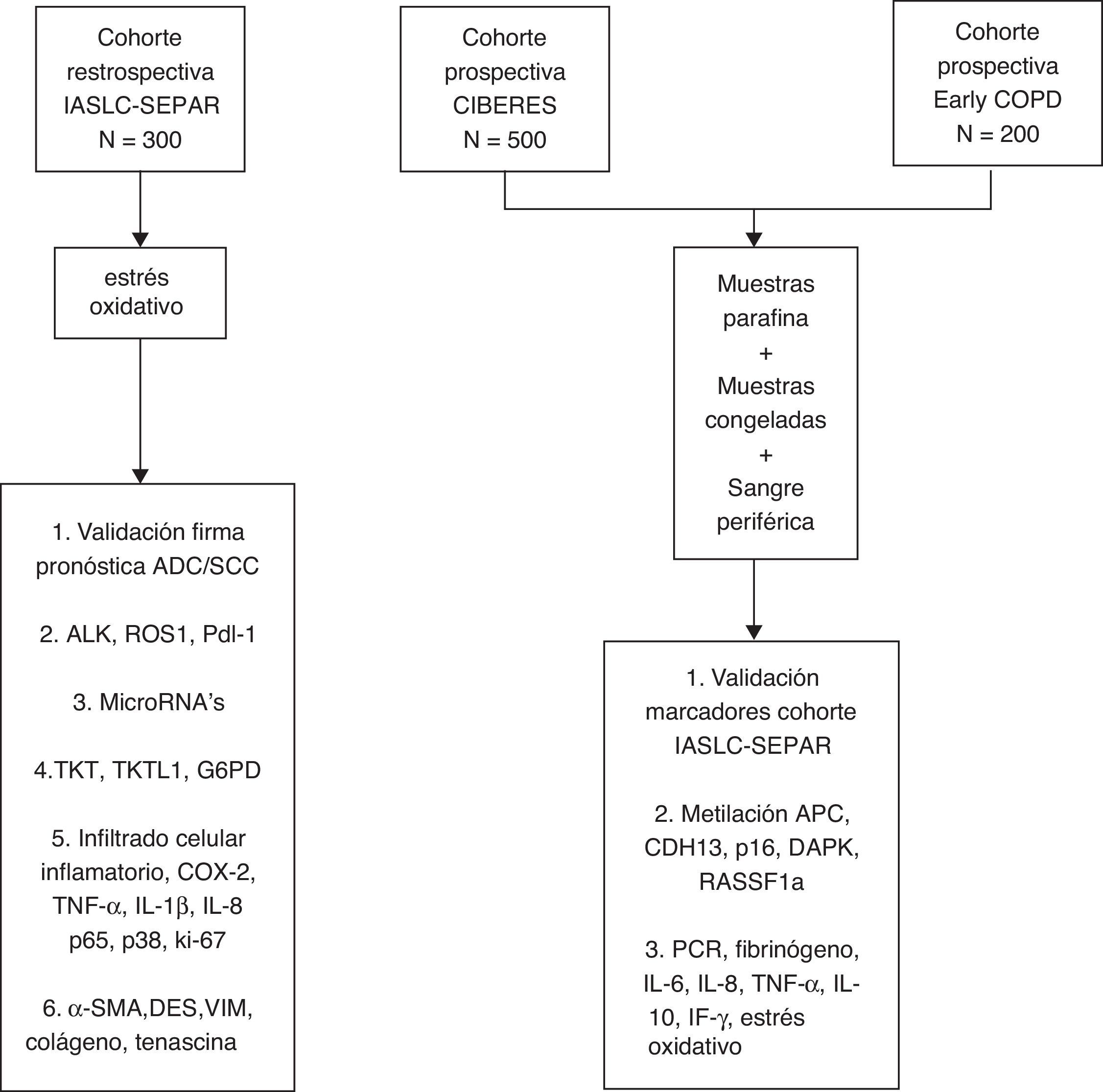
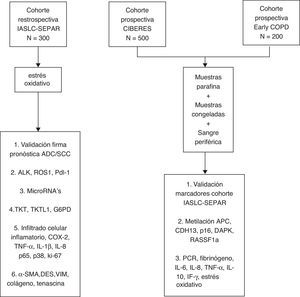
En el marco del proyecto se han creado tres cohortes de pacientes estadificados como I/IIp y tratados quirúrgicamente. Una primera cohorte, la cohorte retrospectiva de la International Association for the Study of Lung Cancer (IASLC), ha sido conformada a partir del trabajo de registro colaborativo del Grupo Cooperativo de Cáncer de Pulmón (GCCP-II) de SEPAR, con disponibilidad de información clínica y de muestras de tejido tumoral parafinado18. Una segunda cohorte prospectiva, la Cohorte CIBERES, incluye nuevos casos de NSCLC estadio I/IIp, de los que se registra información clínica, con creación paralela de un repositorio de muestras de tejido tumoral, tejido pulmonar no tumoral y sangre periférica, material biológico conservado en los medios adecuados para la realización posterior de análisis moleculares. La tercera cohorte parte del proyecto es la Cohorte Early COPD, con casos incidentes de NSCLC identificados por un programa de cribado en pacientes fumadores de más de 45 años y con enfermedad pulmonar obstructiva crónica (EPOC).
El objetivo principal del proyecto es la identificación de variables clínico-moleculares que mejoren la capacidad pronóstica y predictiva de la clasificación TNM en el NSCLC estadio I/IIp. En este artículo se detallan los criterios de selección de los participantes, la información clínica basal y de seguimiento obtenidas, la metodología de procesado inicial y de almacenado de las muestras en la Plataforma Biobanco Pulmonar (PBP) de CIBERES, y los procedimientos analíticos de las muestras biológicas (fig. 1).
MétodoDiseño, población y variables clínicasEl proyecto sigue un diseño de cohorte, incorporando pacientes consecutivos con NSCLC estadio I/IIp a lo largo de dos años, seleccionados en el momento de su tratamiento quirúrgico, que aceptan su participación en el estudio y la cesión de muestras biológicas a un biobanco. Se espera conseguir un número total de 1000 pacientes, considerando las tres cohortes que conforman el proyecto.
En el momento del reclutamiento, se recoge la información clínica y se inicia el periodo de seguimiento de 5 años. Se registran las variables de caracterización parte del proyecto de estadificación TNM de la IASLC18,19, que incluyen sociodemografía, tabaquismo, comorbilidades, analítica sanguínea, función respiratoria, localización, tipología y diferenciación del tumor, exploraciones de estadificación (tomografía computarizada y por emisión de positrones, gammagrafía ósea, tomografía y/o resonancia cerebral, endoscopia y/o mediastinoscopia), resección quirúrgica y disección ganglionar, tratamiento adyuvante, y descripción detallada de los descriptores TNM20,21. En lo referente al seguimiento del paciente, se recoge información sobre recidiva y mortalidad: a) tiempo libre de enfermedad; b) recaída; c) supervivencia; y d) causa de muerte (véase material suplementario).
Obtención de muestras y gestión en la Plataforma Biobanco PulmonarLas muestras anatomopatológicas procedentes del tejido tumoral, tejido pulmonar no tumoral y sangre se procesan inmediatamente después de su extracción según los protocolos descritos en la PBP22 (tabla 1, material suplementario). La PBP tiene por objetivo coordinar y gestionar la recogida de muestras de tejido pulmonar y muestras biológicas relacionadas, vinculándolas con la información clínica, de forma que estos recursos sean fácilmente accesibles para la investigación23. La PBP forma parte de la Plataforma Red Nacional de Biobancos y está formada por los centros hospitalarios del territorio que voluntariamente participan en la inclusión de casos y obtención de muestras. El periodo de recogida de muestras establecido para todas las cohortes es de dos años, con análisis biológicos de las mismas el año posterior a la finalización de la recogida de casos. Las muestras de tejido que no se incluyan en parafina y las muestras de sangre periférica permanecerán almacenadas a -80°C, analizándose con una periodicidad anual24.
Procesamiento inicial de muestras parafinadasDe las tres cohortes de NSCLC en estadio localizado creadas se dispone de muestras conservadas en parafina. En cortes de muestras parafinadas teñidos con hematoxilina-eosina se seleccionan las zonas tumorales más homogéneas de cada bloque, y se obtienen 3 cilindros de 0,1cm de diámetro, con los que se construyen tissue microarrays para análisis inmunohistoquímicos (IHQ), independientes para cada subtipo histológico de NSCLC. En aquellos bloques en que es posible, se recoge también un cuarto cilindro de la misma medida con tejido sano adyacente, y un quinto con tejido de transición tumoral, que forman arrays independientes.
Adicionalmente, se efectúan cortes de parafina para la extracción de ácidos nucleicos, después de una macrodisección para obtener la mayor proporción posible de células tumorales. Paralelamente a la preparación de los tissue microarrays, las tinciones son valoradas por un panel de patólogos que efectúan una valoración semicuantitativa de la diferenciación tisular y de la afectación vascular, linfática y de tejidos circundantes.
Variables biológicasMuestras parafinadasa) Validación de una firma proteica pronóstica
La técnica de arrays de expresión basada en ARNm ha sido la base para generar «firmas pronósticas» para NSCLC25–31. Estos perfiles son difíciles de trasladar y reproducir en el escenario clínico, y una alternativa para solucionar este problema es traducir esas firmas a su correspondiente firma de proteína, y detectar sus niveles de expresión en tejido parafinado mediante IHQ. En el proyecto se desarrollará una firma proteica capaz de clasificar los pacientes con NSCLC en estadios iniciales en subgrupos según su riesgo de recurrencia.
Se han seleccionado un grupo de 15-20 proteínas capaces de clasificar los pacientes con NSCLC en estadios iniciales en dos grupos según su evolución clínica, en base a trabajos previamente publicados, utilizando un algoritmo generado en el laboratorio de biomarcadores del Centro de Investigación Médica Aplicada de la Universidad de Navarra. Entre las proteínas seleccionadas existe un panel de cinco proteínas de unión al ARN que han mostrado valor pronóstico en cohortes de pacientes con NSCLC en estadio inicial32, que ha permitido generar una firma pronóstica proteica que se validará en las cohortes del presente proyecto.
b) Determinación de ALK, Ros 1 y Pdl-1
Se realizará el estudio IHQ de ALK con dos anticuerpos distintos validados, D5F3 y 5a4, para estudiar la correlación entre ellos. Todos los casos positivos se confirmarán mediante fluorescence in situ hybridization. Se realizará el estudio IHQ de Ros-1 para conocer el porcentaje de alteraciones moleculares, y se determinará Pdl-1 y su relación con la supervivencia, también mediante IHQ. Los estudios de Pdl-1 en CP publicados se han basado en un número limitado de casos, pero estudios previos de expresión de Pdl-1 en mesoteliomas han observado relación entre la expresión de Pdl-1 y la supervivencia del paciente.
c) Micro-RNA
Los micro-RNA (miRNA) son moléculas de 19-25 nucleótidos no codificantes, que regulan postranscripcionalmente la expresión de múltiples genes. Están implicados en un amplio rango de procesos biológicos de ciclo celular33, y han demostrado protagonismo en la progresión del cáncer34,35. Los miRNA derivados del tumor pueden entrar en la circulación sanguínea36, con un perfil de expresión de miRNA en suero y plasma distinto en función de la enfermedad37. Estas propiedades, junto al hecho de que se trata de moléculas estables y fácilmente detectables han generado interés en su estudio38,39. En el proyecto se efectúa una selección de los miRNA a estudiar en base a los siguientes criterios:
- 1)
miRNA para los que existan evidencias de asociación con el pronóstico del NSCLC, con un mínimo de tres estudios publicados que coincidan en indicar el miRNA como potencial biomarcador.
- 2)
miRNA reguladores de los genes EGFR, ALK, KRAS, validados en estudios funcionales, a partir de búsqueda en las bases de datos que predicen las dianas para miRNA.
- 3)
miRNA reguladores de otros genes de interés que sean objeto de estudio por los investigadores del grupo, en el contexto del NSCLC (véase material suplementario).
d) Vía metabólica de las pentosas fosfato
La vía metabólica de las pentosas-fosfato desempeña un papel en el desarrollo del cáncer, ya que a través de la misma se sintetizan las bases nitrogenadas necesarias para la síntesis del ADN. A través de la rama no oxidativa de la vía se sintetiza además nicotinamida-adenina-dinucleótido-fosfato, crucial en la síntesis de los ácidos grasos necesarios para la formación de membranas celulares.
La importancia que tiene esta vía para la síntesis de biomoléculas, y para el mantenimiento de la proliferación propia del cáncer, hace que se encuentre regulada por algunos de los más importantes protooncogenes y genes supresores de tumores. Se ha descrito que los cánceres con mutaciones en KRAS presentan un incremento de los niveles de glucosa-6-fosfato- deshidrogenasa (G6PD)40, y que la proliferación celular a través de esta molécula está directamente relacionada con proteínas como la TAp7341. La inhibición de G6PD puede ralentizar el crecimiento tumoral42, y la sobreexpresión de TKTL1 se ha correlacionado con la agresividad tumoral43. En el caso específico del CP, estudios recientes sugieren la existencia de una sobreexpresión tanto de TKT como de G6PD44, lo que confirma el interés de las enzimas de la pentosa-fosfato como potenciales biomarcadores en el CP (véase material suplementario).
e) Marcadores inflamatorios
La inflamación crónica desempeña un papel clave en la patogenia del NSCLC, sobre todo en los pacientes con EPOC45,46. Estudios experimentales han puesto de manifiesto que en pacientes con enfermedad pulmonar obstructiva crónica y en fumadores aumenta la expresión de ciertas citoquinas como la interleuquina (IL)-6, la IL-8, y las IL-10, que, mediante la inducción de la enzima ciclooxigenasa-2, promueven la respuesta inflamatoria linfocitaria. Estas citoquinas pueden inhibir la apoptosis, interferir con los mecanismos de reparación celular y promover la angiogénesis. Otros mecanismos inflamatorios implicados en el CP están mediados por el factor de crecimiento endotelial vascular, regulador de angiogénesis, el factor de crecimiento epidermoide, el factor de necrosis tumoral (TNF)-alfa, el factor nuclear (NF)-kB, y el factor de crecimiento transformante-beta (TGF-beta). La inflamación crónica puede ser importante en la amplificación del proceso de mutagénesis, facilitando el crecimiento tumoral e incrementado la frecuencia de formación de metástasis.
En el proyecto, mediante IHQ, se cuantificarán los siguientes marcadores:
- 1)
Infiltrado celular inflamatorio en las preparaciones histológicas teñidas en hematoxilina-eosina.
- 2)
Infiltrado celular específico, mediante la utilización de anticuerpos específicos para la identificación de leucocitos (anti-CD45) y macrófagos (anti-CD68).
- 3)
Determinación de niveles de moléculas inflamatorias implicadas en procesos relacionados con el desarrollo del cáncer:
3.1) Ciclooxigenasa-2 (COX-2), relacionada con la angiogénesis, la invasión tumoral y la supresión de la inmunidad.
3.2) TNF-alfa, molécula que induce la expresión de COX-2 a través de la vía de señalización de las mitogen-activated protein kinases (MAPKs).
3.3) IL-1beta e IL-8, que inducen la expresión de COX-2 y están implicadas en el reclutamiento de neutrófilos y en la progresión cancerosa.
- 4)
Vías de señalización con implicación en el NSCLC, como son p65 (NF-kB) y p38 (MAPK).
- 5)
Identificación del grado de proliferación celular de las lesiones tumorales mediante cuantificación de la expresión de la proteína nuclear ki-67, como marcador específico de crecimiento tisular (véase material suplementario).
f) Marcadores de actividad estromal
Una fuente importante de señales para las células cancerosas es el estroma alterado, caracterizado por una sobreabundancia de componentes de matriz extracelular y de fibroblastos activados, así como por una composición anómala de esta matriz extracelular, alteraciones en el estroma también se observan en procesos fibrogénicos. La identificación de la contribución de las señales provenientes del estroma activado en la progresión del CP es biomédicamente relevante por ofrecer oportunidades de intervención terapéutica. Las alteraciones en el estroma tumoral han sido estudiadas en cáncer de mama, pero son todavía poco conocidas en el CP. Debido a que el tipo celular más abundante del estroma activado es el miofibroblasto, se examinarán mediante IHQ la expresión de la actina de músculo liso alfa (α-SMA). Para distinguir los miofibroblastos de otros tipos celulares, se examinará la expresión de desmina y vimentina47, y para examinar la presencia de componentes cicatriciales de la matriz extracelular, se analizará en la expresión de colágeno y de tenascina48 (véase material suplementario).
Muestras congeladasLa metilación del ADN participa en el control de la expresión génica, y se ha demostrado que la metilación aberrante del ADN es un fenómeno frecuente en el cáncer. Las regiones donde aparece metilación son las denominadas islas CpG, que se concentran en las zonas promotoras y el primer exón de los genes codificadores de proteínas. Hasta un 60% de estos genes contienen islas CpG en sus promotores, y su estado de metilación está inversamente correlacionado con la transcripción49.
Los genes p 16 (cyclin-dependent kinase inhibitor 2) (CDKN2A/p16), H-cadherin (CDH13), adenomatous polyposis coli (APC), Ras association domain family 1 gene (RASSF1A) y death-associated protein kinase 1 (DAPK) son importantes en el desarrollo del NSCLC, y aparecen frecuentemente metilados en el tejido tumoral50,51. La metilación de los genes p16, DAPK, CDH13, APC y RASSF1a se ha asociado a incremento en el riesgo de CP52, y a recidiva temprana51. Determinar el estado de metilación de estos genes es potencialmente importante, tanto para el diagnóstico como para el pronóstico de la enfermedad (véase material suplementario).
Muestras de sangre periféricaLas características de la respuesta inflamatoria en sangre periférica, en parte mediada por la generación de estrés oxidativo53, pueden influir en el pronóstico y en la respuesta terapéutica del CP. La inflamación relacionada con cáncer representa además una nueva diana terapéutica54, y se han descrito diferentes biomarcadores de inflamación en sangre que se asocian con el CP. En el proyecto se medirán los niveles en sangre de reactantes de fase aguda, citoquinas inflamatorias y marcadores de estrés oxidativo.
1) Reactantes de fase aguda:
1.1) La proteína C reactiva es un reactante inespecífico que se ha asociado a CP por diferentes mecanismos, entre ellos la respuesta inflamatoria causada por el tumor, la respuesta inmune a antígenos del mismo, y la producción de citoquinas por las mismas células tumorales. Niveles elevados de proteína C reactiva son predictores de mortalidad55.
1.2) El fibrinógeno, se ha asociado a un aumento de riesgo para desarrollar CP56.
2) Citoquinas inflamatorias:
2.1) IL-6, IL-8 y TNFα pueden elevarse en el CP por mecanismos similares a los descritos para la proteína C reactiva, y los niveles aumentados de estas citoquinas en sangre se han asociado a CP57.
2.2) La IL-10 es una citoquina antiinflamatoria cuya sobreexpresión se ha asociado a progresión en el CP58.
2.3) La deficiencia de interferón gamma se ha asociado a CP en modelos experimentales59, y en series de pacientes60.
3) Estrés oxidativo:
El estrés oxidativo en sangre se ha relacionado con riesgo de CP61, con enfermedad avanzada62, y con la respuesta terapéutica63 (véase material suplementario).
Plan de análisisInicialmente, con la información clínico patológica y de seguimiento recogida en las 3 cohortes de pacientes con NSCLC estadio I/IIp se realizará una descriptiva general y comparativa entre cohortes que se completará con el estudio de biomarcadores en las muestras de sangre y de tejido disponibles. Los patrones subyacentes serán examinados mediante técnicas de biología computacional.
Se estudiará la asociación con los outcomes estudiados (recidiva y mortalidad), de las variables utilizadas: a) variables de caracterización clínica del paciente (sociodemografia, tabaquismo, comorbilidad, analítica sanguínea, función respiratoria), b) variables tumorales (localización, tipología y diferenciación), c) variables de su estadificación, d) tratamiento quirúrgico realizado (características y disección ganglionar), e) tratamiento adyuvante, f) TNM, y g) variables biológicas analizadas.
Para los modelos multivariantes, se seleccionarán las variables con relevancia clínica que hayan mostrado asociación en los análisis univariantes previos. Se usarán modelos de regresión logística multivariante para cada outcome, y con regresión de Cox se estudiarán los cambios en las curvas de supervivencia en función de las variables explicativas retenidas en los modelos.
Finalmente, los modelos creados con los resultados obtenidos en la Cohorte Retrospectiva IASLC serán validados en la Cohorte CIBERES y en la Cohorte Early COPD.
FinanciaciónEste trabajo ha sido financiado por el CIBER de Enfermedades Respiratorias (CIBERES),una iniciativa del Instituto de Salud Carlos III, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), la Red Temática de Investigación Colaborativa en Cáncer (RTICC), el Fondo de Investigación Sanitaria (FIS PI02040, PI01310 y PI02534) y la Asociación Española contra el Cáncer (AECC).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo Colaborativo en Cáncer de Pulmón CIBERES – RTICC - SEPAR: Jordi Alcaraz2,6, Carlos Álvarez2,7, Pilar Ausin2,8, Joan Albert Barberà2,19, Esther Barreiro2,8, Ana Isabel Blanco9, Anna Brunet10,11, Marta Cascante2,6, Ady Castro2,7, José Ignacio Echeveste12, Ana Belén Enguita2,13, Leonardo de Esteban Júlvez14, Esther Fernández15, M. Jesús Fernández-Aceñero16, M. Ángeles González Castro9, Guadalupe González Pont17, Pedro López de Castro2,15, María Dolores Lozano12, Ramón Marrades18, Carlos Martínez-Barenys15, Elena Martínez-Terroba3,4, José Luis Mate20, Rosario Melchor16, Laura Millares2,10, Eduard Monsó1,2 (coordinador CIBERES), Luis M. Montuenga3,4 (coordinador RTICC), Mariano Monzó19, Alfons Navarro19, María José Pajares3,4, Carles Pericay11, Lara Pijuan21, Ramón Rami-Porta2,17, Josep Ramírez2,18, Antoni Rosell2,22, Julio Sánchez de Cos2,5 (coordinador SEPAR), Rosa María Sánchez Gil9, Jaume Sauleda2,23,24, Sergio Scrimini2,23,24, Luis Seijo2,16, Mireia Serra17, Laia Setó2 y Cristina Villena2.
1. Servicio de Neumología - Hospital Universitari Parc Taulí, Sabadell.
2. CIBER de Enfermedades Respiratorias – CIBERES, Instituto de Salud Carlos III, Madrid. 3. Programa de Patogénesis de Tumores Sólidos, Laboratorio de Biomarcadores, Centro de Investigación Médica Aplicada (CIMA), Universidad de Navarra, Grupo RTICC RD12/0036/0040, Pamplona. 4. Departamentos de Histología y Anatomía Patológica, Facultades de Medicina y Ciencias, Universidad de Navarra, Pamplona. 5. Servicio de Neumología, Hospital San Pedro de Alcántara, Cáceres. 6. Universidad de Barcelona, Barcelona. 7. Servicio de Neumología - Instituto de Investigación, Hospital Universitario 12 de Octubre, Madrid. 8. Servicio de Neumología - Grupo de Investigación en Cáncer de Pulmón, Hospital del Mar-IMIM, Departamento de Ciencias Experimentales y de la Salud, Universidad Pompeu Fabra, Parque de Investigación Biomédica de Barcelona (PRBB), Barcelona. 9. Hospital Virgen del Rocío, Sevilla. 10. Fundació Parc Taulí, Sabadell. 11. Servicio de Oncología Médica, Hospital Universitari Parc Taulí, Sabadell. 12. Departamento de Anatomía Patológica, Clínica Universidad de Navarra, Grupo RTICC RD12/0036/0062, Pamplona. 13. Servicio de Anatomía Patológica - Instituto de Investigación, Hospital Universitario 12 de Octubre, Madrid. 14. Hospital Joan XXIII, Tarragona. 15. Servicio de Cirugía Torácica, Hospital Universitari Germans Trias i Pujol, Badalona. 16. Fundación Jiménez Díaz, Madrid. 17. Hospital Mutua de Terrassa, Terrassa. 18. Hospital Clínic, Barcelona. 19. Hospital Clínic - Facultad de Medicina, Universidad de Barcelona, Barcelona. 20. Anatomía Patológica, Hospital Universitari Germans Trias i Pujol, Badalona. 21. Servicio de Patología, Hospital del Mar, Barcelona. 22. Servicio de Neumología, Hospital Universitari de Bellvitge, L’Hospitalet de LLobregat. 23. Servicio de Neumología, Hospital Universitari Son Espases, Palma. 24. Institut d’Investigació Sanitària de Palma, IdISPa.