Introducción
La distrofia muscular de Duchenne (DMD) es una enfermedad de herencia recesiva ligada al cromosona X, que está causada por mutaciones en el gen de la proteína distrofina del citosqueleto1. Su incidencia es de 1/3.000-3.500 en varones2.
La DMD se caracteriza por una debilidad muscular progresiva y simétrica, que comienza en la infancia e inicialmente afecta a los músculos de las extremidades inferiores para, de forma progresiva, afectar a los de las extremidades superiores y los del tronco, de manera que aproximadamente a los 12 años los niños son por completo dependientes. El diagnóstico se realiza a la edad de 3-5 años, los pacientes precisan de silla de ruedas entre los 6 y 12 años de edad y desarrollan insuficiencia respiratoria antes de la segunda década de la vida1-3. La mayoría de los pacientes tienen alteraciones cardíacas, con miocardiopatía dilatada, arritmias e insuficiencia cardíaca congestiva; también hay algunos con enfermedad cardíaca pero clínicamente asintomáticos2,4-6. La enfermedad se complica también por la presencia de escoliosis2,7, alteraciones en la deglución, pérdida de peso2,8, dilatación gástrica y estreñimiento2,9,10. Clásicamente el pronóstico es malo, pues el fallecimiento se produce entre los 10 y 20 años de edad. La causa más frecuente de muerte es la insuficiencia respiratoria (> 80% de los casos) y la insuficiencia cardíaca (10-20%)1,2,11.
En los pacientes con DMD, la introducción del soporte ventilatorio ha demostrado mejorar los gases arteriales, estabilizar las manifestaciones clínicas respiratorias, reducir las necesidades de hospitalización, aumentar el bienestar e incrementar la supervivencia1,11-15. El inicio electivo de ventilación mecánica no invasiva (VMNI) se realiza frecuentemente cuando aparecen síntomas y/o la alteración en el intercambio gaseoso de día o de noche. Sin embargo, no es infrecuente que los pacientes no refieran síntomas o que no se valoren los gases arteriales. En este caso el comienzo de la enfermedad viene definido por insuficiencia respiratoria hipercápnica aguda, que precisa atención en cuidados intensivos, con intubación endotraqueal y ventilación mecánica invasiva (VMI). En esta situación el paciente en general es incapaz de ser desconectado del ventilador y precisa una traqueostomía16,17.
El objetivo de este estudio es describir nuestra experiencia en el manejo de pacientes con DMD, incluyendo la descripción y evolución de las alteraciones pulmonares y no pulmonares.
Pacientes y métodos
Se han revisado las historias clínicas de 27 pacientes con diagnóstico de DMD enviados al Departamento de Enfermedades Respiratorias del West Park Hospital en los últimos 15 años. El West Park Hospital es un centro médico especializado en la rehabilitación y el tratamiento de pacientes con ventilación crónica. El Departamento de Enfermedades Respiratorias cuenta con una unidad de rehabilitación respiratoria con la capacidad de evaluar y tratar a pacientes con ventilación mecánica (VM) domiciliaria, así como pacientes con VM que requieren ingreso crónicamente en un centro hospitalario.
En nuestra serie el diagnóstico de DMD se realizó de acuerdo con los criterios estándar18. La mayoría de los pacientes fueron remitidos a nuestro centro desde el Hospital Infantil de Toronto, donde habían permanecido ingresados desde la primera infancia, y ya eran portadores de VM. Únicamente 3 pacientes fueron enviados para su estudio desde el punto de vista respiratorio y para evaluar la necesidad o no de soporte ventilatorio, sin haber recibido este tratamiento previamente.
En las historias clínicas de todos los pacientes analizamos los siguientes parámetros: los gases arteriales y la función pulmonar, que incluyó la medida de las presiones respiratorias máximas, inspiratoria (PImáx) y espiratoria, antes (si fue posible) y después de instaurar la VM; el intercambio gaseoso durante el sueño con pulsioximetría para el estudio de la saturación de oxihemoglobina y la capnografía para la evaluación de la presión arterial de anhídrido carbónico por determinación transcutánea; el estudio de la función cardíaca, la evaluación de la disfagia y el análisis de la situación social.
Análisis estadístico
Los datos de función pulmonar y de intercambio de gases se expresan como media ± desviación estándar para las variables cuantitativas. Para comparar los valores de estas variables antes y después de iniciar la VM se utilizó el test de la t de Student para datos emparejados. Todos los análisis se llevaron a cabo mediante el paquete estadístico SPSS versión 11.5 para Windows®. En todos los casos la significación se estableció en un valor de p < 0,05.
Resultados
Se incluyó en el estudio a 27 pacientes con el diagnóstico de DMD. La edad media ± desviación estándar de los pacientes fue de 26 ± 6 años (rango: 20-43). El diagnóstico de DMD se había realizado a la edad de 4 ± 2 años. Los pacientes precisaron de silla de ruedas a los 10 ± 1 años de edad. Todos habían sido intervenidos quirúrgicamente de la columna vertebral por escoliosis antes de los 12 años.
En el momento de realizar esta revisión, los pacientes llevaban 56 ± 49 meses (rango: 1-174) con VM. En el total de los 27 pacientes, el soporte de ventilación se había iniciado a la edad de 21 ± 5 años. En 17 el soporte ventilatorio se inició como VMI por traqueostomía y en los otros 10, como VMNI, aunque en 3 de ellos fue preciso cambiar a VMI después de 18 ± 11 meses, siempre coincidiendo con un episodio de insuficiencia respiratoria aguda relacionada con una neumonía o proceso infeccioso pulmonar. En la tabla I se muestra la causa por la que se indicó el inicio de la ventilación.
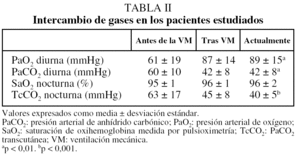
Los gases arteriales antes del inicio de la VM se registraron únicamente en la mitad de los pacientes y evidenciaban una leve hipoxemia con hipercapnia significativa. Después de comenzar la VM se objetivó la normalización de los gases, que se mantuvo a lo largo del tiempo. El estudio del intercambio nocturno de gases antes de la VM se registró sólo en 6 pacientes. Después de iniciar la VM se observó un mejoría significativa en la saturación de oxihemoglobina y la presión arterial de anhídrido carbónico por determinación transcutánea (tabla II).
La VMNI se realizó con un sistema de doble presión (BiPAP S/T®, Respironics Inc., Murrysville, EE.UU.) y con mascarillas comerciales. Los pacientes con traqueostomía utilizaban un respirador ciclado por volumen (LP-6+®, LP-10® o PLV-100®; Lifecare, Lafayette, Co, EE.UU.) y se empleaba una cánula de traqueostomía sin globo siempre que era posible.
En 14 pacientes la VM era sólo nocturna; de ellos, en 7 era VMNI y 7 eran portadores de traqueostomía y toleraban una válvula fonatoria durante el día. Los otros 13 pacientes recibían soporte ventilatorio continuo por traqueostomía (> 20 h al día).
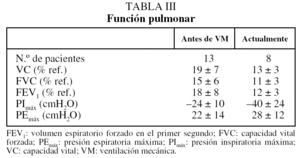
El estudio de la función pulmonar pudo obtenerse únicamente en 13 pacientes. Tras instaurar la VM no se objetivaron cambios significativos en los parámetros (tabla III).
Se registraron síntomas cardíacos en 13 pacientes, fundamentalmente palpitaciones y molestias torácicas. Todos estos pacientes presentaban alteraciones en el electrocardiograma. También se observaron alteraciones en el electrocardiograma de 2 pacientes asintomáticos (tabla IV). Se realizó a todos los pacientes sintomáticos un ecocardiograma, que fue anormal en todos ellos. Los hallazgos más comunes fueron miocardiopatía dilatada, disfunción ventricular izquierda e hipocinesia de la pared posterior.
En el momento de llegar a nuestro centro, 18 pacientes seguían con alimentación oral, 7 eran portadores de sonda de gastrostomía y 2 recibían alimentación por sonda nasogástrica. Todos los pacientes referían una pérdida de peso importante durante el año previo al inicio de la VM. Se realizaron estudios de deglución con videofluoroscopia a 14 pacientes que referían disfagia; todos ellos recibían VMI y eran, por lo tanto, portadores de traqueostomía. Los hallazgos más importantes fueron: a) dificultades para el control y la formación del bolo (disminución en movimiento de protrusión y retracción, debilidad en la fuerza de propulsión lingual, que en ocasiones lleva a la deglución fraccionada, reducción del rango de movimiento de los maxilares, presencia de residuos orales), y b) aumento del tiempo del tránsito oral, lo que puede producir desnutrición por la reducción de la ingesta calórica. En los pacientes que recibían la dieta totalmente por sonda de gastrostomía la alteración en la deglución afectaba tanto a la fase bucal como a la faríngea. La fase faríngea se caracterizaba en todos los pacientes por una intensa limitación en la elevación del hioides y de la laringe, deflexión ausente de la epiglotis y leve aspiración de líquidos, con lo que se producía un significativo residuo faríngeo.
Todos los pacientes con traqueostomía tenían una expresión verbal inteligible, ya fuera utilizando una cánula sin globo, una cánula fenestrada o una válvula de fonación.
Durante el período de seguimiento de este estudio fallecieron 5 pacientes (18%), 4 de ellos con VMI. En el momento de la muerte llevaban 63 ± 47 meses (rango: 10-108) con este tratamiento. Desconocemos la causa exacta de muerte. Tres de estos pacientes presentaban una grave enfermedad cardíaca, con intenso compromiso de la función ventricular izquierda, habían perdido peso de forma rápida previamente y referían aumento del síntoma de fatiga.
Discusión
Al igual que otras series, nuestra experiencia en pacientes con DMD muestra que la VM puede mejorar la situación clínica y prolongar la supervivencia. En nuestra revisión el curso de la enfermedad es similar al descrito en revisiones previas1-3, incluyendo la edad de diagnóstico, la edad en que los pacientes precisan de silla de ruedas y la edad en que presentan insuficiencia respiratoria.
La instauración del soporte ventilatorio en los pacientes con DMD ha cambiado espectacularmente su pronóstico11-17,19, siendo de preferencia la instauración inicial de un sistema de VMNI. Parece evidente que la VMNI prolonga la supervivencia de estos pacientes, pero no hay estudios prospectivos con grupo control que apoyen esta hipótesis, por razones obvias. En la serie publicada por Simonds et al11 se demuestra que la supervivencia de los pacientes con DMD y VMNI fue del 85% en el primer año y del 73% a los 5 años. Se ha observado también que la necesidad de hospitalización por complicaciones respiratorias en estos pacientes es inferior en los portadores de VMNI que en los que precisan de VM por traqueostomía20. Sin embargo, cuando se instaura una tos ineficaz y/o una insuficiencia respiratoria hipercápnica (IRH) que no se corrige con la VMNI, sólo la VM por traqueostomía parece prolongar la supervivencia, tal como han demostrado algunos autores21. La necesidad de pasar de VMNI a VMI varía de unas series a otras11,15 y no parece que sea siempre imprescindible, tal como apuntan Simonds et al11.
En nuestra serie, un 62% de los pacientes eran portadores de traqueostomía y precisaban de VMI, lo que contrasta notablemente con otras series publicadas. La discrepancia no puede explicarse por distintos grados de gravedad de la insuficiencia respiratoria (gases arteriales) ni por diferencias en la mecánica pulmonar (función pulmonar)11,14,15. Desde nuestro punto de vista, las 2 razones que pueden explicarla son, en primer lugar, la falta de experiencia en pediatría con la VMNI durante los años noventa y, en segundo lugar, como dato más importante, el hecho de que en nuestra serie la mayoría de los pacientes precisaron VM durante un episodio de IRH aguda, que requirió intubación y VM, lo que pone de manifiesto la ausencia de seguimiento periódico de estos pacientes. El momento de iniciar la VM es crucial a la hora de determinar la vía de acceso a la ventilación. Según las series publicadas y nuestra propia serie, la necesidad de VM en pacientes con DMD suele aparecer entre los 18 y 20 años de edad. Por lo tanto, habría que evaluar periódicamente a estos pacientes desde el punto de vista respiratorio a partir de los 10-15 años de edad. Registrar la evolución de los síntomas, de los gases arteriales, de la función pulmonar y del intercambio de gases durante el sueño podría prevenir la aparición aguda de IRH. El consenso sobre ventilación de 199922 estableció los criterios para iniciar la VMNI y evitar la IRH aguda y la necesidad de traqueostomía a fin de mejorar la situación clínica y social de los pacientes y prolongar su supervivencia. La VMNI ha demostrado ser eficaz en el tratamiento de la IRH, con un nivel de evidencia III, cuando se instaura de forma programada22. Se recomienda iniciarla cuando los pacientes relatan síntomas de IRH o cuando se observa una alteración en el intercambio de gases, ya sea de día o de noche. También en el seguimiento de estos pacientes se ha propuesto el control de la capacidad vital o de la función de los músculos respiratorios. Ragette et al23 observaron que una capacidad vital menor del 60% y/o una PImáx inferior a 4,5 kPa predicen la aparición de alteraciones en el intercambio de los gases durante el sueño, y que la presencia de una capacidad vital inferior al 25% y/o una PImáx menor de 3,5 kPa predicen la IRH diurna. Por otro lado, se sabe que el uso preventivo de la VMNI, cuando la presión arterial de anhídrido carbónico es normal o no hay síntomas, no es eficaz en pacientes con DMD, tal como demostraron Raphael et al24.
Al igual que en revisiones previas4-6, la afectación cardíaca documentada estuvo presente en un 48% de nuestros pacientes. La enfermedad cardíaca no guarda relación con la gravedad o la fase de la alteración neurológica; sin embargo, se ha descrito en la mayoría de los pacientes a partir de los 18 años de edad25. Chenard et al26 demuestran que la existencia de extrasístoles, la disfunción ventricular izquierda y la miocardiopatía dilatada son factores de riesgo para una muerte súbita. En nuestra serie, 3 de los 5 pacientes que murieron presentaban una grave alteración cardíaca; puesto que su situación respiratoria era similar en gravedad a la de los pacientes que sobrevivieron, podemos suponer que la enfermedad cardíaca fue la causa de muerte. La manifestación cardíaca más frecuente es la miocardiopatía dilatada. Se desconoce su patogenia, aunque se sabe que los pacientes con distrofia muscular presentan alteraciones en la musculatura lisa de las arterias coronarias, lo que podría contribuir en cierta forma a la cardiopatía. Gnecchi-Ruscone et al27 observaron mediante tomografía por emisión de positrones que había una reducción de la reserva vasodilatadora coronaria debido a un incremento basal del flujo sanguíneo miocárdico. Los autores proponen que la corrección de la sobrecarga cardíaca podría normalizar la reserva vasodilatadora coronaria. Del mismo modo, Ishikawa et al28 señalan que el tratamiento específico de la alteración cardíaca podría revertir los síntomas y signos de la insuficiencia cardíaca congestiva. Por lo tanto, son necesarios un buen diagnóstico y un cuidadoso seguimiento de la función cardíaca en los pacientes con DMD.
Nuestros pacientes habían experimentado una importante pérdida de peso en el año previo al inicio de la VM, dato que coincide lo referido en estudios previos29,30, en los que se demuestra que el peso se reduce de forma muy rápida en las fases avanzadas de la enfermedad. Son pocos los estudios que han analizado la nutrición en los pacientes con DMD; en todo caso, de ellos parece extraerse la idea de que los suplementos nutricionales podrían evitar el adelgazamiento o incluso ayudar a recuperar el peso. Sin embargo, estas dietas especiales no parecen alterar el ritmo de deterioro de la función respiratoria o de la fuerza muscular31. Willig et al8 afirman que la pérdida de peso y los síntomas de disfagia mejoran una vez iniciada la VM, de modo que son menos los casos en que se requiere la colocación de una sonda de gastrostomía, incluso en fases evolucionadas de la enfermedad. En nuestra serie, únicamente un 25% de los pacientes necesitaron la colocación de la sonda de gastrostomía para la alimentación; todos ellos eran portadores de VM por traqueostomía. Todos los pacientes, con o sin sonda de gastrostomía, mantuvieron el peso a lo largo del período de seguimiento. Una característica de nuestra revisión es la información aportada por la videofluoroscopia en el estudio de la disfagia en pacientes con DMD. Los hallazgos encontrados en nuestros pacientes, todos ellos con traqueostomía y VMI, parecen relacionados con la afectación muscular derivada de la enfermedad, no con la traqueostomía. Los diferentes patrones de afectación de la musculatura bucal-faríngea pueden aparecer en distintos momentos de la evolución de la enfermedad. En la literatura médica es muy escasa la información relativa a las alteraciones de la deglución en pacientes con DMD. En 1991 Gilardeau32 propuso una clasificación de la disfagia en los pacientes con DMD y establecieron que el riesgo de aspiración estaba relacionado con la disfunción masticatoria, los tipos de alimentos y el cuidado con la alimentación de los pacientes. Lo interesante de nuestra revisión es la aportación de la videofluoroscopia en la descripción detallada de las anormalidades encontradas en las distintas fases de la deglución (bucal, faríngea y esofágica) en pacientes con VM, aportación que ha permitido determinar con claridad que estas alteraciones son debidas propiamente a la enfermedad, no a la traqueostomía. Creemos que sería importante diseñar un estudio prospectivo para analizar las alteraciones de la deglución en pacientes con DMD antes de iniciar la VM. La disfagia puede ser uno de los factores determinantes a la hora de predecir el éxito de la VMNI en pacientes que precisarían de traqueostomía para la protección de la vía aérea.
De nuestra experiencia podemos concluir que en pacientes con DMD el soporte ventilatorio aporta importantes beneficios y que debe ofrecerse a todos con la finalidad de prolongar la vida. Un cuidadoso seguimiento, tanto clínico como funcional, desde edades tempranas es fundamental para evitar la insuficiencia respiratoria aguda y la traqueostomía. El adecuado seguimiento de la función cardíaca y de la deglución puede tener una influencia positiva en el pronóstico de la enfermedad. Por lo tanto, es necesaria una íntima conexión entre los centros pediátricos y de adultos a fin de conseguir el máximo cuidado de estos pacientes.
Correspondencia: Dra M.R. Güell.
Departament de Pneumologia.
Hospital de la Santa Creu i de Sant Pau.
Antoni M. Claret, 167. 08025 Barcelona. España.
Correo electrónico: mguellr@santpau.es
Recibido: 29-8-2006; aceptado para su publicación: 7-11-2006.