Introducción
La esclerosis lateral amiotrófica (ELA) es una enfermedad degenerativa de la motoneurona del adulto con un curso inexorablemente progresivo y una supervivencia media de la enfermedad de 3 años desde el momento del diagnóstico. Su tratamiento es paliativo, ya que no existe un tratamiento etiológico. En 1996 la Food and Drug Administration estadounidense aprobó la utilización de riluzol (Rilutek®), ya que en 2 ensayos clínicos multicéntricos1,2 este fármaco había producido una respuesta clínica modesta con incremento de la supervivencia media en aproximadamente 2 meses. Aunque algunos autores3,4 han manifestado dudas acerca del coste-eficacia del tratamiento, diversos países han aprobado su utilización para el tratamiento de la ELA.
El riluzol es un benzotiazol y, aunque su mecanismo de acción no se conoce por completo, se ha relacionado con la disminución de la acción excitadora que sobre las neuronas ejerce el aminoácido glutamato5. La tolerancia al fármaco suele ser buena y los ensayos clínicos pre y poscomercialización no han objetivado un incremento de los síntomas respiratorios que indiquen toxicidad pulmonar6,7. Sin embargo, recientemente Cassiman et al8 han relacionado el diagnóstico de neumonitis por hipersensibilidad con la toma de riluzol en un paciente con ELA.
Exponemos el caso de un varón de 74 años diagnosticado de ELA que, tras la administración de riluzol, desarrolló un cuadro clínico de tos no productiva con disnea de reposo e infiltrados pulmonares bilaterales en la radiografía de tórax, que desaparecieron tras la retirada del fármaco y la administración de metilprednisolona durante 6 días, sin que pudiéramos relacionarlos con otra etiología.
Observación clínica
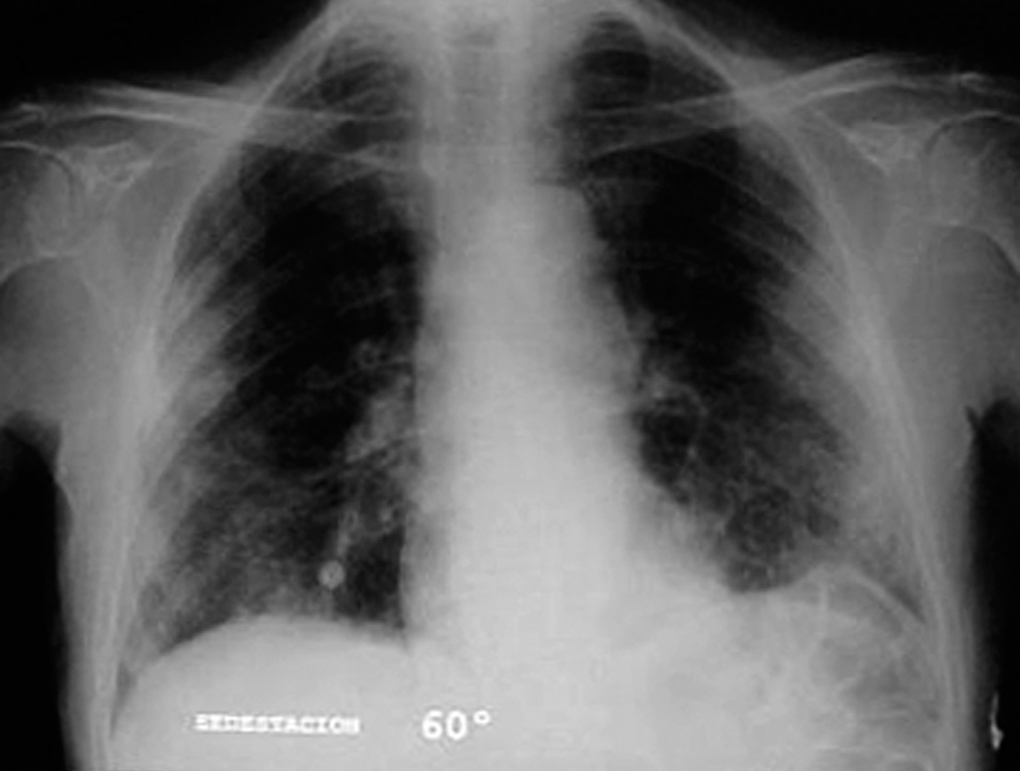
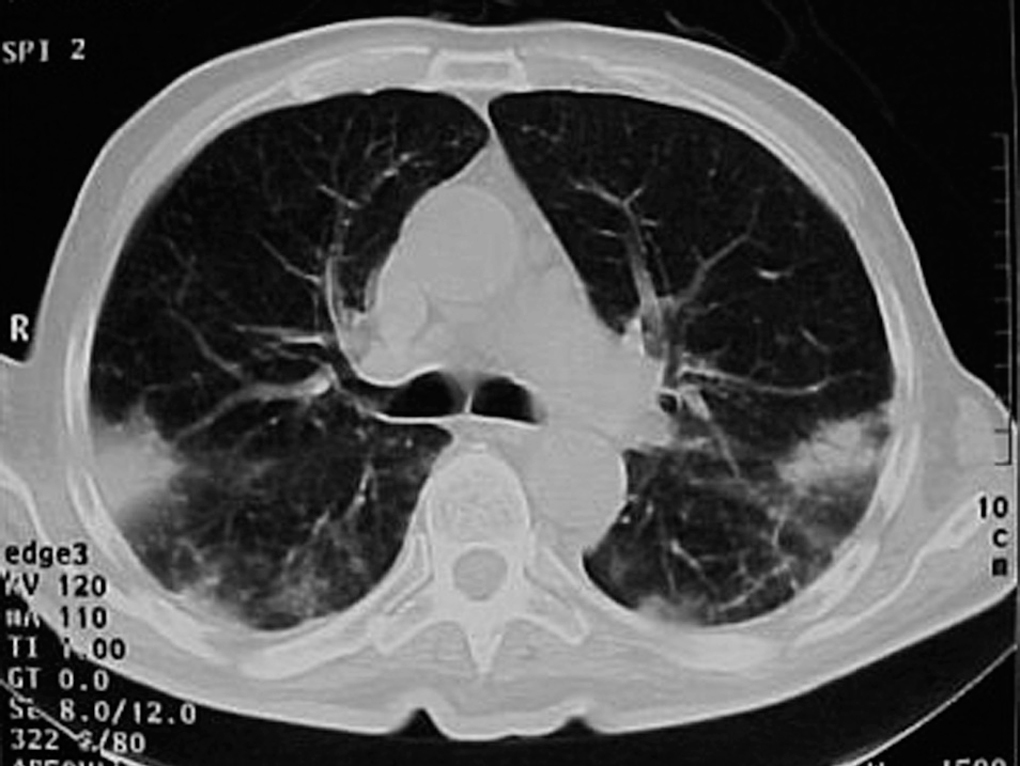
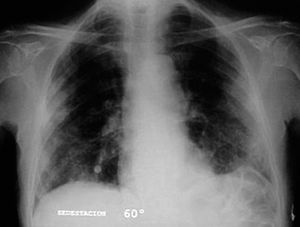
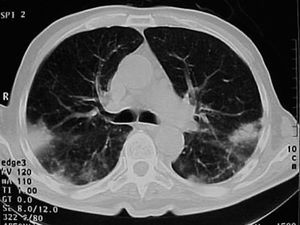
Varón de 74 años, ex fumador de 37 paquetes-año, sin alergias conocidas, diagnosticado de ELA hacía 10 meses y en tratamiento con Rilutek® (riluzol), a dosis de 50 mg/12 h, desde hacía 5 meses, que 45 días antes del ingreso en nuestro centro había iniciado un cuadro clínico consistente en tos no productiva. Inicialmente había recibido tratamiento con amoxicilina-ácido clavulánico a dosis de 875 mg-125 mg/8 h durante 18 días, hasta 5 días antes de su ingreso, con progresivo deterioro clínico consistente en incremento de la tos no productiva, disnea de reposo, astenia, sudación profusa, taquipnea, sin objetivar fiebre durante todo el período de evolución del proceso. En la exploración efectuada en el momento del ingreso hospitalario estaba afebril, con una presión arterial de 110/60 mmHg, frecuencia cardíaca de 94 lat/min y frecuencia respiratoria de 24 respiraciones/min. Se apreció una disminución de la amplitud de los movimientos respiratorios sin otros hallazgos de interés. La gasometría arterial con oxígeno en gafas a 2 l/min mostró los siguientes valores: pH de 7,46, presión arterial de oxígeno de 67 mmHg, presión arterial de anhídrido carbónico de 44 mmHg y HCO3 de 31 mEq/l. En la analítica, el hemograma presentó 6.200 leucocitos (un 68% neutrófilos y un 1% eosinófilos) y una velocidad de sedimentación globular de 74 mm en la primera hora. Existía elevación de las cifras de fibrinógeno (715 mg/dl), inmunoglobulina (Ig) G (1.960 mg/dl; IgG1: 1.310 mg/dl; IgG4: 280 mg/dl), IgA (498 mg/dl), IgE (299 KU/l) y proteína C reactiva (20 mg/l). El resto de las determinaciones analíticas, incluidos los parámetros hematológicos, glucemia, iones, parámetros de función renal, hepáticos, lactatodeshidrogenasa y sus isoenzimas, enzima de conversión de la angiotensina, IgM, anticuerpos antinucleares, anti-ADN, anticuerpos anticitoplasma de neutrófilo y marcadores tumorales séricos, estaban dentro de los valores considerados normales. La prueba de Mantoux, las serologías frente a gérmenes atípicos y virus respiratorios, así como las determinaciones en orina para Legionella pneumophila serotipo 1 y Streptococcus pneumoniae, fueron negativas. A pesar de estar afebril, durante su ingreso se extrajeron hemocultivos, sin que se aislara ningún germen. El paciente no expectoraba, por lo que no se pudieron obtener muestras para procesamiento bacteriológico. El electrocardiograma y un ecocardiograma no objetivaron anomalías. Las pruebas cutáneas a una batería de neumoalergenos habituales, entre ellos ácaros, pólenes de malezas, árboles, gramíneas, hongos y epitelios, fueran negativos. La radiografía y la tomografía computarizada de tórax mostraron infiltrados alveolointersticiales bilaterales (figs. 1 y 2).
Fig. 1. Infiltrados pulmonares bilaterales de predominio periférico.
Fig. 2. Infiltrados pulmonares alveolointersticiales bilaterales de predominio periférico.
Dada la ausencia de fiebre, leucocitosis y semiología de infección respiratoria, se sospechó que la afectación pulmonar podía ser secundaria al riluzol, único fármaco que recibía el paciente. Se retiró el medicamento y se inició tratamiento con 40 mg diarios de metilprednisolona durante 6 días, al cabo de los cuales se interrumpió. A las 72 h ya era manifiesta la disminución del grado de disnea, de la astenia y de los infiltrados, así como el incremento de la saturación de oxígeno. Al cabo de una semana los infiltrados habían desaparecido y la espirometría mostraba los siguientes valores: capacidad vital forzada (FVC) de 1,34 l (33%), volumen espiratorio forzado en el primer segundo (FEV1) de 1,32 l (47%) y FEV1/FVC del 99%. La saturación de oxígeno basal era del 95% y no había desaturación en el test de la marcha de los 6 min. Posteriormente, en el seguimiento realizado no reaparecieron los infiltrados y el paciente falleció al cabo de 8 meses debido a la ELA.
Discusión
Los fármacos son una causa frecuente de iatrogenia y originan una morbilidad y mortalidad considerables. En un estudio realizado en el Reino Unido9, el 6,5% de los ingresos hospitalarios se relacionaron con reacción a fármacos y el 2% de estos pacientes fallecieron, lo que suponía un 0,15% de todas las admisiones en el hospital. En las últimas 2 décadas se ha incrementado el número de publicaciones que hacen referencia a la toxicidad pulmonar por fármacos10-12.
El riluzol ejerce un efecto neuroprotector in vitro e in vivo disminuyendo el efecto excitador que ejerce el glutamato en las neuronas. Se ha relacionado con 3 posibles mecanismos: inhibición de la liberación del glutamato y/o de sus receptores, bloqueo de los canales de sodio dependientes de voltaje y reducción de la entrada de calcio en el interior de la neurona5. La dosis habitual es de 100 mg/día repartidos en 2 tomas, y es la que recibía nuestro paciente. Dosis superiores incrementan la toxicidad sin obtener una mejoría significativa2,13.
El fármaco suele tolerarse bien y como efectos secundarios más frecuentes se ha descrito la aparición de astenia y náuseas en el 15-20% de los pacientes, así como la elevación de las enzimas hepáticas (alaninaaminotransferasa) superior a 3 veces el valor basal en el 10-15% de los tratados, por lo que conviene monitorizarlas durante su administración3,4.
En el caso de la toxicidad pulmonar por fármacos, el diagnóstico de sospecha puede basarse en la correlación temporal entre la aparición de los síntomas y el inicio del tratamiento, así como en su desaparición tras la retirada del fármaco y la baja probabilidad de otras etiologías10,14. En nuestro paciente existió una relación temporal entre la administración del riluzol, la aparición de infiltrados pulmonares y el descenso de la presión arterial de oxígeno, que desaparecieron tras la retirada del fármaco. No se objetivaron otros hallazgos que apuntaran a otra enfermedad. Tampoco tomaba ningún otro fármaco que pudiera modificar el metabolismo hepático del riluzol, aunque Sanderink et al15 consideran improbable la interacción con otros fármacos como causa de toxicidad.
Dadas la situación clínica y la enfermedad de base del paciente, y de acuerdo con éste, se decidió instaurar tratamiento con corticoides, aunque su duración y dosis fueron menores a las establecidas en otros casos de toxicidad por fármacos8,15. Por el mismo motivo, se descartó inicialmente la toma de biopsias mediante fibrobroncoscopia o videotoracoscopia, y tampoco se administró de nuevo el fármaco, por lo que la relación de la toxicidad con el fármaco es de alta sospecha pero no puede considerarse definitiva. La clínica, los hallazgos radiológicos, el incremento de Ig y la respuesta a la retirada del fármaco apuntan a una reacción por hipersensibilidad. En la búsqueda realizada en MEDLINE, Embase y la web específica de toxicidad pulmonar por fármacos (Pneumotox12) sólo se ha hallado la descripción realizada por Cassiman et al8 de un paciente con un cuadro clínico y radiológico y evolución similares a los aquí descrito y con hallazgos histológicos de neumonitis por hipersensibilidad.
Las reacciones por hipersensibilidad forman parte de las reacciones idiosincrásicas o tipo B. A diferencia de las reacciones farmacológicas más frecuentes o tipo A (80-90%), en las que el efecto depende de la dosis, las reacciones de tipo B suelen ser eventos raros o excepcionales (10-20%), que no pueden preverse a pesar de conocer la farmacología del medicamento16. En la actualidad se han publicado diversos trabajos en que se ha utilizado el riluzol como antidepresivo y en determinadas discinesias, por lo que en un futuro es posible que se incremente el número de pacientes en tratamiento con este fármaco.
En conclusión, la aparición de infiltrados pulmonares en pacientes tratados con riluzol, sin datos clínicos o hallazgos en las pruebas complementarias que señalen otro diagnóstico, debería hacernos pensar en una posible toxicidad pulmonar. La resolución del cuadro clínico tras la interrupción de su administración con o sin la administración de corticoides orienta el diagnóstico.
Correspondencia: Dr. L. Borderías-Clau.
Sección de Neumología. Hospital San Jorge.
Avda. Martínez de Velasco, 36. 22004 Huesca. España.
Correo electrónico: lborderias@separ.es
Recibido: 29-3-2005; aceptado para su publicación: 19-4-2005.