Los músculos respiratorios de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) presentan lesiones estructurales, que coexisten con signos de adaptación. Nuestra hipótesis es que esto sólo puede explicarse si se produce simultáneamente la activación de sus células satélite. El propósito del presente trabajo ha sido valorar el número y la eventual activación de dichas células, así como la expresión de marcadores de microlesión estructural, ligados a la regeneración.
Pacientes y métodosSe incluyó en el estudio a 8 pacientes con EPOC grave —media±desviación estándar del volumen espiratorio forzado en el primer segundo: un 33±9% del valor de referencia— y a 7 controles, a quienes se realizó una biopsia del músculo intercostal externo. La muestra se analizó mediante microscopia óptica (fenotipo fibrilar), electrónica (células satélite) y técnica de reacción en cadena de la polimerasa en tiempo real (marcadores de microlesión: factor de crecimiento similar a la insulina de tipo 1, factor de crecimiento mecánico e isoformas de cadenas pesadas de miosina [MyHC] embrionaria e isoformas de perinatal; de presencia y activación de células satélite: Pax-7 y m-caderina, respectivamente; y condicionantes del fenotipo fibrilar: MyHC-I, IIa y IIx).
ResultadosLos pacientes tuvieron unas fibras mayores que los sujetos sanos (54±6 frente a 42±4 μm2; p<0,01), con una población de células satélite conservada o ligeramente incrementada (cuantificación ultraestructural: 4,3±1% frente al 3,7±3,5%, p no significativa; Pax-7: 5,5±4,1 frente a 1,6±0,8, unidades arbitrarias (ua), respectivamente, p<0,05) y una mayor activación (m-caderina: 3,8±2,1 frente a 1,0±1,2 ua; p=0,05). Esto se asociaba a valores aumentados de marcadores de microlesión (factor de crecimiento similar a la insulina de tipo 1: 0,35±0,34 frente a 0,09±0,08 ua, p<0,05; factor de crecimiento mecánico: 0,45±0,55 frente a 0,13±0,17 ua, p=0,05).
ConclusionesLos músculos intercostales de pacientes con EPOC grave muestran signos indirectos de microlesión, acompañados de la activación de sus células satélite. Esto apunta a la presencia de ciclos continuados de lesión y reparación, lo que podría explicar parcialmente la conservación de sus propiedades estructurales.
The respiratory muscles of patients with chronic obstructive pulmonary disease (COPD) display evidence of structural damage in parallel with signs of adaptation. We hypothesized that this can only be explained by the simultaneous activation of satellite cells. The aim of this study was to analyze the number and activation of those cells along with the expression of markers of microstructural damage that are frequently associated with regeneration.
Patients and methodsThe study included 8 patients with severe COPD (mean [SD] forced expiratory volume in 1 second, 33% [9%] of predicted) and 7 control subjects in whom biopsies were performed of the external intercostal muscle. The samples were analyzed by light microscopy to assess muscle fiber phenotype, electron microscopy to identify satellite cells, and real-time polymerase chain reaction to analyze the expression of the following markers: insulin-like growth factor 1, mechano growth factor, and embryonic and perinatal myosin heavy chains (MHC) as markers of microstructural damage; Pax-7 and m-cadherin as markers of the presence and activation of satellite cells, respectively; and MHC-I, IIa, and IIx as determinants of muscle fiber phenotype.
ResultsThe patients had larger fibers than healthy subjects (54 [6] vs 42 [4] μm2; P<.01) with a similar or slightly increased proportion of satellite cells, as measured by ultrastructural analysis (4.3% [1%] vs 3.7% [3.5%]; P>.05) or expression of Pax-7 (5.5 [4.1] vs 1.6 [0.8] arbitrary units [AU]; P<.05). In addition, there was greater activation of satellite cells in the patients, a indicated by increased expression of m-cadherin (3.8 [2.1] vs 1.0 [1.2] AU; P=.05). This was associated with increased expression of markers of microstructural damage: insulin-like growth factor 1, 0.35 (0.34) vs 0.09 (0.08) AU (P<.05); mechano growth factor, 0.45 (0.55) vs 0.13 (0.17) AU (P=.05).
ConclusionsThe intercostal muscles of patients with severe COPD show indirect signs of microstructural damage accompanied by satellite cell activation. This suggests the presence of ongoing cycles of lesion and repair that could partially explain the maintenance of the structural properties of the muscle.
Aunque la enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza fundamentalmente por la afectación del parénquima pulmonar y las vías aéreas, en los últimos años se viene concediendo cada más importancia a sus aspectos sistémicos1, 2. Entre éstos destaca la disfunción muscular esquelética, que ocasiona importantes síntomas y condiciona el pronóstico1-3. Sin embargo, los diferentes músculos esqueléticos de los pacientes con EPOC presentan cambios fenotípicos que no son homogéneos4. Así, los músculos respiratorios muestran cambios que favorecen la actividad aeróbica5, mientras que los músculos de las extremidades sufren un proceso inverso6. A pesar de todo, algunos fenómenos parecen comunes a los diversos grupos musculares. Es el caso del estrés oxidativo7, 8 y del daño muscular9, 10.
Se conoce como daño muscular la lesión estructural provocada por una determinada noxa11, 12. En circunstancias normales, tras el daño se ponen en marcha los mecanismos de reparación y regeneración musculares13. El elemento celular fundamental de estos últimos fenómenos es la célula satélite, que se activa para fusionarse con las fibras musculares, a las que ceden su núcleo11. Dependiendo de variables ligadas al estímulo y a la integridad de los propios mecanismos reparativos, estos procesos pueden dar lugar a un músculo similar al original, o modificado (remodelación). En este sentido, modelos animales de enfermedad pulmonar inflamatoria han permitido observar que los músculos de las extremidades presentan una disminución en su capacidad regenerativa14, lo que podría explicar el fenotipo involutivo que se observa en los pacientes con EPOC. Nuestra hipótesis es que los músculos respiratorios de dichos pacientes, por el contrario, mantienen preservada su capacidad regenerativa, lo que facilita su adaptación fenotípica. Así pues, el obJetivo principal del presente trabaJo ha sido analizar el comportamiento de las células satélite en el músculo intercostal externo de pacientes con EPOC grave. Como objetivos secundarios, quisimos valorar el comportamiento de diversos marcadores moleculares de microlesión y reparación, así como su relación con las células satélite y el fenotipo final del músculo.
Pacientes y métodosPacientesSe incluyó en el estudio a 8 pacientes con EPOC grave —volumen espiratorio forzado en el primer segundo (FEV1)/FVC < 70% y FEV1 < 50% de los valores de referencia—1 en fase estable (sin cambios en la semiología y/o la medicación en los 3 meses precedentes), reclutados de forma consecutiva en el dispensario de nuestro centro. Se consideraron criterios de exclusión la ingesta de alcohol (> 100g/día) o el consumo de drogas, la presencia de enfermedad neoplásica, endocrina, psiquiátrica u ortopédica grave, así como la asociación de enfermedad muscular o neurológica. También se excluyó a las personas con dificultades de colaboración y a aquéllos con tratamientos que pudieran afectar a la estructura y/o función musculares. Se incluyó asimismo un grupo control formado por 7 voluntarios sanos (reclutados entre la población general de forma sincrónica a los pacientes general), que participaban simultáneamente en un estudio paralelo. Tan sólo se incluyó a varones en ambos grupos, para evitar posibles interferencias vinculadas al sexo. Se informó del objetivo del estudio a todos los participantes, que dieron su consentimiento por escrito. El estudio fue aprobado por el Comité de Ética de nuestra institución.
MétodosValoración nutricional y de la función respiratoria. Para la valoración nutricional se determinaron parámetros biológicos y antropométricos. Por otro lado, se efectuó a todos los pacientes una evaluación convencional de la función respiratoria, que incluyó espirometría forzada (espirómetro Datospir 500, SIBEL, Barcelona, España), determinación de volúmenes pulmonares estáticos y resistencia de la vía aérea (equipo Masterlab, Jaeger, Würzburg, Alemania), así como de la capacidad de transferencia del monóxido de carbono (medidor de gases incorporado al citado Masterlab). En todos los casos se emplearon los valores de referencia para población mediterránea15-17. Por último, se determinaron los gases respiratorios en sangre arterial (analizador Rapidlab 860, Bayer, Chiron Diagnostics, GMBH, Tuttlingen, Alemania).
Valoración de la función muscular. Se realizó mediante la determinación de las presiones estáticas máximas en boca, según el método estándar previamente publicado18, empleando valores de referencia para población mediterránea19. Además se realizó el estudio de la resistencia de los músculos inspiratorios según el método ya descrito por nuestro grupo18. Por último, se obtuvo la fuerza prensil de la mano no dominante utilizando la maniobra clásica con un dinamómetro específico (Biopac Systems, Goleta, CA, EE.UU,) conectado a un polígrafo digital (Biopac Systems). Se tomó el valor máximo de 3 maniobras consecutivas válidas y reproducibles.
Obtención de las biopsias musculares y procesamiento de las muestras. Las muestras del músculo intercostal externo se obtuvieron del quinto espacio intercostal, permutando aleatoriamente el costado, según la técnica descrita por nuestro grupo18. Las muestras musculares se dividieron en diversas porciones inmediatamente después de su extracción. Un fragmento se fijó en formaldehído y se incluyó en parafina; fue el que se utilizó para las técnicas inmunohistoquímicas de tipificación fibrilar, según el procedimiento habitual de nuestro laboratorio18. La segunda porción muscular se procesó de forma estándar para el análisis ultraestructural, según procedimiento ya publicado9. Los criterios de identificación de las células satélite por microscopia electrónica fueron: a) separación entre la célula y la fibra muscular adyacente por una membrana plasmática; b) existencia de una lámina basal continua entre las células satélite y la fibra muscular, y c) núcleo de apariencia heterocromática20. Los resultados se han expresado como porcentaje de células satélite sobre el total de núcleos de fibras musculares en un área determinada21.
La tercera porción se colocó inmediatamente en un criovial, se congeló en nitrógeno líquido y se conservó a −70°C hasta su procesamiento para la identificación de transcriptomas -ARN mensajero (ARNm)- clave en la detección de microlesión celular y en los procesos de reparación y fenotipo fibrilares. Se utilizó la técnica de reacción en cadena de la polimerasa en tiempo real, según procedimiento ya publicado22, y se analizaron los transcriptomas correspondientes a las isoformas adultas (I, IIa y IIx, todas ellas directamente involucradas en el fenotipo fibrilar) y no adultas (perinatal y embrionaria, indicadoras de estrés/microlesión celular) de las cadenas pesadas de miosina (MyHC), así como a marcadores de células satélite (Pax-7 y m-caderina, correspondientes, respectivamente, a población y activación celular) y factores de crecimiento mecánico y similar a la insulina de tipo 1, (MGF y IGF-1, respectivamente, también indicativos de estrés/microlesión fibrilar e inicio de regeneración muscular).
Análisis estadísticoLas variables cuantitativas se presentan como media ± desviación estándar. Dado que la prueba de Kolmogorov-Smirnov mostró una distribución no normal en las diferentes variables analizadas, la comparación intergrupos se realizó con la prueba no paramétrica de la U de Mann–Whitney, y los análisis de correlación entre las diferentes variables cuantitativas, con el coeficiente de Spearman. En todos los casos la significación estadística se definió por un error alfa (p) ≤ 0,05.
ResultadosDatos generales, antropométricos y funcionalesEn la tabla I se muestran las principales características generales, antropométricas, nutricionales y funcionales de las 2 poblaciones estudiadas. Los pacientes con EPOC grave presentaban variables analíticas nutricionales y una masa corporal conservadas, con la alteración ventilatoria obstructiva inherente a su inclusión en el estudio, atrapamiento aéreo, reducción de la transferencia de monóxido de carbono e hipoxemia. La fuerza de sus músculos respiratorios y periféricos se hallaba ligeramente disminuida. También la resistencia de los músculos inspiratorios fue menor en los pacientes con EPOC correlacionándose con el valor del FEV1 (r = 0,700; p < 0,05).
Características generales, antropométricas, nutricionales y funcionales de la población estudiada
| EPOC grave | Controles | p | |
| Población (n) | 8 | 7 | − |
| Edad media (años) | 67 ±6 | 69 ± 6 | NS |
| Índice tabáquico (paquetes/año) | 62 ±22 | - | - |
| IMC (kg/m2) | 26,4 ± 4,5 | 25,9 ± 2,7 | NS |
| Albúmina sérica (g/dl) | 4,3 ± 0,5 | 4,7 ± 0,4 | NS |
| Colesterol sérico (mg/dl) | 179 ± 23 | 191 ± 13 | NS |
| FEV1 (% ref.) | 33 ± 9 | 96 ±17 | b |
| FEV1/FVC (%) | 45 ± 9 | 74 ± 3 | b |
| RV (% ref.) | 189 ±36 | 104 ± 15 | b |
| %RV/TLC | 67 ± 5 | 42 ± 3 | b |
| DLCO (% ref.) | 68 ± 26 | 98 ±16 | a |
| PaO2 (mmHg) | 67 ± 2 | - | - |
| PaCO2 (mmHg) | 47,5 ± 2,8 | - | - |
| PIM (cmH2O) | −76 ± 18 | −95 ± 17 | a |
| PIM (% ref.) | 73 ± 17 | 93 ± 16 | a |
| PEM (cmH2O) | 112 ±45 | 142 ± 30 | NS |
| PEM (% ref.) | 61 ± 20 | 82 ±18 | a |
| PI-thmáx (cmH2O) | −44 ±11 | −56 ± 15 | NS |
| TIlim80% (min) | 11,7 ±6,3 | 15,9 ±6,1 | a |
| HG (kg) | 18,6 ±7,7 | 26,8 ± 6,3 | a |
Valores expresados como media ± desviación estándar. DLCO: factor de transferencia para el monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HG: fuerza de prensión de la mano; IMC: índice de masa corporal; NS: no significativo; PaCO2: presión parcial de anhídrido carbónico en sangre arterial; PaO2: presión parcial de oxígeno en sangre arterial; PEM: presión espiratoria estática máxima; PIM: presión inspiratoria estática máxima; PI-thmáx: presión inspiratoria máxima tolerada en la prueba incremental; RV: volumen residual; TIlim80%: tiempo límite de resistencia inspiratoria en la prueba de carga constante (80% de la máxima); TLC: capacidad pulmonar total.
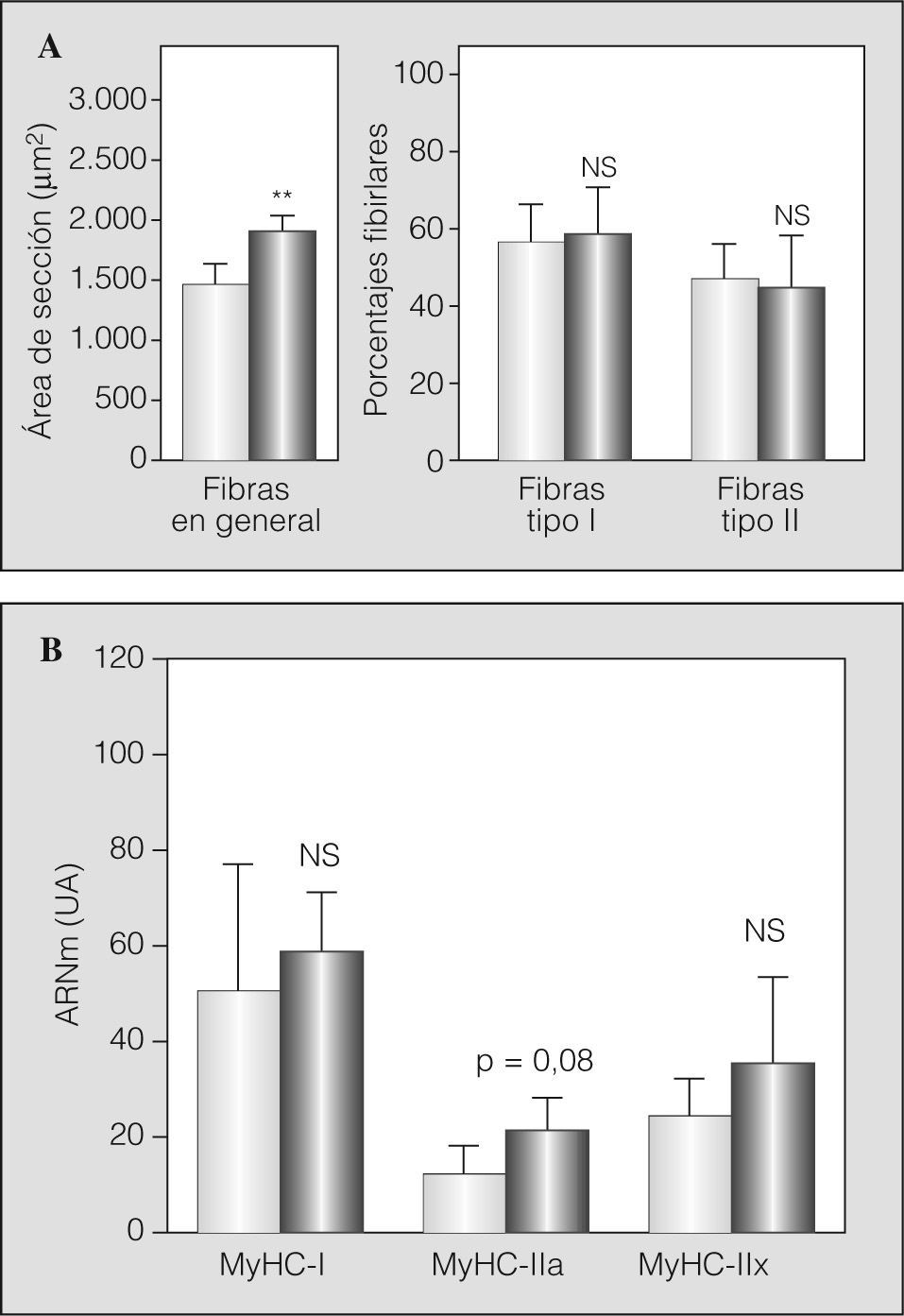
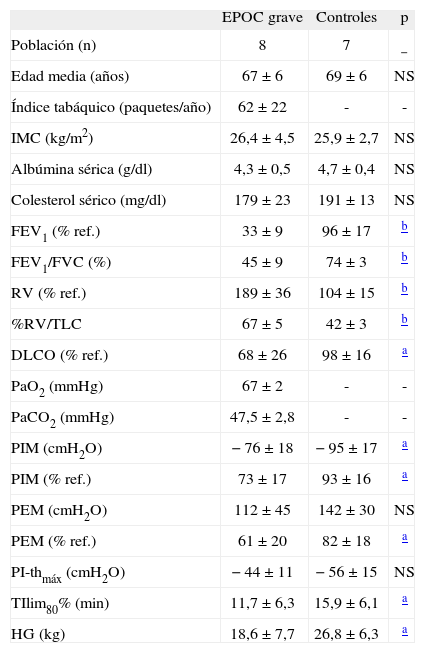
En la figura 1 se muestran las características de las fibras del músculo intercostal externo. En los pacientes con EPOC grave las fibras eran hasta un 24% mayores que las de los controles sanos. Los porcentajes de fibras eran similares en pacientes y controles, con predominio de las de tipo I en ambos casos (fig. 1a). El análisis de los transcriptomas condicionantes del fenotipo fibrilar mostró una tendencia marcada a la sobreexpresión del correspondiente a la MyHC-IIa en los pacientes con EPOC, sin cambios en los ARNm de las restantes isoformas adultas (fig. 1b).
Fenotipo fibrilar en el músculo intercostal externo de controles sanos (barras claras) y pacientes con EPOC grave (barras oscuras): A) tamaño global de las fibras (área de sección transversal) y porcentajes de los tipos fibrilares I y II, y B) expresión en el ARN mensajero (ARNm) de las isoformas adultas humanas (I, IIa y IIx) de las cadenas pesadas de miosina (MyHC). NS: no significativo; UA: unidades arbitrarias. **p < 0,01.
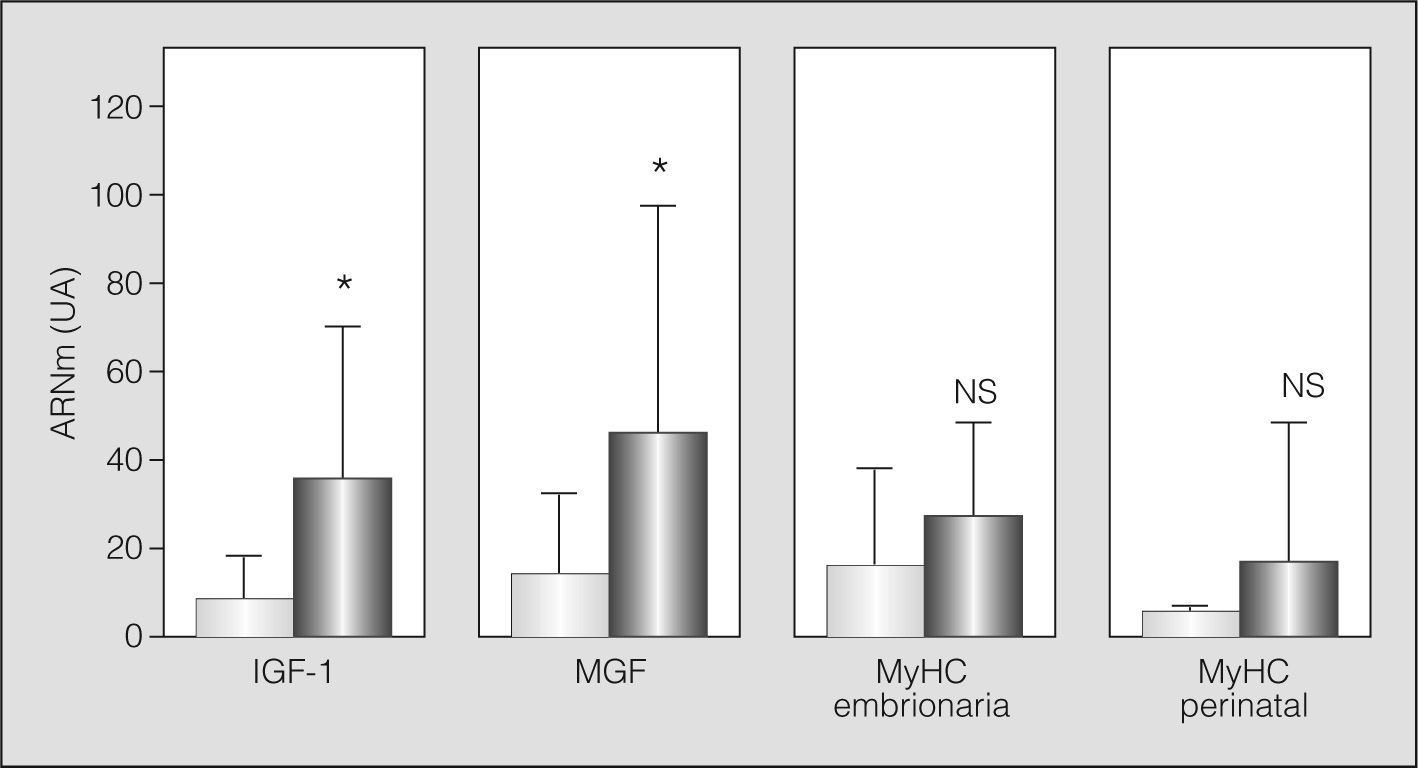
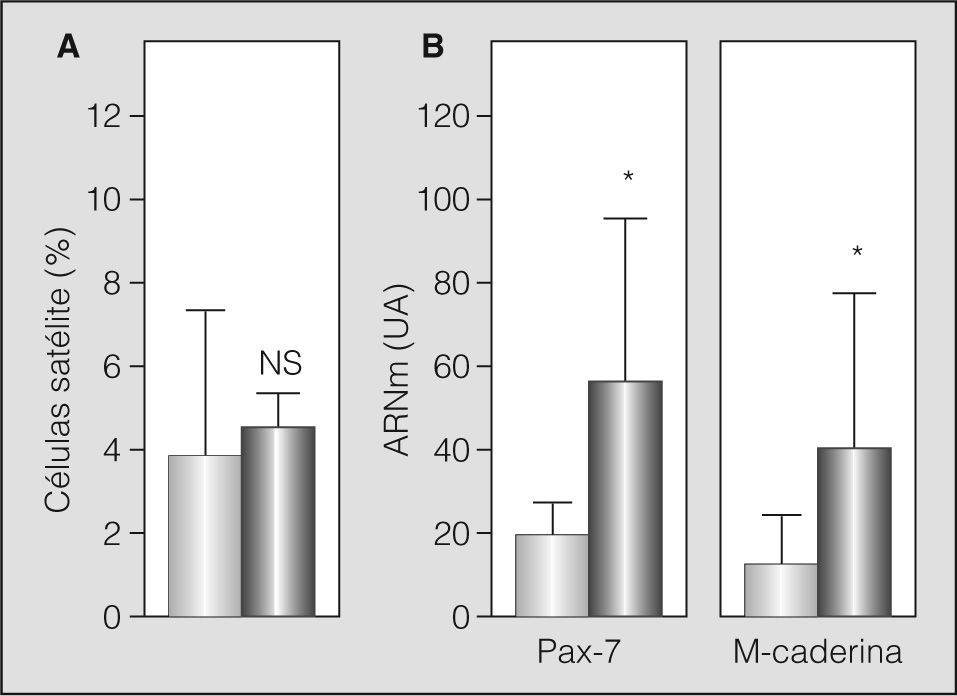
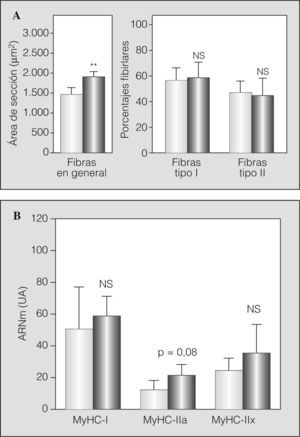
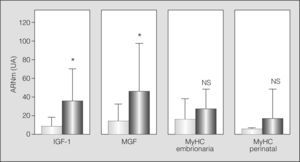
Algunos de los transcriptomas indicativos de estrés/microlesión muscular (MGF e IGF-1) mostraron la probable presencia de este fenómeno al hallarse aumentados. Otros marcadores evidenciaron una tendencia similar, aunque no alcanzaron la significación estadística (MyHC embrionaria y perinatal) (fig. 2). De forma coherente, la población de células satélite se hallaba conservada (análisis ultraestructural) o ligeramente aumentada (expresión de Pax-7) en los pacientes con EPOC grave, con aumento del marcador de actividad (m-caderina) (figs. 3a y 3b).
Expresión en transcriptoma de diferentes marcadores de microlesión/estrés celular e inicio del proceso regenerativo: factor de crecimiento similar a la insulina de tipo 1 (iGF-1), factor de crecimiento mecánico (MGF) e isoformas no adultas de las cadenas pesadas de miosina (MyHC embionaria y fetal). Nuevamente las barras claras representan a los sujetos sanos, y las barras oscuras, a los pacientes con EPOC. NS: no significativo; UA: unidades arbitrarias. *p < 0,05.
Datos correspondientes a las células satélite: A) resultados del análisis con microscopia electrónica, expresado como porcentaje de células satélite sobre el total de núcleos identificables en el músculo, y B) expresión en transcriptoma de los marcadores de población (Pax-7) y activación (m-caderina) de las células satélite. NS: no significativo; UA: unidades arbitrarias. *p < 0,05.
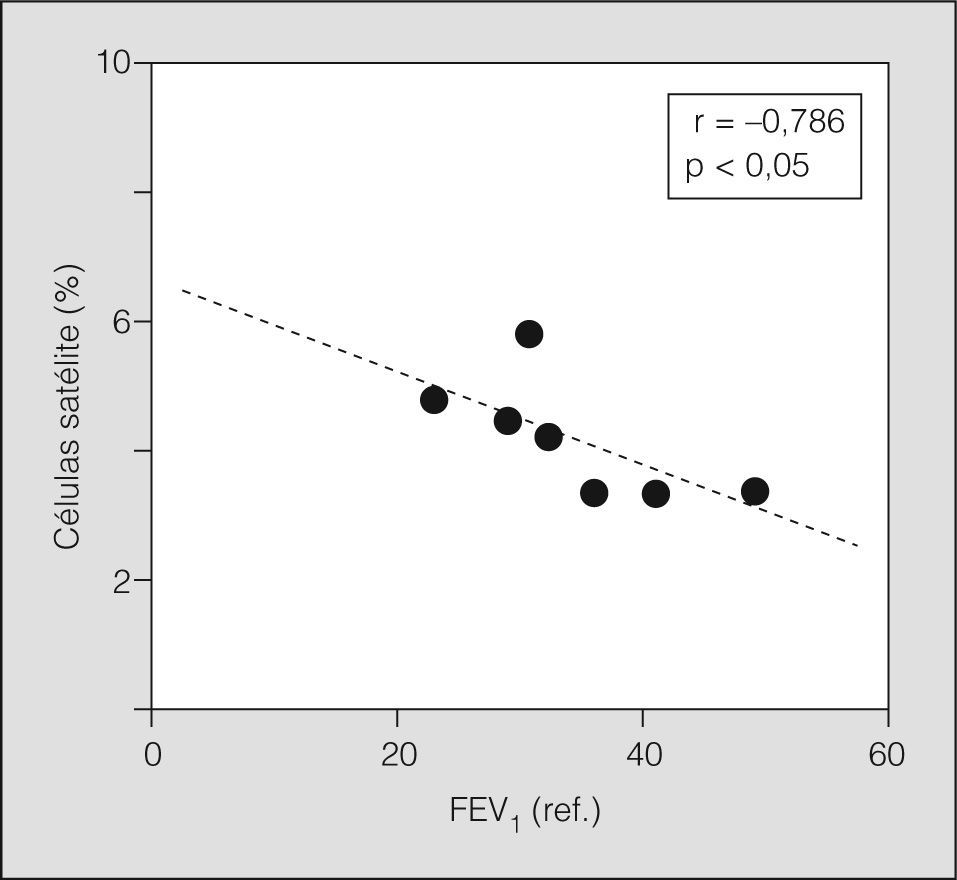
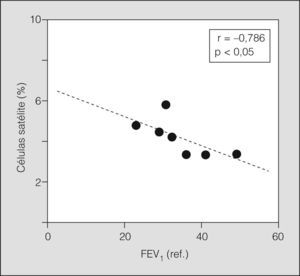
Algunos de los marcadores de microlesión estructural mostraron una relación directa con el grado de afectación funcional en los pacientes con EPOC. Así, los transcriptomas de IGF-1 y MGF se correlacionaron o mostraron una notable tendencia a correlacionar con el volumen residual (r = 0,943 y r = 0,921, respectivamente; p < 0,01 en ambos casos) y el FEV1 (r = −0,771, p = 0,07; r = −0,724, p = 0,08, respectivamente). Por otra parte, la población de células satélite, representada por las variables obtenidas en el análisis ultraestructural, mostró también una relación significativa con la función pulmonar (fig. 4). Finalmente, el índice de masa corporal tuvo una correlación inversa con los marcadores de microlesión y una tendencia directa con los de reparación (con el ARNm de IGF-1, r = −0,943; con el ARNm de MGF, r = −0,921; p < 0,01 en ambos; con el ARNm de m-caderina; r = 0,714; p = 0,09).
DiscusiónEn el presente trabajo se ha observado que los músculos intercostales de los pacientes con EPOC grave muestran hallazgos indicativos de microlesión celular, junto con una activación de sus células satélite, cuyo número se halla conservado o incluso ligeramente aumentado. Estos fenómenos parecen relacionados con el grado de afectación funcional de los pacientes y podrían explicar la presencia de un fenotipo fibrilar que no evidencia signos involutivos.
Los músculos respiratorios de los pacientes con EPOC muestran un grado incrementado de lesión estructural. Éste parece debido, al menos en parte, al sobreesfuerzo ventilatorio9, 22, aunque también podrían estar implicados otros factores, como el estrés oxidativo y la inflamación local7, 22. Sin embargo, los músculos respiratorios presentan simultáneamente un fenotipo modificado, que facilitaría su acción ventilatoria5, 19. Modelos animales parecen demostrar que ambos fenómenos, el daño y la remodelación, se hallan directamente ligados a través de mecanismos de reparación muscular13, 23, 24. Las células satélite son un elemento esencial en dicho proceso, aunque hasta la fecha no tenemos noticia de que se haya evaluado en pacientes con EPOC ni en modelos animales de la enfermedad.
En el presente trabajo se ha demostrado, por una parte, el aumento de marcadores moleculares que apuntan fuertemente a la presencia de microlesión estructural en los músculos intercostales de los pacientes. El uso de dichos marcadores permite detectar fenómenos más sutiles que pueden pasar inadvertidos con las técnicas morfométricas convencionales. Así, tanto los transcriptomas de las isoformas no adultas de las MyHC como los de determinados factores de crecimiento se expresan en situaciones de estrés muscular extremo y microlesiones13, 25, 26. Nuestros hallazgos muestran también que la expresión de algunas de estas moléculas se relaciona con el grado de afectación funcional respiratoria. Todo ello concuerda con trabajos precedentes que utilizando técnicas complementarias han podido demostrar daño estructural en el músculo intercostal de pacientes con EPOC22. Por otra parte, el IGF-1 y su variante genética, el MGF, también intervienen directamente en los estadios iniciales de la regeneración muscular estimulando la diferenciación y proliferación de las propias células satélite27.
Este trabajo muestra asimismo que la población de células satélite está conservada o ligeramente aumentada (dependiendo de la variable analizada) en el intercostal de los pacientes con EPOC, con un grado de activación significativamente superior al de los sujetos sanos. Las células satélite se localizan entre la membrana basal y el sarcolema de las miofibras28, 29, y son responsables del crecimiento, la reparación y el mantenimiento del músculo esquelético29. Su población permanece relativamente estable durante la vida adulta30, debido a su capacidad para autorrenovarse29, 30. Con el envejecimiento, sin embargo, su porcentaje disminuye, lo que se reflejará en la menor capacidad de regeneración del músculo del anciano31. Cuando se produce una lesión, las células satélite se activan, pasando a proliferar, diferenciarse y fusionarse con las fibras musculares. La inmensa mayoría de las células satélite se halla activada a las 24h de producirse una lesión20, aunque este período activo es relativamente corto (unas 120h)32. Esto último dificulta su detección, salvo en condiciones experimentales o cuando el estímulo sea continuado (como probablemente sea el caso de nuestros pacientes). El hecho de que el grado de deterioro de la función pulmonar se haya asociado a la densidad de células satélite en nuestro estudio indica un papel modulador para la sobrecarga mecánica.
Aunque sólo disponemos de una observación transversal, el resultado final del proceso de microlesión y reparación que se evidencia en el presente estudio parece haber sido el apropiado, ya que los intercostales de los pacientes muestran un fenotipo fibrilar conservado. Trabajos precedentes, realizados con series más amplias, han demostrado ocasionalmente un incremento de la proporción de fibras de tipo II (sobre todo IIa)33, lo que podría estar relacionado con la sobreexpresión del gen homónimo evidenciado en el presente estudio. La activación de este gen podría responder a las demandas puntuales y de alta intensidad sobre el músculo (esfuerzo, agudizaciones), que simularían un entrenamiento de tipo anaeróbico33.
Sin embargo, desde el punto de vista funcional la conservación del fenotipo muscular coexiste con la alteración de la fuerza y resistencia de los músculos inspiratorios. Probablemente esto se halle más en relación con factores de tipo mecánico (como parece indicar la relación entre función muscular respiratoria y función pulmonar) o sistémico (como apunta también la coexistencia de disfunción en los músculos espiratorios y de la mano).
Otra asociación interesante revelada en el presente trabajo es la observada entre la masa corporal y los marcadores de microlesión y reparación en los pacientes con EPOC. Esta asociación invita a pensar que estos fenómenos celulares pudieran estar en la base de la cantidad de masa muscular de un paciente. Esta hipótesis debería analizarse en futuros trabajos.
El interés clínico de este estudio radica en sus eventuales implicaciones en el tratamiento rehabilitador. Aunque los músculos intercostales parecen lesionarse con facilidad, si mantienen su capacidad reparadora en los pacientes con EPOC es posible plantear la realización de ejercicios ventilatorios de alta intensidad para mejorar su fenotipo. Ahora sería necesario disponer de datos sobre el proceso de regeneración en los músculos de las extremidades, cuyo fenotipo presenta rasgos involutivos y cuya respuesta ante ejercicios de alta intensidad es controvertida.
El principal músculo respiratorio en sujetos sanos es el diafragma. Sin embargo, la obtención de muestras válidas se halla limitada por el escaso número de candidatos y por la presencia sistemática en ellos de comorbilidad relevante. La opción escogida en el presente trabajo, el intercostal externo, nos parece válida por diferentes razones. En primer lugar, permite seleccionar a los sujetos del estudio excluyendo cualquier comorbilidad relevante. En segundo lugar, el intercostal externo de los pacientes con EPOC muestra actividad ventilatoria incluso en reposo34, además de ser un músculo que participa progresivamente en el esfuerzo ventilatorio al incrementarse las cargas del sistema34, 35. Por tanto, este músculo expresaría no sólo el efecto de la actividad ventilatoria basal de los pacientes con EPOC, sino que además, como ya se ha dicho, podría reflejar los incrementos puntuales de dicha actividad.
En el presente trabajo se decidió complementar la evaluación morfométrica clásica28 con marcadores moleculares expresados específicamente por las células satélite, no por los mionúcleos o las propias fibras musculares. Así, el gen de Pax-7, un factor regulador de la miogenia, cuya activación es necesaria para la formación de células satélite, es un buen marcador de esta población celular36. Además, diferencia las células satélite de las denominadas "células madre pluripotenciales", que no lo expresan36. Por su parte, la m-caderina es una molécula de adhesión, cuya expresión aumenta en las células satélite activadas, por lo que se considera un buen marcador de este fenómeno36.
En conclusión, el presente trabajo demuestra que el músculo intercostal de los pacientes con EPOC grave mantiene una población estable de células satélite, cuya actividad se halla incrementada. Probablemente dicha activación y la expresión paralela de marcadores de regeneración respondan a la presencia de microlesión muscular. Dado que todo ello se acompaña de un fenotipo fibrilar conservado, nuestros resultados apuntan al éxito del proceso reparador en el músculo intercostal de estos pacientes.
Trabajo cofinanciado parcialmente por ayudas de la Unión Europea (V Programa Marco, ref. QLRT-2000-00417), el Ministerio de Ciencia y Tecnología (Plan Nacional I+D, ref. SAF 2001-0426), el Ministerio de Sanidad (Red RESPIRA, ref. RTIC C03/11, FIS, ISCiii), la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y la Generalitat de Cataluña (2005SGR01060).
J. Martínez-Llorens ha contado con ayudas institucionales de la SEPAR, la Societat Catalana de Pneumologia (SOCAP) y el Instituto Municipal de Investigación Médica (IMIM, Becas para Residentes, 2002 y 2003).