El objetivo de este estudio fue validar y comparar 2 escalas pronósticas, la escala española y la escala Pulmonary Embolism Severity Index simplificada (PESIs), en una cohorte de pacientes diagnosticados de tromboembolia de pulmón (TEP) aguda sintomática.
MétodosSe realizó un análisis retrospectivo de una cohorte de 1.447 pacientes diagnosticados consecutivamente de TEP aguda sintomática. Evaluamos el valor predictivo de las 2 escalas para muerte a 30días y para un episodio compuesto de recurrencia tromboembólica no mortal y hemorragia mayor no mortal mediante el estadísticoC, empleando para su cálculo regresión logística y curvas ROC.
ResultadosDurante los primeros 30días de seguimiento fallecieron 138pacientes (9,5%). Las 2escalas mostraron un valor predictivo bueno para mortalidad a 30días (estadísticoC, 0,72 y 0,74) y pobre para la predicción del episodio secundario (estadísticosC, 0,60 y 0,59). La escala PESIs clasificó una proporción significativamente menor de pacientes como de bajo riesgo, comparada con la escala española (32% versus 62%; p<0,001). La mortalidad del grupo de bajo riesgo según la escala PESIs fue menor que la de la escala española (1,1% versus 4,2%). La proporción de episodios no mortales fue similar en el grupo de bajo riesgo de ambos modelos (2,2% versus 2,3%).
ConclusionesLa escala española y la escala PESIs presentaron excelente capacidad discriminatoria para la mortalidad a 30días. La escala PESIs fue más segura para identificar a los pacientes con TEP y bajo riesgo de complicaciones precoces.
The aim of this study was to compare the predictive value of two clinical prognostic models, the Spanish score and the simplified Pulmonary Embolism Severity Index (sPESI), in an independent cohort of patients diagnosed of acute symptomatic pulmonary embolism (PE).
MethodsWe performed a retrospective analysis of a cohort composed of 1447patients with acute symptomatic PE. The Spanish score and the sPESI were calculated for each patient according to different clinical variables. We assessed the predictive accuracy of these scores for 30-day mortality, and a composite of non fatal recurrent venous thromboembolism and non fatal major bleeding, using Cstatistic, which was obtained by means of logistic regression and ROC curves.
ResultsOverall, 138 patients died (9.5%) during the first month of follow-up. Both scores showed an excellent predictive value for 30-day all-cause mortality (Cstatistic, 0.72 and 0.74), but the performance was poor for the secondary endpoint (Cstatistic, 0.60 and 0.59). The sPESI classified fewer patients as low risk (32% versus 62%; P<.001). Low-risk patients based on the sPESI had a lower 30-day mortality than those based on the Spanish score (1.1% versus 4.2%), while the 30-day rate of non fatal recurrent VTE or major bleeding was similar (2.2% versus 2.3%).
ConclusionsBoth scores provide excellent information to stratify the risk of mortality in patients treated of PE. The usefulness of these models for nonfatal adverse events is questionable. The sPESI identified low-risk patients with PE better than the Spanish score.
La tromboembolia de pulmón (TEP) constituye una enfermedad con un espectro amplio de manifestaciones clínicas, con diferente pronóstico y tratamiento1. La estratificación pronóstica de los pacientes con TEP resulta fundamental para: a)la elección del mejor tratamiento; los pacientes con mayor riesgo de complicaciones secundarias a la propia TEP se podrían beneficiar de tratamientos específicos para la recanalización de las arterias obstruidas, y b)el lugar de tratamiento (domiciliario para los pacientes de muy bajo riesgo y unidades de cuidados intensivos para los pacientes de mayor riesgo).
En los últimos años se han validado distintas herramientas pronósticas para pacientes con TEP aguda sintomática, que incluyen escalas clínicas, pruebas de imagen y marcadores biológicos2. Entre ellas, los modelos pronósticos se han mostrado especialmente útiles para la identificación de pacientes de bajo riesgo en los que se podrían considerar estancias hospitalarias abreviadas o incluso el tratamiento ambulatorio de su enfermedad.
Uresandi et al.3 derivaron una escala clínica pronóstica (escala española) en 681pacientes ambulatorios consecutivos con diagnóstico de TEP incluidos en un estudio prospectivo multicéntrico. La escala incluye las siguientes variables: hemorragia grave reciente, cáncer metastásico, cáncer no metastásico, valores de creatinina sérica >2mg/dl, inmovilización por enfermedad médica reciente, ausencia de cirugía en los últimos 2meses y edad >60años. La escala clasificó un 47,8% de los pacientes como de bajo riesgo. El área bajo la curva de eficacia pronóstica de la escala fue de 0,75 (intervalo confianza [IC] del 95%, 0,67 a 0,83). Esta escala no ha sido validada en una cohorte independiente de pacientes.
Aujesky et al.4 derivaron un modelo pronóstico clínico (Pulmonary Embolism Severity Index [PESI]) en 10.354 pacientes ingresados con el diagnóstico de TEP en 186hospitales de Pensilvania. El modelo incluye 11parámetros clínicos en el momento de la presentación de los síntomas: edad, sexo, cáncer, insuficiencia cardiaca, enfermedad pulmonar crónica, frecuencia cardiaca ≥110/min, presión arterial sistólica <100mmHg, frecuencia respiratoria ≥30/min, temperatura <36°C, estado mental alterado y saturación de oxígeno <90%. En la serie original, el 2% de los pacientes pertenecientes a las clases i y ii (muy bajo y bajo riesgo) murieron, comparado con el 14% de las clases iii-v (intermedio a muy alto riesgo) en los 30días posteriores al diagnóstico de la TEP. Jiménez et al.5 derivaron y validaron una simplificación de la escala PESI (PESIs). En una cohorte de 995pacientes, los autores encontraron 6variables que se asociaron de forma independiente a la mortalidad a 30días: edad, cáncer, enfermedad cardiopulmonar crónica, taquicardia (frecuencia cardiaca ≥110/min), hipoxemia (saturación de oxígeno <90%) e hipotensión (presión arterial sistólica <100mmHg). La presencia de cualquiera de estas variables incluye a los pacientes en el grupo de alto riesgo. Esta escala fue validada por los mismos autores en una cohorte de 7.106 pacientes con TEP del registro RIETE. La escala clasificó al 36,1% de los pacientes como de bajo riesgo y la mortalidad a 30 días fue de 1,1% (IC95%, 0,7 a 1,5%).
El objetivo de este estudio fue validar la escala española y compararla con la escala PESIs en una cohorte independiente de pacientes diagnosticados de TEP aguda sintomática.
MétodoDiseñoSe ha realizado un estudio observacional en el que se validaron 2escalas clínicas y se comparó su eficacia pronóstica en una cohorte de pacientes estables e inestables con TEP aguda sintomática.
Pacientes y criterios de selecciónSe incluyeron en el estudio todos los pacientes diagnosticados consecutivamente de TEP aguda sintomática en el Servicio de Urgencias del Hospital Ramón y Cajal (Madrid, España) entre enero de 2003 y diciembre de 2011. El diagnóstico de TEP se confirmó mediante el hallazgo en la angio-tomografía computarizada (TC) de un defecto intraluminal parcial rodeado de contraste o una oclusión completa de una arteria pulmonar en 2cortes consecutivos de TC6. El diagnóstico de TEP mediante gammagrafía de ventilación/perfusión se realizó en los casos de alta probabilidad definidos según criterios PIOPED7 (al menos un defecto de perfusión segmentario o 2subsegmentarios con ventilación normal), o en los casos con sospecha clínica de TEP, gammagrafía no concluyente y ecografía de miembros inferiores diagnóstica que mostrase un defecto de compresibilidad de la luz venosa como signo de trombosis venosa profunda (TVP)8.
IntervencionesLos pacientes fueron tratados con heparina de bajo peso molecular (HBPM) a dosis ajustadas al peso del paciente cada 12h durante un mínimo de 5días. Se inició la administración de antagonistas de la vitaminaK junto con la HBPM entre el primer y el tercer día de tratamiento y la HBPM fue interrumpida cuando el INR era estable y superior a 2,0. La monitorización de los niveles de INR se realizó de acuerdo con las prácticas locales del centro.
El tratamiento de recanalización (trombolíticos, fragmentación o embolectomía) se empleó en los pacientes inestables hemodinámicamente a criterio del médico responsable. De forma general, la fragmentación mecánica y la embolectomía se reservaron para los pacientes inestables con contraindicación para la trombólisis. Se insertó un filtro de vena cava a los pacientes con contraindicación para la anticoagulación (sangrado activo o alto riesgo de sangrado).
Escalas pronósticasLas escalas de riesgo española y PESIs se calcularon a partir de las características clínicas de los pacientes recogidas en el momento de diagnóstico de la TEP en el servicio de urgencias. Este cálculo fue retrospectivo para los pacientes diagnosticados antes de la publicación de dichas escalas, y prospectivo a partir de ese momento. Para cada una de las variables se asignó la puntuación establecida en cada una de las escalas. La puntuación total de cada uno de los pacientes se calculó sumando las puntuaciones obtenidas para cada una de las variables pronósticas incluidas en la escala (tabla 1).
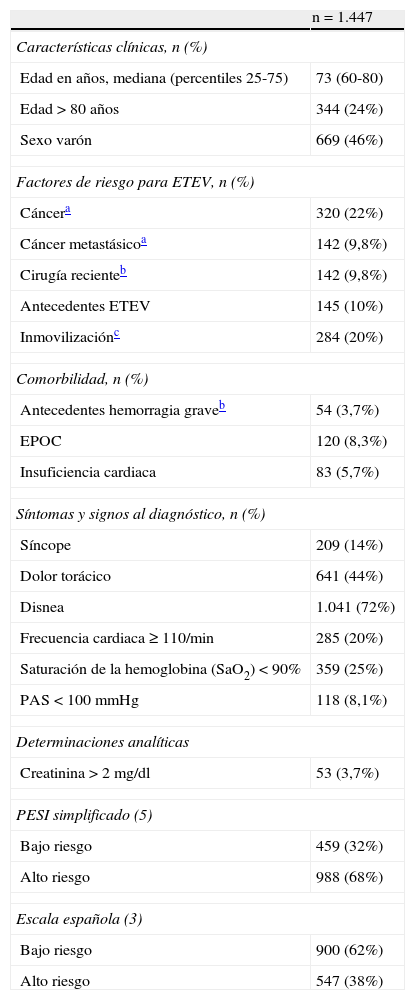
Características basales de los pacientes del estudio
| n=1.447 | |
| Características clínicas, n (%) | |
| Edad en años, mediana (percentiles 25-75) | 73 (60-80) |
| Edad >80años | 344 (24%) |
| Sexo varón | 669 (46%) |
| Factores de riesgo para ETEV, n (%) | |
| Cáncera | 320 (22%) |
| Cáncer metastásicoa | 142 (9,8%) |
| Cirugía recienteb | 142 (9,8%) |
| Antecedentes ETEV | 145 (10%) |
| Inmovilizaciónc | 284 (20%) |
| Comorbilidad, n (%) | |
| Antecedentes hemorragia graveb | 54 (3,7%) |
| EPOC | 120 (8,3%) |
| Insuficiencia cardiaca | 83 (5,7%) |
| Síntomas y signos al diagnóstico, n (%) | |
| Síncope | 209 (14%) |
| Dolor torácico | 641 (44%) |
| Disnea | 1.041 (72%) |
| Frecuencia cardiaca≥110/min | 285 (20%) |
| Saturación de la hemoglobina (SaO2)<90% | 359 (25%) |
| PAS <100mmHg | 118 (8,1%) |
| Determinaciones analíticas | |
| Creatinina >2mg/dl | 53 (3,7%) |
| PESI simplificado (5) | |
| Bajo riesgo | 459 (32%) |
| Alto riesgo | 988 (68%) |
| Escala española (3) | |
| Bajo riesgo | 900 (62%) |
| Alto riesgo | 547 (38%) |
EPOC: enfermedad pulmonar obstructiva crónica; ETEV: enfermedad tromboembólica venosa; PAS: presión arterial sistólica; PESI: Pulmonary Embolism Severity Index.
Definimos como parámetro de valoración principal la mortalidad por todas las causas en el mes posterior al diagnóstico. Los parámetros secundarios fueron las recurrencias tromboembólicas no mortales objetivamente confirmadas y los sangrados mayores no mortales en el mes posterior al diagnóstico.
Los criterios diagnósticos de recurrencia trombótica no mortal fueron la presencia de un nuevo defecto intraluminal en el angio-TC6, o un nuevo defecto de ventilación/perfusión en la gammagrafía pulmonar; un nuevo segmento venoso no compresible, o el aumento del diámetro del trombo de al menos 4mm en la ecografía de miembros inferiores9.
Se definieron los sangrados mayores no mortales como los que requirieron transfusión de al menos 2concentrados de hematíes, que requirieron cirugía, o las hemorragias de localización cerebral, retroperitoneal y articular10.
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar y se compararon con el test de la t de Student para datos emparejados y no emparejados. Las variables categóricas se representan como porcentajes y se comparan con el test de chi cuadrado, o con el test exacto de Fisher en caso necesario.
La ocurrencia de los episodios clínicos para cada clase de riesgo se estimó mediante la incidencia acumulada (definida como el cociente entre número de episodios y el total de pacientes en riesgo) durante el período de seguimiento. Se estimaron los límites exactos del intervalo de confianza (IC) del 95%. La calibración de los modelos de riesgo fue valorada mediante la prueba de bondad de ajuste de Hosmer-Lemeshow. Dicha prueba determina cuánto se acerca la incidencia predicha de episodios a la incidencia observada de episodios a lo largo de una gama de puntuaciones. Un resultado significativo de dicho test indica falta de ajuste del modelo11.
Valoramos la capacidad discriminatoria de los modelos de riesgo para cada uno de los episodios clínicos mediante el estadísticoC. En general, un modelo con un estadísticoC >0,70 posee una aceptable capacidad discriminatoria12. Para el cálculo del estadísticoC empleamos modelos de regresión logística, introduciendo cada uno de los episodios clínicos como variable dependiente y cada uno de las escalas como variable independiente cuantitativa continua13, para estimar así la probabilidad predicha del episodio en cuestión. A continuación enfrentamos en una curva receiver operating characteristic (ROC) dicha probabilidad con la ocurrencia del episodio, para obtener así el área bajo la curva o estadísticoC, con su correspondiente IC95%14. Los estadísticosC de los 2modelos de riesgo fueron comparados entre sí mediante un test no paramétrico desarrollado por DeLong et al.15. Se calcularon la sensibilidad, la especificidad, los valores predictivos y los cocientes de probabilidad para cada escala.
Para el análisis estadístico, empleamos el programa SPSS (versión 19.0, SPSS Inc., Chicago, Illinois, EE.UU.). Para la comparación de las áreas bajo la curva ROC de los modelos para los episodios clínicos, empleamos el programa MedCalc (versión 11.6.1, MedCalc Software, Mariakerke, Bélgica). Se consideró como resultado estadísticamente significativo un valor bilateral de p<0,05.
ResultadosDurante el período de estudio se evaluaron 7.109 pacientes con sospecha de TEP aguda sintomática, y el diagnóstico se confirmó en 1.564 (22%). De ellos, 19 (1,2%) rechazaron firmar el consentimiento informado, y 98 (6,3%) fueron perdidos durante el seguimiento, por lo que la muestra final fue de 1.447 pacientes. Aproximadamente el 60% de los pacientes (856/1.447) fueron diagnosticados mediante angio-TC de tórax, 659 (45%) mediante gammagrafía ventilación/perfusión de alta probabilidad, y 73 (5%) tuvieron pruebas torácicas negativas y TVP confirmada mediante ecografía de miembros inferiores. Algunos pacientes tuvieron varias pruebas diagnósticas positivas simultáneamente.
Las características de los pacientes incluidos en el estudio se muestran en tabla 1. El número de pacientes tratados con filtros de vena cava inferior fue pequeño (1,8%; 28 de 1.447 pacientes). El 4% (64 de 1.447 pacientes) fue tratado con trombolíticos. De los 1.447 pacientes, 138 (9,5%; IC95%, 8,0-11,1) fallecieron durante los primeros 30días de seguimiento. Sesenta y dos pacientes (45%) fallecieron por la propia TEP, 7 (5,1%) por hemorragia y 69 (50%) por otras causas. El episodio secundario se produjo en 47pacientes; 11pacientes presentaron una recurrencia trombótica objetivamente confirmada, 38pacientes sufrieron una hemorragia mayor no mortal, y 2pacientes sangraron y recurrieron simultáneamente.
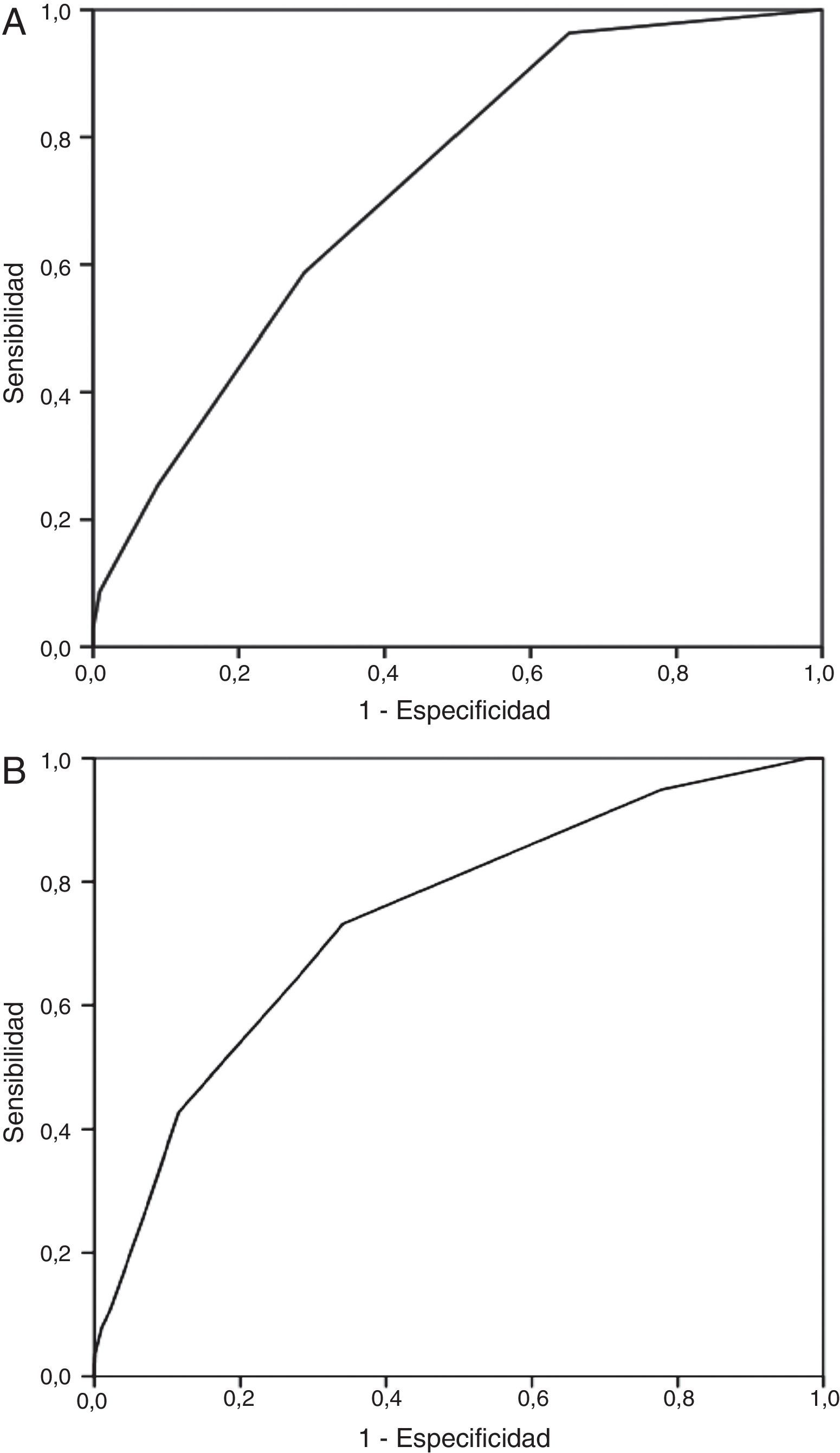
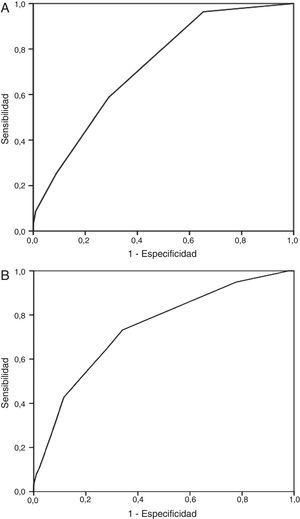
La discriminación de la escala española y de la escala PESIs para la mortalidad a 30días fue de 0,74 (IC95%, 0,70-0,78) y de 0,72 (IC95%, 0,68-0,76), respectivamente (fig. 1). La figura 1 muestra el área bajo la curva obtenida mediante las curvas ROC para la mortalidad a 30días con cada uno de los modelos de riesgo. En cambio, la capacidad discriminativa de los 2modelos de riesgo para la predicción del episodio secundario fue inferior, dado que los estadísticosC fueron inferiores a 0,60. La figura 1 muestra los resultados de la prueba de bondad de ajuste de Hosmer-Lemeshow, que evalúa la calibración de la escala española y de la escala PESIs para la predicción del riesgo de muerte.
Curvas ROC con la mortalidad a 30días para cada uno de los modelos del estudio. A)Escala PESIs.Área bajo la curva (AUC) (estadísticoC): 0,72; IC95%, 0,68-0,76; p<0,001; test de Hosmer-Lemeshow, 8,30; p=0,09. B)Escala española. AUC (estadísticoC): 0,74; IC95%, 0,70-0,78; p<0,001; test de Hosmer-Lemeshow, 4,02; p=0,40.
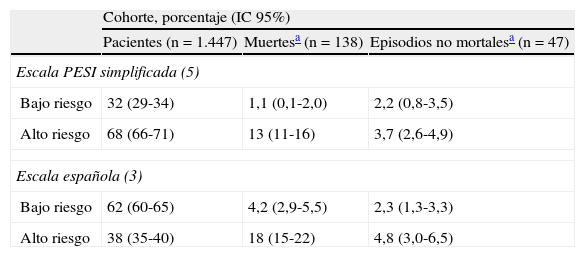
La escala PESIs clasificó una proporción significativamente menor de pacientes como de bajo riesgo (32% [459/1.447], IC95%, 29-34%) cuando se comparó con la escala española (62% [900/1.447], IC95%, 60-65%) (p<0,001) (tabla 2). Comparado con el grupo de bajo riesgo de la escala española, la mortalidad del grupo de bajo riesgo según la escala PESIs fue menor (4,2% [38/900] vs 1,1% [5/459) (tabla 2). El grupo de pacientes de alto riesgo según la escala PESIs tuvo una mortalidad algo menor que el grupo de pacientes de alto riesgo según la escala española (13,5% [133/987] vs 18,3% [100/546]). La proporción de episodios no fatales fue similar en el grupo de bajo riesgo de ambos modelos (2,2% [10/459] vs 2,3% [21/900]).
Distribución de mortalidad y episodios adversos no mortales
| Cohorte, porcentaje (IC 95%) | |||
| Pacientes (n=1.447) | Muertesa (n=138) | Episodios no mortalesa (n=47) | |
| Escala PESI simplificada (5) | |||
| Bajo riesgo | 32 (29-34) | 1,1 (0,1-2,0) | 2,2 (0,8-3,5) |
| Alto riesgo | 68 (66-71) | 13 (11-16) | 3,7 (2,6-4,9) |
| Escala española (3) | |||
| Bajo riesgo | 62 (60-65) | 4,2 (2,9-5,5) | 2,3 (1,3-3,3) |
| Alto riesgo | 38 (35-40) | 18 (15-22) | 4,8 (3,0-6,5) |
IC: intervalo de confianza; PESI: Pulmonary Embolism Severity Index.
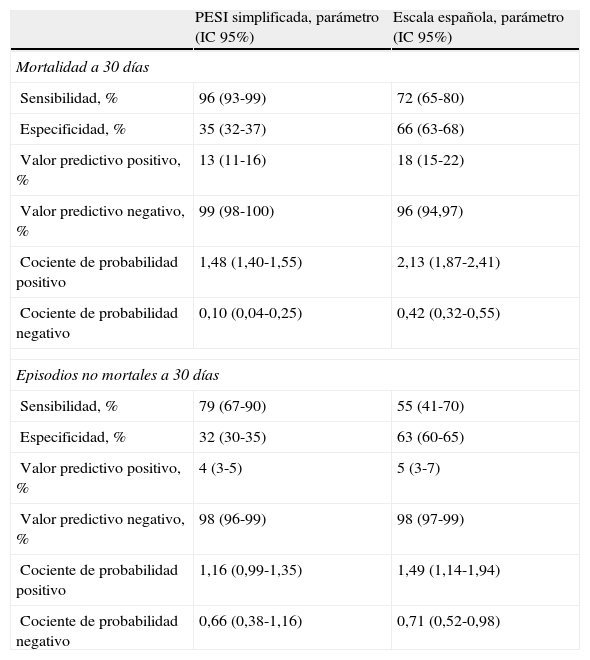
Para la predicción de la mortalidad a 30días, la sensibilidad, el valor predictivo negativo y el cociente de probabilidad negativo fueron mejores para el modelo PESIs que para la escala española (tabla 3). Cuando se consideraron los episodios no mortales a 30días, el valor predictivo negativo para la escala PESIs fue del 97,8%, comparado con el 97,7% para la escala española (tabla 3).
Índices de calidad de la escala PESI simplificada y de la escala española para la predicción de mortalidad y episodios no mortales a 30 días
| PESI simplificada, parámetro (IC 95%) | Escala española, parámetro (IC 95%) | |
| Mortalidad a 30 días | ||
| Sensibilidad, % | 96 (93-99) | 72 (65-80) |
| Especificidad, % | 35 (32-37) | 66 (63-68) |
| Valor predictivo positivo, % | 13 (11-16) | 18 (15-22) |
| Valor predictivo negativo, % | 99 (98-100) | 96 (94,97) |
| Cociente de probabilidad positivo | 1,48 (1,40-1,55) | 2,13 (1,87-2,41) |
| Cociente de probabilidad negativo | 0,10 (0,04-0,25) | 0,42 (0,32-0,55) |
| Episodios no mortales a 30 días | ||
| Sensibilidad, % | 79 (67-90) | 55 (41-70) |
| Especificidad, % | 32 (30-35) | 63 (60-65) |
| Valor predictivo positivo, % | 4 (3-5) | 5 (3-7) |
| Valor predictivo negativo, % | 98 (96-99) | 98 (97-99) |
| Cociente de probabilidad positivo | 1,16 (0,99-1,35) | 1,49 (1,14-1,94) |
| Cociente de probabilidad negativo | 0,66 (0,38-1,16) | 0,71 (0,52-0,98) |
IC, intervalo de confianza; PESI: Pulmonary Embolism Severity Index.
El presente estudio compara la capacidad de la escala española y de la escala PESIs para predecir el riesgo de acontecimientos tras un episodio de TEP aguda sintomática. En nuestra serie, las 2escalas presentaron una capacidad discriminatoria similar para la mortalidad a 30días. Sin embargo, la escala PESIs fue más segura para identificar a los pacientes con TEP y bajo riesgo de complicaciones precoces.
La estratificación del riesgo de episodios clínicos es un aspecto fundamental en el manejo de los pacientes con TEP aguda sintomática. Los modelos pronósticos clínicos se desarrollaron para identificar a pacientes con TEP y bajo riesgo de complicaciones, que podrían beneficiarse de estancias hospitalarias abreviadas o incluso del tratamiento ambulatorio de su enfermedad16,17. Aunque la escala española fue utilizada en un ensayo clínico para el tratamiento ambulatorio de la TEP de bajo riesgo16, nunca había sido validada ni comparada directamente con la escala PESIs.
Nuestros resultados indican que, si bien el funcionamiento general de los 2modelos es similar, la escala PESIs es significativamente mejor que la escala española para la zona de alta sensibilidad. De hecho, el valor predictivo negativo y el cociente de probabilidad negativo son significativamente mejores para la escala PESIs. Cuando se trata de predecir mortalidad interesa un modelo sensible, puesto que un falso negativo tiene un coste muy alto; esto confiere ventaja a la escala PESIs. Esta diferencia entre los 2modelos de riesgo parece explicarse por diferencias en las variables que los componen. A diferencia del modelo español, la escala PESIs incluye la presión arterial, la saturación de la hemoglobina por el O2 y la frecuencia cardiaca, variables que se han asociado de forma constante con la supervivencia en la TEP aguda18–20.
En nuestra serie, la utilidad de las 2escalas para la predicción del riesgo de episodios adversos no fatales fue inferior. Las razones que podrían explicar este escaso poder predictivo podrían ser varias. La más importante es que estos modelos predictivos fueron concebidos para predecir mortalidad, y no resulta sorprendente que su capacidad para predecir otros acontecimientos sea inferior. En cualquier caso, el valor predictivo negativo de ambas escalas para la predicción de episodios adversos no mortales sigue siendo alto, por lo que no dejan de ser herramientas excelentes para la identificación de pacientes subsidiarios de alta precoz o tratamiento ambulatorio.
A la hora de comparar modelos predictivos, se debe establecer un equilibrio entre su capacidad discriminativa y su simplicidad en términos de aplicabilidad clínica. La escala PESIs consta de 6variables con un sistema de puntuación sencillo (la presencia de cualquiera de las variables identifica al paciente de alto riesgo). Sin embargo, la escala española consta de 7variables; una de ellas es una variable de laboratorio (creatinina sérica), y el sistema de asignación de puntuación es más complejo.
Este estudio tiene algunas limitaciones. En primer lugar, se trata de un análisis de una cohorte histórica compuesta por pacientes de un único centro, y está sujeto a los sesgos inherentes a este tipo de estudios. Sin embargo, representa una población no seleccionada de pacientes con TEP de nuestro medio de práctica clínica habitual, por lo que supone una muestra ideal para comprobar la validez externa de los modelos de riesgo analizados. En segundo lugar, la principal limitación de los modelos de riesgo radica en que no se han desarrollado para realizar predicciones individuales, sino grupales. Aunque su capacidad de discriminación sea elevada, nunca será perfecta. Por este motivo, su uso para un paciente en concreto solo tiene una utilidad orientativa, pues permite anticipar un riesgo determinado pero no predecir inequívocamente el resultado clínico final21.
En conclusión, nuestros resultados muestran que la escala PESIs es más segura que la escala española para identificar a pacientes con TEP y bajo riesgo de complicaciones precoces. Se requieren estudios bien diseñados para conocer si las escalas clínicas son herramientas útiles para identificar a pacientes de bajo riesgo con TEP que puedan ser tratados de forma ambulatoria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.