Evaluar la validez diagnóstica de la punciónaspiración con aguja fina (PAAF) percutánea en lesiones mediastínicas considerando la biopsia o el seguimiento clínico como patrón de referencia.
Pacientes y métodosSe realizó PAAF percutánea guiada por TC a 131 pacientes con lesiones mediastínicas. Se usó un TC helicoidal con cortes de 3–10mm y baja dosis de radiación (40mAs, 120kV). Las muestras fueron examinadas in situ por un citólogo para determinar su validez. Se obtuvo comprobación histológica mediante biopsia o estudio de pieza quirúrgica en 73 pacientes y seguimiento clínico en 50, comparándose los resultados globales y en subgrupos.
ResultadosEn 126 pacientes (96,2%) el material fue válido para diagnóstico. Ciento tres lesiones (78,6%) fueron consideradas malignas (62 tumores primarios y 41 metástasis) y 23 (17,6%) benignas. En los 123 pacientes de los que se dispuso de seguimiento clínico o patológico, la PAAF permitió identificar malignidad con una sensibilidad del 95,2% (IC95%: 89,2–97,9%), especificidad 84,2% (IC95%: 62,4–94,5%), valor predictivo positivo 97,1% (IC95%: 91,7–99,0%), valor predictivo negativo 76,2% (IC95%: 54,9–89,4%), razón de verosimilitud positiva 6,03 (IC95%: 2,13–17,05) y exactitud 93,5% (IC95%: 87,7–96,7%). La complicación más frecuente fue el neumotórax (3 casos). La correlación citohistológica fue elevada tanto en las lesiones malignas (kappa 0,641) como en las benignas (kappa 0,607).
ConclusionesLa PAAF percutánea guiada por TC es una técnica segura y eficaz para el diagnóstico de masas mediastínicas con alta rentabilidad para la detección de malignidad.
To evaluate the diagnostic accuracy of the percutaneous fine needle aspiration cytology (FNAC) for mediastinal lesions by using histology or follow-up clinical diagnosis as gold standard.
Patients and MethodsCT-guided percutaneous FNAC was performed on 131 patients with mediastinal lesions. Helical CT was used with 3–10mm image thickness range and low radiation dose (40mAs, 120kV). Samples were immediately examined by a cytologist to determine if they were representative. Histological samples were obtained by means of biopsy or resection specimens in 73 patients and clinical follow-up in 50.
ResultsThe material was satisfactory for diagnosis in 126 patients (95.2 %), in whom 103 lesions (78.6%) were considered malignant (62 primary tumours and 41 metastases) and 23 (17.6%) benign. In the 123 patients with clinical monitoring or pathological diagnosis, using FNAC led to the identification of malignancy with a sensitivity of 95.2 % (95%CI: 89.2–97.9%), specificity 84.2% (95%CI: 62.4–94.5%), positive predictive value 97.1% (95%-CI: 91.7–99.0%), negative predictive value 76.2% (95%CI: 54.9–89.4%), likelihood-ratio positive 6.03 (95%CI: 2.13–17.05) and accuracy 93.5% (95%CI: 87.7–96.7%). Pneumothorax was the most frequent complication (3 cases). There was good agreement between the cytological findings and the histological findings, not only for malignant lesions (kappa coefficient: 0.641) but also for benign (kappa 0.607).
ConclusionsCT-guided percutaneous FNAC is a safe and effective technique for the diagnosis of the mediastinal masses, with a high diagnostic yield for malignancy depicting.
El mediastino es un amplio espacio torácico que contiene numerosos órganos por lo que en él se pueden dar una gran variedad histológica de lesiones. Acceder al mediastino es difícil y entraña un riesgo considerable pues la iatrogenia sobre los grandes vasos, el corazón y la vía aérea principal son potencialmente letales. Sin embargo, actualmente se utilizan técnicas de imagen como guía para las punciones de lesiones mediastínicas, independientemente del calibre de la aguja utilizada, lo que minimiza el riesgo de complicaciones, reduce el número de técnicas más invasivas y permite alcanzar la máxima rentabilidad diagnóstica1–11. Desde el comienzo de la utilización de los rayos X para guiar las PAAF mediastínicas por Rosenberger y Adler12 en 1978, se ha evolucionado desde el uso de la fluoroscopia convencional al de la TC para punciones transtorácicas7–18 y al empleo de la ecografía para PAAF y biopsias vía percutánea6,19 y endoscópica1,2,20,21. Antes de la utilización de las técnicas de imagen para la obtención de muestras de lesiones mediastínicas, se realizaban procedimientos mucho más cruentos con mayor porcentaje de complicaciones y mayor coste como la mediastinotomía anterior, la toracotomía, la toracoscopia y la mediastinoscopia12,13. Posteriormente, se introdujeron técnicas de agresividad intermedia como la minimediastinotomía14 y por último, las punciones transtorácicas (transesternales15,16 y transpleurales6–14,17–19) y endoscópicas (transbronquiales3–5 y transesofágicas9–11,17,18,22,23). Esta evolución en la aproximación a las lesiones, unida al continuo avance y perfeccionamiento de las técnicas de citología, han hecho posible llegar a un diagnóstico definitivo en la mayoría de los casos, pasando del empleo de agujas gruesas a agujas cada vez más finas que permiten la obtención de muestras suficientes mediante procedimientos mínimamente invasivos.
La existencia de tal variedad de técnicas y material para el diagnóstico de lesiones mediastínicas y la generalización del empleo de técnicas de imagen como guía en las punciones, nos ha llevado a plantear este estudio que tiene por objetivo estimar la validez diagnóstica de la PAAF percutánea guiada por TC para la detección de lesiones malignas en el mediastino. También se pretende analizar la sensibilidad y especificidad de la prueba en los diferentes subgrupos de pacientes y la concordancia citohistológica de las lesiones mediastínicas.
Pacientes y métodosFueron consecutivamente incluidos en el estudio todos los pacientes con lesiones mediastínicas remitidos al Servicio de Radiodiagnóstico del Hospital Universitario La Paz para PAAF percutánea guiada por TC helicoidal desde junio del 2003 hasta julio del 2006.
La indicación de la punciónaspiración fue confirmar la condición de malignidad o benignidad de una lesión. Se incluyeron todo tipo de lesiones, sólidas o quísticas, desde pequeños nódulos de 9mm hasta grandes masas de varios centímetros localizadas en cualquier compartimento mediastínico. Como criterios de exclusión se consideraron las contraindicaciones de la prueba. La única contraindicación absoluta fue la falta de colaboración del paciente, mientras que las relativas fueron diátesis hemorrágicas con INR >1,3 o<50.000 plaquetas, medicación con efectos anticoagulantes (dicumarínicos o ácido acetilsalicílico) y dificultad para mantener la posición durante el procedimiento.
Todos los pacientes firmaron un consentimiento informado aprobado por el comité de ética de nuestro centro y usado de manera rutinaria en la práctica clínica diaria para los procedimientos intervencionistas.
Las punciones se realizaron en la sala de TC de forma ambulatoria salvo en los casos en los que el paciente estaba ingresado. Una vez en la sala de TC, se explicaron los pasos del procedimiento al paciente para lograr una adecuada colaboración.
Las imágenes se obtuvieron en un TC helicoidal (Somaton Plus 4, Siemens, Erlangen, Alemania) con la mínima dosis de radiación que permitía la evaluación de la posición de la aguja en relación con la lesión (40mAs, 120kV estándar). El grosor de corte se precisó en función del tamaño de la lesión, siendo como máximo menor que la mitad del diámetro de la lesión (3–10mm, 3mm estándar). No se administró contraste yodado vía intravenosa, ni ningún tipo de contraste vía oral. Todos los pacientes cumplieron 6h de ayuno ante la posibilidad de complicaciones. Se colocaron en decúbito supino, prono o lateral en función de la localización de la lesión, de su tamaño y la tolerancia del enfermo. Se emplearon agujas de 23–25G BD Spinal Needle (Becton Dickinson, San Agustín del Guadalix, Madrid, España) y Gallini Medical Devices (Gallini, Mantova, Italia), de 9, 11 o 15cm, en función de la distancia de la piel al centro de la lesión. La planificación de las punciones, colocación y comprobación de las agujas fueron realizadas por un especialista de radiología torácica o por un residente de radiología bajo su supervisión. Las aspiraciones fueron obtenidas por un citopatólogo con amplia experiencia el cual teñía inmediatamente la muestra con Diff-Quik® para comprobar al microscopio la existencia de material válido para diagnóstico citológico. En caso de muestra insuficiente, se realizaron nuevas tomas hasta un máximo de 3. Parte del material fue fijado en alcohol para posterior tinción de Papanicolaou y realización, en caso necesario, de técnicas complementarias (inmunocitoquímica y reordenamiento genético). Finalizado el procedimiento, se realizó en todos los casos un corte de TC en espiración para descartar neumotórax, hemorragia u otras complicaciones.
Posteriormente, se emitió el diagnóstico citológico de lesión benigna o maligna y dentro de estas se clasificaron en tipos y subtipos. Las lesiones inespecíficas con ausencia de células malignas se aceptaron como «benignas» siempre que la punta de la aguja de punción estuviese dentro la lesión, con muestras de diferentes zonas de esta, celularidad suficiente y el seguimiento radiológico de la lesión demostrase que ésta no había aumentado de tamaño.
Los estudios histológicos fueron realizados a partir de muestras obtenidas mediante biopsia percutánea o endoscópica, mediastinoscopia, mediastinotomía o estudio de la pieza quirúrgica. Las muestras fueron fijadas en formol al 4% y teñidas con hematoxilinaeosina. Posteriormente, se realizaron otras técnicas histoquímicas e inmunohistoquímica para precisar el diagnóstico en determinados casos.
Como patrón de referencia se consideró el diagnóstico histológico y en los casos que no hubo biopsia ni pieza quirúrgica, el diagnóstico que figuraba en la historia clínica del paciente después de un seguimiento clínico durante los 2 años posteriores a la PAAF. De esta manera, fueron incluidos en el análisis los 50 casos con diagnóstico citológico no confirmados mediante estudio histológico por tratarse de enfermedades que requerían tratamiento médico como es el caso de linfomas o tumores en estadios no quirúrgicos o de lesiones que únicamente precisaban seguimiento como los quistes u otras lesiones benignas.
Análisis estadísticoEl documento se presenta según las indicaciones de la normativa STARD. Las variables cuantitativas se expresaron como media±desviación estándar y las cualitativas como porcentaje. Se analizaron en tablas de 2×2 la sensibilidad, la especificidad, los valores predictivos positivos y negativos, las razones de verosimilitud, la exactitud, los valores puntuales y los IC del 95%. El grado de concordancia citohistológica se determinó mediante el coeficiente kappa de Cohen. Para la comparación de variables cualitativas se utilizó la prueba de la chi cuadrado con el estadístico exacto de Fisher. Se consideró significativa una p<0,05. El análisis fue realizado con el programa SPSS.
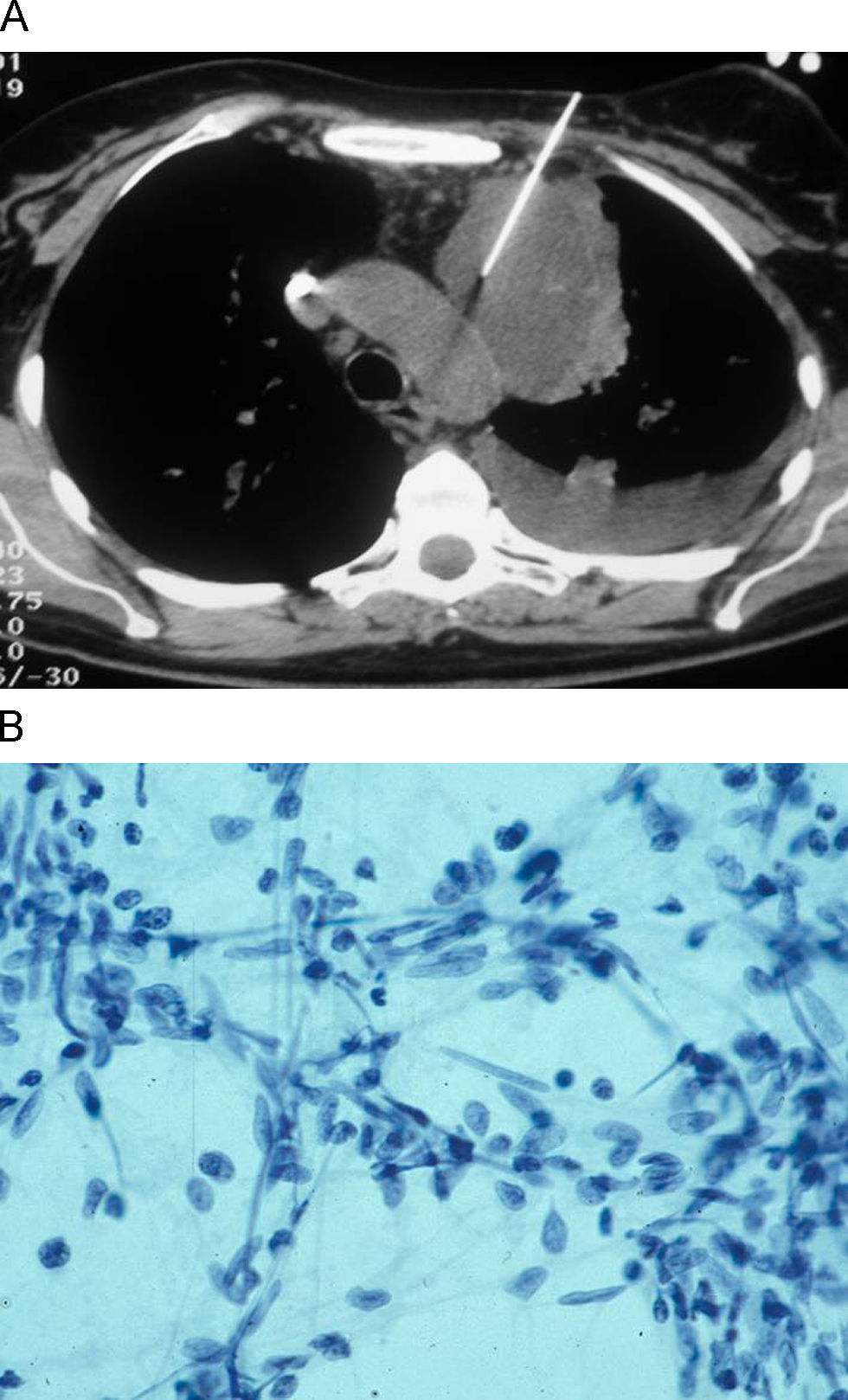
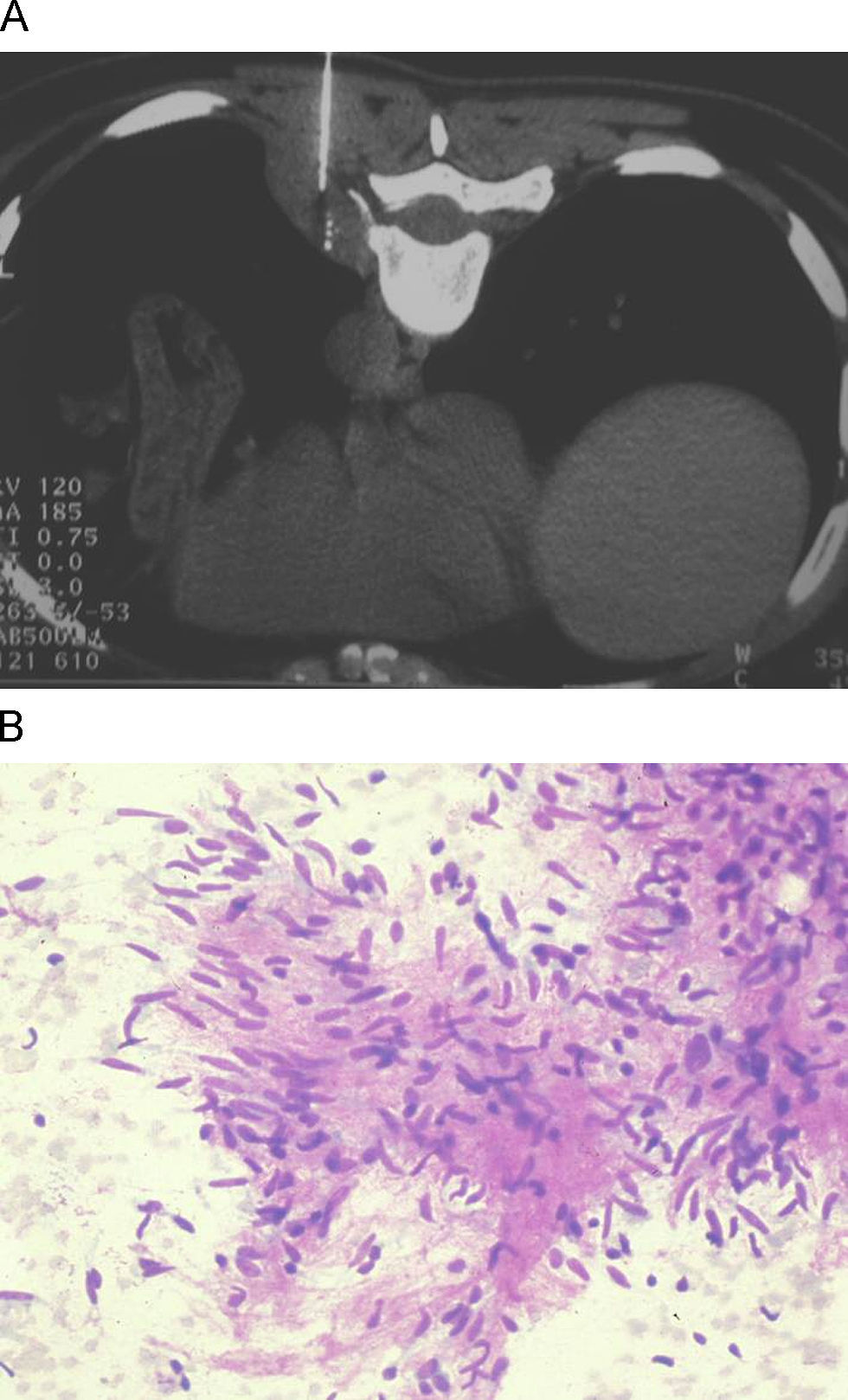
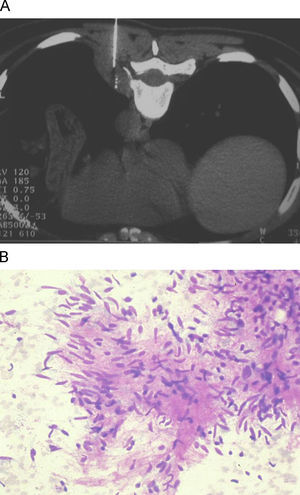
ResultadosSe estudiaron 131 pacientes con lesiones mediastínicas, 71 varones (54,2%) y 60 mujeres (45,8%) con una media de edad de 53±19 años (intervalo: 8–84 años). Un 54,5% de los pacientes era menor de 60 años. Las lesiones se localizaban en cualquiera de los 3 compartimentos del mediastino, 88 (67,2%) en mediastino anterior, 15 (11,4%) en mediastino medio y 22 (16,8%) en mediastino posterior (figs. 1 y 2). En 6 pacientes (4,6%) la lesión se extendía a más de un compartimento: en 5 casos se localizaba en mediastino anterior y medio, mientras que en otro llegaba también al mediastino posterior. En el 10% de los casos, el tamaño de la lesión era menor o igual a 2cm.
De los 131 pacientes de la serie inicial, 5 se descartaron para los análisis estadísticos por no disponer de diagnóstico definitivo (2 de los cuales tampoco tenían muestras válidas para citología) y otros 3 se descartaron por imposibilidad de obtener una muestra valorable para estudio citológico. De esta manera se contabilizaron un total de 126 pacientes con diagnóstico definitivo y 123 con diagnóstico definitivo y PAAF válidas que fueron los que se consideraron para el análisis estadístico. De los 5 frotis no valorables obtenidos, 2 fueron hemorrágicos, 2 contenían insuficiente celularidad y en el caso restante existía discordancia radiocitológica. En estos 5 pacientes se realizó una segunda punción otro día sin éxito. La validez diagnóstica de la PAAF percutánea en la identificación de malignidad con respecto al diagnóstico definitivo establecido tras estudio histológico o seguimiento clínico se muestra en la tabla 1.
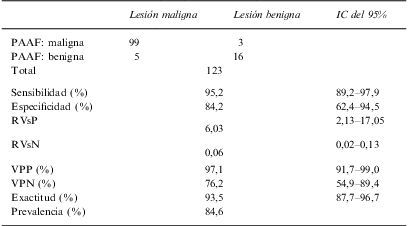
Rentabilidad de la PAAF percutánea en el diagnóstico de malignidad de lesiones mediastínicas con respecto al diagnóstico definitivo
| Lesión maligna | Lesión benigna | IC del 95% | |
| PAAF: maligna | 99 | 3 | |
| PAAF: benigna | 5 | 16 | |
| Total | 123 | ||
| Sensibilidad (%) | 95,2 | 89,2–97,9 | |
| Especificidad (%) | 84,2 | 62,4–94,5 | |
| RVsP | 6,03 | 2,13–17,05 | |
| RVsN | 0,06 | 0,02–0,13 | |
| VPP (%) | 97,1 | 91,7–99,0 | |
| VPN (%) | 76,2 | 54,9–89,4 | |
| Exactitud (%) | 93,5 | 87,7–96,7 | |
| Prevalencia (%) | 84,6 | ||
PAAF: punciónaspiración con aguja fina; RVsN: razón de verosimilitud negativa; RVsP: razón de verosimilitud positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
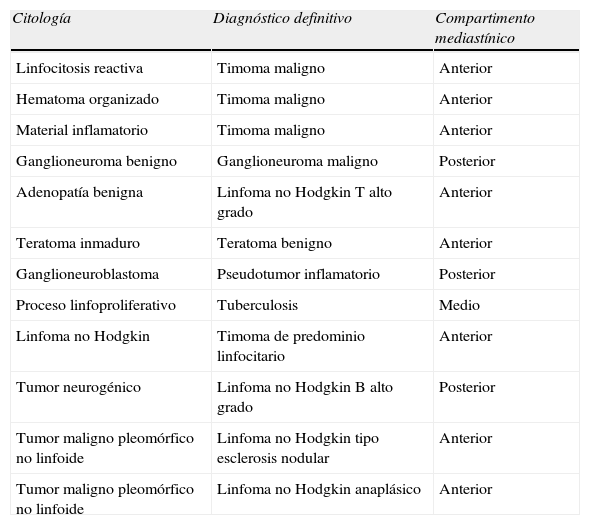
De los 126 casos con diagnóstico citológico (utilidad de la PAAF del 96,2%), se dispuso de 73 muestras histológicas (tabla 2). Se alcanzó un grado elevado de concordancia citohistológica, tanto entre las lesiones malignas (coeficiente kappa: 0,641; p<0,001) como entre las benignas (coeficiente kappa: 0,607; p<0,001). En los 12 casos con discordancia citologíadiagnóstico definitivo (tabla 3), se detectaron 5 falsos negativos, 3 falsos positivos y 4 errores de tipificación de lesiones malignas.
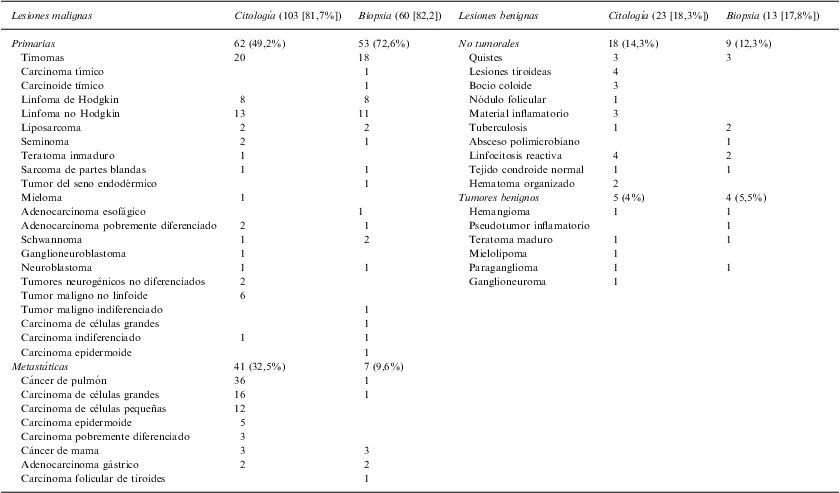
Resultados diagnósticos citológicos e histológicos
| Lesiones malignas | Citología (103 [81,7%]) | Biopsia (60 [82,2]) | Lesiones benignas | Citología (23 [18,3%]) | Biopsia (13 [17,8%]) |
| Primarias | 62 (49,2%) | 53 (72,6%) | No tumorales | 18 (14,3%) | 9 (12,3%) |
| Timomas | 20 | 18 | Quistes | 3 | 3 |
| Carcinoma tímico | 1 | Lesiones tiroideas | 4 | ||
| Carcinoide tímico | 1 | Bocio coloide | 3 | ||
| Linfoma de Hodgkin | 8 | 8 | Nódulo folicular | 1 | |
| Linfoma no Hodgkin | 13 | 11 | Material inflamatorio | 3 | |
| Liposarcoma | 2 | 2 | Tuberculosis | 1 | 2 |
| Seminoma | 2 | 1 | Absceso polimicrobiano | 1 | |
| Teratoma inmaduro | 1 | Linfocitosis reactiva | 4 | 2 | |
| Sarcoma de partes blandas | 1 | 1 | Tejido condroide normal | 1 | 1 |
| Tumor del seno endodérmico | 1 | Hematoma organizado | 2 | ||
| Mieloma | 1 | Tumores benignos | 5 (4%) | 4 (5,5%) | |
| Adenocarcinoma esofágico | 1 | Hemangioma | 1 | 1 | |
| Adenocarcinoma pobremente diferenciado | 2 | 1 | Pseudotumor inflamatorio | 1 | |
| Schwannoma | 1 | 2 | Teratoma maduro | 1 | 1 |
| Ganglioneuroblastoma | 1 | Mielolipoma | 1 | ||
| Neuroblastoma | 1 | 1 | Paraganglioma | 1 | 1 |
| Tumores neurogénicos no diferenciados | 2 | Ganglioneuroma | 1 | ||
| Tumor maligno no linfoide | 6 | ||||
| Tumor maligno indiferenciado | 1 | ||||
| Carcinoma de células grandes | 1 | ||||
| Carcinoma indiferenciado | 1 | 1 | |||
| Carcinoma epidermoide | 1 | ||||
| Metastáticas | 41 (32,5%) | 7 (9,6%) | |||
| Cáncer de pulmón | 36 | 1 | |||
| Carcinoma de células grandes | 16 | 1 | |||
| Carcinoma de células pequeñas | 12 | ||||
| Carcinoma epidermoide | 5 | ||||
| Carcinoma pobremente diferenciado | 3 | ||||
| Cáncer de mama | 3 | 3 | |||
| Adenocarcinoma gástrico | 2 | 2 | |||
| Carcinoma folicular de tiroides | 1 |
Errores diagnósticos de la PAAF percutánea
| Citología | Diagnóstico definitivo | Compartimento mediastínico |
| Linfocitosis reactiva | Timoma maligno | Anterior |
| Hematoma organizado | Timoma maligno | Anterior |
| Material inflamatorio | Timoma maligno | Anterior |
| Ganglioneuroma benigno | Ganglioneuroma maligno | Posterior |
| Adenopatía benigna | Linfoma no Hodgkin T alto grado | Anterior |
| Teratoma inmaduro | Teratoma benigno | Anterior |
| Ganglioneuroblastoma | Pseudotumor inflamatorio | Posterior |
| Proceso linfoproliferativo | Tuberculosis | Medio |
| Linfoma no Hodgkin | Timoma de predominio linfocitario | Anterior |
| Tumor neurogénico | Linfoma no Hodgkin B alto grado | Posterior |
| Tumor maligno pleomórfico no linfoide | Linfoma no Hodgkin tipo esclerosis nodular | Anterior |
| Tumor maligno pleomórfico no linfoide | Linfoma no Hodgkin anaplásico | Anterior |
Se dieron 5 casos de complicaciones postpunción (3,8%): 3 neumotórax (2,3%) que no requirieron tubo de drenaje y 2 hematomas (1,5%) con sangrados autolimitados.
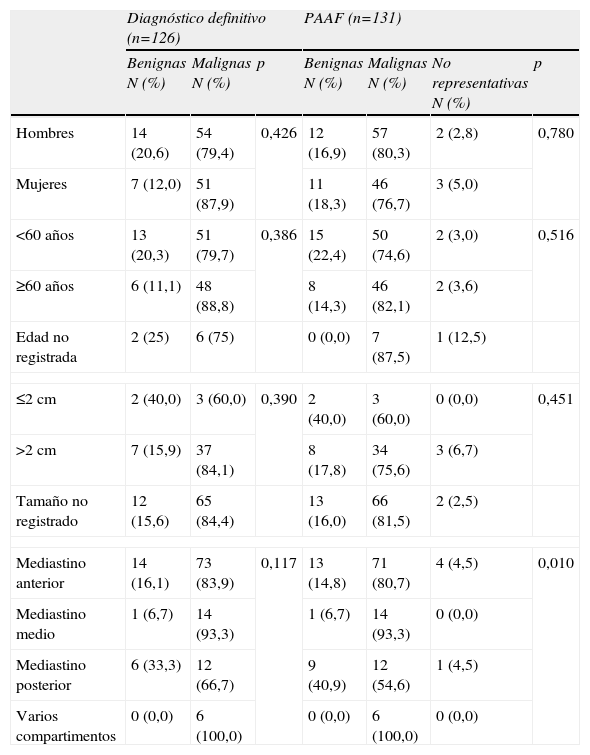
Las frecuencias de lesiones benignas y malignas fueron calculadas en grupos de población según género, edad (<60 años y ≥60 años), tamaño de la lesión (≤2cm y >2cm) y localización de esta (compartimento anterior, medio y posterior) (tabla 4), pero no se dispuso de todos los datos en el total de pacientes sometidos a PAAF (la edad se registró en 123 pacientes y el tamaño de la lesión en 50). Por esta misma razón, en el análisis por subgrupos del total de pacientes con diagnóstico definitivo, los subgrupos de clasificación por edad y tamaño de la lesión quedaron reducidos (118 y 49 pacientes respectivamente). Aunque se aprecian porcentajes ligeramente más elevados de tumores malignos en mujeres que en hombres (85,0 vs. 76,1%), en mayores de 60 años que en menores (85,7 vs. 76,1%) ninguna de estas diferencias alcanzó significación estadística. Sin embargo, en la clasificación de benignidad y malignidad según la PAAF de las lesiones en los diferentes compartimentos mediastínicos sí se alcanzaron diferencias estadísticamente significativas, siendo predominantemente malignas las lesiones localizadas en mediastino anterior y medio (80,7 y 93,3%, respectivamente; p=0,032).
Frecuencia de lesiones benignas y malignas en diferentes subgrupos muestrales según el patrón de referencia y la PAAF
| Diagnóstico definitivo (n=126) | PAAF (n=131) | ||||||
| Benignas N (%) | Malignas N (%) | p | Benignas N (%) | Malignas N (%) | No representativas N (%) | p | |
| Hombres | 14 (20,6) | 54 (79,4) | 0,426 | 12 (16,9) | 57 (80,3) | 2 (2,8) | 0,780 |
| Mujeres | 7 (12,0) | 51 (87,9) | 11 (18,3) | 46 (76,7) | 3 (5,0) | ||
| <60 años | 13 (20,3) | 51 (79,7) | 0,386 | 15 (22,4) | 50 (74,6) | 2 (3,0) | 0,516 |
| ≥60 años | 6 (11,1) | 48 (88,8) | 8 (14,3) | 46 (82,1) | 2 (3,6) | ||
| Edad no registrada | 2 (25) | 6 (75) | 0 (0,0) | 7 (87,5) | 1 (12,5) | ||
| ≤2cm | 2 (40,0) | 3 (60,0) | 0,390 | 2 (40,0) | 3 (60,0) | 0 (0,0) | 0,451 |
| >2cm | 7 (15,9) | 37 (84,1) | 8 (17,8) | 34 (75,6) | 3 (6,7) | ||
| Tamaño no registrado | 12 (15,6) | 65 (84,4) | 13 (16,0) | 66 (81,5) | 2 (2,5) | ||
| Mediastino anterior | 14 (16,1) | 73 (83,9) | 0,117 | 13 (14,8) | 71 (80,7) | 4 (4,5) | 0,010 |
| Mediastino medio | 1 (6,7) | 14 (93,3) | 1 (6,7) | 14 (93,3) | 0 (0,0) | ||
| Mediastino posterior | 6 (33,3) | 12 (66,7) | 9 (40,9) | 12 (54,6) | 1 (4,5) | ||
| Varios compartimentos | 0 (0,0) | 6 (100,0) | 0 (0,0) | 6 (100,0) | 0 (0,0) | ||
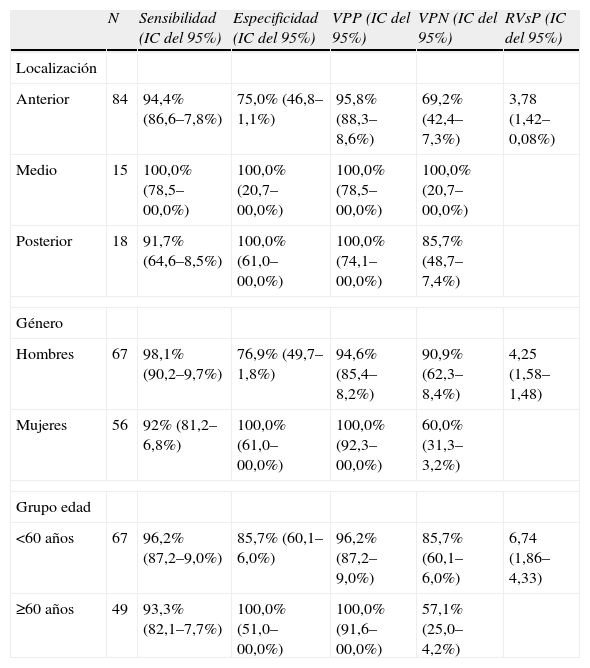
Se analizó la rentabilidad diagnóstica de la PAAF percutánea en función de la localización de la lesión y del género y edad de los pacientes (tabla 5) sin detectar diferencias significativas en la misma en función de la localización, género o edad. No se consideró el subgrupo de lesiones localizadas en varios compartimentos mediastínicos por ser muy escasas y el análisis por edad quedó reducido a 116 pacientes porque no se registró este dato en todos los casos.
Análisis de la rentabilidad diagnóstica de la PAAF en la identificación de malignidad de lesiones mediastínicas en función de la localización de las lesiones y del género y edad de los pacientes
| N | Sensibilidad (IC del 95%) | Especificidad (IC del 95%) | VPP (IC del 95%) | VPN (IC del 95%) | RVsP (IC del 95%) | |
| Localización | ||||||
| Anterior | 84 | 94,4% (86,6–7,8%) | 75,0% (46,8–1,1%) | 95,8% (88,3–8,6%) | 69,2% (42,4–7,3%) | 3,78 (1,42–0,08%) |
| Medio | 15 | 100,0% (78,5–00,0%) | 100,0% (20,7–00,0%) | 100,0% (78,5–00,0%) | 100,0% (20,7–00,0%) | |
| Posterior | 18 | 91,7% (64,6–8,5%) | 100,0% (61,0–00,0%) | 100,0% (74,1–00,0%) | 85,7% (48,7–7,4%) | |
| Género | ||||||
| Hombres | 67 | 98,1% (90,2–9,7%) | 76,9% (49,7–1,8%) | 94,6% (85,4–8,2%) | 90,9% (62,3–8,4%) | 4,25 (1,58–1,48) |
| Mujeres | 56 | 92% (81,2–6,8%) | 100,0% (61,0–00,0%) | 100,0% (92,3–00,0%) | 60,0% (31,3–3,2%) | |
| Grupo edad | ||||||
| <60 años | 67 | 96,2% (87,2–9,0%) | 85,7% (60,1–6,0%) | 96,2% (87,2–9,0%) | 85,7% (60,1–6,0%) | 6,74 (1,86–4,33) |
| ≥60 años | 49 | 93,3% (82,1–7,7%) | 100,0% (51,0–00,0%) | 100,0% (91,6–00,0%) | 57,1% (25,0–4,2%) | |
RVsP: razón de verosimilitud positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Por último, se evaluó la rentabilidad de la PAAF en el diagnóstico de malignidad con respecto a la biopsia en los 73 pacientes que disponían de muestras histológicas. En este subgrupo, la PAAF alcanza una sensibilidad del 94,9% (IC95%: 86,1–98,3%), especificidad 71,4% (IC95%: 45,4–88,3%), valor predictivo positivo (VPP) 93,3% (IC95%: 84,1–97,4%), valor predictivo negativo 76,9% (IC95%: 49,7–91,8%), razón de verosimilitud positiva 3,32 (IC95%: 1,45–7,62) y exactitud del 90,4% (IC95%: 81,5–95,3%).
DiscusiónLa PAAF percutánea guiada por TC helicoidal es un procedimiento muy útil y efectivo para el diagnóstico de lesiones mediastínicas como demuestra nuestro estudio. Se obtuvo un diagnóstico correcto en el 94,5% de los casos con tan solo 5 falsos negativos, 3 falsos positivos y 4 errores de tipificación histológica. La rentabilidad diagnóstica alcanzada en nuestra serie (95,2% de sensibilidad, 97,1% de VPP y 93,5% de exactitud) resulta discretamente superior a la referida en estudios previos (sensibilidad y VPP de 85–87% y 78–97%, respectivamente)11,18. La sensibilidad obtenida para el diagnóstico de procesos malignos mediante guía TC es similar o superior a la descrita para la PAAF ecoendoscópica (81–96%)1,2 o transbronquial (63–89%)3–5. El perfeccionamiento del procedimiento también ha aumentado su utilidad y seguridad. Se ha pasado de un 81% de muestras válidas en las primeras series11 a un 94% en las más recientes9 e incluso a un 96,2% en nuestro estudio. En la primera serie publicada13, se producían un 21,4% de complicaciones, mientras que en las series más actuales17 solo se presentan en el 2–4% de los casos (3,8% en nuestro estudio). Sin embargo, es necesario considerar que existen diferencias de hasta un 13–15% en la sensibilidad, utilidad y seguridad, pues la eficacia y frecuencia de complicaciones dependen en gran parte de la experiencia del equipo que realice la PAAF.
Nuestro estudio presenta diversas limitaciones. Por sus características, se evalúa una población seleccionada, es decir, pacientes en los que se consideró adecuada la realización del procedimiento, descartándose los no colaboradores y las lesiones inferiores a 9mm cuya inclusión podía haber disminuido la rentabilidad diagnóstica. Así mismo se desestimaron aquellos pacientes con enfisema pulmonar importante para punciones transpulmonares y enfermos con alteraciones de los parámetros de coagulación en todos los casos lo que minimizó el riesgo de complicaciones. Además, se excluyeron 8 casos del análisis de rentabilidad (5 por carecer de seguimiento clínico y 3 por material insuficiente). Aunque esto último podría suponer un sesgo de selección, consideramos que un resultado no valorable no debería incluirse en el estudio de eficacia. La evaluación según el tamaño de la lesión se desestimó al disponer únicamente de este dato en 50 casos (40,6%).
En nuestra muestra, la distribución de las lesiones es similar a la recogida en la literatura. La mayoría son de mediastino anterior, las posteriores son mucho menos frecuentes y las del compartimento medio más raras1,2,9,16–18. Numerosos autores incluyen únicamente lesiones de mediastino anterior6,11, más frecuentes y fácilmente accesibles vía percutánea, permitiendo el uso de la ecografía como guía siempre que contacten con la pared torácica19.
Habitualmente, se considera que la mayoría de las masas mediastínicas son malignas, siendo más numerosas las lesiones primarias9,10,17,18. Nuestros resultados son concordantes con estos datos (84,5% lesiones malignas, la mayoría primarias), sin embargo Assaad et al9 y Powers et al18 vieron que la mayoría de las lesiones malignas eran metastásicas, luego no está claro que un subgrupo predomine frente al otro. La indicación de PAAF guiada por TC en el caso de sospecha de malignidad de una lesión mediastínica es indudable puesto que tiene un alto VPP (97,1% en nuestra serie y 78–97% en la literatura) y escaso riesgo de complicaciones, la mayoría banales (neumotórax y hematomas autolimitados)8,12,13,17. Nuestros resultados todavía podrían tener una mayor relevancia clínica en el caso de lesiones clínica y radiológicamente sugestivas de benignidad. En estas lesiones, la PAAF alcanza un elevado valor predictivo negativo (76,2%) que resulta similar al obtenido en el subgrupo de pacientes con diagnóstico histológico (76,9%). Aunque estos datos sugieren que en estos casos podría estar justificado realizar seguimiento clínicoradiológico, obviando la biopsia, se necesitan más estudios para apoyar esta actitud clínica. Además, se debe ser cauto en la punción de lesiones quísticas cuyo porcentaje en el total de masas mediastínicas no es despreciable (hasta un 20% en la literatura y un 15,4% en esta serie), pues existe un mayor riesgo de infección por lo que diversos autores recomiendan profilaxis antibiótica22,23.
En nuestros pacientes, se obtuvo concordancia citologíabiopsia en tipo y subtipo histológico en el 90,4% de los casos lo que es concordante con el 78–95% descrito por otros autores9,17,10,11. Las diferencias entre estudios pueden ser atribuidas a diversos factores. La presencia del citólogo en la sala del TC resulta fundamental pues al analizar de inmediato la validez de la muestra puede indicar la repetición de la punción lo que aumenta su valor predictivo negativo18,24. También se debe considerar la complejidad del diagnóstico de las lesiones mediastínicas, por su gran variedad histológica, sin olvidar que la experiencia de radiólogos y citólogos y la colaboración del paciente son factores determinantes de la eficacia del procedimiento. Debido a estas frecuentes discordancias en el diagnóstico citohistológico, existe cierta controversia en la indicación de punción con aguja fina o gruesa (tru cut ). La obtención de mayor cantidad de material con tru cut (14–18G) proporciona una mayor precisión diagnóstica, fundamentalmente en carcinomas, timomas y linfomas6,19, pero con un mayor riesgo de complicaciones6,7. Por ello, se recomienda el uso de aguja fina en punciones transpulmonares y de lesiones adyacentes a grandes vasos o hipervasculares8, reservando el tru cut solo para cuando los hallazgos clínicoradiológicos no concuerden con el resultado de la PAAF25.
De los diversos errores descritos en el diagnóstico citológico de masas mediastínicas26–30, el más frecuente corresponde a las lesiones de células fusiformes que incluye lesiones benignas no tumorales, tumores benignos (timoma o tumores neurogénicos) y tumores malignos (carcinoma escamoso, melanoma, linfoma no Hodgkin con esclerosis o liposarcoma)27. De hecho, un linfoma no Hodgkin con esclerosis de uno de nuestros pacientes simulaba un tumor neurogénico en la citología debido a la abundancia de células fusiformes, error descrito por varios autores27–28. Además, los linfomas y los tumores neurogénicos pueden tener un patrón de células pequeñas y mimetizar un tumor carcinoide o microcítico metástasicos30 por lo que para el diagnóstico de tumores de células fusiformes y de células pequeñas pueden requerirse técnicas de inmunohistoquímica28. Por otro lado, un timoma con predominio del componente linfoide puede simular un linfoma17,29 como ocurrió en nuestro estudio o en casos excepcionales parecer un carcinoma si predomina el componente epitelial26.
A modo de conclusión, nuestro estudio confirma que la PAAF percutánea guiada por TC permite llegar al diagnóstico de la gran mayoría de las lesiones mediastínicas con una fiabilidad muy alta9–11,17,18. Tiene una alta sensibilidad para la detección de malignidad cuando es realizada por expertos, es bien tolerada, mínimamente invasiva, con menor riesgo de complicaciones que las PAAF endoscópicas y con menor coste. Por todo ello, debería ser considerada como procedimiento diagnóstico de primera elección ante la sospecha de lesiones mediastínicas malignas, dejando técnicas más agresivas como las endoscópicas para aquellos casos difíciles en los que no se consiga una muestra adecuada para diagnóstico mediante PAAF percutánea guiada por TC.