El análisis del lavado broncoalveolar (LBA) se ha propuesto como técnica objetiva para certificar la exposición a amianto. Sin embargo, la fiabilidad y rendimiento diagnóstico de este procedimiento diagnóstico no se han analizado en España. El propósito de este estudio fue evaluar la utilidad del análisis de cuerpos de amianto (CA) en el LBA para el diagnóstico de enfermedades relacionadas con el amianto (ERA).
MétodosSe analizaron muestras de LBA de 72 pacientes (66 varones, edad media de 66 años) sometidos a broncoscopia. También se analizó el tejido pulmonar de 23 de estos pacientes. La exposición al amianto se evaluó a partir de la anamnesis y la revisión de las historias clínicas de los pacientes. Las muestras de LBA y de tejido pulmonar se procesaron, y la cantidad de CA se determinó mediante microscopia óptica. El valor umbral aceptado para diagnosticar una enfermedad relacionada con el amianto fue de 1 CA/ml de LBA o 1.000 CA/g de tejido seco.
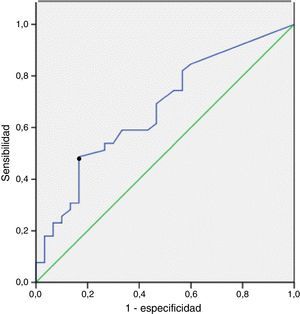
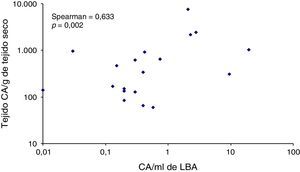
ResultadosTreinta y nueve pacientes refirieron exposición a amianto. En 13 (33%) de estos pacientes, los niveles de CA fueron superiores a 1 CA/ml de LBA. De los 33 pacientes no expuestos, los valores de CA fueron superiores a 1 CA/ml de LBA en 5 casos (15%). La diferencia entre los niveles de CA de los pacientes expuestos y los no expuestos fue significativa (p=0,006). La curva ROC indicó que el nivel de 0,5 CA/ml de LBA era el que alcanzaba mayor sensibilidad (46%), con un 83% de especificidad. El grado de correlación entre los niveles de CA en el LBA y el tejido pulmonar fue de 0,633 (p=0,002).
ConclusionesEl estudio del LBA ofrece una prueba objetiva de la exposición a amianto. La buena correlación observada entre los recuentos de CA en el LBA y en el tejido pulmonar indica la validez de ambas técnicas para analizar el contenido de amianto.
Bronchoalveolar lavage (BAL) analysis has been proposed as an objective technique for confirming asbestos exposure. However, the reliability and diagnostic yield of this procedure has not been studied in Spain. The aim of this study was to assess the usefulness of the analysis of asbestos bodies (AB) in bronchoalveolar lavage (BAL) for the diagnosis of asbestos-related diseases (ARD).
MethodsBAL samples from 72 patients (66 male, mean age 66 years) undergoing bronchoscopy were analyzed. Lung tissue from 23 of these patients was also analyzed. Asbestos exposure was assessed by anamnesis and a review of the patient's medical records. BAL and lung samples were processed and AB count was determined by light microscopy. The accepted threshold value to diagnose asbestos-related diseases was 1 AB/ml BAL or 1000 AB/gr dry tissue.
ResultsThirty-nine patients reported exposure to asbestos. Of these, 13 (33%) presented AB values above 1 AB/ml BAL. In the 33 non-exposed patients, 5 (15%) presented AB values above 1 AB/ml BAL. There was a significant difference between the AB levels of exposed and non-exposed patients (P=.006). The ROC curve showed that a value of 0.5 AB/ml BAL achieved the most satisfactory sensitivity, 46%, and a specificity of 83%. The correlation between AB levels in BAL and lung was 0.633 (P=.002).
ConclusionsBAL study provides objective evidence of exposure to asbestos. The good correlation between the AB counts in BAL and lung tissue indicates that both techniques are valid for the analysis of asbestos content.
El uso generalizado de amianto en la industria y su inhalación por parte de los trabajadores han comportado la aparición de enfermedades, tales como el mesotelioma, el cáncer de pulmón, la asbestosis y patologías pleurales benignas1,2. Dada la gran cantidad de amianto importado en España —2,4 millones de toneladas antes de 19983— y el hecho de que su uso no se prohibió totalmente hasta el año 2012, los efectos sobre la salud de la población expuesta se continuarán notando en los años venideros, debido, sobre todo, al prolongado periodo de latencia que transcurre entre la exposición y el diagnóstico de la enfermedad resultante.
El diagnóstico de las enfermedades relacionadas con el amianto (ERA) se basa en la noción de exposición y la presencia de un cuadro clínico y un perfil radiológico compatibles. A pesar de la importancia de investigar la exposición durante la anamnesis, en muchas ocasiones, la información que el paciente proporciona es insuficiente o confusa. Es posible que el paciente no haya sido consciente de la presencia o ausencia de amianto en su puesto de trabajo, o que tenga dificultades para recordar actividades realizadas muchos años atrás. En estos casos, es importante poder acceder a información objetiva que certifique la exposición y permita hacer un diagnóstico fiable4.
La prueba más objetiva de la exposición a amianto es su depósito en el pulmón, que corresponde a la parte del amianto inhalado que no se pudo eliminar. El análisis de muestras de pulmón es un método seguro para determinar el alcance de este depósito pero, obviamente, requiere disponer de tejido5,6. Una técnica alternativa es el análisis del contenido en fibras o, más frecuentemente, cuerpos de amianto (CA) en el lavado broncoalveolar (LBA). Esta técnica tiene la ventaja de no ser invasiva y algunos trabajos publicados han demostrado su buena correlación con la determinación de amianto en el tejido pulmonar7-9.
En España, los estudios científicos recientes sobre ERA son escasos6,8–13, y aun más los que han analizado de forma objetiva el depósito pulmonar de amianto5,6. Hoy en día, solo un laboratorio realiza análisis rutinarios de amianto en muestras biológicas en España. Los valores de referencia publicados para la población española5 pueden ser de utilidad para establecer los puntos de corte en diferentes patologías. Sin embargo, no existe ningún estudio de este tipo en relación al LBA.
El propósito de este estudio fue efectuar una evaluación inicial de la utilidad del análisis de CA en el LBA para el diagnóstico de ERA en la ciudad de Barcelona.
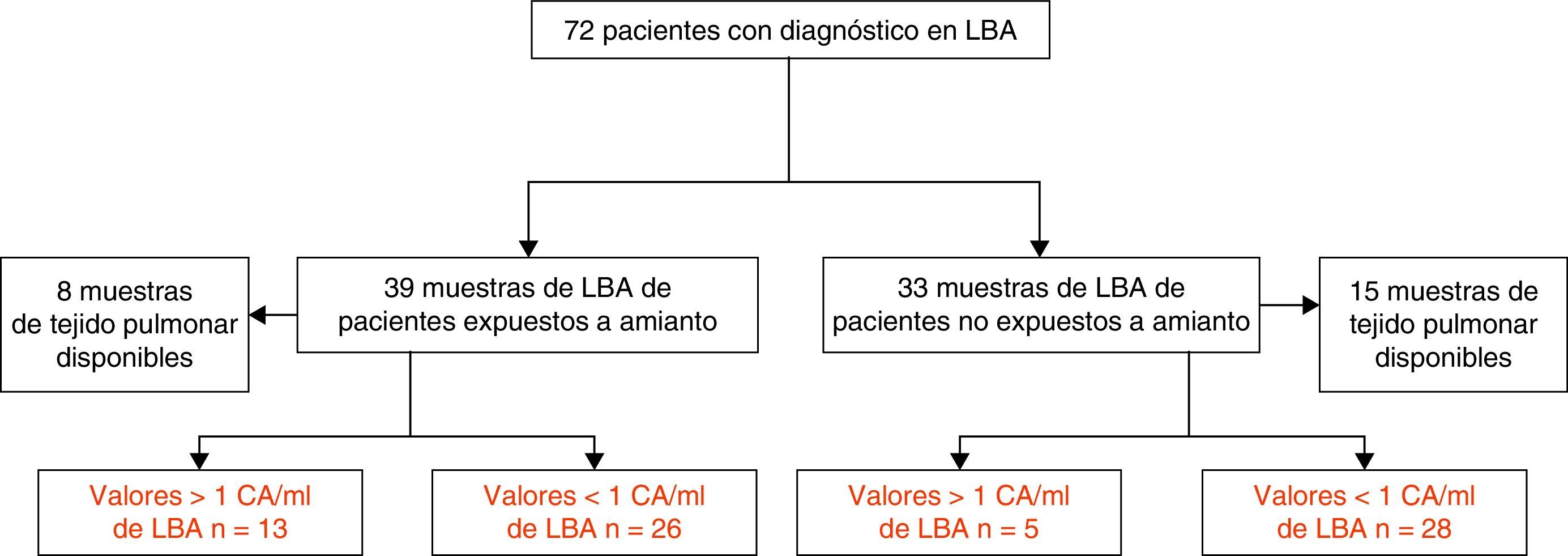
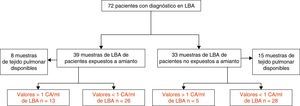
Material y métodosPoblación del estudioEn este estudio observacional retrospectivo fueron incluidos 39 pacientes expuestos a amianto, a los que se practicó un LBA diagnóstico por sospecha de ERA entre 2007 y 2013. La sospecha de ERA se basó en la comunicación del paciente de exposición previa a amianto y/o una imagen radiológica torácica compatible. En el estudio también se incluyó un segundo grupo de 33 pacientes no expuestos a amianto, en cuyo proceso diagnóstico estaba indicada la práctica de un LBA. También contamos con muestras de tejido pulmonar de 8 pacientes expuestos y de 15 no expuestos (todos los cuales se habían sometido a resección quirúrgica por cáncer de pulmón) (fig. 1).
Cincuenta y ocho pacientes de la población del estudio residían en la ciudad de Barcelona, 13 en el área metropolitana de esta ciudad y uno en la ciudad de Tarragona. La exposición a amianto se determinó a partir de la anamnesis. Las profesiones y las actividades de los pacientes se registraron en orden cronológico y uno de los autores estableció la presencia o ausencia de exposición. El estudio fue aprobado por el comité de ética de nuestro hospital (PR[AG]20/2007). Todos los pacientes otorgaron su consentimiento por escrito para participar en el estudio.
Diagnóstico clínico y radiológicoSe efectuaron anamnesis, exploración física, radiología torácica, TAC pulmonar y análisis de sangre a todos los pacientes. El diagnóstico de enfermedad relacionada con el amianto se estableció cuando la exposición a amianto concurría con un cuadro clínico y un perfil radiológico compatibles.
El diagnóstico de cáncer de pulmón se basó en el examen histológico realizado por un patólogo. El diagnóstico de ERA pleural benigna se basó en la existencia de imágenes radiológicas compatibles con presencia de placas, fibrosis y derrames pleurales, y en la exclusión de otras patologías. Se diagnosticó atelectasia redonda si la TAC torácica mostraba el patrón radiológico clásico de esta patología. Los diagnósticos de mesotelioma los efectuó el patólogo en muestras de biopsia pleural y mediante técnicas convencionales e inmunohistoquímicas. Se evaluó a los pacientes que presentaban enfermedad pulmonar intersticial difusa. Se diagnosticó asbestosis en aquellos pacientes que presentaban una combinación de patrón pulmonar intersticial, exposición a amianto, alteraciones pleurales compatibles o niveles elevados de CA en el LBA14.
Protocolo de la recogida de muestrasMuestras de LBA: el LBA se efectuó a nivel de la língula o del lóbulo medio del pulmón derecho, en el pulmón contralateral a la neoplasia. Se instilaron 150ml de solución salina y, para el examen de amianto, se utilizaron 10ml de fluido, como mínimo.
Tejido pulmonar: el tamaño de los especímenes fue de 2 cm3. Las muestras se obtuvieron de una región pulmonar lejana al tumor y se fijaron en formaldehído. Un patólogo de nuestro hospital examinó todos los especímenes pulmonares.
Preparación de las muestras de lavado broncoalveolarSe obtuvieron muestras de 10ml de LBA de todos los pacientes y se centrifugaron a 2.000 G durante 20 min. Se añadieron 30ml de hipoclorito sódico filtrado. Las mezclas obtenidas se agitaron durante una hora para facilitar la eliminación de material orgánico y se centrifugaron a 2.000 G durante 20 min. El hipoclorito sódico se desechó y las muestras se suspendieron de nuevo en agua destilada filtrada. Las soluciones obtenidas se filtraron a través de una membrana con un diámetro de poro de 0,45μm. Los filtros se dejaron secar durante una noche en un horno a 37°C y se transfirieron a portaobjetos para microscopia mediante un vaporizador de acetona (JS Holdings 240v/110v) para su posterior interpretación.
Preparación de las muestras de tejido pulmonarDe cada muestra se obtuvieron 2 fragmentos de 0,5g de tejido pulmonar que no contuvieran pleura ni vasos sanguíneos. Uno de los fragmentos se congeló, se liofilizó y se pesó para determinar el peso del tejido seco, con arreglo al acuerdo internacional para expresar los resultados de CA en gramos de tejido pulmonar seco. Una vez conocido el peso del tejido seco, las muestras liofilizadas se desecharon, puesto que esta técnica puede alterar la concentración y el tamaño de las PA6.
Las secciones de tejido no liofilizado se dividieron en pequeños fragmentos y se lavaron con agua destilada filtrada durante 16 h. A continuación, se añadieron 35 ml de hipoclorito sódico previamente filtrado. Los fragmentos se dejaron en esta solución durante 4 h para facilitar la digestión del tejido y la eliminación de la materia orgánica.
Las muestras se centrifugaron a 2.000 G durante 20 min. Tras descartar el sobrenadante, se añadieron 30ml de agua destilada filtrada. Después de efectuar otro centrifugado y eliminar el sobrenadante, las muestras se volvieron a suspender en 20ml de agua destilada filtrada y se sometieron a un baño ultrasónico (UCI-50, 300W, 50/60Hz, Raypa S.L., Terrassa, Barcelona) durante 10 s.
Se añadieron 20ml de una mezcla 1:1 de etanol (Merck-Millipore Corporation, Darmstadt, Alemania) y cloroformo (Panreac Química S.A.U., Barcelona, España) a las muestras y se centrifugaron. Tras el centrifugado, las soluciones presentaban un gradiente de densidad. La capa superior del gradiente se eliminó mediante una pipeta Pasteur y la solución resultante se filtró mediante un filtro de 0,45μm de diámetro (Millipore Membrane filters HAWP02500, Merck-Millipore Corporation, Darmstadt, Alemania). Los filtros se dejaron secar durante una noche en un horno a 37°C y se transfirieron a portaobjetos para microscopia mediante un vaporizador de acetona (JS Holdings 240v/110v, JS Holding, Hertfordshire, Reino Unido) para su posterior interpretación.
Recuento de cuerpos de amianto mediante microscopia ópticaLos filtros se examinaron al microscopio óptico (CX21FS2; Olympus Life Science Europe GmbH, Hamburgo, Alemania) con un aumento de 400×. De acuerdo con los criterios establecidos por el grupo de trabajo de la Sociedad Respiratoria Europea en 1998, los niveles de amianto superiores a 1 CA/ml de LBA o 1.000 CA/g de tejido seco se consideraron potencialmente causantes de enfermedad7.
Análisis estadísticoLos datos se expresan mediante la mediana y el intervalo (r). En un análisis inicial con la prueba de Kolmogorov-Smirnov, los valores de CA no siguieron una distribución normal, por lo que las diferencias entre grupos se determinaron mediante la prueba de Wilcoxon. Para establecer las relaciones entre los parámetros analizados se calculó el coeficiente de correlación de Spearman. La consistencia de los niveles de CA en el LBA se estimó evaluando la sensibilidad y la especificidad del método, los valores predictivos positivos y negativos, y la razón de probabilidad de un valor positivo (RP+) y negativo (RP−) así como los correspondientes intervalos de confianza del 95% (IC del 95%) mediante el método de Wilson15. Se construyeron curvas de características operativas del receptor (ROC) para determinar el punto de corte de CA/ml de LBA más discriminativo para predecir una ERA. El análisis estadístico se efectuó con el programa informático Graph Pad (2002-2005).
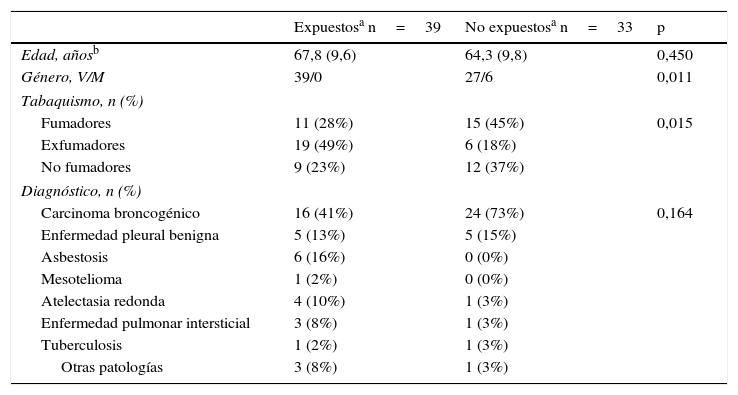
ResultadosCaracterísticas clínicas de la población del estudioLas características iniciales de los 72 pacientes se muestran en la tabla 1. Predominaron los pacientes varones y los fumadores o exfumadores. Treinta y tres pacientes comunicaron no tener conocimiento de exposición a amianto. A 40 pacientes se les había diagnosticado carcinoma, a 10 enfermedad pleural benigna, a seis asbestosis, a uno mesotelioma, a 5 atelectasia redonda, a 4 enfermedad pulmonar de origen desconocido, a 2 tuberculosis y a 4 otras patologías (bronquiectasias, enfermedad pulmonar obstructiva crónica, aneurisma aórtico y carcinoma escamoso esofágico). Se observaron diferencias significativas entre los pacientes expuestos y los no expuestos en relación con el sexo y el tabaquismo (p=0,011 y 0,015, respectivamente).
Características demográficas de la población del estudio
| Expuestosa n=39 | No expuestosa n=33 | p | |
|---|---|---|---|
| Edad, añosb | 67,8 (9,6) | 64,3 (9,8) | 0,450 |
| Género, V/M | 39/0 | 27/6 | 0,011 |
| Tabaquismo, n (%) | |||
| Fumadores | 11 (28%) | 15 (45%) | 0,015 |
| Exfumadores | 19 (49%) | 6 (18%) | |
| No fumadores | 9 (23%) | 12 (37%) | |
| Diagnóstico, n (%) | |||
| Carcinoma broncogénico | 16 (41%) | 24 (73%) | 0,164 |
| Enfermedad pleural benigna | 5 (13%) | 5 (15%) | |
| Asbestosis | 6 (16%) | 0 (0%) | |
| Mesotelioma | 1 (2%) | 0 (0%) | |
| Atelectasia redonda | 4 (10%) | 1 (3%) | |
| Enfermedad pulmonar intersticial | 3 (8%) | 1 (3%) | |
| Tuberculosis | 1 (2%) | 1 (3%) | |
| Otras patologías | 3 (8%) | 1 (3%) | |
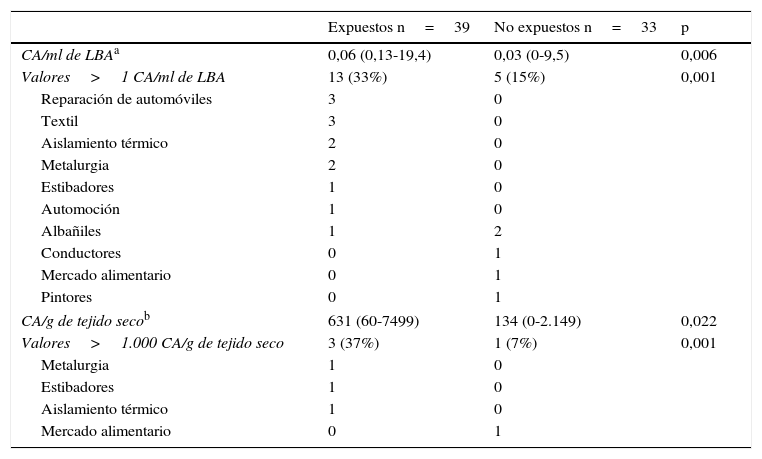
En la tabla 2 se muestran los niveles de CA/ml de LBA y CA/g de tejido pulmonar seco de los pacientes expuestos y no expuestos. De los 39 pacientes no expuestos, 13 (33%) mostraron valores de CA superiores a 1 CA/ml de LBA, con un valor mediano de 0,06 (r: 0,13-19,4) De los 33 pacientes no expuestos, 5 (15%) mostraron valores de CA superiores a 1 CA/ml de LBA, con un valor mediano de 0,03 (r: 0-9,5). Uno de estos pacientes residía en Cerdanyola del Vallès. La diferencia entre los niveles de CA de los pacientes expuestos y los no expuestos fue significativa (p=0,006).
Niveles de CA en LBA y tejido pulmonar en la población del estudio
| Expuestos n=39 | No expuestos n=33 | p | |
|---|---|---|---|
| CA/ml de LBAa | 0,06 (0,13-19,4) | 0,03 (0-9,5) | 0,006 |
| Valores>1 CA/ml de LBA | 13 (33%) | 5 (15%) | 0,001 |
| Reparación de automóviles | 3 | 0 | |
| Textil | 3 | 0 | |
| Aislamiento térmico | 2 | 0 | |
| Metalurgia | 2 | 0 | |
| Estibadores | 1 | 0 | |
| Automoción | 1 | 0 | |
| Albañiles | 1 | 2 | |
| Conductores | 0 | 1 | |
| Mercado alimentario | 0 | 1 | |
| Pintores | 0 | 1 | |
| CA/g de tejido secob | 631 (60-7499) | 134 (0-2.149) | 0,022 |
| Valores>1.000 CA/g de tejido seco | 3 (37%) | 1 (7%) | 0,001 |
| Metalurgia | 1 | 0 | |
| Estibadores | 1 | 0 | |
| Aislamiento térmico | 1 | 0 | |
| Mercado alimentario | 0 | 1 | |
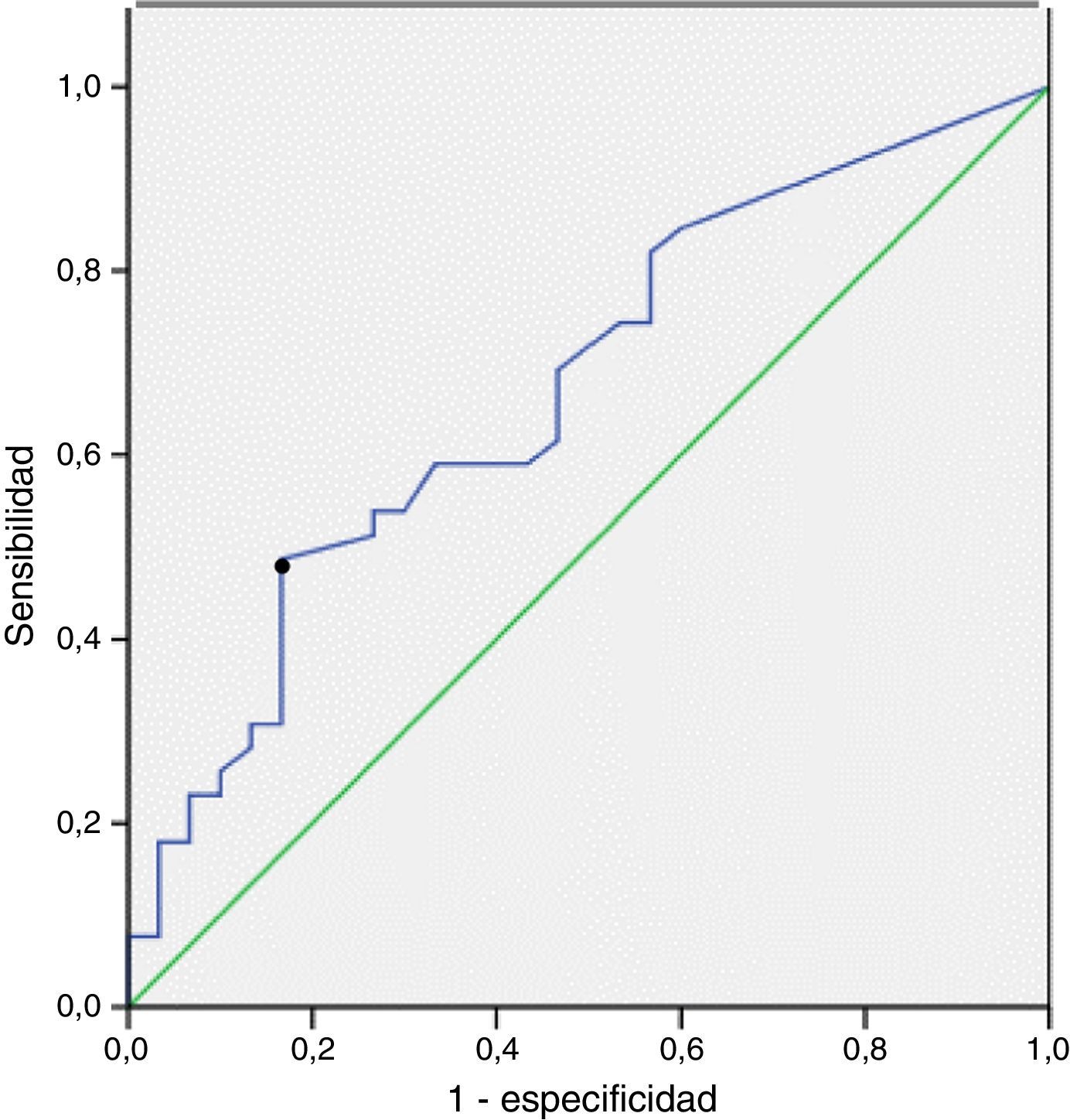
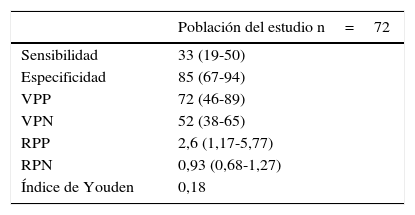
La sensibilidad, la especificidad y los valores predictivos positivo y negativo de CA en el LBA para el diagnóstico de ERA, según la exposición determinada a partir de registros laborales, se muestran en la tabla 3. La sensibilidad y la especificidad para el diagnóstico de ERA de los niveles de CA superiores a 1 CA/ml de LBA fueron de un 33% (IC del 95%: 19-50) y un 85% (IC del 95%: 67-94), respectivamente. La curva ROC mostró el punto de corte más relevante de CA/ml de LBA para la predicción de una ERA. El área bajo la curva ROC fue de 0,7. El valor de 0,5 CA/ml de LBA fue el que mostró mayor sensibilidad, un 46% (IC del 95%: 29-84), con una especificidad de un 83% (IC del 95%: 68-96) (fig. 2).
Sensibilidad y especificidad de la cuantificación de CA en LBA para el diagnóstico de ERA
| Población del estudio n=72 | |
|---|---|
| Sensibilidad | 33 (19-50) |
| Especificidad | 85 (67-94) |
| VPP | 72 (46-89) |
| VPN | 52 (38-65) |
| RPP | 2,6 (1,17-5,77) |
| RPN | 0,93 (0,68-1,27) |
| Índice de Youden | 0,18 |
RPN: razón de probabilidad negativa; RPP: razón de probabilidad positiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los datos se expresan en % (IC del 95%).
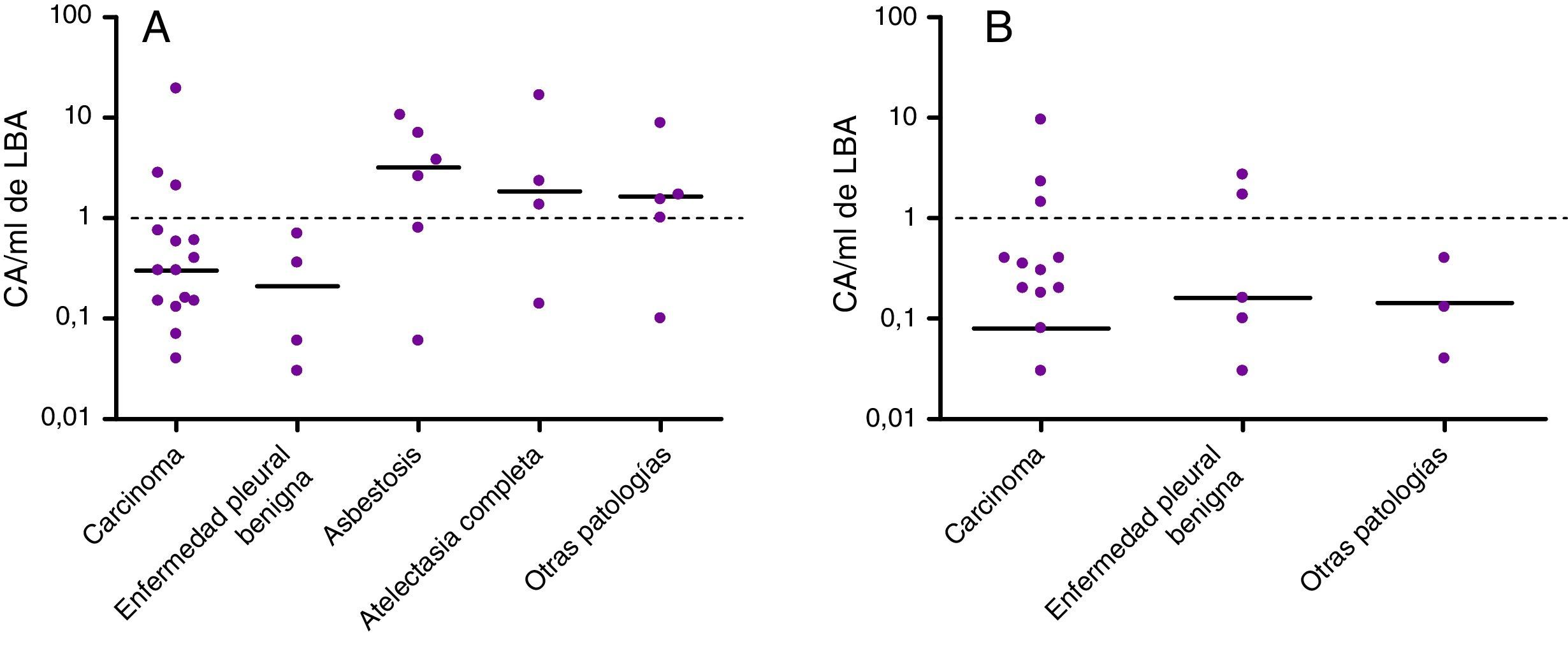
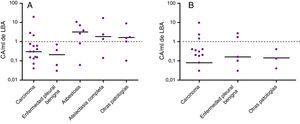
En la figura 3 se presentan los niveles de CA en el LBA en las diferentes patologías. Seis de los 40 pacientes con cáncer de pulmón (15%) presentaban niveles elevados de CA en el LBA: 3 (19%) de los 16 expuestos a amianto y 3 (12%) de los 24 no expuestos. Solo 2 de los 10 pacientes con enfermedades pleurales benignas por amianto (ambos no expuestos) mostraron niveles elevados de CA en el LBA. De los 6 pacientes con diagnóstico de asbestosis, 4 (todos ellos expuestos a amianto) mostraron niveles elevados de CA en el LBA. Tres de los 5 pacientes con atelectasia redonda (todos ellos previamente expuestos a amianto) mostraron niveles elevados de CA.
Cuerpos de amianto en el tejido pulmonar y correlación entre los cuerpos de amianto en el lavado broncoalveolar y en el tejido pulmonarLas medianas obtenidas fueron de 631 (r: 60-7.499) y 134 (r: 0-2.149) CA/g de tejido seco en los pacientes expuestos y no expuestos, respectivamente (tabla 2). Tres (37%) pacientes del grupo expuesto y uno (7%) del grupo no expuesto presentaron valores superiores a 1.000 CA/g.
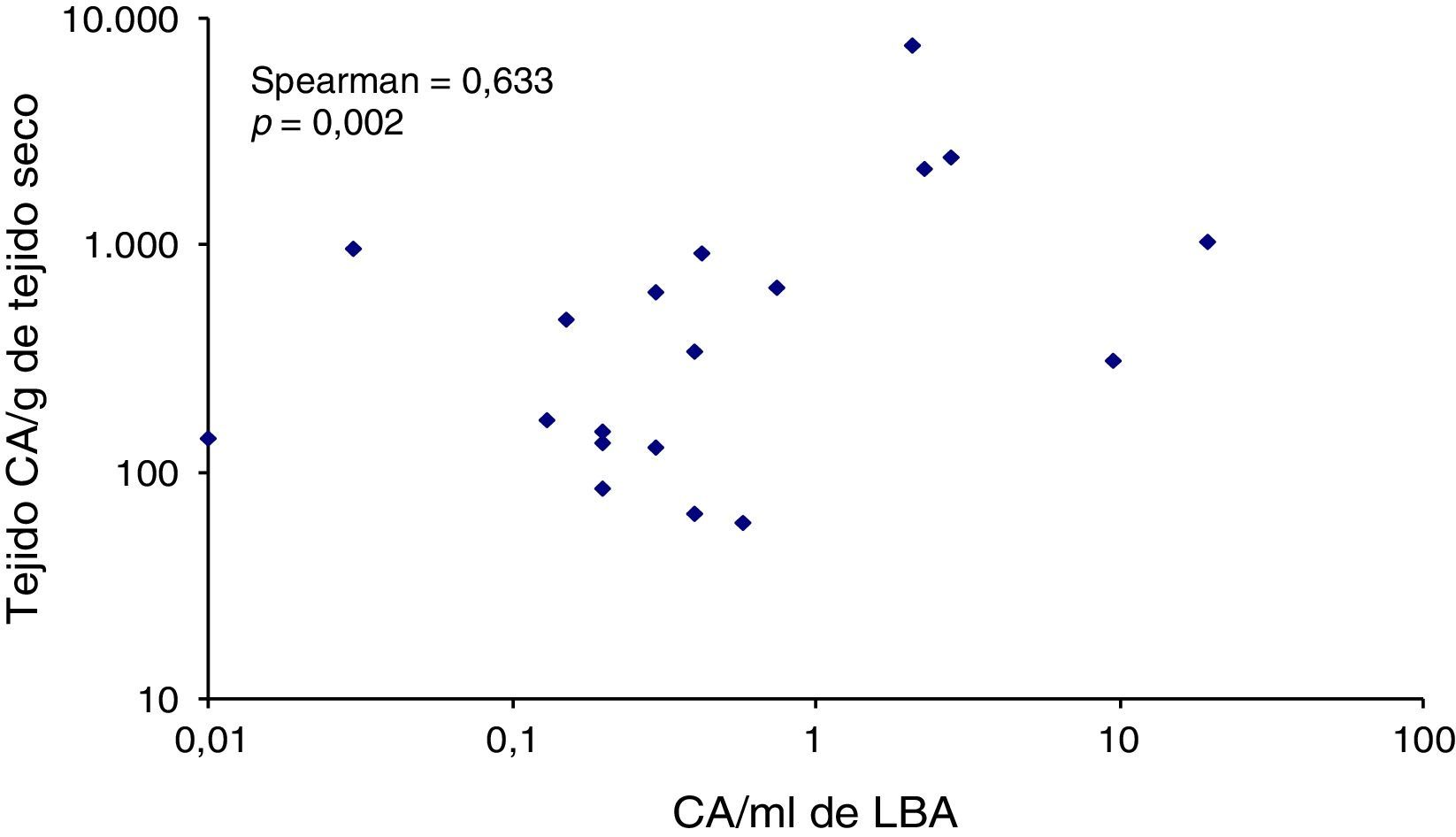
En la figura 4 se muestra la correlación entre los niveles de CA/ml de LBA y de CA/g de tejido pulmonar, con un coeficiente de rango de Spearman de 0,633 (p=0,002). Ninguno de los 4 pacientes con niveles superiores a 1.000 CA/g de tejido pulmonar presentó valores inferiores a 1 CA/ml de LBA, mientras que en un paciente con adenocarcinoma pulmonar y niveles elevados de CA en el LBA, la presencia de CA en el tejido pulmonar no se confirmó.
DiscusiónNuestro estudio mostró un buen grado de correlación (0,63) entre los niveles de CA en el pulmón y en el LBA. Además, no observamos discrepancias clínicamente significativas entre estas 2 determinaciones; solo en un paciente con cáncer de pulmón, los niveles elevados de CA en el LBA no pudieron confirmarse en el tejido pulmonar. El valor de 0,5 CA/ml de LBA fue el que alcanzó mayor sensibilidad (46%, intervalo 29-84%) para el diagnóstico de una ERA, con una especificidad de un 83% (intervalo 68-96%).
Los resultados del presente estudio confirman, por primera vez en España, la utilidad diagnóstica de la cuantificación de las CA en el LBA. La carga pulmonar de amianto se considera una prueba objetiva de la exposición a este silicato en el pasado y se ha propuesto que su determinación es una herramienta útil en caso de sospecha una enfermedad relacionada con el amianto en pacientes cuya noción de exposición no es clara7. Debido a la dificultad de obtención de muestras de pulmón para su análisis, se han examinado métodos diagnósticos menos invasivos. La sensibilidad del análisis de esputo es motivo de controversia16-19, pero varios autores han determinado la carga pulmonar de amianto en el LBA7,20-22. El presente estudio respalda esta idea debido a la significativa correlación observada entre los recuentos de CA en el LBA y en el tejido pulmonar. En estudios anteriores, se habían observado grados de correlación entre estos valores de alrededor de 0,723,24. En nuestro estudio, la correlación fue algo inferior, de 0,63, lo que probablemente fue debido a las características de la muestra de pacientes: los porcentajes de pacientes no expuestos en los estudios anteriores fueron muy bajos, entre un 7 y un 8%, mientras que en nuestra serie este porcentaje fue alto, de un 46%23,24. En pacientes con niveles bajos de CA, el análisis de amianto en muestras biológicas es menos sensible y la variabilidad en los resultados es más alta debido a las técnicas de lavado broncoalveolar y recuento de cuerpos de amianto7.
En nuestra serie, la fiabilidad del recuento de CA en el LBA para el diagnóstico de ERA fue satisfactoria. En todos los pacientes con recuentos elevados de CA en pulmón, los recuentos de CA en el LBA también fueron altos y solo en un caso los niveles elevados en el LBA no pudieron confirmarse en el pulmón. Este paciente, que había trabajado como conductor, no comunicó exposición a amianto. La diferencia en los resultados obtenidos en pulmón y en el LBA podría ser debida a variaciones en los análisis realizados, que incluyeron diferentes áreas pulmonares17. Como conclusión, la experiencia de nuestro laboratorio muestra que la determinación de CA en el LBA es una buena alternativa al examen pulmonar para determinar la exposición a amianto y ofrece la ventaja de ser menos invasiva para el paciente.
El presente estudio subraya las dificultades que existen en la práctica clínica para verificar la exposición a amianto. En general, el rendimiento diagnóstico del LBA para determinar la exposición fue moderado, como reflejó el índice de Youden, de 0,18. Aunque en este estudio observamos que el umbral más sensible y específico del recuento de CA en el LBA era de 0,5, el umbral aceptado a nivel internacional es de 1, por lo que calculamos nuestro rendimiento diagnóstico de acuerdo con este último valor. Solo un 33% de los pacientes que comunicaron algún grado de exposición a amianto presentaron recuentos de CA superiores a 1ml. Un hallazgo sorprendente, aunque ya había sido observado en estudios anteriores25, son los bajos recuentos de CA en el LBA de pacientes expuestos. La explicación más probable es la diferencia entre la exposición y la retención. La mayor parte del amianto importado correspondió a crisotila, cuya eliminación es más rápida que la de otras fibras de amianto. Según esta hipótesis, gran parte del amianto inhalado sería eliminado, lo que explicaría la negatividad observada en los análisis de LBA efectuados muchos años más tarde. De hecho, datos recientes de nuestro grupo han revelado que gran parte de las fibras de amianto retenidas en los pulmones de la población española son anfíboles (información no publicada). Además, esta limitación de la sensibilidad puede aumentar de forma directamente proporcional al tiempo de latencia7, lo que indica que el análisis de la carga pulmonar de amianto no puede sustituir a la anamnesis en la evaluación inicial de los pacientes. Por consiguiente, la noción de exposición previa debe continuar siendo la piedra angular para el diagnóstico de las ETA. El examen del LBA es pues una opción práctica para establecer la exposición definitiva de los pacientes que refieren información confusa durante la anamnesis.
Sin embargo, nuestros resultados también destacan las limitaciones de la anamnesis para verificar de manera fiable la exposición a amianto en el pasado. Los niveles de CA en el LBA fueron altos en un 50% de los pacientes no expuestos. Como han señalado otros autores25, es posible que se continúe infrarreconociendo la exposición profesional, ambiental o doméstica desconocida, y este hecho supone un desafío para los médicos que tratan ERA. Los factores responsables del desconocimiento de la exposición en el pasado son diversos e incluyen la falta de información sobre las actividades y los productos existentes en el medio de trabajo del sujeto, así como su incapacidad para recordar información concreta del pasado lejano. Un ejemplo es el caso de un paciente de nuestra serie que no comunicó exposición a amianto, pero presentaba niveles elevados de CA en el LBA; este paciente había residido en Cerdanyola del Vallès, una ciudad con altos niveles ambientales de amianto demostrados, debido a la vecindad de una fábrica de fibrocemento.
Los niveles de CA en el LBA variaron según la enfermedad específica. En el cáncer de pulmón, un 15% de los pacientes presentaban recuentos altos de CA, lo que indican que, en nuestro medio, la exposición al amianto se debería investigar como posible factor de riesgo de cáncer de pulmón. Dado el efecto aditivo del amianto y el tabaquismo, el amianto constituye un importante problema de salud en España, país en el que el porcentaje de fumadores continúa siendo alto. Es más, la atribución del cáncer de pulmón al amianto es particularmente difícil en los pacientes fumadores, y esta cuestión suele tener implicaciones legales26,27.
La relevancia de los niveles elevados de CA en el LBA depende de la enfermedad que se pretende diagnosticar. En nuestra serie, en pacientes con mesotelioma, atelectasia redonda o enfermedades pleurales benignas, los niveles elevados de CA confirmaron el diagnóstico, mientras que en pacientes con asbestosis, la detección de niveles elevados (66%) respaldó un diagnóstico específico y ayudó a descartar otras enfermedades intersticiales.
El estudio presenta algunas limitaciones. No se pudo evaluar la exposición a amianto mediante una matriz y es posible que los pacientes refirieran la exposición de forma poco precisa. Asimismo, debido a que los resultados de las pruebas corresponden a pacientes de Barcelona, una ciudad industrial, estos no se pueden extrapolar a sujetos residentes en áreas rurales. Finalmente, los pacientes con mesotelioma no fueron incluidos, por lo que nuestros resultados no son aplicables a esta patología.
Para concluir, nuestros resultados demuestran que el análisis de CA en el LBA podría ser un método fiable para verificar el contenido pulmonar de amianto en la población española. A pesar de que su limitada sensibilidad no permite que la evaluación de las CA en el LBA reemplace a la anamnesis como prueba de elección para establecer la exposición a amianto, representa una buena opción en los casos en los que la historia clínica es confusa.
AutoríaConcepción y diseño: MJC y JF. Análisis e interpretación: DAS, VC, JG, MC, LP y ASF. Redacción del contenido intelectual relevante del manuscrito: MJC y JF.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este proyecto fue financiado a través de la beca Fis PI07/90478 (Instituto de Salud Carlos III, Madrid), la Fundació Catalana de Pneumologia (FUCAP) y la Sociedad Española de Patología Respiratoria (SEPAR). MJC dispone de una subvención del programa de investigación Miguel Servet del Instituto de Salud Carlos III (CP12/03101).