Determinar la prevalencia de trombosis de muñón arterial (TMA) en cirugías de resección pulmonar por carcinoma broncogénico, y describir su evolución radiológica y tratamiento.
Material y métodosEstudio observacional y retrospectivo de casos de TMA detectados mediante angiotomografías con contraste intravenoso (TAC). La comparación de variables clínicas, radiológicas, y el análisis de supervivencia mediante curvas de Kaplan-Meier, se realizó planteando 3 grupos: pacientes con TMA, pacientes con tromboembolismo pulmonar (TEP) y pacientes sin TMA ni TEP.
ResultadosSe detectaron 9 TMA en 473 cirugías (1,9%), 6 de ellas en el lado derecho (67% de las TMA), con una mediana de tiempo de detección desde la cirugía de 11,3 meses (rango intercuartílico 2,7-42,2 meses). Salvo el número de TAC en pacientes con TMA comparados con el grupo sin TEP ni TMA, y la recidiva tumoral en pacientes con TEP en comparación con los restantes 2 grupos, no se encontraron diferencias estadísticamente significativas en las características basales ni en las oncológicas. Igualmente no se encontraron diferencias en el análisis de supervivencia.
ConclusionesEn nuestra serie, la TMA fue una patología infrecuente que tendió a localizarse en las cirugías del lado derecho, y cuya detección a lo largo del tiempo fue variable. No se asoció a factores de riesgo previos a la cirugía ni tuvo predisposición en relación con la estirpe histológica, estadificación oncológica o recidiva tumoral.
To determine the prevalence of arterial stump thrombosis (AST) after pulmonary resection surgery for lung cancer and to describe subsequent radiological follow-up and treatment.
Material and methodsObservational, descriptive study of AST detected by computerized tomography angiography (CT) using intravenous contrast. Clinical and radiological variables were compared and a survival analysis using Kaplan-Meier curves was performed after dividing patients into 3 groups: patients with AST, patients with pulmonary embolism (PE), and patients without AST or PE.
ResultsNine cases of AST were detected after a total of 473 surgeries (1.9%), 6 of them in right-sided surgeries (67% of AST cases). Median time to detection after surgery was 11.3 months (interquartile range 2.7-42.2 months), and range 67.5 months (1.4-69.0 months). Statistically significant differences were found only in the number of CTs performed in AST patients compared to those without AST or PE, and in tumor recurrence in PE patients compared to the other 2 groups. No differences were found in baseline or oncological characteristics, nor in the survival analysis.
ConclusionsIn this series, AST prevalence was low and tended to occur in right-sided surgeries. Detection over time was variable, and unrelated to risk factors previous to surgery, histopathology, and tumor stage or recurrence. AST had no impact on patient survival.
La presencia de trombosis en el muñón arterial (TMA) de cirugías de resección pulmonar ha sido descrita previamente aunque no estudiada de forma exhaustiva, particularmente en lo referente a las implicaciones pronósticas y la conducta terapéutica a seguir. Desde que en 1966 fueron descritos los primeros 2 casos de TMA en neumonectomías1, en la literatura se pueden encontrar solamente 2 estudios2,3, pequeñas series y casos aislados, todos de tipo retrospectivo. A pesar de que clásicamente se asumía la escasa trascendencia de este hallazgo, en los últimos años se ha comunicado un número creciente de casos con complicaciones asociadas4-11, dada la generalización de las pruebas de imagen en el seguimiento, y la mejora de la resolución de estas.
Los objetivos principales de nuestro estudio fueron determinar la prevalencia de TMA en cirugías de resección pulmonar por carcinoma broncogénico, identificando factores de riesgo previos a la intervención y los inherentes a la cirugía, y describir su evolución posterior en lo referente a su seguimiento radiológico y tratamiento. El objetivo secundario fue establecer las diferencias clínicas, oncológicas y pronósticas entre pacientes con TMA, aquellos que no presentaron trombosis de ningún tipo, y los que tuvieron tromboembolismo pulmonar (TEP).
Material y métodosDiseñoEstudio observacional y retrospectivo de la cohorte histórica de pacientes intervenidos de resección pulmonar por cáncer broncogénico. De acuerdo a las indicaciones del Comité de Ética local, dadas las características observacionales y retrospectivas del estudio, no se requirió consentimiento informado. La redacción del trabajo se adhirió a la iniciativa STROBE12.
Escenario y población de estudioEl Hospital Universitario 12 de Octubre es un hospital universitario docente de tercer nivel con una población de referencia aproximada de 500.000 habitantes. Se consideraron elegibles los pacientes intervenidos de cirugías de resección pulmonar desde enero de 2006 a junio de 2012, y se incluyeron los que reunían los siguientes criterios de inclusión: a)pacientes con diagnóstico clínico de carcinoma broncogénico previo a la cirugía; b)haber sido intervenidos mediante toracotomía abierta y resección anatómica (lobectomía o neumonectomía); c)con seguimiento mínimo de 3años, y d)disponibilidad de angiotomografía (TAC) con contraste intravenoso en el seguimiento posterior a la cirugía. Se excluyeron los pacientes fallecidos en las 2 semanas posteriores a la cirugía y los pacientes con resecciones sublobares. El seguimiento finalizó el 25 de mayo de 2015, y la recogida de datos se realizó de junio a agosto de 2015.
La cohorte fue conformada empleando los registros de la actividad quirúrgica de cirugía torácica durante los años referidos, mientras que el seguimiento y el resto de variables clínicas y supervivencia fueron obtenidos mediante la revisión de todos los informes clínicos disponibles en el archivo, documental y digital de nuestro hospital y de otros centros de la comunidad de Madrid con el programa HORUS, incluyendo visitas a urgencias, ingresos hospitalarios e informes de consulta externa. Finalmente, las variables radiológicas se recabaron con la revisión de las imágenes e informes de todos los estudios realizados a estos pacientes disponibles en el repositorio digital de nuestro hospital. De acuerdo a la normativa SEPAR sobre profilaxis de enfermedad tromboembólica venosa (ETEV)13, se asumieron todas las cirugías como de alto riesgo, empleándose medidas físicas (medias de compresión) durante el ingreso hospitalario, y dosis de heparinas de bajo peso molecular de 2 a 6h antes de la cirugía. Respecto al seguimiento clínico, los pacientes se citaron 2 semanas, 3 meses, 6 meses y 12 meses después de la cirugía, y después se realizaron visitas anuales. El seguimiento fue radiológico, con TAC con contraste intravenoso en la visita de los meses 3 y 12 tras la cirugía, y luego anualmente.
Variables analizadasVariables de resultado. La variable principal fue la presencia radiológica de trombo en el muñón arterial, definido como la formación de un trombo localizado y adherido a la sutura arterial de cirugías de resección pulmonar y manifestado como un defecto de repleción visible en la luz del mismo. En el caso del análisis de supervivencia, la variable resultado fue la de muerte de cualquier causa.
Se recogieron otras variables de tipo clínico, quirúrgico, oncológico y radiológico.
Clínicas: ETEV, ya sea trombosis venosa profunda (TVP) o TEP, definido este último como el enclavamiento en las arterias pulmonares de un trombo desprendido (émbolo) desde alguna parte del territorio venoso14; hipertensión arterial (sistólica/diastólica >140/90mmHg o tratamiento antihipertensivo); diabetes mellitus (glucemias en ayunas >125mg/dl en 2 o más mediciones o tratamiento hipoglucemiante); fibrilación auricular (diagnosticada por electrocardiografía y/o tratamiento antiarrítmico); obesidad (índice de masa corporal ≥30kg/m2) y obstrucción crónica al flujo aéreo (volumen espirado máximo en el primer segundo [FEV1] <80%), todas estas de forma dicotómica.
Quirúrgicas y radiológicas: tipo de intervención (lobectomía superior o inferior derecha o izquierda, lobectomía media, bilobectomía y neumonectomía derecha o izquierda); si fue necesaria una técnica de reconstrucción arterial; número de TAC con contraste intravenoso; hipertensión pulmonar posterior a la cirugía y diagnosticada por ecocardiografía transtorácica.
Oncológicas: estirpe histológica y estadificación oncológica de acuerdo a las clasificaciones internacionales15,16 con el informe anatomopatológico de la pieza quirúrgica; recidiva tumoral y fallecimientos.
Asociadas al TEP: en los pacientes donde se documentó TMA se recogieron los siguientes datos: tratamiento anticoagulante; resolución radiológica y trastorno de hipercoagulabilidad, de forma dicotómica; duración del tratamiento anticoagulante en días, y los períodos entre la cirugía, aparición y resolución de la trombosis en meses, si es que se dio.
Las variables clínicas previas a la cirugía se recogieron del informe de alta de la cirugía, y el resto de variables empleando las bases de datos referidas en el apartado «Escenario y población de estudio». Las TAC fueron revisadas por 2 radiólogos con experiencia en radiología cardiotorácica y en el diagnóstico de TEP (EPG, TYRO), y la estadificación fue consensuada por 2 investigadores independientes (DLP y JSC).
EstadísticaEl análisis estadístico fue llevado a cabo mediante SPSS versión 21.0 (SPSS Inc., Chicago, IL). Los pacientes fueron divididos en 3 grupos: «sin TEP ni TMA», «TEP» y «TMA». Las variables cualitativas son presentadas como números absolutos y porcentajes, mientras que las variables cuantitativas como medias ±desviaciones estándar, o medianas con rango intercuartílico, según sea el caso. La distribución normal de las variables fue evaluada con el test de Kolmogorov-Smirnov. La diferencia entre las características dicotómicas de los grupos de estudio se presenta como odds ratio (OR) calculadas por correlación logística, y mediante el test t de Student para muestras independientes o el de U de Mann-Whitney en el caso de las variables cuantitativas, en función de su distribución. Un valor p menor de 0,05 se consideró estadísticamente significativo.
Como análisis secundarios, se realizó un análisis de supervivencia de los 3 grupos propuestos mediante el test de Kaplan-Meier y comparados mediante el test de log-rank, a partir de la cirugía, y se consideraron variables clínicas, propias de la cirugía y oncológicas, para el análisis de pacientes con aparición de TMA divididos en los subgrupos «antes de 12 meses» y «después de 12 meses» a partir de la cirugía.
Se consideraron «pérdidas de seguimiento» en aquellos pacientes donde la variable principal no pudo establecerse al final del estudio, es decir, la presencia de TMA. No obstante, no fueron excluidos del análisis final y se consideró la información recogida en su último contacto con personal sanitario y del que se haya tenido acceso informático, a efecto de los cálculos estadísticos. Finalmente, previendo un escaso número de pacientes con la variable principal de estudio, no se plantearon análisis de sensibilidad.
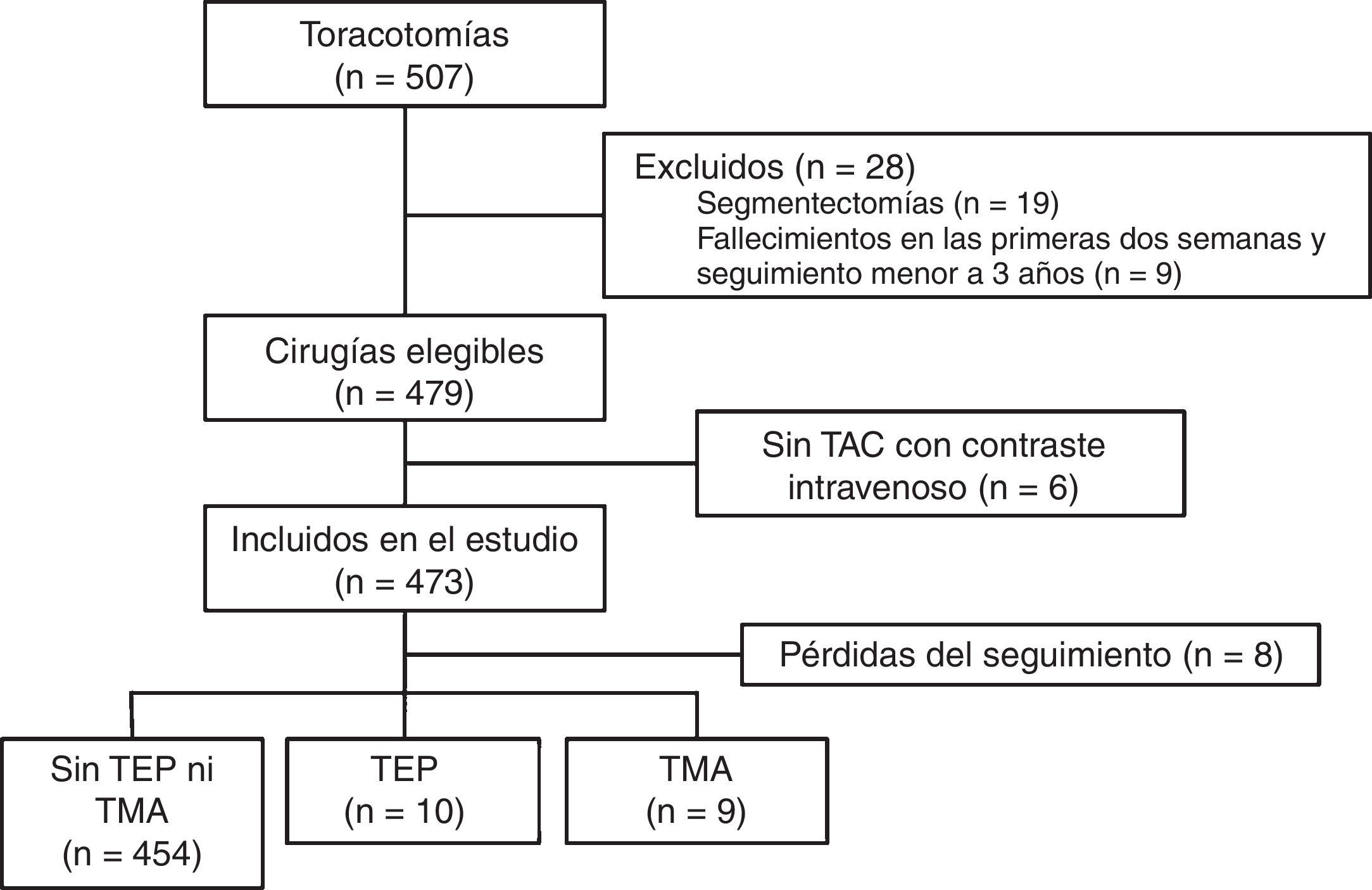
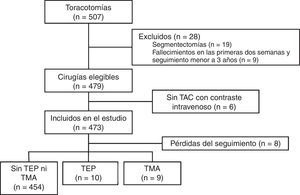
ResultadosDurante el periodo de estudio se realizaron 507 toracotomías, de las cuales se excluyeron 19 casos (4%) por tratarse de segmentectomías; 9 pacientes (1,8%) por fallecer en las primeras 2 semanas después de la intervención, y 6 casos (1,2%) de los que no se tuvo acceso a una TAC con contraste intravenoso en el seguimiento. Por lo tanto, se incluyeron 473 cirugías, de las cuales el diagnóstico final fue carcinoma broncogénico en 471 casos (99,5%), linfoma T cutáneo con extensión a pulmón en un paciente, e infección fúngica en otro. Por el tipo de resección, 393 fueron lobectomías (83%), 61 neumonectomías (13%) y 19 resecciones simultáneas de 2 lóbulos (4%). El tipo de intervención y la estirpe histológica más frecuentes fueron la lobectomía superior derecha, con 147 pacientes (31%), y el carcinoma de células escamosas, con 213 casos (45%), respectivamente. Fueron intervenidos 388 hombres (82%), con una edad media de 65,3±9,5años. El flujo de pacientes se presenta en la figura 1, y el resto de las características basales, en la tabla 1.
Características basales previas a la cirugía
| Población total (n=473) | Sin TMA (n=464) | TMA (n=9) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Hombres | 388 (82) | 379 (82) | 9 (100) | 1,79 (0,22-14,56) | 0,58 |
| Edad (años) | 65,3 (9,5) | 65,3 (9,5) | 66 (6,8) | 1,01 (0,94-1,09) | 0,71 |
| ETEV previa | 24 (5) | 23 (5) | 1 (11) | 2,17 (0,26-18,13) | 0,47 |
| Hipertensión arterial | 208 (44) | 203 (44) | 5 (56) | 1,67 (0,44-6,31) | 0,45 |
| Diabetes mellitus | 85 (18) | 83 (18) | 2 (22) | 1,36 (0,28-6,70) | 0,70 |
| FEV1<80% | 203 (43) | 197 (42) | 6 (67) | 2,78 (0,69-11,28) | 0,15 |
Los resultados se presentan como números absolutos (%) o media (desviación estándar).
TMA: trombosis en el muñón arterial; ETEV: enfermedad tromboembólica venosa; FEV1: volumen espirado máximo en el primer segundo.
No se encontraron diferencias significativas en todas las comparaciones realizadas.
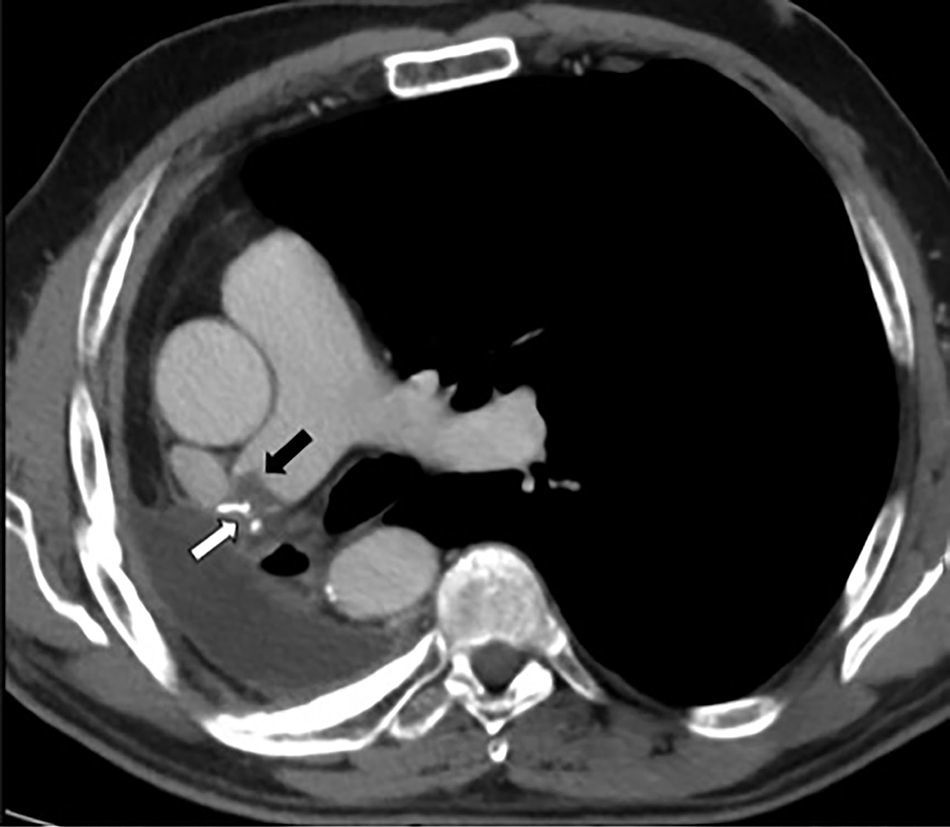
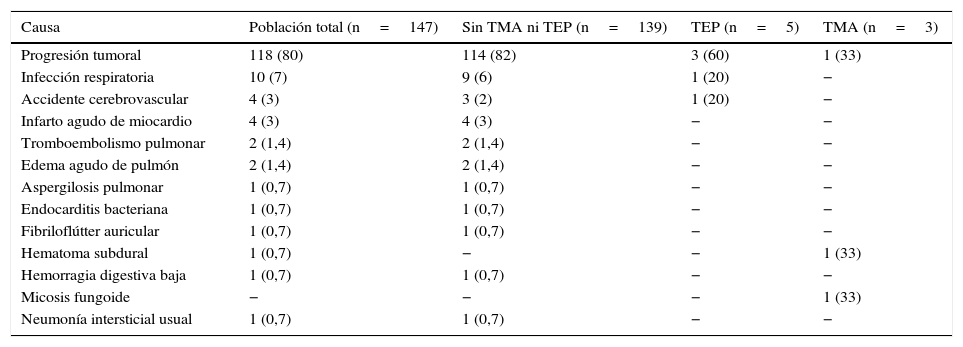
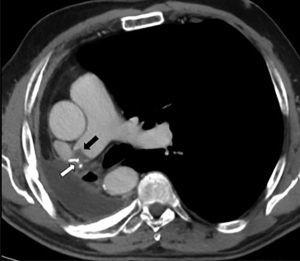
Se diagnosticaron 10 casos (2,1%) de TEP y 9 (1,9%) de TMA (fig. 2), resultando en una incidencia de 1,9 casos al año de trombosis en sutura por cada 100 pacientes operados. La tabla 2 presenta datos de variables quirúrgicas, radiológicas y oncológicas de acuerdo con los grupos de pacientes planteados. La mediana de seguimiento después de la cirugía fue de 49,4 meses (rango intercuartílico 34,8-70,1meses), documentándose 147 fallecimientos (31%). La tabla 3 presenta las causas de muerte de acuerdo a los grupos de estudio planteados.
Corte axial de tomografía computarizada multidetector tras contraste intravenoso en fase arterial, en paciente con antecedente de neumonectomía derecha. Se observa defecto de repleción compatible con trombosis del muñón arterial (flecha negra) y también se aprecian las suturas asociadas a la misma (flecha blanca).
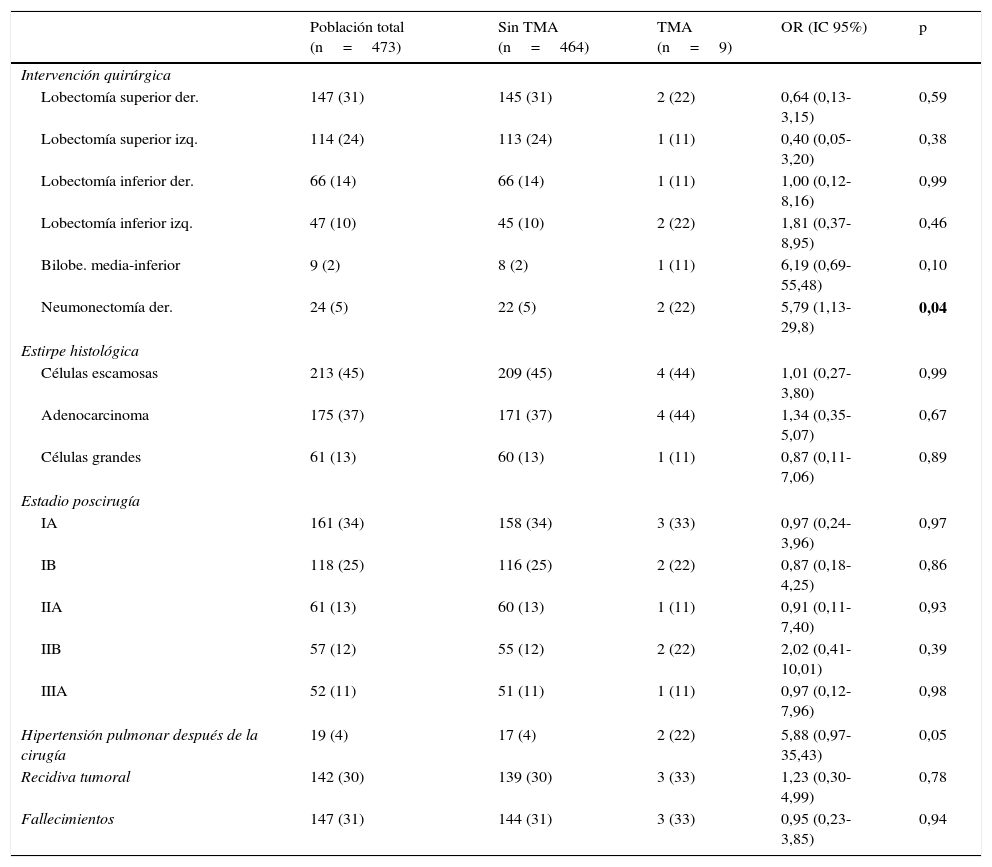
Comparación de las características quirúrgicas, oncológicas y fallecimientos en los 2 grupos conformados de acuerdo a la presentación de trombosis del muñón arterial
| Población total (n=473) | Sin TMA (n=464) | TMA (n=9) | OR (IC 95%) | p | |
|---|---|---|---|---|---|
| Intervención quirúrgica | |||||
| Lobectomía superior der. | 147 (31) | 145 (31) | 2 (22) | 0,64 (0,13-3,15) | 0,59 |
| Lobectomía superior izq. | 114 (24) | 113 (24) | 1 (11) | 0,40 (0,05-3,20) | 0,38 |
| Lobectomía inferior der. | 66 (14) | 66 (14) | 1 (11) | 1,00 (0,12-8,16) | 0,99 |
| Lobectomía inferior izq. | 47 (10) | 45 (10) | 2 (22) | 1,81 (0,37-8,95) | 0,46 |
| Bilobe. media-inferior | 9 (2) | 8 (2) | 1 (11) | 6,19 (0,69-55,48) | 0,10 |
| Neumonectomía der. | 24 (5) | 22 (5) | 2 (22) | 5,79 (1,13-29,8) | 0,04 |
| Estirpe histológica | |||||
| Células escamosas | 213 (45) | 209 (45) | 4 (44) | 1,01 (0,27-3,80) | 0,99 |
| Adenocarcinoma | 175 (37) | 171 (37) | 4 (44) | 1,34 (0,35-5,07) | 0,67 |
| Células grandes | 61 (13) | 60 (13) | 1 (11) | 0,87 (0,11-7,06) | 0,89 |
| Estadio poscirugía | |||||
| IA | 161 (34) | 158 (34) | 3 (33) | 0,97 (0,24-3,96) | 0,97 |
| IB | 118 (25) | 116 (25) | 2 (22) | 0,87 (0,18-4,25) | 0,86 |
| IIA | 61 (13) | 60 (13) | 1 (11) | 0,91 (0,11-7,40) | 0,93 |
| IIB | 57 (12) | 55 (12) | 2 (22) | 2,02 (0,41-10,01) | 0,39 |
| IIIA | 52 (11) | 51 (11) | 1 (11) | 0,97 (0,12-7,96) | 0,98 |
| Hipertensión pulmonar después de la cirugía | 19 (4) | 17 (4) | 2 (22) | 5,88 (0,97-35,43) | 0,05 |
| Recidiva tumoral | 142 (30) | 139 (30) | 3 (33) | 1,23 (0,30-4,99) | 0,78 |
| Fallecimientos | 147 (31) | 144 (31) | 3 (33) | 0,95 (0,23-3,85) | 0,94 |
Los resultados se presentan como números absolutos (%) o media (desviación estándar).
bilobe.: bilobectomía; der.: derecha; izq.: izquierda; OR: odds ratio; TMA: trombosis en el muñón arterial.
Causas de muerte, de acuerdo a los grupos de estudio
| Causa | Población total (n=147) | Sin TMA ni TEP (n=139) | TEP (n=5) | TMA (n=3) |
|---|---|---|---|---|
| Progresión tumoral | 118 (80) | 114 (82) | 3 (60) | 1 (33) |
| Infección respiratoria | 10 (7) | 9 (6) | 1 (20) | − |
| Accidente cerebrovascular | 4 (3) | 3 (2) | 1 (20) | − |
| Infarto agudo de miocardio | 4 (3) | 4 (3) | − | − |
| Tromboembolismo pulmonar | 2 (1,4) | 2 (1,4) | − | − |
| Edema agudo de pulmón | 2 (1,4) | 2 (1,4) | − | − |
| Aspergilosis pulmonar | 1 (0,7) | 1 (0,7) | − | − |
| Endocarditis bacteriana | 1 (0,7) | 1 (0,7) | − | − |
| Fibriloflútter auricular | 1 (0,7) | 1 (0,7) | − | − |
| Hematoma subdural | 1 (0,7) | − | − | 1 (33) |
| Hemorragia digestiva baja | 1 (0,7) | 1 (0,7) | − | − |
| Micosis fungoide | − | − | − | 1 (33) |
| Neumonía intersticial usual | 1 (0,7) | 1 (0,7) | − | − |
Los resultados se presentan como números absolutos (%).
TEP: tromboembolismo pulmonar; TMA: trombosis del muñón arterial.
Desde la cirugía, la mediana de tiempo de visualización de la TMA fue de 11,3meses (rango intercuartílico 2,7-42,2meses) y un rango de 67,5meses (1,4-69,0meses), de tal forma que de los 9 casos, 5 de ellos (56%) se presentaron en los 12meses inmediatos a la cirugía. De los pacientes con TMA, se inició tratamiento anticoagulante en 7 (78%). Tres pacientes (33%) fallecieron, y de estos, 2 estaban tratándose con anticoagulación: un trastorno linfoproliferativo y un hematoma subdural agudo mientras se trataba también con quimioterapia por recidiva tumoral. La mediana de la duración del tratamiento anticoagulante fue de 298días (rango intercuartílico 45-532días). En la evolución radiológica el defecto de repleción se resolvió en 6 casos (67%), 2 de ellos sin anticoagulación (22%). Tal resolución se documentó en una mediana de tiempo de 12,9meses (rango intercuartílico 3,8-20,3meses). La media de número de TAC en el seguimiento de los pacientes con TMA fue de 11,7±6,3TAC, estadísticamente superior a la media en los pacientes sin TMA o TEP, con 6,9±4,9 TAC (p=0,02).
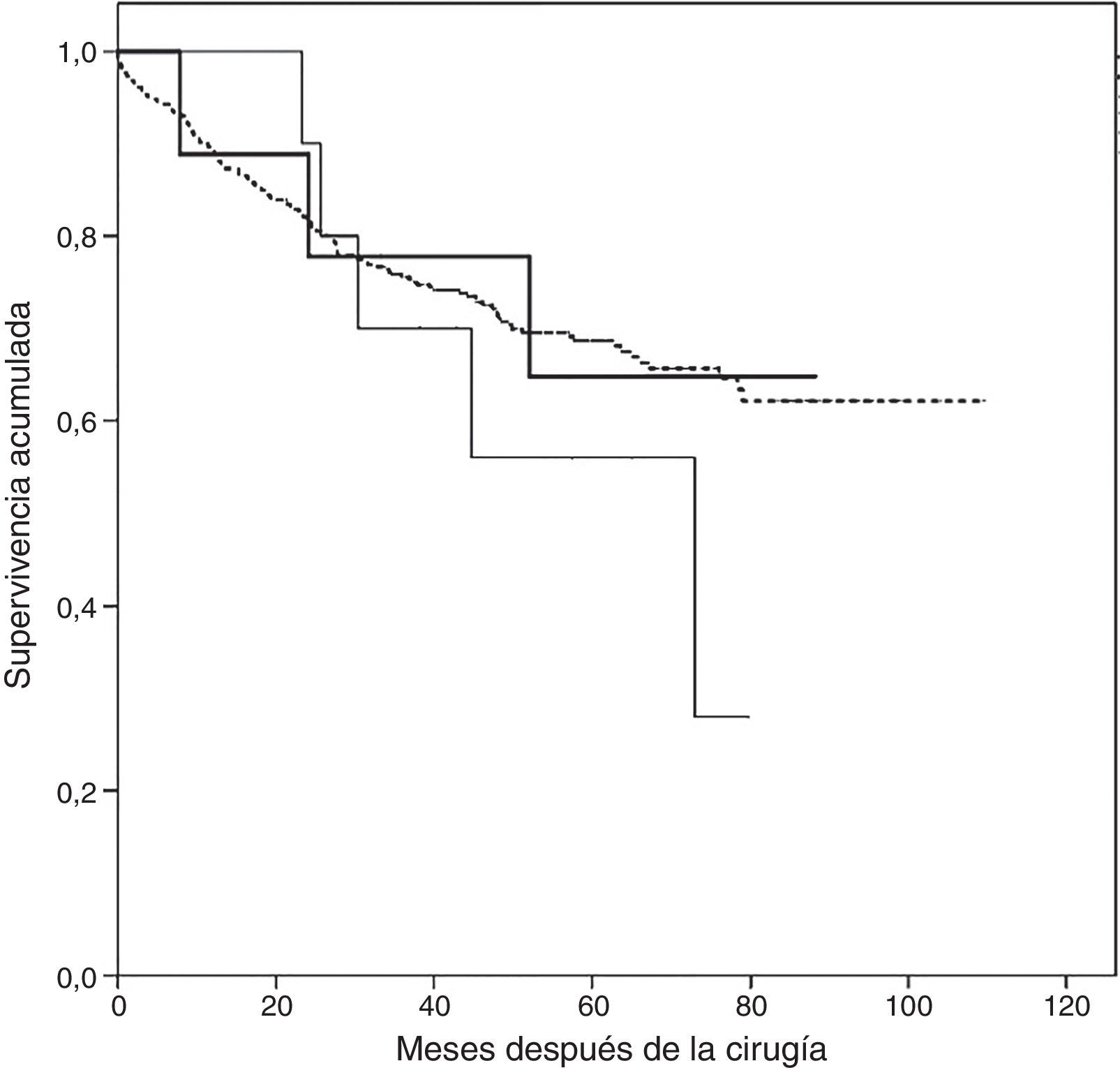
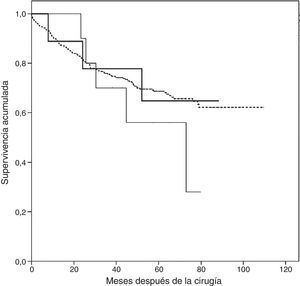
El período de seguimiento desde la aparición de la TMA fue de 44meses (rango intercuartílico 11,8-56,0meses). El análisis de supervivencia por Kaplan-Meier reveló una supervivencia acumulada mayor en los pacientes que no presentaron TEP ni TMA durante el seguimiento, con una mediana de 80,9meses (IC95%: 76,6-85,2meses), mientras que los pacientes con TMA tuvieron una mediana de 67,4meses (IC95%: 47,4-87,4), y los pacientes con un TEP presentaron la menor supervivencia con 56,9meses (IC95%: 42,1-71,8). No obstante, no se encontraron diferencias estadísticamente significativas (log-rank 1,148, p=0,56) (fig. 3).
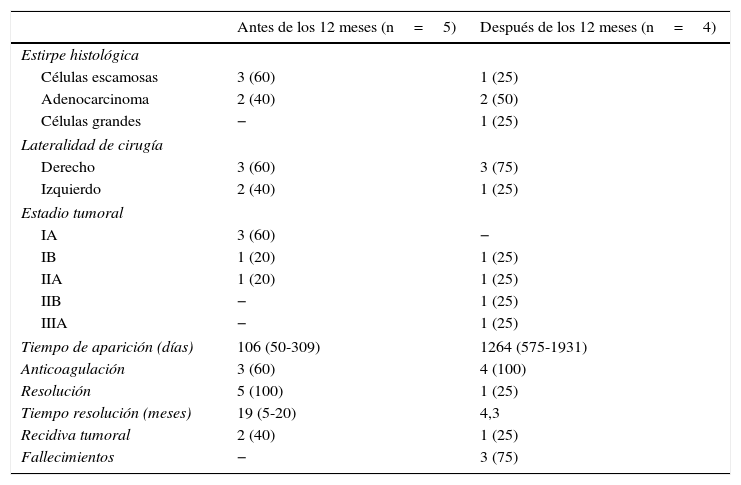
Finalmente, las características quirúrgicas, clínicas y oncológicas en el grupo de pacientes con TMA dividido en subgrupos de «antes de 12 meses» y «después de 12 meses» hasta documentarse la trombosis a partir de la cirugía, se presentan en la tabla 4.
Características oncológicas, quirúrgicas y del seguimiento de acuerdo a la aparición de la trombosis en el muñón arterial antes o después de 12 meses a partir de la intervención quirúrgica
| Antes de los 12 meses (n=5) | Después de los 12 meses (n=4) | |
|---|---|---|
| Estirpe histológica | ||
| Células escamosas | 3 (60) | 1 (25) |
| Adenocarcinoma | 2 (40) | 2 (50) |
| Células grandes | − | 1 (25) |
| Lateralidad de cirugía | ||
| Derecho | 3 (60) | 3 (75) |
| Izquierdo | 2 (40) | 1 (25) |
| Estadio tumoral | ||
| IA | 3 (60) | − |
| IB | 1 (20) | 1 (25) |
| IIA | 1 (20) | 1 (25) |
| IIB | − | 1 (25) |
| IIIA | − | 1 (25) |
| Tiempo de aparición (días) | 106 (50-309) | 1264 (575-1931) |
| Anticoagulación | 3 (60) | 4 (100) |
| Resolución | 5 (100) | 1 (25) |
| Tiempo resolución (meses) | 19 (5-20) | 4,3 |
| Recidiva tumoral | 2 (40) | 1 (25) |
| Fallecimientos | − | 3 (75) |
Los resultados se presentan como números absolutos (%) y medianas (rango intercuartílico), a menos que se especifique lo contrario.
El hallazgo más importante de nuestro estudio fue determinar la caracterización epidemiológica y clínica de las TMA en cirugías de resección pulmonar: fue una patología infrecuente; tendió a localizarse en las cirugías del lado derecho; no se asoció a factores de riesgo previos a la cirugía; no tuvo predisposición en relación con la estirpe histológica, estadio oncológico o recidiva tumoral; su aparición a lo largo del tiempo fue variable, y no tuvo repercusión en la supervivencia de los pacientes.
Referente a la prevalencia del cuadro, Kim et al.2 determinaron un total de 18 casos de TMA en 147 neumonectomías (12,2%), y con una prevalencia prácticamente idéntica, Kwek y Wittram3 objetivaron 11 trombosis en 89 pacientes (12,4%) intervenidos igualmente de neumonectomías, enfocando su estudio sobre todo a la asociación de la longitud del muñón con el cambio dinámico del flujo sanguíneo. Si bien estos 2 trabajos incluyeron únicamente neumonectomías, la prevalencia de nuestra serie en este subgrupo de cirugías sigue siendo baja, con 2 casos en 61 pacientes (3,3%). La principal razón que puede explicar estos diferentes hallazgos puede ser técnica, considerando que la sutura se realizó mediante ligadura continua hasta el primer semestre de 2010 y después se emplearon suturas mecánicas con grapas de material metálico inerte, y una segunda razón pudo ser el cumplimiento de un protocolo estricto de anticoagulación asociada al tipo de cirugía y el riesgo de ETEV, propuesto por la Sociedad Española de Neumología y Cirugía Torácica13. De tal forma que nuestros resultados se acercan más a los presentados por trabajos que han analizado la prevalencia de ETEV en cirugías torácicas en general, donde en una serie de casi 700 pacientes se determinó una prevalencia del 1,3% sin hacer mención de las TMA17, y en otra serie española se encontró una prevalencia del 0,18% en 6.004 pacientes intervenidos de cualquier cirugía torácica con 7 casos de TEP y 4 de TVP, destacando que todos los casos de TEP tenían un diagnóstico oncológico de base y 6 de ellos se habían sometido a cirugías mayores, incluyendo neumonectomías, lobectomías o segmentectomías atípicas18. Respecto a la técnica quirúrgica, Işik et al.19 determinaron en monos que en las suturas transfixiantes de neumonectomías izquierdas era más probable la formación de trombosis y su embolización, al ser comparadas con las suturas con ligadura continua.
El tipo de vaso suturado ha sido motivo de estudio previamente. Cuando las complicaciones embólicas e infartos en el caso de las TMA han sido reportadas de forma anecdótica, en el caso de las trombosis en suturas venosas sí se han asociado de forma significativa a infartos, sobre todo cerebrales. Recientemente, Yamamoto et al.20 presentaron una serie de 6 pacientes intervenidos de lobectomías superiores izquierdas complicadas por infartos cerebrales, documentándose 3 casos con trombosis en la vena correspondiente. Estudios por ultrasonografía intraoperatoria han demostrado, de igual manera, que se produce una mayor estasis sanguínea sanguínea en el muñón venoso cuando la cirugía es una lobectomía superior izquierda21. En nuestra serie no se determinó ningún infarto de órganos vitales.
La asociación del lado de la cirugía con la aparición de TMA no está claramente estudiada. Contrariamente a los 2 últimos estudios del párrafo anterior, nuestros casos de TMA fueron más frecuentes en las cirugías del lado derecho, como lo fue en los estudios de neumonectomías y TMA previamente descritos, con 19 de los 29 casos detectados (66%)2,3. Por otra parte, en las series pequeñas y casos clínicos aislados, de 7 casos presentados en neumonectomías se objetivaron TMA en 6 del lado derecho (86%)4,5,7-9, y un caso después de una lobectomía inferior derecha6. En esta línea argumental, la neumonectomía como procedimiento quirúrgico mayor se ha asociado a una mayor activación de la cascada de coagulación y, por ende, al incremento de la probabilidad de presentar una TMA, en comparación con las lobectomías22.
Nuestro estudio tiene hallazgos interesantes. Las TMA presentadas en los primeros 12 meses después de la cirugía tuvieron una mayor probabilidad de resolverse, incluso el 40% de los casos sin tratamiento anticoagulante. Por el contrario, las detectadas después del primer año de la cirugía presentaron una peor tasa de resolución, prescribiéndose tratamientos anticoagulantes prolongados en todos estos casos. Considerando la escasa casuística, la decisión de anticoagular y la duración del tratamiento todavía no cuentan con una evidencia sólida. Como eventos adversos derivados de la anticoagulación, un paciente presentó un hematoma subdural agudo, mientras se encontraba en quimioterapia activa por recidiva tumoral, y por ende no fue posible descartar o afirmar su asociación con el anticoagulante. De igual manera, encontramos un significativo mayor número de TAC en los pacientes con TMA en comparación a los pacientes sin TEP ni TMA, que parece lógico al detectarse tal hallazgo. Sin embargo, no se cuenta con ninguna evidencia sobre la frecuencia del seguimiento radiológico o su duración, siendo importante obtener dicha evidencia ante la no inocuidad de esta prueba radiológica y el considerable gasto sanitario que supone23.
El presente estudio tiene varias limitaciones. En primer lugar, al tratarse de un estudio retrospectivo la pérdida esperable de información en el seguimiento limita la fiabilidad de nuestros resultados, aunque cabe mencionar que hasta la fecha ninguno de los estudios publicados sobre TMA ha seguido un protocolo prospectivo. En segundo lugar, el escaso número de casos detectados disminuye la potencia del estudio e impide realizar un análisis multivariante que permita dilucidar posibles factores de riesgo controlables. Todas las series previas publicadas presentan una similar limitación, sin que dispongan de un análisis multivariante con más de 2 variables por la ausencia de una frecuencia suficiente de eventos2,3, concluyendo ambos en la longitud del muñón como factor asociado. En nuestra serie no fue posible realizar tal medición en todos los casos al no estar digitalizadas de forma regular las imágenes de la TAC hasta el año 2008 y a la variabilidad de las características técnicas de estas pruebas. En tercer lugar, y en consonancia con la primera limitación descrita, al no tratarse de un protocolo prospectivo los pacientes tuvieron un seguimiento irregular en cuanto a la frecuencia de estudios con TAC, sobre todo en los primeros 4 años del estudio, de tal forma que al ser evaluados por diferentes facultativos es posible que una TMA no haya podido ser detectada.
Nuestro estudio tiene también fortalezas. Es una amplia serie que no solamente incluyó neumonectomías, así como el primero en presentar un análisis de supervivencia, considerando que es también el estudio con mayor seguimiento publicado hasta la fecha. La relevancia clínica de esta patología no está ni mucho menos aclarada, y por lo tanto esta serie aporta cierta información en el conocimiento de la frecuencia y evolución de este evento postoperatorio.
En conclusión, es posible que la TMA no sea más que un hallazgo incidental y que efectivamente su curso sea benigno, aunque lo cierto es que no se sabe exactamente cómo seguirla o tratarla. Es deseable la constitución de una cohorte con mayor número de casos, destinada a su identificación, seguimiento y actitud terapéutica.
AutoríaDaniel López-Padilla participó en la recogida de datos y asume la responsabilidad de la integridad y precisión de su análisis, al igual que contribuyó con el diseño del estudio, interpretación, análisis y redacción del documento final. Esteban Peghini Gavilanes y Teresa Yolanda Revilla Ostolaza revisaron todas las pruebas de imágenes disponibles para detectar la trombosis del muñón arterial y contribuyeron en la redacción del documento final. María Dolores Trujillo e Iván Martínez Serna recopilaron todas las intervenciones quirúrgicas realizadas durante el período del estudio y contribuyeron en la redacción del documento final. Nuria Arenas Valls, Walther Girón Matute, Roberto Larrosa Barrero, Adriana Manrique Multiozábal, Marta Pérez Gallán y Annette Zevallos realizaron la recogida de datos, además de contribuir con la interpretación y redacción del documento final. Javier Sayas Catalán contribuyó sustancialmente con el diseño del estudio, interpretación, análisis y redacción del documento final.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A los doctores Pablo Gámez y Roberto del Pozo por su valiosa asesoría metodológica.