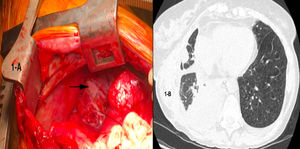
Presentamos el caso de una paciente de 64 años sometida a un trasplante unipulmonar derecho por linfangioleiomiomatosis (LAM), realizado sin complicaciones intraoperatorias ni postoperatorias inmediatas. Al séptimo día postoperatorio, presentó un débito pleural lechoso por los drenajes pleurales, con características de exudado, linfocítico, con cifra de triglicéridos de 630mg/dl, siendo diagnosticada de quilotórax derecho. Se instauró tratamiento dietético con nutrición enteral, aporte de triglicéridos de cadena media y octeótrido durante una semana. Sin embargo, ante la persistencia del quilotórax (fig. 1B), se indica tratamiento quirúrgico.
Una hora antes del procedimiento quirúrgico, se administró una solución oral de leche con mantequilla para poder localizar macroscópicamente la fístula quilosa durante la cirugía. Tras la disección del espacio paraesofágico y periaórtico, se localizó una fístula quilosa en el conducto torácico y aferentes del mismo (fig. 1A). Se procedió a la ligadura de los mismos y a la colocación de sellantes hemostáticos en superficie. La paciente evolucionó favorablemente, con resolución completa del quilotórax, encontrándose en buen estado clínico a los 12 meses de la intervención.
La LAM es una enfermedad rara multisistémica propia del sexo femenino y catalogada como una enfermedad neoplásica de bajo grado. Se caracteriza por insuficiencia respiratoria progresiva, neumotórax recidivantes, angiomiolipomas renales y enfermedad linfática (quilotórax, ascitis quilosa o linfangioleimiomas)1,2.
Radiológicamente, se caracteriza por la presencia de múltiples quistes intersticiales, redondeados y de bordes finos3. Según la ERS, el diagnóstico de LAM se establece ante la presencia de hallazgos radiológicos característicos, asociados a angiomiolipomas renales, quilotórax, ascitis quilosa, linfangiomiolipoma o adenomegalias4. En ausencia de estos, se indica una biopsia pulmonar.
El trasplante pulmonar está indicado en estadios avanzados de la enfermedad, sin respuesta a tratamiento médico, con supervivencia del 65% a los 5 años del trasplante, representando solo el 1% de las indicaciones para trasplante pulmonar según el Registro Internacional5.
Entre el 7 y el 10% de los pacientes con LAM desarrollan un quilotórax, que debe tratarse precozmente dado que conlleva un estado de desnutrición, inmunodepresión, insuficiencia respiratoria y metabólica y desequilibrio electrolítico, que pueden llevar al fallecimiento del paciente6.
En nuestro caso, el diagnóstico se sospechó al apreciar cambios en las características macroscópicas del débito de los drenajes pleurales, que coincidió con el inicio de tolerancia vía oral, y se confirmó con la determinación de triglicéridos en el exudado pleural. Se inició tratamiento con dieta exenta de grasas, triglicéridos de cadena media y octeótrido, con el fin de reducir las secreciones gastrointestinales y el flujo sanguíneo esplácnico7,8. El sirolimús también ha demostrado su eficacia en el control del quilotórax9, pero en nuestro caso concreto no se empleó por riesgos en el proceso de cicatrización tras la cirugía reciente. Sin embargo, las medidas conservadoras no fueron suficientes, sugiriendo la presencia de una solución de continuidad del conducto torácico de calibre significativo. Por tal motivo, se indicó una revisión quirúrgica del paciente.
Cuando el tratamiento conservador fracasa, como en el presente caso, se indican procedimientos invasivos como la cirugía, la pleurodesis química, los sistemas de derivación o la embolización linfática percutánea10. Estos procedimientos se contemplan cuando el débito del quilotórax sea mayor de 1 l/día durante más de 5-7 días.
Los procedimientos quirúrgicos descritos son la ligadura del conducto torácico o, en caso de no localizarlo, ligar el tejido graso que se ubica entre la aorta, los cuerpos vertebrales, el esófago y la vena ácigos. En algunos casos, se ha propuesto la pleurodesis mecánica como un método igualmente efectivo; no obstante, en el caso que nos ocupa, se desestimó este procedimiento puesto que la paciente, debido su enfermedad de base, presentaba anomalías anatómicas y morfológicas de los vasos quilíferos aferentes de la pleural parietal.
En resumen, la presencia de un quilotórax en el postoperatorio de un trasplante pulmonar por LAM requiere inicialmente un tratamiento conservador, dietético y farmacológico, de instauración precoz. Si pese a estas medidas el quilotórax fuera inagotable o recidivara tras reintroducir la dieta enteral, se debe optar por la exploración quirúrgica. En nuestro caso, por tratarse de una paciente recientemente trasplantada, se desaconsejó el tratamiento con sirolimús debido a la alta posibilidad de dehiscencias de sutura tras el reciente trasplante pulmonar.