Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) en una enfermedad crónica, progresiva e invalidante, producida por el consumo de tabaco1. Su curso progresivo se ve a menudo agravado por períodos de aumento de los síntomas, particularmente de la tos, la disnea y la cantidad y purulencia del esputo. Estos episodios son lo que conocemos por agudizaciones. La mayoría de estas agudizaciones están producidas por infecciones bronquiales: bacterianas, víricas o mixtas2.
La definición de agudización es difícil y no hay criterios clínicos universalmente aceptados, aunque la combinación de síntomas descrita por Anthonisen et al3 (incremento de la disnea y de la producción y purulencia del esputo) ha sido ampliamente utilizada. En cualquier caso, se debe evitar la confusión entre la definición de agudización y la de agudización infecciosa. Los citados criterios de Anthonisen et al3 se han utilizado para establecer la probabilidad de etiología bacteriana y la necesidad de un antibiótico, pero no deben emplearse para definir la agudización, pues infravaloraría la frecuencia de agudizaciones no infecciosas, que no cursan con combinaciones de los síntomas mencionados.
Para la definición de agudización se han propuesto 3 enfoques distintos: uno basado en síntomas de infección; otro, en síntomas generales, y un tercero basado en la utilización de recursos4. Las ventajas e inconvenientes de cada uno de ellos se resumen en la tabla I.
La definición basada en síntomas de infección deriva del trabajo mencionado de Anthonisen et al3. Desde su publicación en 1987, los criterios llamados "de Anthonisen" o "de Winnipeg" se han utilizado para decidir la necesidad o no de un tratamiento antibiótico de la agudización. Sin embargo, conviene recordar que los pacientes que participaron en dicho estudio tenían una EPOC moderada-grave, con un valor medio de volumen espiratorio forzado en el primer segundo (FEV1) de tan sólo un 33%; por este motivo sus resultados no pueden aplicarse a los pacientes con función pulmonar normal o próxima a la normalidad, incluso aunque presenten una agudización de tipo I o II (con 3 o 2 de los síntomas antes enumerados, respectivamente). Estudios más recientes han intentado definir nuevos criterios de agudización infecciosa. La combinación de un resultado negativo en la tinción de Gram, una disminución poco importante de la función pulmonar durante el episodio y una historia de menos de 2 agudizaciones el año previo fue un 100% predictiva de una etiología no bacteriana de la agudización, mientras que la presencia de las 3 características tuvo un valor predictivo positivo del 67%5. Sin embargo, a excepción del número de agudizaciones previas, las otras 2 características muy raramente pueden verificarse en la práctica cotidiana. La búsqueda de marcadores biológicos de agudización ha suscitado gran interés. Hurst et al6 estudiaron hasta 36 posibles marcadores en suero de pacientes en fase estable y durante una agudización. El marcador más selectivo fue la proteína C reactiva, pero por sí sola, sin la utilización de alguno de los síntomas de agudización, no fue lo suficientemente sensible ni específica para diagnosticar una agudización. Otros estudios han confirmado que la determinación de la proteína C reactiva no es lo bastante sensible ni específica para diagnosticar una etiología bacteriana en la infección respiratoria baja7. Otra molécula candidata es la procalcitonina. En un estudio aleatorizado se utilizó la concentración plasmática de procalcitonina para decidir el tratamiento antibiótico, comparado con la práctica clínica habitual. Los pacientes del grupo de procalcitonina recibieron significativamente menos antibióticos que los del grupo de tratamiento habitual, pero cabe destacar que la evolución a largo plazo fue peor en los pacientes del grupo de procalcitonina que recibieron menos antibióticos. Por el tamaño reducido de la muestra (tan sólo 60 pacientes con agudización de la EPOC) no es posible extraer conclusiones definitivas8.
Llegados a este punto cabe afirmar que los síntomas clásicos de agudización son insustituibles para el diagnóstico de la agudización y que los criterios de Anthonisen son los que mejor nos aproximan a la etiología bacteriana. La única aportación significativa ha sido la confirmación de que el cambio de color del esputo o su aspecto purulento es el mejor signo de infección bacteriana9,10. Este hallazgo, junto a la alteración de la función pulmonar, debe servir para orientar la posible etiología y guiar el tratamiento antibiótico empírico11-13.
Etiología de las agudizaciones
Los mecanismos de defensa pulmonar están alterados en los pacientes con EPOC. Por este motivo las bacterias pueden adherirse al epitelio bronquial y proliferar; es lo que conocemos como "colonización bronquial". Diversos estudios realizados con técnicas diagnósticas sensibles y específicas, como el cepillado bronquial protegido, han demostrado que entre un 25 y un 50% de los pacientes con EPOC estable pueden estar colonizados por microorganismos potencialmente patógenos14. Por este motivo el aislamiento en el esputo de un microorganismo potencialmente patógeno durante una agudización no puede considerarse la prueba definitiva de su papel etiológico. En cualquier caso, la carga bacteriana durante las agudizaciones es superior a la encontrada en pacientes colonizados en fase estable14,15, lo que apoya la participación decisiva de las bacterias en el desarrollo de las agudizaciones.
La colonización bacteriana de las vías aéreas se ha relacionado directamente con la frecuencia y con la gravedad de las agudizaciones, y también con la evolución de la EPOC. Los pacientes colonizados por Haemophilus influenzae presentan más agudizaciones, a igual grado de deterioro de la función pulmonar, que los sujetos que no se encuentran colonizados por microorganismos. Además, los pacientes con EPOC en quienes se identificó este patógeno en fase estable presentaron más síntomas y un esputo más purulento en el momento de la agudización que las personas no colonizadas16. Pero la evidencia más importante de la influencia de la colonización bronquial en la evolución de la enfermedad se detalla en un estudio realizado en 30 pacientes con EPOC grave, que fueron controlados durante más de un año. Los resultados mostraron que el incremento de la carga bacteriana bronquial y los cambios en las cepas bacterianas aisladas durante el seguimiento se asociaban de forma significativa e independiente con un aumento de la inflamación de las vías aéreas y, más importante aún, con una pérdida acelerada de la función pulmonar17.
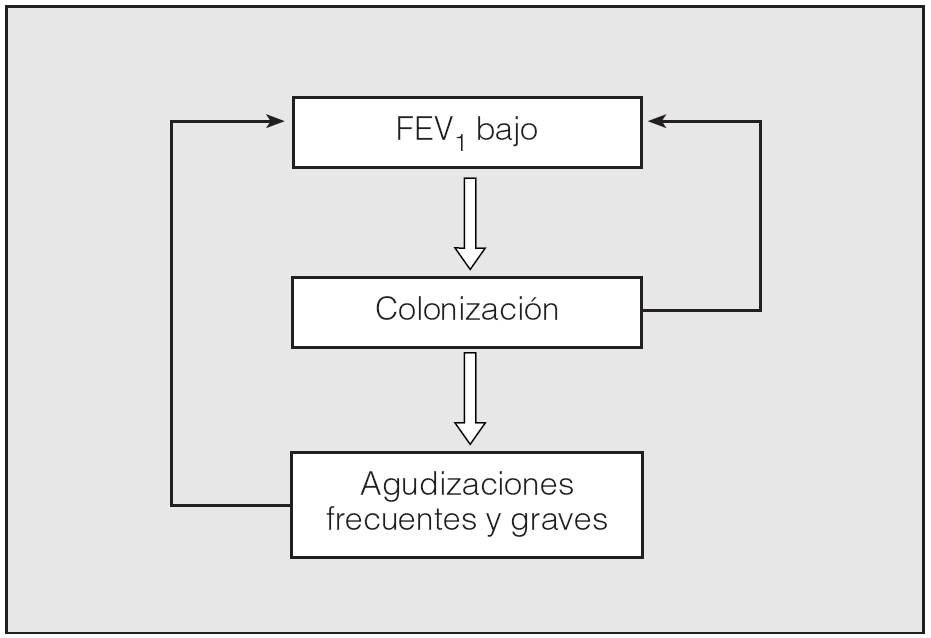
Por tanto, las bacterias colonizadoras de las vías aéreas pueden afectar y modificar la historia natural de la EPOC por 2 mecanismos diferentes pero complementarios: por una parte, la colonización por sí misma desencadenaría una reacción inflamatoria bronquial, que sería la responsable del incremento del daño inflamatorio y del deterioro de la función pulmonar; por otra, la colonización bronquial crónica actuaría como un factor que predispondría a la aparición de un número superior de agudizaciones de mayor gravedad. La mayor frecuencia de agudizaciones también se ha asociado de forma significativa con una pérdida acelerada de función pulmonar (fig. 1)18.
Fig. 1. Impacto de la colonización bronquial y las agudizaciones en la evolución de la EPOC. FEV1: volumen espiratorio forzado en el primer segundo.
Para explicar la etiopatogenia de la infección bacteriana durante las agudizaciones existen 2 teorías: el cambio de las cepas colonizantes y el aumento de la carga bacteriana. Según la primera, cuando una nueva cepa bacteriana alcanza el epitelio bronquial, aumenta la probabilidad de que se desarrolle una agudización, ya que no hay una respuesta específica de anticuerpos frente a la nueva cepa. Se basa en estudios de Sethi et al19, que observaron que la adquisición de una nueva cepa se asociaba con una odds ratio de 2,15 (intervalo de confianza del 95%, 1,8-2,5) para presentar una agudización. No obstante, en su estudio tan sólo un 33% de las agudizaciones se asoció a un cambio de cepa, por lo que otro mecanismo debe explicar el restante 67%. La segunda teoría se basa en que existe una relación muy estrecha entre colonización y agudización, ya que podría tratarse de pasos sucesivos del mismo proceso. Esta hipótesis está sustentada por estudios que han demostrado que los pacientes con agudizaciones frecuentes presentan concentraciones significativamente mayores de las bacterias patógenas aisladas que los mismos pacientes en fase estable y, además, las especies bacterianas son las mismas en ambas circunstancias15,20.
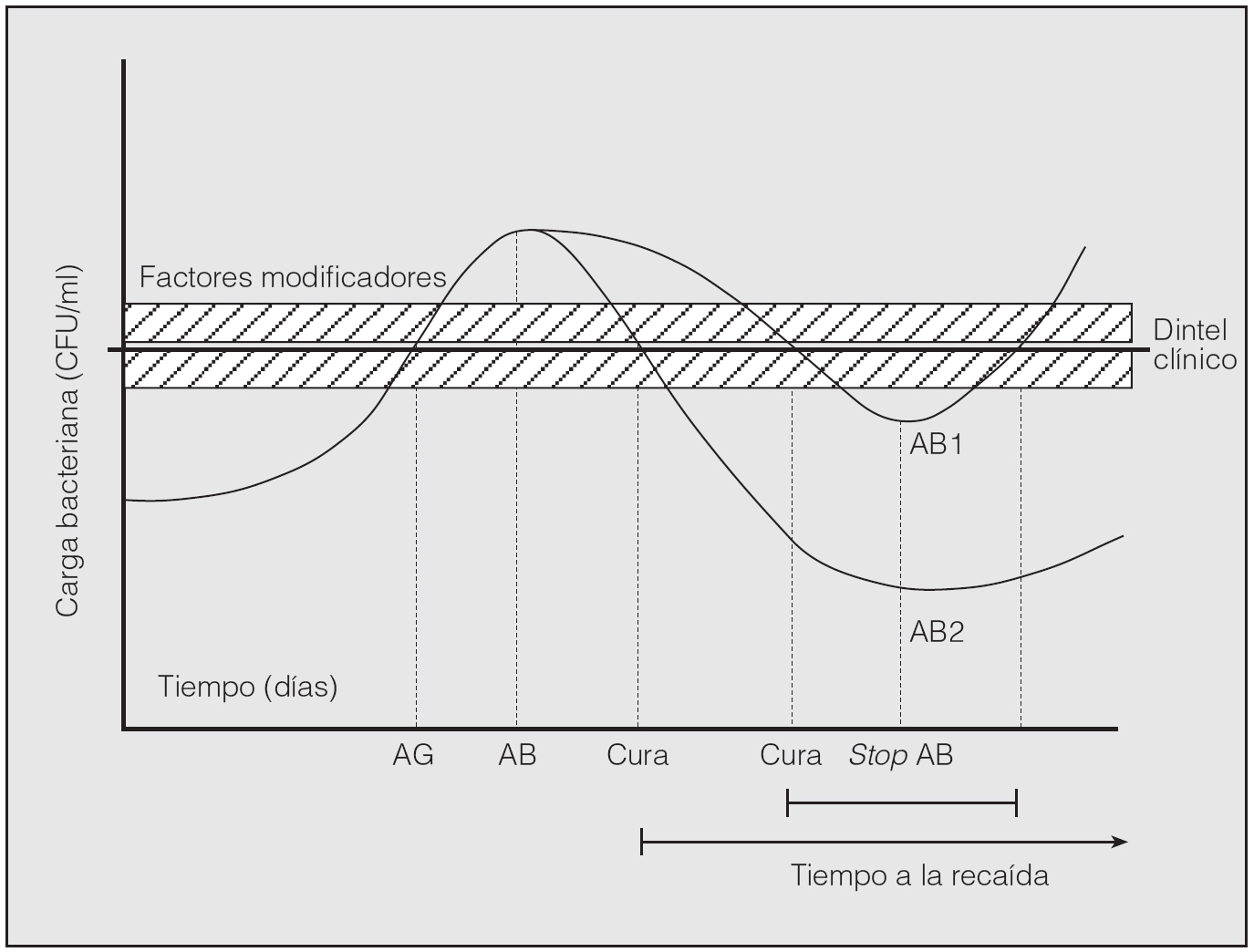
Al parecer sería precisa una concentración elevada de bacterias en las secreciones respiratorias para desencadenar una agudización; es lo que podemos denominar "concentración umbral o dintel". Cuando la carga bacteriana supera este valor, aparecerán los síntomas de agudización. El tratamiento antibiótico podría reducir la carga bacteriana por debajo del dintel y eliminar los síntomas, pero al cesar la presión antibiótica los microorganismos volverían a proliferar y producir una nueva agudización; es lo que se conoce como "la teoría cuantitativa de la agudización" o del fall and rise21 (fig. 2). Hay una serie de factores que pueden modificar el dintel de aparición de los síntomas de agudización bacteriana en la EPOC (tabla II).
Fig. 2.Fall and risede las agudizaciones bacterianas de la EPOC. En el eje de abscisas se representa la carga bacteriana, que está directamente relacionada con la respuesta inflamatoria del huésped. Cuando la carga bacteriana aumenta, también aumenta la reacción inflamatoria, hasta que cruza un umbral o dintel clínico, momento en que aparecen los síntomas de agudización. El paciente recibe un antibiótico (AB) y la carga bacteriana disminuye hasta atravesar de nuevo el dintel clínico (cura), momento en el cual desaparecen los síntomas. Nótese que no es necesario alcanzar la erradicación bacteriana para lograr la remisión de los síntomas.El paciente prosigue su tratamiento hasta acabar el antibiótico (stopAB). En ese momento se logra la máxima disminución de la carga bacteriana y el punto alcanzado determinará el tiempo hasta la siguiente agudización (tiempo hasta la recaída). Podemos observar cómo entre el antibiótico 1 (AB1) y el 2 (AB2) hay importantes diferencias. Si bien ambos logran la curación clínica, el AB2 la logra mucho más precozmente; además, la erradicación bacteriana es más intensa y, por tanto, el tiempo hasta la siguiente agudización se prolonga. AG: agudización; CFU: unidades formadoras de colonias. (Tomada de Miravitlles21.)
En resumen, la agudización respiratoria en los pacientes con EPOC podría desencadenarse a consecuencia de un proceso inflamatorio en las vías aéreas inferiores, que a su vez estaría causado por la presencia de microorganismos patógenos en concentraciones elevadas. La presencia de uno o más factores modificadores del dintel de aparición de la agudización implicaría que cada paciente, según sus características propias, precisaría una concentración determinada de gérmenes para desencadenar la infección respiratoria. En el caso de que el paciente no presentara ningún factor modificador de este dintel, probablemente necesitaría una carga bacteriana mucho más elevada para desencadenar los síntomas de exacerbación.
Otro aspecto importante de esta hipótesis es que se ha demostrado una prolongación del tiempo sin síntomas de agudización en los casos en que el tratamiento antibiótico consigue erradicar el microorganismo causal de la agudización. En cambio, cuando el antimicrobiano no consigue erradicar las bacterias de las vías aéreas, la recaída sucede más precozmente22-24.
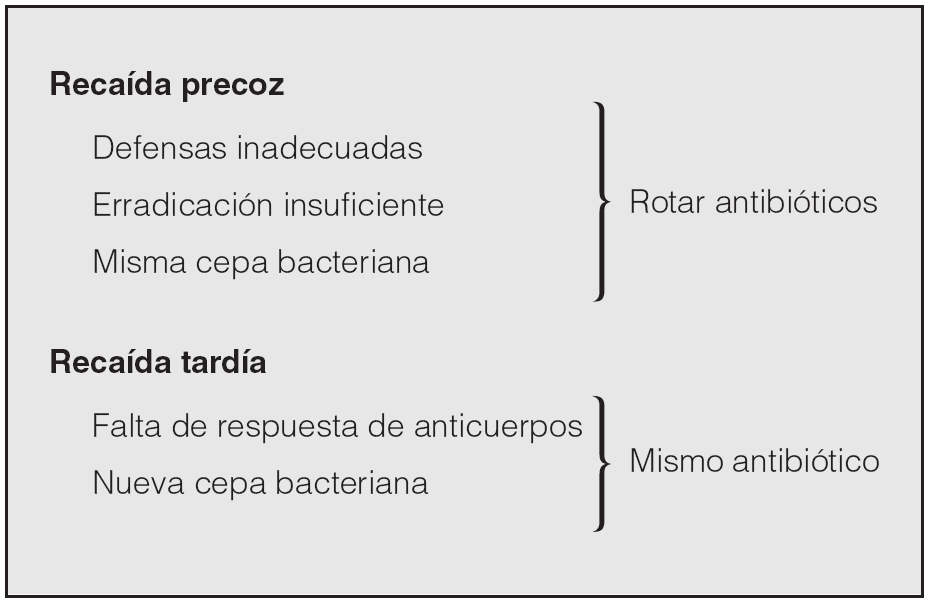
La hipótesis del fall and rise puede explicar el mecanismo por el que se producen las agudizaciones en los pacientes con EPOC que presentan episodios frecuentes, y puede explicar también las recaídas que se producen cuando no se ha conseguido la erradicación bacteriológica tras un tratamiento antibiótico poco eficaz. Por el contrario, el cambio en el serotipo de la bacteria infectante19 puede ser crucial en los pacientes que no presentan agudizaciones frecuentes. El factor tiempo puede ser decisivo; las recaídas precoces podrían deberse al mismo microorganismo que no ha sido erradicado eficazmente, y las tardías, a una nueva cepa colonizante frente a la que no existe protección específica de anticuerpos25. Para distinguir entre precoz y tardía la única pista nos la proporciona el estudio MOSAIC24, que demostró que una mejor erradicación bacteriana se acompañaba de una prolongación del tiempo hasta la recaída durante los primeros 5 meses tras el tratamiento antibiótico. La confirmación de esta hipótesis tendría consecuencias terapéuticas, ya que en caso de recaídas precoces deberíamos cambiar de antibiótico, pues el anterior no erradicó la cepa causante; en cambio, en caso de recaídas tardías podríamos usar el mismo antibiótico que en la agudización anterior, ya que no está relacionado con un mal resultado del anterior tratamiento. En la figura 3 se resumen estas posibilidades.
Fig. 3. Tratamiento antibiótico según el tiempo transcurrido desde la agudización previa (véase texto).
Según las evidencias publicadas, algo más del 50% de las agudizaciones podrían atribuirse a infecciones respiratorias26, aunque este número asciende hasta el 75-80% en pacientes graves2. H. influenzae es la bacteria aislada con mayor frecuencia en todas las series, seguido de Streptococcus pneumoniae, Moraxella catarrhalis y Pseudomonas aeruginosa15,26. Las infecciones virales, particularmente por los virus de la gripe, paragripal, Rhinovirus y Adenovirus, provocan, solas o combinadas con bacterias, hasta el 30% de los episodios de agudización infecciosa27 (tabla III). Con frecuencia coexisten la infección vírica y la bacteriana, sobre todo en pacientes graves o de edad avanzada, y se ha observado que la coinfección se asocia a una mayor gravedad de la inflamación bronquial y de los síntomas, así como a un mayor deterioro de la función pulmonar28. Por desgracia, las manifestaciones clínicas no permiten identificar la causa de la agudización debido a que tanto las agudizaciones de origen vírico como bacteriano muestran los mismos síntomas clínicos y similar respuesta inflamatoria27,28.
Se ha observado que el grado de deterioro funcional respiratorio de los pacientes con EPOC puede indicar la presencia de diferentes microorganismos potencialmente patógenos en las muestras de esputo en el curso de una agudización11-13. En la EPOC leve-moderada, es decir, con un FEV1 superior al 50%, el cultivo de esputo es poco efectivo y en muchos casos no se aíslan microorganismos potencialmente patógenos, mientras que los pacientes que presentan un deterioro funcional grave, manifestado por un FEV1 inferior al 50%, tienen un riesgo 6 veces superior de presentar una agudización causada por H. influenzae o P. aeruginosa. Por último, debemos considerar la posibilidad de una infección por P. aeruginosa cuando, además de la alteración funcional, el paciente tenga bronquiectasias importantes o haya recibido un antibiótico en los 3 meses previos29.
Tratamiento antibiótico de las agudizaciones
La mayoría de los pacientes con EPOC agudizada van a ser tratados de forma ambulatoria. Estudios realizados en atención primaria indican que menos de un 10% de las agudizaciones precisa tratamiento hospitalario30. El tratamiento ambulatorio de la agudización se basa en 3 pilares fundamentales: broncodilatadores, corticoides y antibióticos. En esta revisión se tratará de forma exclusiva el tratamiento antibiótico.
La elección razonada de un antibiótico debe basarse en 3 aspectos: a) conocimiento de las especies bacterianas causantes de la infección bronquial; b) conocimiento de la prevalencia de la resistencia antibiótica de los diferentes agentes causales en una comunidad, y c) características y factores de riesgo del paciente31,32.
Anteriormente se han mencionado los microorganismos causales más frecuentes y su relación con el deterioro funcional pulmonar. Respecto a las resistencias, es importante tener en cuenta las que presentan H. influenzae y S. pneumoniae a los antimicrobianos clásicos (tabla IV). La importancia de la resistencia a la penicilina en infecciones por S. pneumoniae va unida también al hecho de que es muy común que estas cepas presenten también resistencia a otros antimicrobianos usados en el tratamiento de la infección neumocócica, como macrólidos, tetraciclinas o cotrimoxazol33.
En cuanto a H. influenzae conviene remarcar que la serie más amplia publicada en España señalaba una resistencia del 25,7% frente a las penicilinas ya en 1996, con diferencias importantes entre los hospitales analizados, que oscilaron entre el 7,9 y el 47,9%34. La resistencia a las cefalosporinas oscila entre el 0 y el 18%, y a los macrólidos puede llegar a ser del 30%34.
Los factores de riesgo del paciente con agudización de la EPOC se han descrito en diversos estudios30,35-37 y en su mayoría coinciden con los llamados "factores modificadores del dintel de agudización" (tabla II). La importancia de modificar el tratamiento antibiótico según los factores de riesgo del huésped viene determinada por la alteración importante que presentan estos pacientes en sus mecanismos de defensa y la posibilidad de que desarrollen insuficiencia respiratoria en caso de que el antibiótico no actúe de forma rápida y eficaz. Un tratamiento antibiótico menos enérgico en un paciente sin factores de riesgo puede tener éxito gracias a la aportación de las defensas del paciente, pero esto puede no ser cierto en pacientes más comprometidos31,32. Por este motivo, en el tratamiento antibiótico son importantes otras variables, como la tasa de erradicación bacteriológica, la rapidez de acción y la prevención de recaídas. Si no logramos la erradicación tras el tratamiento antibiótico, se corre el riesgo de provocar la perpetuación de una colonización residual en pacientes que han superado el episodio de agudización. Además, la mayor erradicación bacteriológica se acompañará de una prolongación del tiempo hasta la próxima agudización23.
Las nuevas fluoroquinolonas presentan mayor actividad frente a S. pneumoniae, aunque conservan el mismo perfil de actividad frente a los otros patógenos respiratorios. Entre ellas, actualmente están comercializadas en nuestro país el levofloxacino y el moxifloxacino. De estas 2, el moxifloxacino es la más activa frente a neumococo y el levofloxacino se hallaría entre ésta y las quinolonas anteriores38,39.
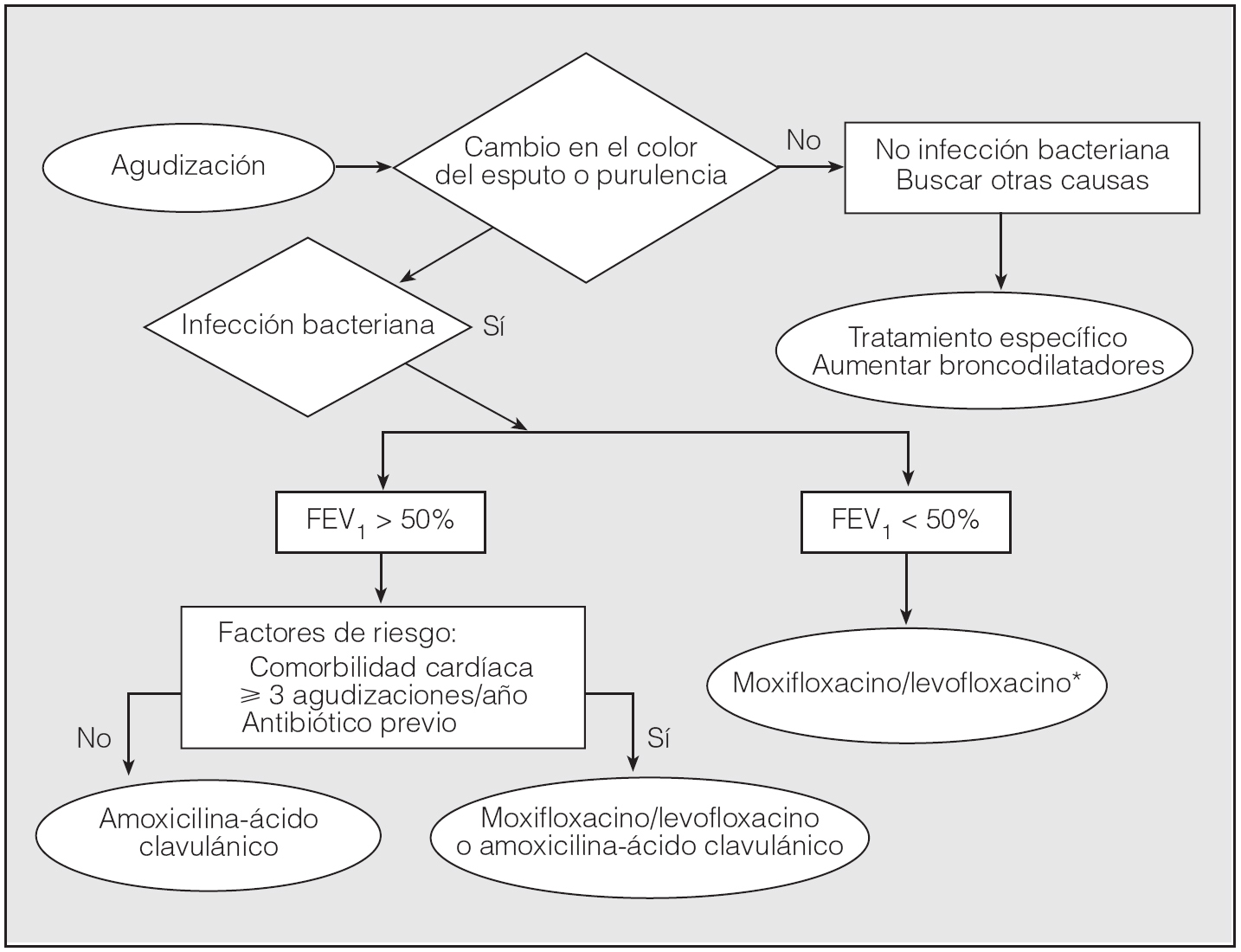
La erradicación conseguida con moxifloxacino sobre H. influenzae es significativamente superior a la conseguida con macrólidos40. Nuevos ensayos clínicos han demostrado que en pacientes con EPOC el tratamiento con una fluoroquinolona como el moxifloxacino se acompaña de una tasa de curación significativamente superior y una reducción significativa del riesgo de recaída, comparado con el tratamiento considerado estándar24. Por este motivo, en pacientes de edad avanzada con una alteración moderada o grave de la función pulmonar las fluoroquinolonas deben ser el tratamiento antibiótico de primera línea31,41. Estos beneficios no se han demostrado de forma concluyente en pacientes con enfermedad leve, jóvenes o con bronquitis crónica sin obstrucción al flujo aéreo42,43; en estos casos el antibiótico de elección en nuestro medio será amoxicilina-ácido clavulánico. Por último, las nuevas fluoroquinolonas también han demostrado una mayor rapidez de resolución de los síntomas en pacientes con EPOC y un FEV1 menor del 50%44. Como ejemplo, en la figura 4 se muestra el algoritmo de decisión del tratamiento antibiótico de la guía clínica elaborada por la Sociedad Española de Neumología y Cirugía Torácica y la Sociedad Española de Geriatría y Gerontología (SEPAR-SEEG)41.
Fig. 4. Tratamiento antibiótico de las agudizaciones de la EPOC. FEV1: volumen espiratorio forzado en el primer segundo. *Excepto en pacientes con factores de riesgo de infección porP. aeruginosa (véase texto). (Adaptada de Miravitlles y Martín Graczyk41.)
En pacientes graves debemos tener en cuenta la posibilidad de infección por P. aeruginosa, que viene determinada por el número de tandas previas de antibióticos recibidas y por una alteración funcional respiratoria con un FEV1 inferior al 50% o a 1,7 l11,12,29. También aumenta el riesgo de infección pseudomónica la demostración de bronquiectasias. En estos casos se recomienda tratamiento por vía oral con dosis altas de ciprofloxacino. Sin embargo, en estos pacientes es muy importante poder disponer de un cultivo de esputo y adecuar el tratamiento en función del resultado del antibiograma y de la evolución clínica.
Hay otras opciones antibióticas potencialmente útiles en el tratamiento del paciente con EPOC agudizada, pero de las que se dispone de una experiencia limitada. El cefditorén pivoxil es una cefalosporina oral, con un buen espectro de actividad antibacteriana y estable frente a betalactamasas. Sus características lo convierten en un buen candidato para el tratamiento de pacientes sin factores de riesgo. No obstante, los datos existentes sobre su efectividad clínica son limitados y la dosis recomendada para las agudizaciones de la bronquitis crónica (200 mg 2 veces al día durante 5 días) puede ser excesivamente baja para pacientes con EPOC y/o con algún factor de riesgo. Esta dosis recomendada se ha estudiado exclusivamente en pacientes con bronquitis crónica de más de 18 años45. Carecemos de información sobre su eficacia clínica y bacteriológica a estas dosis en pacientes con EPOC y distintos factores de riesgo.
Otra posibilidad es el tratamiento con dosis elevadas de amoxicilina para lograr superar la baja susceptibilidad de algunas cepas de S. pneumoniae y conseguir reducir la duración del tratamiento. La administración de amoxicilina-ácido clavulánico a dosis de 2.000/125 mg 2 veces al día durante 5 días se ha demostrado que es tan eficaz desde el punto de vista clínico y bacteriológico como el tratamiento durante 7 días con el mismo compuesto a dosis de 875/125 mg 2 veces al día, sin diferencias en su tolerabilidad46.
Obviamente, los nuevos tratamientos van destinados a reducir la duración de la antibioterapia para mejorar el cumplimiento47 y restituir la función lo antes posible. Hay experiencias puntuales dirigidas a reducir la duración del tratamiento más allá de los 5 días. La formulación de levofloxacino 750 mg utilizada una vez al día durante 3 días se ha demostrado equivalente a azitromicina durante 5 días en pacientes mayores de 18 años con bronquitis crónica no complicada48. No obstante, es importante resaltar que en estos casos se echa de menos un grupo de comparación con placebo. Por último, la máxima reducción de la duración del tratamiento antibiótico sería la administración de una dosis única. Esta estrategia se ha ensayado con azitromicina en microesferas en administración única de 2 g. Esta nueva preparación permite administrar una dosis elevada por vía oral, que proporciona una mayor concentración pico plasmática y mayor área bajo la curva de 24 h. En un ensayo clínico comparativo en pacientes fumadores o exfumadores mayores de 50 años y con agudizaciones tipo I de Anthonisen, la azitromicina en microesferas en dosis única fue bien tolerada y equivalente desde el punto de vista clínico y bacteriológico a 500 mg de levofloxacino al día durante 7 días49.
En resumen, debemos aplicar el tratamiento antibiótico que se ha mostrado más eficaz y con mejor capacidad de erradicación, especialmente cuando nos encontremos frente a pacientes con algún factor de riesgo. En la tabla V se resumen las características que debe reunir el antibiótico ideal para el tratamiento de las agudizaciones de la EPOC. También debemos intentar siempre prescribir el tratamiento más corto que haya demostrado su eficacia y, por último, iniciar el tratamiento lo antes posible para lograr mejorar los resultados clínicos31,50.
Prevención de las agudizaciones de la EPOC
Las agudizaciones frecuentes suponen un impacto permanente sobre el estado de salud de los pacientes con EPOC32,51,52. Por este motivo no es de extrañar que, si preguntamos a pacientes con EPOC qué esperan del tratamiento antibiótico de las agudizaciones, su respuesta sea conseguir la curación lo antes posible y, sobre todo, evitar la recurrencia53. El tratamiento antibiótico eficaz es el que permitirá la mejor tasa de curación y el alivio más rápido de los síntomas, y también el que prolongará el tiempo hasta la recaída32. Además del tratamiento antibiótico hay otras estrategias destinadas a prevenir la aparición de agudizaciones; básicamente el mejor tratamiento de la EPOC estable, desde el punto de vista farmacológico y no farmacológico (rehabilitación), contribuye a disminuir la frecuencia de agudizaciones54.
Desde la perspectiva de la infección bronquial hay otras alternativas al tratamiento erradicador de la agudización; entre ellas destacan las destinadas a incrementar la capacidad defensiva del paciente. Las vacunas con extractos bacterianos de administración oral pueden ser útiles para reducir el número, la gravedad y/o la duración de las agudizaciones en pacientes con EPOC, aunque por desgracia la mayoría de los estudios realizados con estos compuestos son de escasa calidad55. La vacuna antigripal ha demostrado su utilidad a la hora de disminuir la frecuencia de agudizaciones, y la vacuna antineumocócica con 23 serotipos es eficaz para prevenir la neumonía en pacientes con EPOC menores de 65 años y en aquéllos con obstrucción grave al flujo aéreo56; no obstante, es eficaz y está recomendada para la prevención de la neumonía y la enfermedad invasiva por neumococo en mayores de 65 años tengan o no EPOC, por lo que debe administrarse a todos los pacientes con EPOC57.
El tratamiento con un inmunoestimulante oral, el AM3 (Inmunoferón®), ha demostrado restablecer los defectos en la actividad de las células fagocíticas y los linfocitos T presentes en la EPOC58,59. Este efecto podría tener un papel importante en la defensa frente a la colonización y la infección en la EPOC. Un ensayo clínico de doble ciego, aleatorizado y controlado con placebo en 253 pacientes con EPOC demostró que los tratados con AM3 tenían una mejoría significativa de su estado de salud tras 6 meses de tratamiento comparado con placebo, y se observó una tendencia a un mayor número de pacientes sin agudización en el grupo de AM3, pero sin alcanzar la significación estadística (el 55,3 frente al 48,8%; p = 0,11). La corta duración del estudio, tan sólo 6 meses, no permitió comprobar de forma inequívoca el efecto de AM3 sobre la reducción de las agudizaciones60.
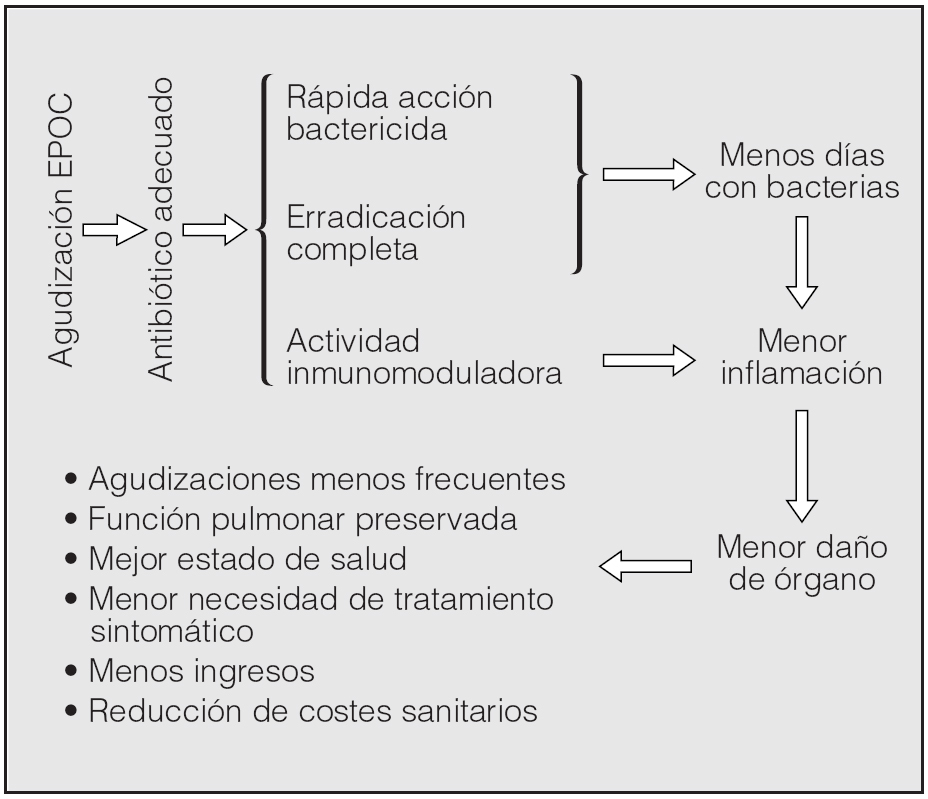
Para acabar, merece la pena comentar que las últimas tendencias en la prevención de las agudizaciones incluyen la utilización de antibióticos de forma profiláctica en pacientes con EPOC moderada-grave. Aunque no es un tratamiento nuevo, pues se utilizó hace ya algunos años de forma empírica61, la aparición de nuevos antibióticos y los conocimientos sobre las interacciones entre bacteria y huésped han llevado al diseño de nuevos ensayos clínicos aleatorizados y controlados con placebo, con objeto de evaluar la eficacia del tratamiento antibiótico en pacientes estables administrando tandas repetidas a lo largo de un año para la prevención de agudizaciones62. En un plazo no muy largo podremos disponer de resultados que contestarán algunas preguntas, pero seguro que abrirán muchos interrogantes más acerca del uso de los antibióticos en pacientes estables con EPOC grave. Hasta entonces debemos concentrar nuestros esfuerzos en proporcionar el mejor tratamiento antibiótico posible a nuestros pacientes agudizados para conseguir lo que se ha denominado el círculo virtuoso, esto es, eliminar el máximo de bacterias lo antes posible para lograr la preservación del órgano63 (fig. 5).
Fig. 5. El llamado "círculo virtuoso" del tratamiento antibiótico de las agudizaciones de la EPOC (véase texto). (Adaptada de De Benedetto y Sevieri63.)
Correspondencia: Dr. M. Miravitlles.
Institut Clínic del Tòrax. Hospital Clínic.
Villarroel, 170 (escalera 2, planta 3). 08036 Barcelona. España.
Correo electrónico: marcm@clinic.ub.es