Las bronquiectasias presentan actualmente una importancia creciente tanto por el incremento en el número de diagnósticos que se realizan como por el impacto negativo que su presencia supone sobre la enfermedad de base que las genera. Un aspecto fundamental en estos pacientes es la colonización e infección de la mucosa bronquial por microorganismos potencialmente patógenos (MPP), causante en la mayoría de los casos del inicio del proceso inflamatorio crónico que termina con la destrucción y la dilatación del árbol bronquial que caracteriza a estos pacientes. El tratamiento de la colonización y de la infección bronquial crónica en estos pacientes se debe basar en la terapia antibiótica prolongada en sus distintas presentaciones, de las cuales la forma inhalada está adquiriendo un especial protagonismo en los últimos tiempos por su elevada eficacia y su escasa producción de efectos adversos importantes. Sin embargo, no debe pasarse por alto que el manejo del paciente con bronquiectasias debe ser multidisciplinar y multidimensional, dado que además del tratamiento antibiótico es imprescindible el trabajo de diferentes especialidades médicas y quirúrgicas para el manejo de las agudizaciones, los aspectos nutricionales, la fisioterapia respiratoria, la rehabilitación muscular, las complicaciones, la inflamación e hiperreactividad bronquial y la hipersecreción que caracteriza a estos pacientes.
Bronchiectasis is currently growing in importance due to both the increase in the number of diagnoses made as well as the negative impact that its presence has on the baseline disease that generates it. A fundamental aspect in these patients is the colonization and infection of the bronchial mucous by potentially pathogenic microorganisms (PPM), which are the cause in most cases of the start of the chronic inflammatory process that results in the destruction and dilatation of the bronchial tree that is characteristic in these patients. The treatment of the colonization and chronic bronchial infection in these patients should be based on prolonged antibiotic therapy in its different presentations. Lately, the inhaled form is becoming especially prominent due to its high efficacy and limited production of important adverse effects. However, one must not overlook the fact that the management of patients with bronchiectasis should be multidisciplinary and multidimensional. In addition to antibiotic treatment, the collaboration of different medical and surgical specialties is essential for the management of the exacerbations, nutritional aspects, respiratory physiotherapy, muscle rehabilitation, complications, inflammation and bronchial hyperreactivity and the hypersecretion that characterizes these patients.
Las bronquiectasias son el estadio final del daño pulmonar que causan decenas de enfermedades, tanto sistémicas como locales1-5. Si bien hasta hace algunos años se pensaba que las bronquiectasias tendían a la extinción y no pasaban de ser un reducto del pasado, secuelas de las epidemias infecciosas de otras épocas, hoy se acepta que el número de diagnósticos está incrementándose de forma muy rápida. Entre otras razones por la mayor longevidad de la población, lo que permite una mayor cronicidad de las enfermedades generadoras, pero sobre todo gracias a la elevada fiabilidad de las técnicas tomográficas de alta definición que ya hoy en día se utilizan de forma rutinaria6-8. Sin embargo, la verdadera dimensión de las bronquiectasias hay que buscarla no solo en el deterioro que por ellas mismas generan en la calidad de vida del paciente, sino en el impacto pronóstico negativo que añaden a la enfermedad que las genera9-11. Desde un punto de vista patogénico se conoce desde la década de los ochenta cuáles son los mecanismos más frecuentes en la formación de las bronquiectasias12,13. Una agresión inicial de la mucosa bronquial habitualmente debida a la infección producida por un microorganismo potencialmente patógeno (MPP) inicia una cascada de acontecimientos que acaban con la progresiva destrucción de la pared bronquial y la característica dilatación de la luz de la vía aérea que define a esta enfermedad. Los mecanismos intermedios que acaban produciendo esta destrucción se derivan fundamentalmente de la lesión previa de los mecanismos de defensa, bien de forma genética —como ocurre en muchas enfermedades— o bien por destrucción adquirida, como consecuencia tanto de los productos líticos segregados por la inflamación neutrofílica y mononuclear consecuencia de la infección, como de la propia secreción de sustancias tóxicas por parte de los propios MPP que perpetúan una situación de inflamación e infección crónica que acaba por cerrar el círculo vicioso asegurando la progresión de la enfermedad. La consecuencia final no es otra que la progresiva obstrucción de la vía aérea y la aparición de los síntomas típicos de esta enfermedad, en especial la hipersecreción crónica y los estadios más avanzados la disnea, todo lo cual modula la pérdida progresiva de función pulmonar y de calidad de vida de los pacientes que las padecen, lo que les lleva a una mortalidad precoz14.
A lo largo de la historia natural de las bronquiectasias hay un hecho que marca un punto de inflexión importante desde el punto de vista evolutivo: la aparición de una colonización de la mucosa bronquial por MPP, en especial cuando esta situación se cronifica y genera un incremento en los síntomas del paciente. Pero sin lugar a dudas, de entre los posibles MPP que pueden colonizar la mucosa de los pacientes con bronquiectasias hay uno que sobresale sobre todos los demás debido a su especial virulencia, Pseudomonas aeruginosa (PA). Sigue siendo motivo de controversia cuál es la relación entre la presencia de una colonización bronquial, en especial por PA, y el deterioro posterior de la enfermedad. Algunos autores postulan que su presencia supone un deterioro progresivo posterior de la enfermedad en términos de causalidad15, mientras que otros sugieren que este microorganismo tan solo es un marcador de gravedad que aparece en las formas más graves de la enfermedad debido a la gran desestructuración previa de la mucosa bronquial16. Sea como fuere, parece que existe acuerdo en pensar que el aislamiento de PA en la mucosa bronquial de los pacientes con bronquiectasias no augura una buena evolución, dado que se relaciona con mayor número y mayor gravedad de las agudizaciones, peor calidad de vida, mayor volumen y purulencia del esputo, mayor deterioro de la función pulmonar y, en definitiva, peor pronóstico vital17-20. En este sentido, las dos normativas sobre el tratamiento de las bronquiectasias actualmente vigentes —una auspiciada por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)21 y la otra por la British Thoracic Society (BTS)22, ambas de reciente aparición— coinciden en señalar que la aparición de PA en la mucosa bronquial de estos pacientes, en sus diferentes modalidades de colonización, debe tratarse de forma agresiva y precoz, en especial mediante una terapia antibiótica más o menos prolongada. Sin embargo, no se debe olvidar que el tratamiento de las bronquiectasias y de la colonización bronquial de estas ha de ser multidisciplinar, y si bien no cabe duda de que el tratamiento antibiótico es el pilar fundamental de ese tratamiento, no siempre consigue el control óptimo del paciente y precisa del apoyo de otros tratamientos adyuvantes, cuya función principal será mejorar la clínica general del paciente ya sea mediante la disminución de la inflamación bronquial (antiinflamatorios), la mejoría de los síntomas (broncodilatadores), la ayuda a la expectoración (fisioterapia y mucolíticos) o la mejora del estado general (ejercicio físico, rehabilitación y nutrición). En la presente revisión se hará una puesta al día, con un eminente sentido práctico, de cuál es el manejo global del paciente con bronquiectasias no debidas a fibrosis quística (FQ), así como de las distintas variedades de colonización e infección bronquial que afectan a estos pacientes apoyándose fundamentalmente en las normativas existentes.
Tratamiento de la colonización bronquial en pacientes con bronquiectasiasConceptos de colonización e infección bronquial en bronquiectasiasComo consecuencia de las alteraciones estructurales ya comentadas en puntos anteriores, las bronquiectasias generan un microambiente idóneo para el crecimiento de MPP cuya existencia se perpetúa por su capacidad de desarrollar mecanismos de defensa y entorpecer la acción del sistema inmune o de los antimicrobianos (hipermutabilidad, formación de cápsulas o biopelículas, etc.). La cantidad de bacterias en un momento dado, la situación del sistema de defensa inmunitario, la capacidad invasora de los MPP y la acción de los antibacterianos van a determinar diferentes situaciones cuya caracterización es importante, dado que presenta implicaciones terapéuticas23,24. La colonización bronquial se define como la presencia de una población bacteriana en la mucosa bronquial que no induce respuesta inflamatoria con repercusión clínica, salvo un incremento en la expectoración mucosa. Dependiendo de la identificación y permanencia del MPP en las muestras respiratorias, puede ser inicial, en el caso de un primer cultivo positivo fuera de un proceso de agudización no aislado en cultivos periódicos previos; intermitente, en el caso de cultivos alternantes positivos y negativos para un mismo MPP, con al menos un mes de diferencia entre ellos; suele reflejar una colonización bronquial crónica de bajo grado o por un número bajo de colonias, que en ocasiones no son detectables en el esputo; y crónica, cuando se detecta el mismo MPP en 3 o más cultivos consecutivos y separados entre sí al menos un mes durante un periodo de 6 meses sin tratamiento antibiótico concomitante.
La infección bronquial crónica supone la situación en la que una colonización bronquial genera una respuesta inflamatoria tal que provoca la aparición de síntomas claramente discernibles en el paciente que la padece, en general una expectoración purulenta crónica. Suele acompañarse de afectación sistémica y un aumento en el número de agudizaciones25,26.
Tratamiento de la colonización bronquial inicialAntes de comentar el tratamiento de la colonización bronquial inicial es importante comentar que actualmente no existe indicación para el tratamiento antibiótico profiláctico administrado de forma periódica en pacientes con bronquiectasias no debidas a FQ y elevado riesgo de colonización por MPP, incluida PA, si bien hacen falta estudios que determinen la rentabilidad de este tipo de tratamiento22.
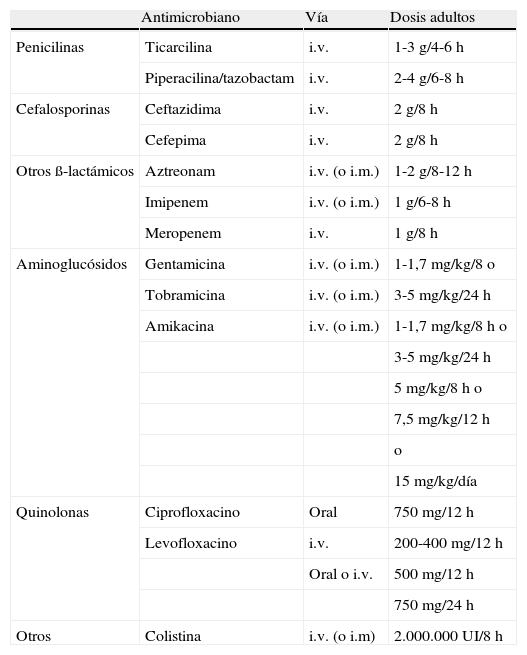
A pesar de que la evidencia científica es escasa en pacientes con bronquiectasias no debidas a FQ (es mayor para pacientes con FQ), se acepta que, conocidos los efectos nocivos de PA sobre distintos parámetros clínicos, funcionales y evolutivos en pacientes con bronquiectasias de cualquier origen17-20, el crecimiento de este MPP ya en un primer cultivo de una muestra respiratoria debería plantear la utilización de un tratamiento antibiótico intenso, ya que supondría, al menos en teoría, la última oportunidad de erradicar a PA de la mucosa bronquial, hecho mucho más improbable una vez que este microorganismo coloniza de forma crónica la vía aérea. El tratamiento más recomendado se basa en la utilización de 750mg cada 12h de ciprofloxacino por vía oral durante 3 semanas. La adición de un antibiótico inhalado (tobramicina libre de aditivos o colistimetato de sodio) a más largo plazo (3-12 meses) debe considerarse en el caso de falta de eficacia del tratamiento oral valorada como la persistencia de PA en los cultivos de las muestras respiratorias de control posteriores. Una alternativa al ciprofloxacino es la utilización de dos antibióticos por vía intravenosa con actividad antiseudomónica durante 14-21 días (tabla 1). Para el resto de MPP no existe ninguna evidencia científica que avale el tratamiento antibiótico en esta situación, por lo que deberá individualizarse21. La BTS también recomienda el tratamiento antibiótico según antibiograma en la colonización inicial por Staphylococcus aureus resistente a la meticilina debido al impacto negativo sobre el paciente27.
Antibióticos sistémicos con actividad frente a Pseudomonas aeruginosa utilizados en pacientes con bronquiectasias y dosis recomendadas
| Antimicrobiano | Vía | Dosis adultos | |
| Penicilinas | Ticarcilina | i.v. | 1-3 g/4-6 h |
| Piperacilina/tazobactam | i.v. | 2-4 g/6-8 h | |
| Cefalosporinas | Ceftazidima | i.v. | 2 g/8 h |
| Cefepima | i.v. | 2 g/8 h | |
| Otros ß-lactámicos | Aztreonam | i.v. (o i.m.) | 1-2 g/8-12 h |
| Imipenem | i.v. (o i.m.) | 1 g/6-8 h | |
| Meropenem | i.v. | 1 g/8 h | |
| Aminoglucósidos | Gentamicina | i.v. (o i.m.) | 1-1,7 mg/kg/8 o |
| Tobramicina | i.v. (o i.m.) | 3-5 mg/kg/24 h | |
| Amikacina | i.v. (o i.m.) | 1-1,7 mg/kg/8 h o | |
| 3-5 mg/kg/24 h | |||
| 5 mg/kg/8 h o | |||
| 7,5 mg/kg/12 h | |||
| o | |||
| 15 mg/kg/día | |||
| Quinolonas | Ciprofloxacino | Oral | 750 mg/12 h |
| Levofloxacino | i.v. | 200-400 mg/12 h | |
| Oral o i.v. | 500 mg/12 h | ||
| 750 mg/24 h | |||
| Otros | Colistina | i.v. (o i.m) | 2.000.000 UI/8 h |
i.v.: intravenoso; i.m.: intramuscular; (): vía escasamente utilizada.
El tratamiento debe basarse en la administración prolongada de antibióticos ante la aparición de alguna de las siguientes situaciones: colonización intermitente o crónica por PA, agudizaciones repetidas (según la normativa de la BTS al menos 3 agudizaciones al año con necesidad de tratamiento antibiótico sistémico), recaídas tempranas, ingresos hospitalarios o deterioro acelerado de la función pulmonar (en estos últimos cuatro casos, independientemente del MPP que provoque la situación). La pauta a seguir será la misma que para la infección bronquial crónica21,22 (ver siguiente punto).
Tratamiento de la infección bronquial crónicaEn este caso, el objetivo del tratamiento va dirigido a romper el círculo vicioso patogénico de infección-inflamación de la vía aérea reduciendo tanto la carga bacteriana como la respuesta inflamatoria, y con ello conseguir la reducción del volumen y purulencia del esputo, el número y la gravedad de las agudizaciones, e intentar frenar la pérdida de la función pulmonar, dado que raramente (especialmente en el caso de PA) se conseguirá una erradicación duradera del microorganismo. El tratamiento se basa en la administración de un tratamiento antibiótico a largo plazo, de la misma forma que en la colonización intermitente, ante la presencia de una infección crónica por PA en todos los casos o por otros MPP si aparecen agudizaciones repetidas, recaídas tempranas, ingresos hospitalarios o un deterioro acelerado de la función pulmonar. En cuanto a la posología, varios estudios han analizado la efectividad de diversas pautas de tratamiento antibiótico prolongado con resultados dispares según la vía de administración: tratamiento oral antiseudomónico (habitualmente fluoroquinolonas del tipo ciprofloxacino o levofloxacino); tratamiento intravenoso (ceftacidima, piperacilina-tazobactam, imipenem, aminoglucósidos o aztreonam) o bien tratamiento antibiótico inhalado prolongado (tobramicina o colistina). Una cuarta opción en pacientes más graves es la combinación de dos de las tres opciones anteriores, habitualmente antibióticos inhalados más antibióticos sistémicos (orales o intravenosos). Si bien no existe una clara evidencia científica sobre cuál debe de ser la elección, como ya ha sido comentado, los antibióticos inhalados ofrecen ciertas ventajas que hacen que muchos profesionales los escojan como primera opción de tratamiento (ver Antibióticos por vía inhalada). La elección final del tipo de antibiótico lógicamente debe depender del MPP aislado y de su antibiograma. El tratamiento será mantenido hasta conseguir el control de la infección basada en un esputo lo más mucoso posible o en una reducción de las agudizaciones21,22.
Antibióticos por vía sistémicaLos primeros estudios que se realizaron versaban sobre el efecto de los antibióticos a largo plazo en el tratamiento de la colonización-infección crónica en pacientes con bronquiectasias con la utilización de amoxicilina, tetraciclinas, gentamicina, amoxicilina o ciprofloxacino28-38. Una revisión sistemática llevada a cabo por Evans et al. en 200328 concluyó que la terapia a largo plazo con antibióticos sistémicos para el tratamiento de la colonización crónica conseguía una mejoría general de los síntomas pero sin ningún efecto sobre la función pulmonar o el número o gravedad de las agudizaciones de los pacientes, quedando por dilucidar cuál es el efecto sobre la mortalidad. Se ha observado, sin embargo, un incremento en las resistencias de algunos antibióticos sistémicos administrados a largo plazo para PA, en especial las fluoroquinolonas, por lo que según las normativas de la BTS se debería evitar el uso repetitivo de tandas de esta familia de antibióticos en estas condiciones.
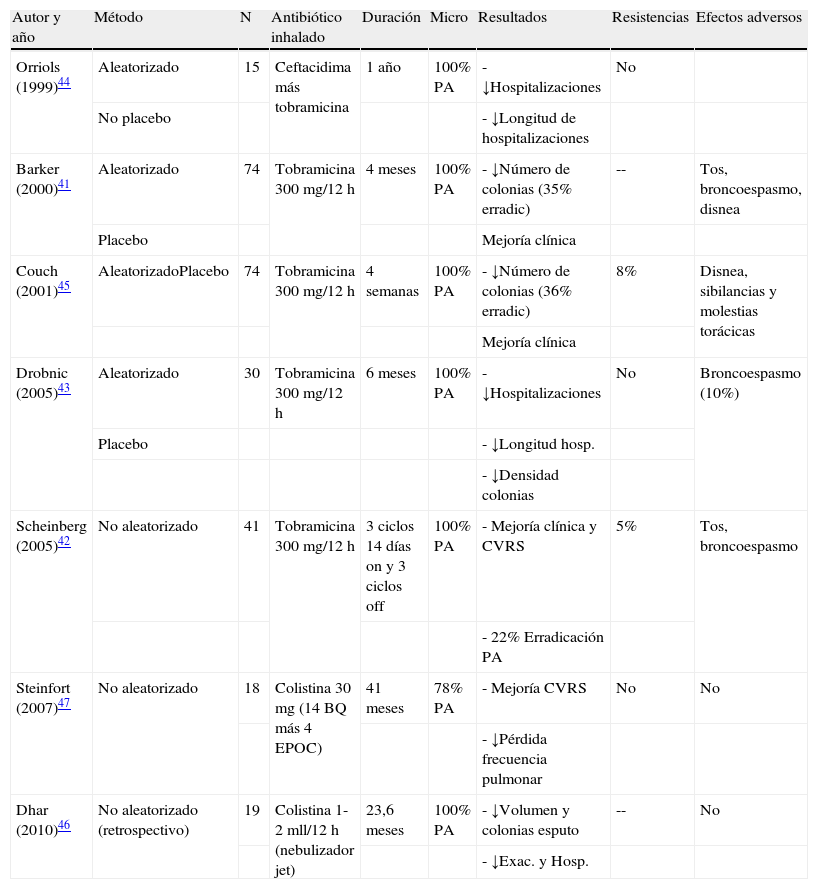
Antibióticos por vía inhaladaAlgunos autores han demostrado que la concentración de antibiótico conseguida en las secreciones respiratorias es hasta 20 veces superior en la terapia inhalada que en la terapia sistémica, lo que podría implicar una mayor eficacia, una menor tasa de efectos adversos sistémicos y, por lo tanto, la posibilidad de prolongar de forma segura el tiempo de tratamiento39,40. En pacientes con bronquiectasias no debidas a FQ no está aprobada hasta el momento la indicación formal de antibioterapia inhalada y debe solicitarse como medicación compasiva. Sin embargo, existen diferentes estudios que coinciden en señalar que el tratamiento con antibióticos inhalados es efectivo en la reducción de la densidad de colonias de PA en el esputo y en la mejoría de ciertos aspectos clínicos41-47 (tabla 2). Las tasas de erradicación prolongada de PA con el tratamiento antibiótico inhalado, y también con el sistémico, son muy variables. La mayoría de autores coinciden en señalar que tras abandonar la medicación, la tasa de recurrencia es casi universal. Algunas revisiones recientes y las normativas vigentes recomiendan el uso de antibióticos inhalados en pacientes con bronquiectasias no debidas a FQ y colonización/infección bronquial crónica por PA (para la infección crónica por otros microorganismos su indicación debe individualizarse) o ante la presencia de efectos adversos, resistencias o ineficacia del tratamiento prolongado por vía oral, siempre que se intensifique el cuidado en la monitorización de efectos adversos y la efectividad del tratamiento21,22,48,49, pudiéndose incluso, en algunos casos, combinar ambas vías de administración (inhalada y sistémica). Tanto en FQ como en el resto de etiologías se ha comunicado la aparición de resistencias de PA a la tobramicina con la utilización de este fármaco por vía inhalada y que pueden desaparecer tras la supresión temporal del tratamiento. Algunos autores han referido una menor frecuencia (tan solo del 5%) de resistencias a PA con la utilización de colistimetato de sodio47. Las características farmacológicas de las preparaciones intravenosas no son las idóneas para la inhalación, especialmente en lo que se refiere a su osmolaridad, pH y presencia de sustancias irritantes para las vías aéreas. La solución de tobramicina para nebulizador (TOBI®, Novartis; Bramitob®, Chiesi) y colistimetato de sodio (GES®, G.E.S. Genéricos Españoles Laboratorio; Promixin®, Praxis Pharmaceutical) son los dos antibióticos disponibles en el mercado aptos para su uso por vía inhalada en pacientes con bronquiectasias (indicación formal en FQ y compasiva en bronquiectasias de otro origen). Su administración se realiza mediante nebulizadores tipo jet (Pari LC Plus®) o nebulizadores electrónicos de malla estática o dinámica (eFlow rapid® e I-neb®)50. En comparación con los nebulizadores tipo jet, los de malla son menos voluminosos, más silenciosos, más rápidos y más portátiles. El tratamiento con la solución de tobramicina para inhalación debe realizarse a una dosis de 300mg/12h a tandas alternas de 28 días. El colistimetato de sodio se utiliza habitualmente a una dosis de 2 millones de UI/12h disuelto en 4ml de una solución lo más isotónica posible, si bien, con la utilización del nebulizador I-neb de Respironics® la dosis puede reducirse a 1 millón de UI/12h al liberarse la medicación solo durante la inspiración del paciente y no de forma continua como en el resto de nebulizadores. Este fármaco suele utilizarse, a diferencia de la tobramicina inhalada, sin periodos de descanso. El tratamiento con antibióticos inhalados para la colonización/infección crónica por PA debe mantenerse mientras se consiga un cociente riesgo/beneficio aceptable.
Estudios más importantes sobre la utilización de antibióticos inhalados para el tratamiento de la colonización-infección bronquial crónica en pacientes con bronquiectasias
| Autor y año | Método | N | Antibiótico inhalado | Duración | Micro | Resultados | Resistencias | Efectos adversos |
| Orriols (1999)44 | Aleatorizado | 15 | Ceftacidima más tobramicina | 1 año | 100% PA | - ↓Hospitalizaciones | No | |
| No placebo | - ↓Longitud de hospitalizaciones | |||||||
| Barker (2000)41 | Aleatorizado | 74 | Tobramicina 300 mg/12 h | 4 meses | 100% PA | - ↓Número de colonias (35% erradic) | -- | Tos, broncoespasmo, disnea |
| Placebo | Mejoría clínica | |||||||
| Couch (2001)45 | AleatorizadoPlacebo | 74 | Tobramicina 300 mg/12 h | 4 semanas | 100% PA | - ↓Número de colonias (36% erradic) | 8% | Disnea, sibilancias y molestias torácicas |
| Mejoría clínica | ||||||||
| Drobnic (2005)43 | Aleatorizado | 30 | Tobramicina 300 mg/12 h | 6 meses | 100% PA | - ↓Hospitalizaciones | No | Broncoespasmo (10%) |
| Placebo | - ↓Longitud hosp. | |||||||
| - ↓Densidad colonias | ||||||||
| Scheinberg (2005)42 | No aleatorizado | 41 | Tobramicina 300 mg/12 h | 3 ciclos 14 días on y 3 ciclos off | 100% PA | - Mejoría clínica y CVRS | 5% | Tos, broncoespasmo |
| - 22% Erradicación PA | ||||||||
| Steinfort (2007)47 | No aleatorizado | 18 | Colistina 30mg (14 BQ más 4 EPOC) | 41 meses | 78% PA | - Mejoría CVRS | No | No |
| - ↓Pérdida frecuencia pulmonar | ||||||||
| Dhar (2010)46 | No aleatorizado (retrospectivo) | 19 | Colistina 1-2 mll/12 h (nebulizador jet) | 23,6 meses | 100% PA | - ↓Volumen y colonias esputo | -- | No |
| - ↓Exac. y Hosp. |
PA: Pseudomonas aeruginosa; BQ: bronquiectasias; EPOC: enfermedad pulmonar obstructiva crónica; Exac.: exacerbaciones; Hosp.: hospitalizaciones; CVRS: calidad de vida relacionada con la salud.
Los efectos adversos suelen ser menores y aparecen localmente. El más frecuente es el broncoespasmo, habitualmente ligero y reversible, la disnea, la tos y las molestias torácicas. Menos frecuentes son la hemoptisis y el tinnitus, y muy infrecuentes los efectos adversos sistémicos, si bien se han publicado casos de ototoxicidad y nefrotoxicidad. Es aconsejable el pretratamiento con broncodilatadores de acción corta y realizar la fisioterapia respiratoria antes de la nebulización. Es necesario extremar las precauciones en pacientes con hemoptisis activa, hiperreactividad bronquial importante, problemas auditivos o renales y enfermedades neuromusculares, y no deben utilizarse en periodos de agudización. Por todo ello es recomendable que la primera dosis sea administrada en el centro hospitalario. Tanto el propio principio activo como la solución de conservación pueden ser causantes de efectos adversos, en especial del broncoespasmo. La utilización de los nuevos nebulizadores podría en algunos casos generar una mayor hiperreactividad bronquial debido al incremento en el flujo de partículas que generan51-54. Sobre la utilización de antibióticos inhalados en pacientes con colonización/infección bronquial crónica por otros microorganismos diferentes a PA existe muy poca literatura, por lo que debe individualizarse21.
El futuro de la terapia antibiótica inhalada, no solo para el tratamiento de la colonización-infección bronquial crónica en pacientes con bronquiectasias sino para otro tipo de enfermedades infecciosas de la vía aérea, parece muy prometedor. Consultando la base de datos Clinicaltrials.gov55 al menos son identificables 42 ensayos clínicos que están siendo realizados o han concluido recientemente sobre la utilización de antibióticos inhalados para el tratamiento de enfermedades pulmonares como el aztreonam (Cayston®, con próxima salida al mercado), amikacina liposomal (Arikace®), gentamicina56, ciprofloxacino liposomal y no liposomal, vancomicina, una combinación de tobramicina y fosfomicina, levofloxacino (Aeroquin®), tobramicina [TIP] y colistina en polvo seco (Colobreath®). Por otro lado, también existe una importante investigación sobre diferentes formas de administración de estos fármacos que están consiguiendo cada vez mayor depósito pulmonar y menores efectos adversos. De entre ellas destacan las formas liposomales, en las que el antibiótico está encapsulado en un ambiente acuoso rodeado de una capa lipídica que está siendo utilizada para la vehiculización de ciprofloxacino y amikacina57; la utilización de polvo seco, que próximamente saldrá al mercado para la utilización de tobramicina y colistina58,59, asegurando una mayor comodidad del paciente al reducir el tiempo de inhalación sin modificar de forma significativa el depósito pulmonar, y la mejora de los nuevos nebulizadores de malla. Algunos autores han observado que el depósito pulmonar de ciprofloxacino inhalado en pacientes con bronquiectasias es mayor del 20% y que con una única inhalación al día se consiguen concentraciones locales del fármaco cien veces superiores a la concentración mínima inhibitoria para algunos MPP sin producir efectos adversos importantes60,61.
Tratamiento etiológicoUn primer aspecto a tener en cuenta siempre en un paciente con bronquiectasias (con o sin colonización bacteriana) es la del tratamiento de la enfermedad de base que las genera si esta es conocida. En este sentido, tanto las normativas nacionales como internacionales21,22 apoyan con claridad la realización de todos los estudios complementarios necesarios encaminados a dilucidar la etiología de las bronquiectasias, en especial en las enfermedades potencialmente curables o tratables, en pro de enlentecer la pérdida de función pulmonar. En este sentido, ante un paciente con bronquiectasias es especialmente importante descartar la presencia de déficit de producción de anticuerpos, aspergilosis broncopulmonar alérgica, reflujo gastroesofágico, obstrucción del árbol bronquial, asma o enfermedad pulmonar obstructiva crónica (EPOC) (con o sin déficit de alfa 1-antitripsina), infección por micobacterias, FQ y enfermedades sistémicas asociadas.
Tratamiento antiinflamatorioMacrólidosLos macrólidos presentan una serie de efectos inmunomoduladores demostrados in vitro e in vivo independientes de las cualidades antibacterianas que puedan tener. Su eficacia en bronquiectasias y en otras enfermedades respiratorias se explica principalmente por su efecto sobre los factores de virulencia bacterianos62,63 y la inflamación64. La administración prolongada de macrólidos se ha mostrado efectiva en las bronquiectasias secundarias a panbronquiolitis difusa65 y en las secundarias a FQ, especialmente en los pacientes con infección bronquial crónica por PA. Es en este grupo de pacientes donde se ha objetivado que el tratamiento prolongado con azitromicina disminuye el número de agudizaciones y mejora la función pulmonar66. En los pacientes con FQ sin infección bronquial crónica por PA, la azitromicina disminuye el número de agudizaciones pero no se ha demostrado que mejore la función pulmonar67,68.
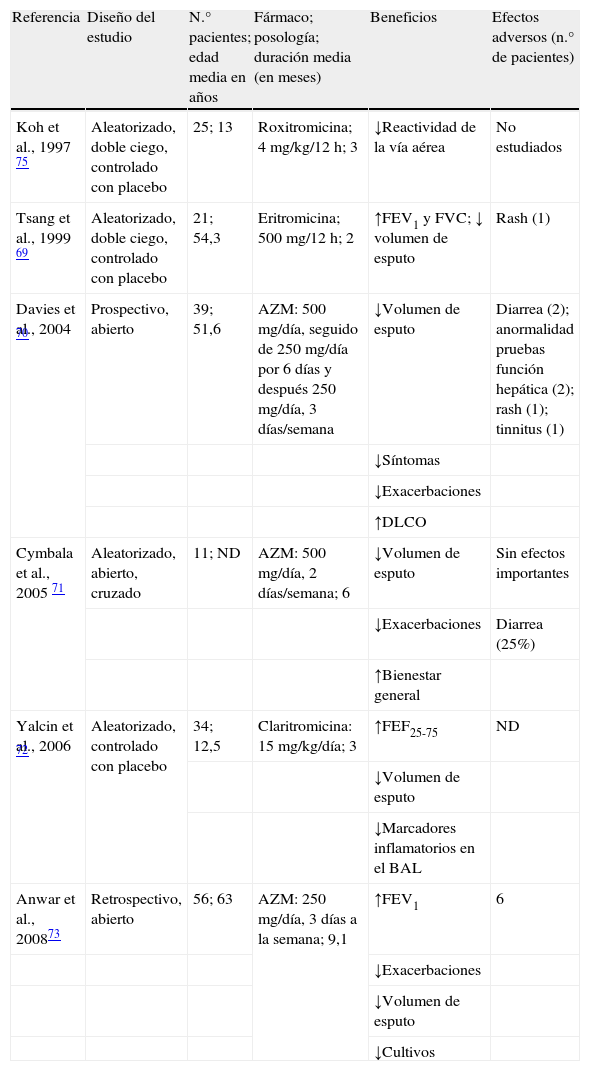
Varios estudios han investigado los efectos clínicos y microbiológicos de los macrólidos en los pacientes con bronquiectasias no asociadas a FQ (tabla 3). En 1999 Tsang et al.69 realizaron un estudio aleatorizado, doble ciego, en 21 pacientes adultos con bronquiectasias, comparando 8 semanas de tratamiento con eritromicina (500mg/12h) frente a placebo. En este estudio, el 76% de los pacientes estaba colonizado crónicamente por PA. Los pacientes tratados con eritromicina presentaron un incremento significativo del FEV1 y de la FVC respecto al grupo placebo y una disminución significativa del volumen de esputo. El tratamiento con eritromicina no se tradujo en una disminución de la densidad bacteriana o de los marcadores inflamatorios en esputo. En otro estudio, abierto, 33 pacientes que al menos presentaron 4 exacerbaciones durante el año previo se trataron con azitromicina a dosis de 500mg 3 veces a la semana durante al menos 4 meses70. Los autores objetivaron una mejoría significativa de los síntomas y una reducción de la colonización crónica y de la frecuencia de exacerbaciones. En 2005 Cymbala et al.71 evaluaron el efecto del tratamiento con azitromicina durante 6 meses. Los autores observaron una disminución del volumen de esputo y de la frecuencia de exacerbaciones y una mejoría del estado general de los pacientes. Un año más tarde, Yalcin et al.72 publicaron un estudio aleatorizado controlado con placebo con claritromicina en 34 niños con bronquiectasias. Los pacientes recibieron claritromicina a dosis de 15mg/kg/día o placebo. Los pacientes tratados presentaron una disminución del volumen de esputo, sin cambios significativos en la función pulmonar entre el grupo tratado y el placebo. En el lavado broncoalveolar se objetivó una disminución del número total de leucocitos, del porcentaje de neutrófilos, macrófagos y de la interleucina (IL) 8. No hubo cambios significativos en otros parámetros inflamatorios estudiados, como el factor de necrosis tumoral y la IL-10.
Estudios realizados con macrólidos en pacientes con bronquiectasias no debidas a fibrosis quística
| Referencia | Diseño del estudio | N.° pacientes; edad media en años | Fármaco; posología; duración media (en meses) | Beneficios | Efectos adversos (n.° de pacientes) |
| Koh et al., 1997 75 | Aleatorizado, doble ciego, controlado con placebo | 25; 13 | Roxitromicina; 4 mg/kg/12 h; 3 | ↓Reactividad de la vía aérea | No estudiados |
| Tsang et al., 1999 69 | Aleatorizado, doble ciego, controlado con placebo | 21; 54,3 | Eritromicina; 500 mg/12 h; 2 | ↑FEV1 y FVC; ↓ volumen de esputo | Rash (1) |
| Davies et al., 2004 70 | Prospectivo, abierto | 39; 51,6 | AZM: 500 mg/día, seguido de 250 mg/día por 6 días y después 250 mg/día, 3 días/semana | ↓Volumen de esputo | Diarrea (2); anormalidad pruebas función hepática (2); rash (1); tinnitus (1) |
| ↓Síntomas | |||||
| ↓Exacerbaciones | |||||
| ↑DLCO | |||||
| Cymbala et al., 2005 71 | Aleatorizado, abierto, cruzado | 11; ND | AZM: 500 mg/día, 2 días/semana; 6 | ↓Volumen de esputo | Sin efectos importantes |
| ↓Exacerbaciones | Diarrea (25%) | ||||
| ↑Bienestar general | |||||
| Yalcin et al., 2006 72 | Aleatorizado, controlado con placebo | 34; 12,5 | Claritromicina: 15 mg/kg/día; 3 | ↑FEF25-75 | ND |
| ↓Volumen de esputo | |||||
| ↓Marcadores inflamatorios en el BAL | |||||
| Anwar et al., 200873 | Retrospectivo, abierto | 56; 63 | AZM: 250 mg/día, 3 días a la semana; 9,1 | ↑FEV1 | 6 |
| ↓Exacerbaciones | |||||
| ↓Volumen de esputo | |||||
| ↓Cultivos |
AZM: azitromicina; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; DLCO: capacidad de difusión del monóxido de carbono; ND: no datos; BAL: lavado broncoalveolar; FEF25-75: flujo espiratorio forzado entre el 25 y el 75% de la capacidad vital forzada.
Anwar et al.73 publicaron recientemente los resultados de un estudio retrospectivo sobre los efectos de la azitromicina a dosis de 250mg, 3 veces a la semana, en pacientes que habían presentado 3 o más exacerbaciones durante 6 meses. Los pacientes tuvieron un 50% menos de exacerbaciones, una disminución del volumen de esputo y de los cultivos bacterianos y un leve aumento de la función pulmonar. Es importante destacar que la mayoría de los aislados eran de Haemophilus influenzae y Streptococcus pneumoniae, microorganismos habitualmente sensibles a los macrólidos, a diferencia de PA, por lo que es difícil saber si la mejoría se debió solo a los efectos inmunomoduladores de la azitromicina o a sus efectos antimicrobianos sobre estos microorganismos. En el último trabajo publicado hasta la fecha los autores llegan a la conclusión que la eritromicina, a dosis de 250mg/día, en pacientes adultos con bronquiectasias no FQ reduce el número de exacerbaciones y el consumo de antibióticos74.
En resumen, aunque se precisan más estudios para conocer claramente el papel de los macrólidos en el tratamiento de los pacientes con bronquiectasias no asociadas a la FQ, hay alguna evidencia de que el empleo de estos, especialmente la azitromicina, puede beneficiar a los pacientes con bronquiectasias que presentan agudizaciones frecuentes75. Se recomienda su administración en la infección bronquial crónica por PA o por otros microorganismos si el control clínico es difícil a pesar de un tratamiento adecuado21. Aunque la pauta óptima (duración, dosis, periodicidad) todavía no se ha establecido con claridad, las dosis azitromicina que suelen emplearse son de 250mg a 500mg cada 24h en función del peso (en pacientes > 40kg: 500mg, y en pacientes < 40kg: 250mg), 3 días por semana, preferiblemente no consecutivos. No se han realizado estudios que demuestren su eficacia y su seguridad en tratamientos de más de 12 meses de duración. Una opción razonable puede ser intentar un tratamiento durante 3 o 6 meses y ver los resultados en términos de calidad de vida y número de exacerbaciones, entre otros. Si los resultados no son los adecuados, el tratamiento debería suspenderse. Si no, deberían prolongarse, valorando cuidadosamente el riesgo/beneficio y vigilando la posible aparición de efectos secundarios.
Antes de iniciar el tratamiento y periódicamente cada 6 meses debe descartarse una infección respiratoria por micobacterias no tuberculosas por medio de un análisis de esputo, ya que los pacientes con aislamiento de micobacterias no tuberculosas no deberían recibir monoterapia con macrólidos por el riesgo de incrementar la selección de cepas de micobacterias no tuberculosas resistentes a macrólidos. Los efectos secundarios más frecuentes son gastrointestinales (náuseas, diarrea), elevación de las transaminasas, disminución de la capacidad auditiva, así como candidiasis urogenital, sobre todo en las mujeres. Por ello se recomiendan controles periódicos de las transaminasas en las primeras semanas de tratamiento y cada 6 meses. Para disminuir en lo posible los efectos gastrointestinales puede ser recomendable la administración de probióticos orales de mantenimiento. Se ha demostrado que el tratamiento prolongado con macrólidos aumenta las resistencias de los microorganismos presentes a nivel bronquial (S. aureus, H. influenzae), lo que debería ser evaluado en estudios futuros. El tratamiento prolongado con otros fármacos antiinflamatorios, como son los corticoides orales o el ibuprofeno, no se recomienda en las bronquiectasias no FQ por sus efectos secundarios21.
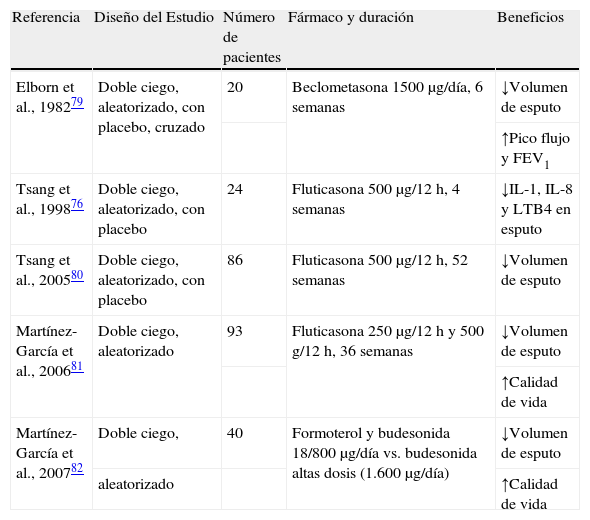
Corticoides inhaladosLos corticoides inhalados pueden reducir la inflamación y mejorar la obstrucción de las vías aéreas. Fisiopatológicamente disminuyen los marcadores proinflamatorios en el esputo76. No hay evidencia suficiente como para recomendar su uso rutinario en pacientes estables, pero podría valorarse su empleo en pacientes adultos con dificultad para el control de su sintomatología21,77, si bien hay que tener una especial precaución cuando se emplean dosis altas78. Un estudio aleatorizado doble ciego controlado con placebo cruzado y realizado en pacientes adultos con bronquiectasias79 mostró una reducción del 18% en la producción de esputo con una pequeña mejoría del FEV1 y del flujo espiratorio máximo que, aunque significativos, tuvieron una dudosa significación clínica. Un estudio realizado años después demostró que el empleo de fluticasona inhalada a dosis elevadas (1.000μg/día) es capaz de reducir la densidad de leucocitos y los parámetros inflamatorios en esputo en pacientes con bronquiectasias, disminuyendo el volumen de expectoración y mejorando la calidad de vida de los pacientes80. El incremento de los efectos adversos cuando se emplean dosis elevadas hace que no se recomienden de forma general en pacientes con bronquiectasias, sino en los pacientes con mayor broncorrea u obstrucción al flujo aéreo81. Por último, Martínez-García et al. observaron por primera vez en pacientes con bronquiectasiasque la adición de un beta-2 adrenérgico de acción prolongada (formoterol) permite la reducción de corticoides inhalados a la mitad de la dosis, mejorando los parámetros clínicos y de calidad de vida de los pacientes y con una disminución de efectos adversos locales82. En la tabla 4 aparecen los estudios más significativos realizados al respecto.
Estudios realizados con corticoides inhalados en pacientes con bronquiectasias no debidas a fibrosis quística
| Referencia | Diseño del Estudio | Número de pacientes | Fármaco y duración | Beneficios |
| Elborn et al., 198279 | Doble ciego, aleatorizado, con placebo, cruzado | 20 | Beclometasona 1500μg/día, 6 semanas | ↓Volumen de esputo |
| ↑Pico flujo y FEV1 | ||||
| Tsang et al., 199876 | Doble ciego, aleatorizado, con placebo | 24 | Fluticasona 500μg/12 h, 4 semanas | ↓IL-1, IL-8 y LTB4 en esputo |
| Tsang et al., 200580 | Doble ciego, aleatorizado, con placebo | 86 | Fluticasona 500μg/12 h, 52 semanas | ↓Volumen de esputo |
| Martínez-García et al., 200681 | Doble ciego, aleatorizado | 93 | Fluticasona 250μg/12 h y 500 g/12 h, 36 semanas | ↓Volumen de esputo |
| ↑Calidad de vida | ||||
| Martínez-García et al., 200782 | Doble ciego, | 40 | Formoterol y budesonida 18/800μg/día vs. budesonida altas dosis (1.600μg/día) | ↓Volumen de esputo |
| aleatorizado | ↑Calidad de vida |
FEV1: volumen espiratorio forzado en el primer segundo; IL: interleucina; LT: leucotrieno.
Debido a que no hay estudios que avalen la eficacia y la seguridad del tratamiento prolongado con corticoides orales o ibuprofeno, no se recomienda su empleo21,83. Los antagonistas de los receptores de leucotrienos podrían ser potencialmente útiles en bronquiectasias debido a que inhiben la inflamación neutrofílica en las vías aéreas. Sin embargo, tampoco hay estudios controlados hasta la fecha que apoyen tal práctica en esta patología84.
Tratamiento broncodilatadorEl mecanismo de la obstrucción bronquial en bronquiectasias no asociadas a FQ no está claro. Podría explicarse por varios factores como la producción excesiva de moco, la distorsión de la arquitectura bronquial y la constricción del músculo liso de las vías aéreas. Pero debido a que las bronquiectasias pueden coexistir tanto con el asma como con la EPOC, es difícil diferenciar en los estudios cuándo la obstrucción de las vías aéreas se debe a un asma subyacente, a la EPOC, a las bronquiectasias o a una combinación de estas patologías. Aunque en estos pacientes es frecuente observar tanto un aumento de la hiperreactividad bronquial85,86 como cierto grado de reversibilidad de la obstrucción bronquial con el empleo de broncodilatadores inhalados36,86-88, hasta la fecha no se han publicado estudios aleatorizados que hayan evaluado adecuadamente el papel de los broncodilatadores en las bronquiectasias en tratamientos prolongados88,89. En un estudio controlado con placebo se observó un incremento mayor de la FVC y FEV1 tras el salbutamol90. No hay evidencia para emplear anticolinérgicos inhalados en niños con bronquiectasias83. Sin embargo, estos fármacos pueden ser eficaces en algunos pacientes adultos91. En general se recomienda valorar la reversibilidad de la obstrucción de las vías aéreas de los pacientes a salbutamol y a bromuro de ipratropio e instaurar el tratamiento cuando se objetive mejoría de la función pulmonar o de los síntomas. También se recomienda la administración de cualquiera de ellos antes de la fisioterapia y de los antibióticos aerosolizados para prevenir en lo posible un broncoespasmo21.
Debido a que los broncodilatadores de acción larga tienen un claro papel en el manejo de la obstrucción de los pacientes asmáticos, ya que permiten reducir las dosis de esteroides inhalados y la frecuencia de exacerbaciones, podrían tener un papel teórico en el tratamiento de los pacientes en los que coexistan bronquiectasias y asma, aunque hasta la fecha no hay una buena evidencia que apoye esta práctica en los pacientes con bronquiectasias sin asma92.
En el momento actual no hay evidencia que apoye el empleo de las metilxantinas en el tratamiento de los pacientes con bronquiectasias93, por lo que no se recomienda su empleo.
Rehabilitación respiratoriaEl objetivo de la rehabilitación respiratoria es ayudar a movilizar las secreciones, mejorar la capacidad ventilatoria, mejorar la tolerancia al ejercicio y reducir la disnea de los pacientes. Hay dispositivos que permiten de forma mecánica realizar la permeabilización adecuada de las vías respiratorias, que permiten y/o favorecen la expulsión de las secreciones bronquiales, y que evitan su acumulación y las posibles complicaciones derivadas de esta94-97.
Ejercicio físicoEl ejercicio físico aeróbico mejora la tolerancia física y la calidad de vida relacionada con la salud. Se recomienda que todos los pacientes practiquen un ejercicio de moderado a intenso durante 30min al día, de 3 a 4 veces por semana o, en su defecto, una actividad física moderada todos los días, además de las técnicas de fisioterapia98-100.
Fisioterapia respiratoriaEl objetivo de la fisioterapia respiratoria es favorecer el aclaramiento mucociliar y reducir la frecuencia de la tos. Aunque no hay una clara evidencia que indique qué pacientes deberían beneficiarse de las técnicas de fisioterapia101,102, es un hecho admitido por todos los que se dedican a tratar esta patología que la limpieza rutinaria de la hipersecreción bronquial es un componente fundamental del manejo de los pacientes que tienen una tos crónica productiva o evidencia de tapones mucosos en la TAC. Aunque no existe evidencia para saber si los pacientes con tos no productiva también podrían beneficiarse de las técnicas de fisioterapia, el consenso de los expertos es que al menos deben realizar la fisioterapia respiratoria durante las exacerbaciones22. La fisioterapia debe realizarse tres veces al día, después del tratamiento broncodilatador y antes de los antibióticos inhalados103. Existen varias técnicas de fisioterapia respiratoria que pueden usarse en los pacientes con bronquiectasias, pero aunque según determinados estudios alguna técnica puede ser más eficaz que otra104, en realidad no hay una evidencia clara de cuál es la más efectiva. Las técnicas asistidas requieren ayuda de otra persona (fisioterapeuta o cuidador), pero existen alternativas que puede realizar el paciente por sí mismo y que le proporcionan más independencia en el manejo y control de su enfermedad. La elección dependerá de la edad del paciente y de su capacidad para realizar la técnica. En general, se recomienda utilizar técnicas autoadministradas para facilitar el cumplimiento.
Mucolíticos y agentes hiperosmolaresLos mucolíticos no han demostrado claramente su eficacia ni en pacientes con bronquiectasias105 ni en pacientes con otras patologías pulmonares106-108. La revisión sistemática Cochrane105, basándose en el trabajo de Olivieri et al.109, sugiere que la bromhexina es el único mucolítico que ha demostrado un cierto beneficio en el tratamiento de las exacerbaciones de los pacientes con bronquiectasias.
La inhalación de agentes hiperosmolares (solución salina hipertónica y manitol en polvo seco) es una terapia mucho más prometedora en pacientes con bronquiectasias110. Estos agentes favorecen la limpieza de las vías aéreas en la mayoría de las enfermedades respiratorias que se caracterizan por una producción excesiva de esputo, favoreciendo la hidratación de las vías aéreas y el aclaramiento mucociliar111-113. La mayor evidencia de la eficacia de este tipo de agentes se ha demostrado con la inhalación de la solución salina hipertónica al 7% en pacientes con bronquiectasias secundarias a FQ114. En estos pacientes se ha demostrado que su inhalación reduce las exacerbaciones, mejora la calidad de vida y mejora levemente la función pulmonar115. En pacientes con bronquiectasias no asociadas a FQ se ha demostrado que la solución salina hipertónica al 7% puede reducir la viscosidad del esputo y mejorar ligeramente la función pulmonar cuando se compara con la solución salina al 0,9%116. Aunque la inhalación de DNasa se ha demostrado efectiva en FQ, en las bronquiectasias debidas a otras etiologías puede ser ineficaz117 o incluso perjudicial118, por lo que no se recomienda su empleo.
Tratamiento nutricionalLos pacientes con bronquiectasias evolucionadas suelen presentar desnutrición, y existe una estrecha relación entre la desnutrición y la función pulmonar. Todos los pacientes con bronquiectasias deben recibir educación y control nutricional como parte de la asistencia integral con el objetivo de mantener o alcanzar un estado nutricional normal, bien sea a través de la dieta natural y/o la nutrición enteral, especialmente en las agudizaciones. El índice de masa corporal (IMC) debe ser uno de los parámetros que hay que controlar habitualmente en las consultas de los pacientes adultos con bronquiectasias, y de manera especial en aquellos con enfermedad grave119,120, con el objetivo de hacer una intervención nutricional precoz. Deberá considerarse la administración de suplementos orales en los pacientes con un IMC < 20kg/m2, o bien > 20kg/m2 que estén perdiendo peso de forma aguda (especialmente durante las exacerbaciones e ingresos hospitalarios)121.
Tratamiento de las complicacionesLas complicaciones más frecuentes de las bronquiectasias son las atelectasias, la hemoptisis y la insuficiencia respiratoria.
AtelectasiasLa atelectasia lobar o segmentaria puede deberse a la presencia de tapones de moco intrabronquial o por enfermedad parenquimatosa grave. El tratamiento convencional de la atelectasia se basa en la intensificación de la fisioterapia respiratoria y en la administración de antibióticos, con broncodilatadores inhalados e, incluso, corticoides sistémicos. Puede ser útil la administración de broncodilatadores con suero salino aerosolizado. Si las medidas conservadoras no son suficientes, debe realizarse una fibrobroncoscopia para aspirar las secreciones espesas o el tapón mucoso responsable de la atelectasia. Si fracasan las medidas anteriores, podría valorarse la realización de una lobectomía, si bien debe considerarse que esta última opción puede comprometer un futuro trasplante pulmonar21.
HemoptisisEs una de las complicaciones más frecuentes. Puede ir desde formas muy leves a más graves. Estas últimas son menos frecuentes, pero potencialmente mortales. La causa más frecuente de hemoptisis es una exacerbación. Hay pocas publicaciones sobre el manejo de la hemoptisis en adultos con bronquiectasias no asociadas a la FQ. En estos pacientes, la hemoptisis amenazante requiere, además de las medidas habituales de toda hemoptisis (mantener libre la vía aérea, optimizar la oxigenación y estabilizar hemodinámicamente al paciente), la administración de antibióticos intravenosos, evitar los fármacos nebulizados y fisioterapia al menos durante las primeras 24-48h, y embolización de las arterias bronquiales patológicas de la zona de la hemorragia122-125. La cirugía solo está indicada cuando hay riesgo vital, cuando el origen de la hemorragia está bien localizado y cuando no se puede controlar la hemoptisis con las medidas anteriores.
Insuficiencia respiratoriaLa insuficiencia respiratoria es la causa más frecuente de muerte en los pacientes con bronquiectasias. Aparece en las formas más graves de la enfermedad o de modo pasajero durante las exacerbaciones. Debido a que no existen estudios específicos que analicen cómo manejar a estos pacientes, deben seguirse los principios recomendados de forma general para el tratamiento con oxígeno. La ventilación mecánica no invasiva puede utilizarse en pacientes en situación de insuficiencia respiratoria global, si bien debe monitorizarse estrechamente la utilidad de este tratamiento y la aparición de posibles complicaciones126-129.
El gran avance de los tratamientos antibióticos en las últimas décadas ha relegado el tratamiento quirúrgico de las bronquiectasias solo para algunos casos excepcionales, como la extracción de un tumor o un cuerpo extraño, las bronquiectasias localizadas con infecciones recurrentes frecuentes que no responden al tratamiento médico, las causantes de hemoptisis graves en las que la embolización de arterias bronquiales no es efectiva, las sospechosas de albergar microorganismos resistentes, como micobacterias no tuberculosas, o las bronquiectasias abscesificadas no curables con tratamiento antibiótico130-132.