Introducción
El trasplante alogénico de médula ósea (TMO) es un tratamiento establecido con un alto potencial curativo para varias enfermedades hematológicas1. La enfermedad crónica del injerto contra huésped (EICH) es una complicación mayor de este procedimiento y es la principal causa de mortalidad tardía tras el TMO. La clínica incluye características similares a la de enfermedades autoinmunitarias que afectan a diversos órganos como el riñón, el hígado, la boca, los ojos, el tracto gastrointestinal, los pulmones y el tejido blando. La bronquiolitis obliterante es una complicación particularmente grave que ocurre en el 10-15% de los pacientes con EICH extensa2,3 y con frecuencia es refractaria a tratamiento. Si no hay respuesta al tratamiento inmunodepresor convencional tras 3-6 meses de tratamiento, el pronóstico de estos pacientes es infausto.
Presentamos el caso de una paciente con bronquiolitis obliterante tras TMO, rebelde al tratamiento habitual, por lo que evolucionó hacia una enfermedad pulmonar terminal que fue tratada con éxito mediante trasplante pulmonar.
Observación clínica
Niña de 8 años con anemia aplásica grave, por la que recibió un TMO procedente de un hermano con complejo principal de histocompatibilidad compatible. Como tratamiento de acondicionamiento se le administró ciclofosfamida intravenosa. La primera semana tras el trasplante recibió profilaxis frente a la EICH con metotrexato por vía intravenosa.
El período postrasplante inmediato transcurrió sin incidencias. El día 58 postrasplante, comenzó a presentar afectación cutánea y hepática moderada, y tras biopsia de las lesiones cutáneas se confirmó la existencia de EICH. Se trató con prednisona a dosis altas, con posterior reducción hasta 1 mg/kg/día y adición de ciclofosfamida y azatioprina en días alternos al considerarse la cronificación del cuadro.
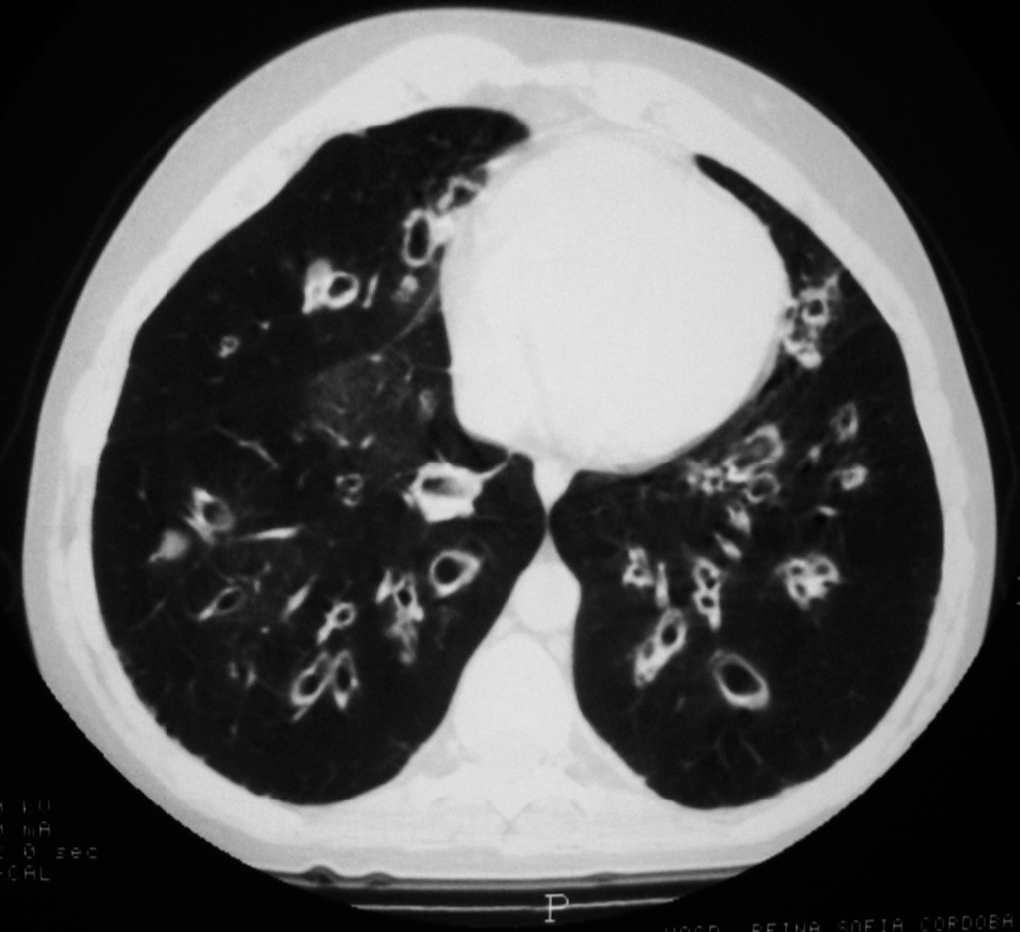
Transcurridos unos 120 días desde el trasplante, comenzó con disnea progresiva, junto con tos, expectoración mucopurulenta y sibilancias generalizadas. A pesar del intenso tratamiento broncodilatador y esteroideo, progresó rápidamente hacia una alteración ventilatoria obstructiva grave e insuficiencia respiratoria hipoxémica. La radiografía de tórax mostraba hiperinflación pulmonar y patrón intersticial evidente, con imágenes areolares indicativas de bronquiectasias difusas, que la tomografía axial computarizada de alta resolución (TACAR) de tórax confirmó (fig. 1). Se realizaron fibrobroncoscopia y biopsia transbronquial, que fue diagnóstica de bronquiolitis obliterante.
Fig. 1. Tomografía axial computarizada de alta resolución de tórax antes del trasplante pulmonar. Se aprecian bronquiectasias saculares bilaterales, de predominio central, con áreas de hipoventilación distales a ellas, junto a engrosamiento de las paredes bronquiales.
Esta situación se mantuvo, sin apenas modificaciones espirométricas, durante 17 años, a lo largo de los cuales la paciente presentó múltiples infecciones respiratorias por microorganismos gramnegativos, fundamentalmente Escherichia coli. En el último año precisaba oxigenoterapia continua, incluso oxígeno líquido para caminar.
En esta situación se la remitió a nuestro hospital para evaluación de trasplante pulmonar. Clínicamente la paciente se encontraba en clase funcional III (escala de la New York Heart Association) con disnea a mínimos esfuerzos. Desde el punto de vista físico destacaban signos cushingoides y aumento de la cifosis dorsal, así como acropaquías en las manos. En la auscultación se apreciaba un descenso generalizado del murmullo vesicular, con crepitantes diseminados en ambos campos pulmonares.
Tras exponer a la paciente la indicación del trasplante pulmonar, ingresó para proceder a su evaluación final según el protocolo de trasplante de nuestra unidad4. Se constató la normalidad de las funciones renal, hepática, cardíaca y hematopoyética. El panel frente a anticuerpos citotóxicos fue negativo.
La espirometría mostraba los siguientes datos: capacidad vital forzada de 920 ml (27%), volumen espiratorio forzado en el primer segundo de 380 ml (13%), capacidad pulmonar total de 6.410 cm² (156%) y volumen residual de 5.610 ml (489%). En la gasometría arterial basal la presión arterial de oxígeno era de 56 mmHg y la presión arterial de anhídrido carbónico de 48 mmHg.
Se aceptó a la paciente como candidata a trasplante pulmonar. Tras permanecer 3 meses en lista de espera, se le sometió a un trasplante bipulmonar secuencial con órganos procedentes de cadáver del mismo grupo sanguíneo.
El procedimiento quirúrgico transcurrió sin incidencias y el postoperatorio también fue favorable. Se le dio el alta a los 21 días de la intervención, sin que hubiera presentado episodios de rechazo ni infección.
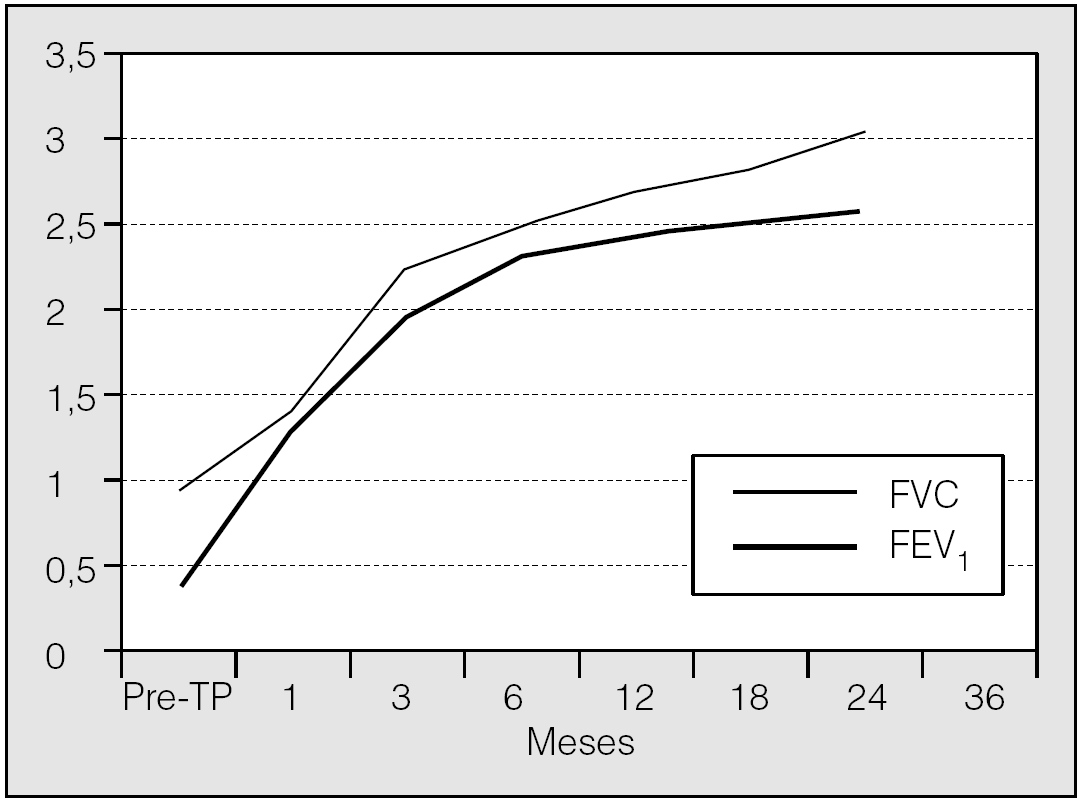
Desde el trasplante pulmonar recibe tratamiento inmunodepresor oral antirrechazo con corticoides a dosis mínimas, mofetil micofenolato y ciclosporina ajustados a las concentraciones sanguíneas, y en las revisiones periódicas ambulatorias se mantiene asintomática. Realiza vida activa con normalidad a los 3 años del trasplante, sin evidencia de rechazo ni signos de bronquiolitis obliterante. La TACAR torácica realizada a los 36 meses muestra normalidad del parénquima pulmonar y vías respiratorias. Desde los primeros meses postrasplante pulmonar se aprecia una progresiva recuperación funcional (fig. 2).
Fig. 2. Evolución funcional tras el trasplante pulmonar (TP). FVC: capacidad vital forzada; FEV1: volumen espiratorio forzado en el primer segundo.
Discusión
La bronquiolitis obliterante tras el TMO ocurre entre el 10 y el 15% de los pacientes con EICH, sin que esté aún clara la causa2,3. Se consideran factores relacionados con su aparición la edad adulta, las infecciones virales, la autoinmunidad, la irradiación corporal total, la historia de EICH aguda (meses 1-2 post-TMO), la administración de células madre en lugar de médula ósea y la historia de neumonía intersticial3.
La bronquiolitis obliterante se manifiesta generalmente en el primer año tras el TMO, como ocurrió en nuestra paciente. El síntoma más frecuentemente encontrado es tos recurrente y persistente inexplicada. El diagnóstico se establece mediante la realización de pruebas de función pulmonar que muestran obstrucción irreversible de las vías aéreas. En las fases iniciales la radiografía de tórax es normal. La TACAR torácica puede mostrar dilataciones bronquiales, patrón en vidrio deslustrado y evidencia de atrapamiento aéreo en espiración1.
El manejo de estos pacientes incluye tratamiento inmunodepresor como corticoides, ciclosporina, azatioprina o mofetil micofenolato, así como broncodilatadores, antibióticos e inmunoglobulinas. Si no hay respuesta tras 6 meses de tratamiento, el pronóstico empeora. A pesar del tratamiento inmunodepresor, la tasa de mortalidad en este período de tiempo es superior al 50% en la mayoría de las series publicadas5.
Hay publicados casos esporádicos o series cortas de trasplante pulmonar por bronquiolitis obliterante tras TMO6-10. Calhoon et al7 publicaron el caso de una mujer de 25 años con leucemia aguda linfoblástica y enfermedad pulmonar restrictiva tratada con éxito con un trasplante unipulmonar; a los 9 meses de seguimiento permanecía asintomática y sin limitación para sus actividades cotidianas. Gascoigne y Corris6 recogen un caso similar; en esta ocasión, el paciente murió 9 meses más tarde. Svendson et al8 publicaron un caso de trasplante lobular de donante vivo emparentado por bronquiolitis obliterante tras TMO por aplasia medular; la paciente permanecía viva a los 14 meses de seguimiento. Rabitsch et al9 describieron el caso de un varón con TMO tras leucemia mieloide crónica que desarrolló EICH, por lo que recibió un trasplante bipulmonar 18 meses después del TMO; a los 23 meses de seguimiento tras el trasplante pulmonar permanecía vivo y sin signos de insuficiencia respiratoria. Heath et al10 recogen 4 casos con enfermedad pulmonar crónica e irreversible entre uno y 3 años después de un TMO en la infancia; uno de ellos era una niña de 6 años con aplasia medular, al igual que nuestra paciente. En todos se observó mejoría clínica significativa y la función pulmonar llegó a normalizarse al año.
Aunque a priori un paciente con TMO previo pudiera tener un riesgo mayor de rechazo agudo o crónico tras el trasplante pulmonar, debido a la cantidad de leucocitos inmunocompetentes presentes en el pulmón donante, nuestra paciente no ha presentado episodios de rechazo agudo y se encuentra libre de bronquiolitis obliterante. Este punto resulta interesante; es importante conocer la duración y la cantidad de inmunodepresión administrada antes del trasplante pulmonar. Como ya hemos comentado, nuestra paciente recibió diferentes fármacos inmunodepresores (metotrexato, prednisona, ciclofosfamida y azatioprina) en el tiempo transcurrido entre el trasplante medular y el pulmonar. La EICH y la inmunodepresión pudieran haber inducido alteraciones en la alorreactividad, conduciendo a una mejor adaptación al injerto. Dos de 3 casos publicados7,8 también recibieron inmunodepresión durante largo tiempo antes del trasplante pulmonar, sin manifestación clínica de rechazo posterior. Estudios previos muestran que la inmunodepresión en el receptor puede conducir a un estado de baja respuesta a aloantígenos, lo que conduce a una mayor supervivencia del injerto11.
Otro aspecto interesante es la causa que motiva el TMO. En las diversas series publicadas tan sólo hemos encontrado 2 casos de TMO por aplasia medular8,10 que posteriormente desarrollaron EICH, tratada mediante trasplante pulmonar. En el resto de casos la indicación del TMO fue una enfermedad hematológica maligna.
Actualmente, transcurridos 21 años desde el trasplante medular y 36 meses desde el pulmonar, nuestra paciente se encuentra en remisión completa hematológica y con función pulmonar normal. En nuestra opinión, el trasplante pulmonar es una opción terapéutica para determinados pacientes que desarrollan enfermedad pulmonar terminal tras un TMO, en quienes el órgano de choque fundamental de la EICH es el pulmón y que no responden al tratamiento médico conservador.
Correspondencia: Dr. J. Redel-Montero.
Avda. Arruzafilla, 7, portal 4, 2.o I. 14011 Córdoba. España.
Correo electrónico: javierredel@msn.com
Recibido: 28-4-2005; aceptado para su publicación: 24-5-2005.