Conocer la frecuencia del síndrome de apnea-hipopnea del sueño (SAHS)y del síndrome metabólico (SM) en normopeso y sus características. Determinar si existen diferencias epidemiológicas con aquellos con sobrepeso u obesidad.
MétodosSe estudiaron todos los pacientes con sospecha de SAHS remitidos al laboratorio del sueño desde enero a diciembre 2009. Se diagnosticó de SAHS cuando el índice de apnea-hipopnea (IAH) era >5 y existía clínica. Se diagnosticó el SM según los criterios de la International Diabetes Federation (IDF). Los pacientes se distribuyeron en 3 grupos según el índice de masa corporal (IMC): normopeso (<25kg/m2), sobrepeso (25-29,9kg/m2) y obesidad (≥30kg/m2).
ResultadosSe estudiaron 475pacientes: 7,60% normopeso y 56,40% obesos. De los normopeso, la mayoría eran mujeres, roncadores, no fumadores, no consumían alcohol y eran significativamente más jóvenes y con menor perímetro de cuello y abdomen. Se diagnosticó de SAHS al 90,10%: normopeso 77,70%. En pacientes con SAHS y normopeso la mayoría eran SAHS leve, existiendo diferencias entre diagnóstico de SAHS e IMC categorizado. Se diagnosticó de SM al 64,40%: 33,33% normopeso, encontrando mayor probabilidad de SM al aumentar el IMC. La prevalencia de SAHS y SM simultáneamente en normopeso fue del 22% y en obesos del 70,52%. El SAHS en normopeso se relacionó con el sexo y la edad. No se encontró relación entre SM y SAHS, y tampoco entre malformación otorrinolaringológica y SAHS. Se trató con CPAP a 8pacientes normopeso con SAHS.
ConclusionesLa frecuencia de SAHS en normopeso era menor que en los sobrepeso y obesos. La frecuencia de SAHS y SM simultáneamente en normopeso frente a obesos fue menor. Los pacientes normopeso eran con más frecuencia mujeres, más jóvenes y sin hábitos tóxicos. Los factores predictores de SAHS en normopeso eran sexo y edad, sin que existiera relación entre SM y SAHS.
To determine the frequency of obstructive sleep apnoea (OSA) and metabolic syndrome (MS) in normal weight patients and their characteristics, and to compare these with overweight and obese patients.
MethodsWe studied all patients with suspected OSA referred to the sleep laboratory from January to December 2009. OSA was diagnosed when the apnoea-hypopnoea index (AHI) was >5 and symptoms were present. MS was diagnosed according to International Diabetes Federation (IDF) criteria. The patients were distributed into 3 groups according to body mass index (BMI): normal weight (<25kg/m2), overweight (25-29.9kg/m2) and obese (≥30kg/m2).
ResultsWe studied 475 patients: 7.60% normal weight and 56.4% obese. Most patients in the normal weight group were women, snorers, non-smokers, non-drinkers and were significantly younger and with a smaller neck and waist circumference than obese and overweight patients. OSA was diagnosed in 90.10%: 77.70% normal weight. OSA in these patients was mostly mild, and there were differences between the diagnosis of OSA and the BMI classified. MS was diagnosed in 64.40%: 33.33% normal weight. There was a higher probability of MS as the BMI increased. OSA and MS frequency in normal weight patients was 22% and in obese patients was 70.52%. OSA in normal weight patients was related with gender and age. There was no relationship between OSA and MS, or between otorhinolaryngological malformations and OSA in normal weight patients. Eight normal weight patients with OSA were treated with continuous positive airway pressure (CPAP) therapy.
ConclusionsThe frequency of OSA in normal weight patients was lower than in overweight and obese patients. The frequency of concomitant OSA and MS was lower in normal weight patients than in obese subjects. Normal weight patients were mostly women, younger and had no toxic habits. In normal weight patients, age and gender were predictive factors for OSA, but OSA and MS were not related.
El síndrome de apnea-hipopnea del sueño (SAHS) es una enfermedad muy prevalente en la población general que puede causar deterioro de la calidad de vida, hipertensión arterial, enfermedades cardiovasculares, cerebrovasculares, accidentes de tráfico y un exceso de mortalidad por sí misma1. En España, del 3 al 6% de la población padece un SAHS sintomático y del 24 al 26% un índice de apnea-hipopnea (IAH) >52. Esta patología se caracteriza por episodios repetidos de obstrucción de la vía aérea superior, que se acompaña de desaturación nocturna, fragmentación del sueño y somnolencia diurna excesiva1.
Los factores de riesgo que más se asocian con el SAHS son la edad, el sexo masculino y un elevado índice de masa corporal (IMC)2,3. La prevalencia del SAHS aumenta con la edad, llegando a triplicarse en los ancianos comparados con las edades medias. La relación hombre/mujer en edades medias es 2-3/1, con tendencia a igualarse a partir de la menopausia2. Otras variables que influyen en la aparición o desarrollo del SAHS son el consumo de alcohol, tabaco, sedantes, hipnóticos, barbitúricos, así como la posición en decúbito supino durante el sueño. También pueden estar implicados factores genéticos, familiares y raciales1.
Diversos estudios relacionan el SAHS con el síndrome metabólico (SM). El SM hace referencia a un conglomerado de alteraciones metabólicas que predice un incremento del riesgo de padecer enfermedades cardiovasculares y diabetes mellitus tipo2. Según los diferentes trabajos realizados se han producido modificaciones en la definición de este síndrome, considerando actualmente el SM como un cuadro pluripatológico en el que los componentes fundamentales son obesidad, resistencia a la insulina, hipertensión, hipertrigliceridemia y niveles bajos de colesterol ligado a lipoproteínas de alta densidad (cHDL). La prevalencia del SM no se conoce con exactitud y varía sustancialmente entre los diversos países y según los criterios utilizados (National Education Program. Adult Treatment Panel III [NCEP ATPIII], Organización Mundial de la Salud [OMS], International Diabetes Federation [IDF], etc.), objetivándose cifras del 27,3% en Canadá, del 20,95 y del 23% según se usen los criterios de la OMS o del ATPIII en la cohorte de San Antonio; del 13,2% y del 16,55% según el Grupo Europeo para el Estudio de la Resistencia a Insulina (EGIR) o la OMS, respectivamente, en Francia. En España, el Registro Nacional del SM (Registro MESYAS) determinó una prevalencia del 10% en trabajadores activos de ambos sexos. A pesar de estas diferencias, hay un hecho común que es que la prevalencia está aumentando a medida que aumenta la prevalencia de obesidad4,5.
En la literatura se ha puesto de manifiesto que ambas entidades están estrechamente relacionadas con la obesidad como factor de riesgo para su desarrollo y agravamiento. En base a esto, nuestro objetivo fue conocer la prevalencia del SAHS y del SM en los pacientes delgados, así como sus características epidemiológicas, y determinar si existen diferencias con aquellos con sobrepeso u obesidad.
Material y métodosEstudio retrospectivo, observacional de todos los pacientes remitidos a la consulta externa de la unidad de trastornos respiratorios del sueño (UTRS) del Complexo Hospitalario Universitario de Ourense (CHUO) por sospecha de SAHS, desde enero a diciembre de 2009. La recogida de casos se realizó utilizando la base de datos de la UTRS. Las variables recogidas fueron: edad, sexo, consulta de procedencia, motivo de consulta, profesión (pensionista, activo, conductor habitual, otras), antecedentes de hipertensión arterial (HTA), síndrome depresivo, puntuación en la escala de Epworth, uso de sedantes, IMC, perímetro de cuello, perímetro de cintura, malformación otorrinolaringológica (ORL), tabaquismo, alcohol, polisomnografía, poligrafía respiratoria, parámetros de sueño (IAH, CT90, número de desaturaciones por hora, saturación media de oxihemoglobina), diagnóstico, SM, hiperglucemia, HTA, cHDL bajo, hipertrigliceridemia, tratamiento con presión positiva continua en vía aérea (CPAP). El diagnóstico de SAHS se realizó mediante polisomnografía (PSG) o poligrafía respiratoria (PR), cuando el IAH era >5 y existía clínica compatible. Se clasificó en 3 grados: leve (6-15), moderado (16-30) y severo (≥30). El SM se diagnosticó según los criterios de la IDF6. Posteriormente los pacientes se distribuyeron en 3 grupos según el IMC: normopeso (IMC<25kg/m2), sobrepeso (IMC25-29,9kg/m2) y obesos (IMC≥30kg/m2)7.
Análisis estadísticoPara el análisis estadístico de los datos se utilizó el programa SPSS versión 15.0. Las variables cuantitativas se expresaron como media±desviación estándar (DE) y las cualitativas como frecuencias y porcentajes. Se determinó la normalidad de las variables mediante la prueba de Kolmogorov-Smirnov. Para determinar la asociación entre variables cualitativas se utilizó la prueba de la χ2; para las cuantitativas gaussianas, la prueba paramétrica ANOVA de un factor, y para las no gaussianas, la prueba no paramétrica de Kruskal-Wallis. Para determinar la relación entre las variables de estudio y el SAHS en el grupo de pacientes delgados se utilizaron las pruebas χ2 (variables categóricas) y la no paramétrica U de Mann-Whitney (variables continuas). En todos los análisis se consideró un valor de p<0,05 como estadísticamente significativo.
ResultadosEn el periodo de estudio acudieron a la consulta de la UTRS 486pacientes, excluyéndose 9 por ausencia de datos de IMC. Finalmente se estudiaron 475pacientes, de los cuales 36 (7,60%) eran normopeso, 171 (36%) sobrepeso y 268 (56,40%) obesos. La mayor parte de los pacientes fueron derivados de atención primaria (278; 58,5%) y neumología (79; 16,6%).
De los pacientes normopeso, la mayoría eran mujeres (20; 55,60%), con una edad media de 53,64±16,36años, significativamente menor que en los otros grupos (p=0,021). Presentaban un perímetro de cuello de 36,33±3,52cm, menor que en los otros grupos (p<0,001), y un perímetro de abdomen de 90,42±13,48cm, también significativamente inferior (p<0,001). En cuanto a los hábitos tóxicos, 24 (66,70%) eran no fumadores, 30 (83,30%) no consumían alcohol de forma habitual y 7 (19,40%) utilizaban sedantes. Los pacientes con peso normal eran con más frecuencia activos (22; 61,10%).
Con respecto al motivo de consulta, en los normopeso el más frecuente fue el ronquido (23; 63,90%). La hipersomnolencia diurna medida por el Epworth fue significativamente menor (p=0,006) en los pacientes con normopeso. En los parámetros del estudio del sueño se objetivó un menor IAH (12,08±9,67; p<0,01), menor CT90 (10,77±26,65; p<0,001), menor número de desaturaciones por hora (p<0,001) y mayor saturación media de oxihemoglobina (94,33%±2,81; p<0,001) en los pacientes normopeso con respecto a los demás grupos.
El SM tenía una menor frecuencia global (33,33%; p<0,001) en los pacientes normopeso y también se objetivó menor frecuencia de los criterios de SM por separado (p<0,001). La hiperglucemia y la HTA fueron los criterios de SM predominantes en pacientes con normopeso (tabla 1).
Características clínicas y epidemiológicas de los pacientes estratificados por IMC y valor de p
| Normopeson=36 | Sobrepeson=171 | Obesosn=268 | p | |
| Hombresa | 16 (44,40%) | 135 (78,90%) | 202 (75,40%) | < 0,001 |
| Edad (años)b | 53,64±16,36 | 55,57±14,38 | 58,55±12,27 | 0,021 |
| IMC (kg/m2)b | 23,02±1,78 | 27,63±1,39 | 35,63±5,77 | – |
| Perímetro de cuello (cm)b | 36,33±3,52 | 40,60±3,24 | 44,76± 4,03 | < 0,001 |
| Perímetro de cintura (cm)b | 90,42±13,48 | 100,97±8,08 | 118,97±12,13 | < 0,001 |
| Epworthb | 9,64±5,24 | 11,26±5,74 | 12,45±5,46 | 0,006 |
| Tabaquismoa | 5 (13,90%) | 21(12,6%) | 51 (19,60%) | 0,160 |
| Alcohola | 6 (16,70%) | 43 (25,1%) | 105 (39,20%) | 0,001 |
| Antecedentes de HTAa | 9 (25,70%) | 65 (38%) | 161 (60,10%) | < 0,001 |
| Estudio de sueñoa | 0,779 | |||
| Polisomnografíaa | 16 (44,40%) | 71 (41,50%) | 105 (39,20%) | – |
| Poligrafía respiratoriaa | 20 (55,60%) | 100 (58,50%) | 163 (60,80%) | – |
| IAHb | 12,08±9,67 | 22,30±18,52 | 37,31±25,17 | < 0,001 |
| CT90b | 10,77±26,65 | 10,56±19,31 | 28,23±31,95 | < 0,001 |
| Saturación media de oxihemoglobinab | 94,33±2,81 | 93,68±2,60 | 91,31±3,77 | < 0,001 |
| Síndrome metabólico y componentes | – | |||
| SMa | 11 (33,30%) | 69 (43,90%) | 208 (80,90%) | < 0,001 |
| Hiperglucemiaa | 13 (39,40%) | 64 (41,80%) | 189 (73,80%) | < 0,001 |
| HTAa | 11 (33,30%) | 70 (45,80%) | 182 (71,10%) | < 0,001 |
| cHDL bajoa | 8 (24,20%) | 69 (44,80%) | 141 (54,90%) | 0,002 |
| Hipertrigliceridemiaa | 2 (6,10%) | 37 (24,20%) | 96 (37,50%) | < 0,001 |
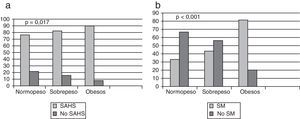
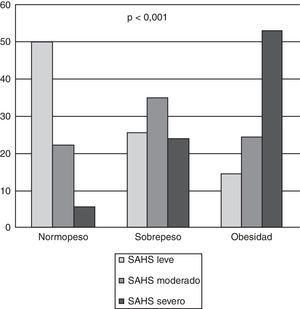
En total se diagnosticó de SAHS a 428pacientes (90,10%); en el grupo de los pacientes normopeso la frecuencia fue del 77,70%; en sobrepeso, del 84,79%, y en obesos, del 91,40% (fig. 1a). En pacientes con SAHS y normopeso la mayoría (64,28%) eran SAHS leve, con sobrepeso eran SAHS moderado (41,38%) y el 57,90% de obesos eran SAHS severo. Existen diferencias significativas (p<0,001) entre diagnóstico de SAHS e IMC categorizado (fig. 2). Cabe destacar que en el grupo de los pacientes normopeso se diagnosticó de SAHS a 28pacientes (77,70%), de los cuales 13 (46,40%) eran mujeres.
Se diagnosticó de SM a 288pacientes (64,40%): el 33,33% en normopeso, el 43,94% en sobrepeso y el 80,93% en obesos. Se encontró mayor probabilidad de presentar SM (p<0,001) a medida que aumentaba el grado de obesidad (fig. 1b).
La frecuencia de SAHS y SM simultáneamente en normopeso fue del 22%, frente al 70,52% en obesos (p<0,001). El SAHS en los pacientes normopeso estaba relacionado con el sexo (p=0,039; ser mujer reducía el riesgo) y la edad (p=0,045; los enfermos eran mayores). No se encontró relación entre SM y SAHS en normopeso (p=0,421) y tampoco se halló relación entre la malformación ORL y el SAHS en pacientes normopeso (p=0,990).
En cuanto al tratamiento, además de las medidas higiénico-dietéticas que fueron recomendadas en todos los pacientes con SAHS, en los pacientes normopeso con SAHS se trató con CPAP a 8 (22,20%) de ellos; en el grupo de los pacientes con sobrepeso se trató con CPAP a 71 (41,50%), y en el grupo de los obesos, a 177 (66%).
DiscusiónLa frecuencia del SAHS en pacientes con peso normal fue significativamente menor que en aquellos con sobrepeso y obesidad, así como la frecuencia del SAHS y el SM simultáneamente. Esto concuerda con lo afirmado en la literatura, puesto que la obesidad es el principal factor de riesgo tanto para el SAHS como para el SM1.
En nuestro estudio, los pacientes normopeso que acudían a consulta eran con más frecuencia mujeres, más jóvenes, sin hábitos tóxicos y con un uso de sedantes similar al resto de grupos.
Con respecto al sexo, hay que decir que a pesar de que acudían más mujeres normopeso a la consulta, fue mayor el porcentaje de hombres normopeso diagnosticados de SAHS (15 frente a 13), aunque no existían diferencias significativas.
En nuestro trabajo se objetivó que ser mujer reducía el riesgo de padecer SAHS, datos similares a lo referido en estudios previos, donde ya se afirmaba que el sexo masculino era un factor de riesgo para SAHS en la población general. En el artículo de Martínez-Rivera et al. 8 se comunicó que las mujeres debían tener algún factor protector, puesto que en ese estudio, a pesar de tener un IMC mayor que los hombres, presentaban menor IAH. También hay otros estudios que comparten esta teoría9-11, y en alguno de ellos se proponía como factor protector el componente hormonal femenino12.
En contra de lo que se observó en otro trabajo13, en el que se encontró una prevalencia del uso de sedantes significativamente mayor en noobesos (52,9% frente a 24,7% en obesos) y una mayor edad media en los pacientes no-obesos (57,1años frente a 48,3años en obesos), en nuestro estudio los pacientes normopeso fueron más jóvenes y el uso de sedantes resultó similar al de los pacientes con sobrepeso y obesos. La menor edad al diagnóstico de SAHS y el menor uso de sedantes pueden deberse al alto grado de sospecha de SAHS, por la importante concienciación que tienen nuestros compañeros de atención primaria de esta patología, que hace que sean remitidos antes para su valoración12. De hecho, la consulta de procedencia más frecuente fue atención primaria y en segundo lugar neumología, tanto en pacientes normopeso como los de los otros 2 grupos.
Los pacientes normopeso, al igual que los pacientes con sobrepeso, eran con más frecuencia activos, mientras que los obesos solían ser pensionistas. El síntoma más frecuente de consulta en los 3 grupos fue el ronquido, después la excesiva somnolencia diurna y luego las paradas respiratorias.
Se diagnosticó de SAHS al 90% de los pacientes remitidos a consulta. La mayoría de los pacientes con normopeso presentaban un SAHS leve, en el grupo con sobrepeso la mayoría fueron diagnosticados de SAHS moderado y en el grupo de obesos la mayoría eran SAHS severo, existiendo diferencias significativas entre el diagnóstico de SAHS y el IMC categorizado. Esto implica que a medida que aumenta el grado de obesidad medido por el IMC categorizado también aumenta la gravedad del SAHS, siendo este más severo en los enfermos más obesos, tal como se observa al comparar los parámetros de las pruebas de sueño (IAH, CT90, número de desaturaciones por hora, saturación media de la oxihemoglobina), en los que se han hallado diferencias estadísticamente significativas entre los pacientes normopeso y los otros 2 grupos. Sin embargo, en el trabajo de Namyslowski et al.14, que se realizó comparando parámetros de estudios de sueño entre pacientes con sobrepeso y obesos, se encontró relación significativa entre el aumento del IMC y los parámetros del sueño solo en obesos, pero no en los pacientes con sobrepeso.
En la literatura persiste controversia acerca de si es el IMC15 o el perímetro abdominal8,16,17 el mejor factor predictor de SAHS. En un trabajo previo de nuestro grupo18 se encontró relación significativa con el perímetro de cintura pero no con el IMC. Con respecto al grupo de pacientes normopeso, solo se ha objetivado asociación con el sexo y la edad.
Una condición obligatoria para el diagnóstico de SM, de acuerdo a los criterios de la IDF en la población europea, es la presencia de obesidad central objetivada por un perímetro abdominal ≥94cm en hombres y ≥80cm en mujeres. En nuestro trabajo esto solo lo cumplían 11 de los 36pacientes con IMC normal; estos pacientes presentaban obesidad troncular (perímetro de cintura aumentado) pero no obesidad generalizada (IMC≤25kg/m2), y es en estos en los que se diagnosticó el SM (11/36).
En el grupo de los pacientes normopeso en ningún caso se cumplieron los 4 posibles criterios de SM; la mayoría cumplían uno o ninguno, siendo los más frecuentes la diabetes mellitus, seguido de la HTA. Sin embargo, se observó que, en la muestra total, a medida que aumentaba el grado de obesidad aumentaban el número de criterios; así, en el grupo de los sobrepeso se cumplían uno o dos y en el grupo de los obesos dos o tres, siendo el criterio más frecuente en ambos grupos la HTA y el segundo la diabetes mellitus. El menos frecuente de todos los criterios fue la hipertrigliceridemia.
En la población general sabemos que existe una mayor probabilidad de presentar SM a medida que aumenta el IMC, algo que se observó en nuestro estudio.
Por otra parte, la relación entre SM y SAHS en la población general está evidenciada en la literatura, pero en nuestros pacientes normopeso no hemos encontrado dicha relación. En el trabajo de Kono et al.19 realizado en pacientes no obesos (IMC<30kg/m2, que incluía sujetos normopeso y con sobrepeso) con SAHS y sin SAHS se sugirió que incluso los no obesos con SAHS eran propensos a desarrollar SM. También en el estudio de Lin et al.20 se demostró que el SAHS estaba asociado de manera independiente a dislipidemia, HTA y al menos 2 criterios de SM en no obesos (IMC<25kg/m2).
Cabe destacar que nuestro trabajo no puede ser comparado con estos estudios, puesto que el trabajo de Kono et al.19 se diferencia del nuestro en que nosotros sí hemos realizado una distinción entre los pacientes no obesos, separándolos en pacientes normopeso y en pacientes con sobrepeso, y también se incluyeron mujeres. Con respecto al trabajo de Lin et al.20, en este caso nuestros pacientes normopeso sí se asemejan a los suyos (IMC<25kg/m2) y también incluyeron mujeres, sin embargo sus pacientes normopeso presentaban un perímetro de cintura también compatible con la delgadez, excluyendo los que presentaban un perímetro de cintura >90cm en hombres y >80cm en mujeres. En nuestro caso el perímetro de cintura en 11pacientes no era compatible con delgadez, y estos pacientes fueron los que presentaban SM, lo que puede estar influyendo en el resultado.
En la patogenia del SAHS también se han visto implicadas alteraciones a nivel del área ORL, como obstrucción nasal, hipertrofia amigdalar o de úvula y paladar blando, entre otras; en nuestros pacientes normopeso la más frecuente fue hipertrofia del paladar, generalmente en grado leve-moderado que no precisó ningún tipo de intervención. En nuestro estudio no se encontró relación entre la malformación ORL y el SAHS en pacientes normopeso, puesto que de los 36pacientes con peso normal, solo 11 tenían algún tipo de malformación, y de estos solamente eran 9 (81%) los que presentaban SAHS y 18 (75%) no presentaban malformación pero sí SAHS (p=0,990).
Nuestro trabajo tiene varias limitaciones. En primer lugar puede estar sesgado debido a que nuestros pacientes son pacientes muy seleccionados, derivados a una unidad específica de estudio de los trastornos del sueño por sospecha de SAHS. Además se trata de un estudio retrospectivo, con las implicaciones que ello conlleva. En tercer lugar, el número de pacientes normopeso es muy pequeño, algo que aunque es de esperar dada la implicación de la obesidad tanto en el SAHS como en el SM, puede limitar el estudio. Y en cuarto lugar, en nuestro estudio no se registró la presencia o no de menopausia, que influye en la prevalencia de SAHS en mujeres.
FinanciaciónEste trabajo se ha realizado sin ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.