Introducción
Desde el descubrimiento de los antibióticos en los años treinta y hasta los años ochenta era generalizada la creencia de que dichos fármacos eran capaces de curar casi la totalidad de las infecciones bacterianas. Desde entonces, la aparición y el incremento de resistencias a los antimicrobianos y la constatación de la emergencia de microorganismos multirresistentes están generando entre los médicos una preocupación creciente, que empieza a trascender a la sociedad. Si a ello añadimos una pobre perspectiva, poco conocida incluso entre los médicos, en cuanto al desarrollo de nuevos fármacos antibióticos a corto-medio plazo, empezaremos a situarnos en la verdadera magnitud del problema.
Los microorganismos siguen generando resistencias
Algunos ejemplos pueden servir. A principios de los años noventa había en los hospitales en torno a un 5% de cepas de Staphylococcus aureus resistentes a meticilina (MRSA), por lo que el tratamiento de las infecciones estafilocócicas podía acometerse con éxito con meticilina o sus derivados, o con cefalosporinas de primera y segunda generación. En el momento actual, en los hospitales de EE.UU. el 50-60% de las cepas de S. aureus que colonizan o infectan a los pacientes son resistentes a meticilina y, en consecuencia, también a oxacilina, cloxacilina, amoxicilina-ácido clavulánico y fluoroquinolonas1. Por si fuera poco, se han objetivado ya algunos casos de infecciones resistentes a vancomicina, fármaco de elección para el MRSA2. En España, aunque hay variaciones importantes entre regiones, se ha observado en los últimos 11 años un incremento de los aislamientos nosocomiales (del 22 al 41%) y de la comunidad (del 7 al 28%) de MRSA3. Aunque es un problema de primera magnitud en los hospitales, en los últimos años ya se han descrito infecciones respiratorias y cutáneas graves en la comunidad por este germen en jóvenes previamente sanos y sin contacto con hospitales ni con instituciones cerradas4, hecho que ha alarmado a los epidemiólogos5.
Las infecciones por bacterias gramnegativas productoras de betalactamasas de espectro extendido, en especial Klebsiella pneumoniae y Escherichia coli, resistentes a cefalosporinas y a otros betalactámicos se producen cada vez con mayor frecuencia en hospitales y también en instituciones cerradas, tanto de forma aislada como epidémica6. Pueden afectar al aparato respiratorio, además de la cavidad abdominal, tejidos blandos, piel y aparato urinario, y se asocian a elevada mortalidad. Se han identificado algunos factores de riesgo, como la edad avanzada, la diabetes y otras comorbilidades, estancias en hospital o en instituciones cerradas, así como uso previo de antibióticos, en especial cefalosporinas de segunda y tercera generación, y fluoroquinolonas7,8. Aunque por el momento estas infecciones están confinadas en instituciones cerradas, donde deben extremarse las medidas de control, basadas en métodos barrera y en el uso juicioso de los antibióticos, es muy probable que en el futuro se difundan cada vez con más frecuencia a pacientes ambulatorios8,9.
El preocupante aumento de las resistencias en bacterias anaerobias, en especial del grupo de Bacteroides fragilis, tiene su principal impacto en el manejo de las infecciones abdominales y pelvianas, pero la emergencia de cepas resistentes de microorganismos anaerobios considerados altamente sensibles a los antibióticos, como Peptostreptococcus spp., sí puede tener una repercusión en los problemas infecciosos respiratorios, incluidos los adquiridos en la comunidad10.
Mayor importancia para las infecciones respiratorias, y en especial en la enfermedad pulmonar obstructiva crónica (EPOC), tiene la situación de Haemophilus influenzae. Es bien conocido desde hace mucho tiempo el desarrollo de resistencias a amoxicilina por producción de betalactamasas, más del 25% de las cepas aisladas en esputo en nuestro país. Menos conocido es que cerca del 5% de H. influenzae que no producen betalactamasas son resistentes a amoxicilina11, siendo afortunadamente mucho menor la prevalencia de las cepas resistentes a amoxicilina-ácido clavulánico, sean o no productoras de betalactamasas. La elevada incidencia de resistencia de H. influenzae a amoxicilina-ácido clavulánico y a cefalosporinas de primera y segunda generación por mutaciones en las proteínas diana (penicillin binding proteins o PBP), recientemente publicada en Japón, que se ha incrementado en los últimos años y que supera el 40%12, es un hecho que produce dudas respecto a si puede ser un problema emergente en el resto del mundo. En España, amoxicilina-ácido clavulánico, y en especial su presentación de liberación mantenida (2.000/125 mg), conserva su eficacia frente a prácticamente la totalidad de las cepas de H. influenzae, lo mismo que el ciprofloxacino, levofloxacino y moxifloxacino, y la nueva cefalosporina de tercera generación oral cefditoreno. Cefuroxima, a pesar de sus buenos valores de sensibilidad in vitro, tiene unos parámetros farmacodinámicos claramente inferiores, lo mismo que los únicos macrólidos con actividad in vitro frente a H. influenzae, claritromicina y acitromicina, cuyas tasas de sensibilidad farmacodinámica están en torno al 60-65%11,13. La sensibilidad in vitro de Moraxella catarrhalis, el tercer germen tras neumococo y H. influenzae en las exacerbaciones de la EPOC, es baja para amoxicilina por su amplia producción de betalactamasas. Sin embargo, como ocurre con H. influenzae, mantiene una sensibilidad in vitro de prácticamente el 100% para amoxicilina-ácido clavulánico, cefuroxima, ciprofloxacino, moxifloxacino y levofloxacino y, cefditoreno11,14-16.
El neumococo, permanente caballo de batalla
Desde los primeros años de la década de los noventa existe una conciencia generalizada de la pérdida de actividad de los betalactámicos para inhibir en el laboratorio el crecimiento de un importante porcentaje de cepas de Streptococcus pneumoniae por disminución de grado variable de la afinidad de las proteínas diana PBP de estos antibióticos en las bacterias. Ello, junto con la irrupción de Legionella pneumophila como productora de neumonías adquiridas den la comunidad (NAC) potencialmente letales, llevó a recomendar el uso de macrólidos como primera elección en el tratamiento de la NAC y también de otros tipos de infecciones respiratorias. El uso masivo de macrólidos, en especial los de vida larga, con administración una o 2 veces al día17, ha provocado en todo el mundo la rápida emergencia de neumococos resistentes a estos antibióticos, lo que además se traduce en un impacto mucho mayor en el manejo clínico de las infecciones respiratorias que la resis-tencia in vitro a los betalactámicos. En efecto, en la literatura médica son abundantes las evidencias de que un betalactámico con buena actividad frente a neumococo (p. ej., amoxicilina, cefotaxima/ceftriaxona), si se emplea en la práctica clínica a dosis adecuadas, será capaz de controlar una infección neumocócica no meníngea en la inmensa mayoría de los casos, aunque el germen se haya mostrado resistente en el laboratorio18-22. Las nuevas formulaciones de liberación mantenida de amoxicilina han incrementado su actividad, debido a su favorable comportamiento farmacodinámico23-25.
Esto no es extrapolable a otros betalactámicos. Están comercializados y tienen una amplia utilización muchos con menor actividad frente a neumococo, en especial casi todas las cefalosporinas orales (cefaclor, cefixima, ceftibuteno, cefpodoxima, cefuroxima, entre otras), que en consecuencia no deberían emplearse ante una posible infección neumocócica. Además, como parece lógico en antibióticos de baja potencia frente a neumococo, la emergencia de resistencias de alto nivel a betalactámicos se ha relacionado con el uso en la comunidad de las cefalosporinas orales de primera y segunda generación, más que con el resto de penicilinas y cefalosporinas17.
La resistencia in vitro a los macrólidos, que sobrepasa ampliamente el 30% (y el 50% en niños) en España, sí tiene en cambio importantes connotaciones prácticas. Se debe a que se trata, en la gran mayoría de los casos en nuestro medio, de mutaciones en las dianas ribosómicas bacterianas que precisarían cantidades inalcanzables de macrólidos para mantener su eficacia. Esto se ha puesto de manifiesto, al contrario de lo que ocurre con los betalactámicos eficaces frente a S. pneumoniae, con la publicación de fracasos clínicos con su uso21,26-30, lo que ha llevado a desaconsejarlos como monoterapia en una posible infección neumocócica, en especial en la NAC31. Al contrario también de lo que sucedía con los betalactámicos, la resistencia del neumococo a un macrólido es cruzada con el resto y también con clindamicina. La aparición de telitromicina, cetólido derivado de eritromicina que recuperaba la eficacia de los macrólidos sobre los neumococos resistentes a los mismos32,33, despertó gran interés y fue incluido en las normativas como primera elección en la NAC que no ingresa31. Sin embargo, la notificación de casos de toxicidad hepática grave y también de empeoramiento de miastenia gravis y de aparición de trastornos visuales y del nivel de conciencia han llevado a las principales agencias de medicamentos, EMEA europea y FDA americana, respectivamente, a restringir y retirar su aprobación para las indicaciones de sinusitis, bronquitis y exacerbación de la EPOC34-35. Estas decisiones, tomadas el presente año 2007, hacen más que incierto el futuro de este otrora prometedor antibiótico36,37.
Las llamadas fluoroquinolonas (FQ) respiratorias (levofloxacino y moxifloxacino) tienen una buena actividad in vitro frente a S. pneumoniae y prácticamente la totalidad de los patógenos respiratorios bacterianos más importantes. Sin embargo, en los últimos años se ha puesto de manifiesto un incremento de las cepas de neumococo con pérdida de susceptibilidad a las FQ, relacionado con su sobreutilización y variable de unos países a otros. En Europa los neumococos con pérdida de susceptibilidad a FQ, en términos de resistencia in vitro a ciprofloxacino, marcador de susceptibilidad a FQ, varían desde el 0,0% de Holanda, donde existe una excelente política antibiótica, hasta Italia, con un 7,1%, y Portugal, país de la Unión Europea que más FQ prescribe ambulatoriamente38, con un 10%39. En España se han publicado cifras muy variables, desde un 3,2%39 hasta un 9% de pérdida de sensibilidad a levofloxacino en algunas zonas de nuestro país40. Aunque hay algunos datos contradictorios en la literatura médica sobre la emergencia de resistencias de neumococos a FQ41, es de destacar que recientemente se ha publicado en Italia una serie en la que el 15,1% de los aislamientos clínicos había perdido susceptibilidad a ciprofloxacino y un 5,6% a levofloxacino. Lo más preocupante es que 3 años antes (2001) la tasa de resistencias a levofloxacino en esas mismas áreas italianas era inexistente42. Otro aspecto interesante es que, al contrario que los neumococos con resistencia a betalactámicos y a macrólidos, que tienen su principal reservorio en la nasofaringe de los niños colonizados, los resistentes a FQ asientan en especial en pacientes ancianos, con hospitalización reciente, tratados previamente con FQ y (lo que resulta interesante) con EPOC43-46, y parece asociarse a resistencia a macrólidos46.
Otro aspecto que debe tenerse en cuenta es la publicación de algunos fracasos terapéuticos con levofloxacino en neumonías por neumococos resistentes, algunos de los cuales adquirieron su resistencia durante el tratamiento47. Esto se debe a que el principal mecanismo de resistencia (mutaciones en las enzimas topoisomerasas diana, que conforman la estructura helicoidal del ADN de la bacteria) se produce en 2 tiempos: tras una primera mutación, que disminuirá la susceptibilidad del antibiótico pero mantendrá su actividad, durante o después de un segundo tratamiento se producirá, de manera relativamente fácil, la mutación de la segunda diana, que producirá a su vez resistencia completa, con implicaciones clínicas en forma de fracasos terapéuticos45,47-50, aunque probablemente ya superan el 20%36. No se conoce con precisión la prevalencia de cepas que se muestran sensibles in vitro aunque ya hayan sufrido la primera mutación, pues los datos al respecto son contradictorios51-54. Sin embargo, es seguro que, como en el resto de antibióticos, se relaciona directamente con su consumo y, de manera muy especial, en el medio extrahospitalario. Recientemente, se comprobó que, de todas las clases de antibióticos utilizados para la infección neumocócica, incluyendo betalactámicos, macrólidos y quinolonas, fueron precisamente éstas las que tuvieron un mayor impacto en la generación de resistencias dentro de los 3 primeros meses tras su utilización36. El ciprofloxacino tiene una actividad escasa frente a S. pneumoniae y, en consecuencia, será más seleccionador de resistencias, motivos ambos por los que no debe emplearse en infecciones presuntamente neumocócicas55. El moxifloxacino, por el contrario, muestra la mayor potencia intrínseca frente a neumococo, por lo que el riesgo de generar resistencias a FQ es menor56. Las FQ respiratorias son unos antimicrobianos excepcionales, y precisamente por este motivo, entre otros, tenemos la obligación de preservarlas mediante un uso responsable, y en especial en el medio extrahospitalario. En este sentido, los Centers for Disease Control han recomendado restringirlas a situaciones concretas, como alergia o fracaso terapéutico con betalactámicos o infección por neumococo resistente demostrada o sospechada57.
Con el fin de intentar minimizar la posibilidad de fracaso terapéutico por resistencia adquirida por un reciente tratamiento, algunos autores abogan por una rotación antibiótica específica para cada paciente36.
Existen pocos antibióticos nuevos en perspectiva: no tenemos apenas banquillo
El desarrollo de nuevos antibióticos comporta un esfuerzo económico considerable, que no siempre llega a buen puerto. Se tardan aproximadamente unos 10 años en establecer la eficacia y seguridad de nuevos compuestos. Por otra parte, es más interesante para las grandes multinacionales farmacéuticas investigar en medicamentos dirigidos a enfermedades muy prevalentes (hipertensión, dislipemia, etc.) que condicionen tratamientos muy prolongados, en ocasiones de por vida, en lugar de tratamientos cortos e intermitentes, como ocurre con los antibióticos. Por ello las grandes compañías han dejado en gran medida de investigar e invertir en nuevos antibióticos que superen a los actuales. Algunos datos al respecto son muy reveladores5: entre 1983 y 2002 la cifra de antimicrobianos aprobados disminuyó más de un 50% respecto a los años previos, y en 2004, de los 118 fármacos aprobados por la Food and Drug Administration norteamericana, sólo 10 eran antibióticos. La mayoría de los antimicrobianos nuevos se dirigen a los grampositivos resistentes, en especial al MRSA (linezolid, daptomicina), mientras que otros se adaptan más a infecciones respiratorias de la comunidad tratadas ambulatoriamente (telitromicina, cefditoreno) o en el medio hospitalario (ertapenem). En contraste con estos datos, se están aprobando entre 3 y 7 veces más fármacos para procesos inflamatorios, neoplásicos o endocrinológicos. Otro dato revelador es que en los próximos 5-10 años no se espera que aparezcan nuevos antibióticos activos frente a Pseudomonas aeruginosa, germen con el que hemos de enfrentarnos cada vez más debido, entre otras razones, al aumento de la supervivencia de pacientes con enfermedad pulmonar obtructiva crónica (EPOC) y bronquiectasias graves.
Una excepción es tigeciclina, nuevo antimicrobiano de la familia de las tetraciclinas, que ha sido aprobado por la European Medicines Agency en 2006 para uso hospitalario por el momento para infecciones abdominales y de piel y tejidos blandos. Tiene un espectro amplio frente a grampositivos (incluidos MRSA y enterococos), gramnegativos (entre ellos, bacilos entéricos productores de betalactamasa de espectro extendido) y anaerobios, aunque no es eficaz frente a P. aeruginosa ni a muchas cepas de Proteus spp.58. De los antimicrobianos en fases avanzadas de investigación, podemos destacar otro antibiótico de uso hospitalario, el doripenem, carbapenem muy parecido al meropenem59, y 3 glucopéptidos: dalbavancina, oritavancina y telavancina, dirigidos básicamente, como la vancomicina, a grampositivos resistentes, como MRSA, y en menor medida S. pneumoniae multirresistente59-62. Entre las FQ, hay 2 en investigación avanzada: el sitafloxacino, que, como otros, no se comercializará en nuestro medio por fototoxicidad en raza caucásica, y el garenoxacino, más prometedor59. Cierto es que en algunos países, como Japón, se usan algunos antibióticos, en especial betalactámicos del grupo de los carbapenems, como faropenem, panipenem y biopenem, que muestran una buena actividad in vitro frente a neumococo, incluso en cepas con alta resistencia a la penici-lina, y es posible que puedan comercializarse en el futuro en Europa y EE.UU., de la misma manera que recientemente ocurrió con la cefalosporina oral cefditoreno, disponible en Japón desde hace prácticamente una década.
Dados el incremento de las resistencias a los antimicrobianos, por un lado, y la previsible precariedad en el desarrollo de nuevos fármacos, por otro, es necesaria una revisión pormenorizada de los antibióticos actualmente disponibles para conseguir los mejores resultados con ellos. De hecho ya estamos asistiendo, con excepción de las FQ, a una disminución de la utilización global de dichos fármacos; además, están apareciendo fórmulas de alta dosificación, con parámetros farmacodinámicos más favorables, y por último, cada vez se identifican mejor los antibióticos más activos, que permiten una erradicación más rápida y minimizan la selección de cepas resistentes, con la correspondiente reducción progresiva del uso de los antibióticos más seleccionadores de resistencias, como los macrólidos y las cefalosporinas de primera y segunda generación. Además, afortunadamente, se va imponiendo la tendencia a tratar las infecciones del aparato respiratorio inferior de manera más enérgica y con tandas cortas de antibióticos. La duración óptima de la terapia antibiótica para la NAC, la NN o la exacerbación de la EPOC no se conoce aún, pero existe cada vez más información respecto a que se producen resultados igualmente buenos con menos días de antibióticos que los tradicionalmente empleados, usando fármacos y dosis adecuadas. En este sentido, la medición seriada de procalcitonina (PCT), marcador sérico de infección, se ha mostrado recientemente eficaz, no sólo para indicar la necesidad de utilizar antibióticos, sino como una guía para la duración del tratamiento en la NAC63.
En consecuencia, se trata de aprovechar al máximo lo que tenemos, revisando en profundidad los fármacos disponibles con el fin de utilizar los más activos de cada grupo, conseguir los mejores resultados con ellos e inducir el menor número de resistencias a los antimicrobianos. Todo ello pasa, indefectiblemente, por el estudio de la farmacocinética y de la farmacodinamia de cada uno de ellos.
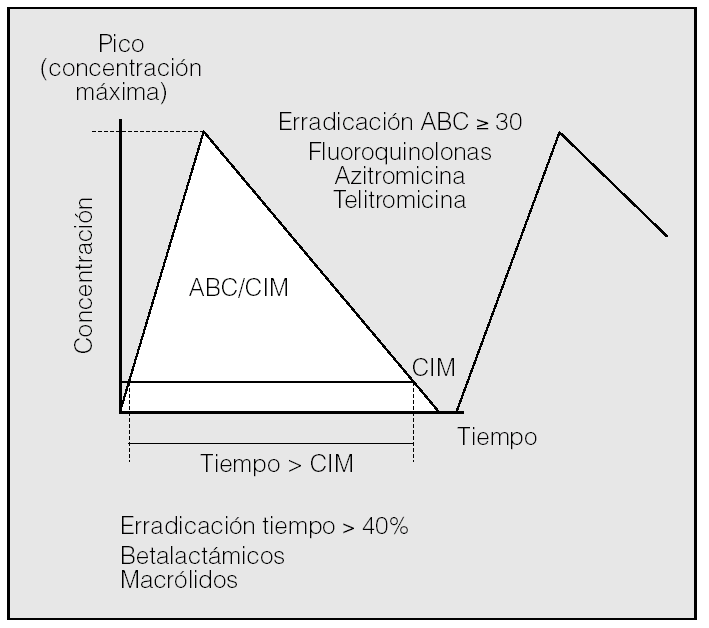
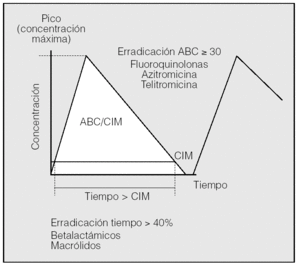
Erradicación bacteriana. Importancia de la farmacocinética y de la farmacodinamia (fig. 1)
Fig. 1. Los parámetros farmacodinámicos predicen la erradicación bacteriana. La presencia de concentraciones bajas de antibiótico induce, además, la aparición de resistencias. ABC: área bajo la curva concentración-tiempo; CIM: concentración inhibitoria mínima.
Todos entendemos que la curación de determinadas infecciones como la endocarditis, la meningitis o la osteomielitis pasa necesariamente por la erradicación de la bacteria causal. Sin embargo, para las infecciones respiratorias el concepto de erradicación se ha considerado tradicionalmente un objetivo secundario respecto al principal: la eficacia clínica. Esto se debe a múltiples factores, entre ellos la alta tasa de curaciones espontáneas en determinadas infecciones respiratorias de la comunidad, lo que lleva a distinguir mal entre un antibiótico muy eficaz y otro poco efectivo, y también en ocasiones a la pobre correlación lineal entre tasas de erradicación y curación clínica, debido en parte a la incidencia de infecciones víricas. Estas circunstancias hacen que, si medimos la eficacia de un antibiótico en función de la mejoría de los síntomas, algunos fármacos muy eficaces parecen serlo menos, y otros con actividad pobre simulan ser mejores de lo que en realidad son64. En los pacientes con EPOC la situación se complica aún más, puesto que algunos están colonizados con bacterias potencialmente patógenas, lo que hace con frecuencia imposible diferenciar entre colonización e infección y también, por otro lado, alcanzar la erradicación bacteriana. Sin embargo, a pesar de estas dificultades, y como parecía lógico, cada vez son más las evidencias de que la erradicación bacteriana tiene un papel muy importante en la respuesta clínica favorable, en una resolución más rápida de los síntomas, en la disminución de las recaídas y en la menor selección de resistencias64-67. En este sentido, es importante tener siempre presente que el fracaso en la erradicación bacteriana contribuye a agravar la selección de cepas resistentes, ya que tanto en el foco de la infección como en la nasofaringe de los portadores los clones resistentes no destruidos recolonizarán las mucosas una vez finalizado el tratamiento antibiótico, con lo que se incrementará el número de poblaciones resistentes en el individuo, que a su vez puede transmitir estos clones no susceptibles al antibiótico al resto de la población64,66. En consecuencia, una erradicación bacteriana lo más cercana al 100% tendrá como valor añadido a la eficacia clínica el evitar al máximo el riesgo de adquisición de resistencias in vivo durante el tratamiento. Los parámetros farmacodinámicos predicen la erradicación bacteriana y son diferentes de unos antibióticos a otros.
Los llamados parámetros farmacodinámicos y farmacocinéticos de los antibióticos permiten, en efecto, predecir sus efectos antibacterianos y, en consecuencia, sus resultados clínicos, los regímenes de dosis apropiadas y la probabilidad de aparición de resistencias40. Tradicionalmente se ha medido la potencia in vitro de un antibiótico frente a una bacteria mediante su concentración inhibitoria mínima (CIM): el CIM 90, o concentración necesaria para inhibir el crecimiento bacteriano del 90% de las bacterias. De esta manera, a menor CIM se conseguirá una mayor actividad antimicrobiana. Aunque sin duda se trata de un dato muy importante, aún lo es más predecir lo más fielmente posible qué sucederá en el individuo y en su foco de infección por esa bacteria cuando se le administre una determinada dosis de ese antibiótico. La farmacocinética se refiere a los factores (absorción, distribución, metabolismo y eliminación) que, unidos al régimen posológico, determinan la concentración que alcanza el fármaco en el suero y en los tejidos a lo largo del tiempo. La farmacodinamia aborda la relación entre la concentración del antibiótico en el organismo y su actividad antibacteriana para un microorganismo determinado, teniendo en cuenta la CIM del antibiótico para éste16,64.
Los antibióticos, en función de la actividad y duración de su efecto, se dividen, como es sabido, en 2 grandes grupos. Los dependientes del tiempo, entre los que figuran betalactámicos y macrólidos, son más eficaces cuanto más tiempo mantengan concentraciones superiores, aunque sólo sean ligeramente, a la CIM. Se considera que un betalactámico o un macrólido tienen una eficacia garantizada si al menos en el 40-60% del intervalo entre dosis la concentración del antibiótico libre (no unido a proteínas) en el foco de infección es de 4 o más veces superior a la CIM13,55,68, aunque es recomendable superar estos valores en el paciente crítico. A efectos prácticos, esto hace aconsejable, siempre que sea posible, administrar los fármacos en perfusión continua, o al menos administrar cada dosis en perfusión lenta (2-3 h), ajustar los intervalos entre dosis y utilizar preferentemente los betalactámicos con vida media larga68. Un ejemplo de ello son las ventajas farmacodinámicas de la presentación oral de liberación sostenida de amoxicilina-ácido clavulánico (2.000-125 mg), que la hace más eficaz que las presentaciones convencionales16,64. Este tiempo en el que la concentración del antibiótico supera a la CIM es especialmente importante en antibióticos que, como los betalactámicos, carecen de efecto postantibiótico, entendido éste como la actividad antimicrobiana que persiste sobre las bacterias tras la desaparición del fármaco del foco de infección.
Alternativamente a la dependencia del tiempo, otros antibióticos tienen una actividad que depende de su concentración, por lo que en líneas generales una mayor dosis implicará una mayor actividad. Algunos de ellos, como los aminoglucósidos, dependen fundamentalmente del pico máximo de concentración, de modo que serán más eficaces cuanto más elevado sea éste respecto a la sensibilidad del germen; se considera que este pico debe ser 10-12 veces superior a la CIM. Por ello se recomienda su administración en dosis altas (5-7 mg/kg de gentamicina o tobramicina, o 15-20 mg/kg de amikacina), pero una sola vez al día, en 30-60 min y sin ser necesario prolongar el tratamiento más de 3-5 días. La dosis única en estas condiciones tiene una actividad bactericida más rápida, mayor efecto postantibiótico y menor selección de cepas resistentes, siendo especialmente importante la primera dosis, que, si consigue un pico de 10-15 veces superior a la CIM, la posibilidad de curar la infección será del 80-100%68,69.
Para otros antibióticos dependientes de la concentración, como FQ azólidos y cetólidos, el área bajo la curva concentración-tiempo (ABC) del antibiótico relacionada con la CIM del germen para ese fármaco (ABC/CIM) es el mejor predictor de la eficacia no sólo clínica, sino también erradicadora del antimicrobiano. Son por tanto antibióticos con actividad dependiente de su exposición total y, en consecuencia, tanto del pico de concentración alcanzado como del tiempo durante el que esta concentración supera a la CIM, lo que en gran medida dependerá de la vida media del fármaco. Para evitar que una FQ genere resistencias se debe conseguir una concentración del fármaco que esté al menos 8 veces por encima de la CIM y que además se mantenga así durante un tiempo suficiente (habitualmente entre 4 y 6 h) para eliminar los potenciales mutantes con CIM elevada68. Esto ha llevado a desaconsejar el uso de ciprofloxacino en las infecciones presuntamente neumocócicas55 y a preferir para ellas dosis de levofloxacino oral de 750 mg cada 24 h, presentación disponible en otros países, siendo suficiente la de 400 mg de moxifloxacino cada 24 h por tener una CIM inferior para S. pneumoniae y una vida media más prolongada68. Para tratamientos orales de infecciones por P. aeruginosa podemos emplear 750 mg de ciprofloxacino o 500 mg de levofloxacino, ambos cada 12 h. Existe una nueva formulación de azitromicina de 2 g en una sola dosis para un tratamiento completo de NAC36.
La correcta aplicación práctica de los conceptos de farmacocinética y farmacodinamia puede aportar numerosas ventajas, tales como la mejoría de la eficacia del tratamiento, una menor duración de éste, unas mayores posibilidades de tratamiento en régimen ambulatorio y una reducción de la incidencia de resistencias40,64.
Antibióticos inhalados y antibióticos inmunomoduladores en la infección respiratoria
La utilización de antibióticos por vías de administración diferentes de las habituales ha sido una práctica documentada en pacientes con fibrosis quística70-100, sobre todo en infecciones por P. aeruginosa. Los beneficios demostrados en estos estudios indican que los pacientes tratados con antibióticos inhalados presentan una mejoría significativa de los parámetros clínicos y funcionales, además de conseguirse una disminución significativa de la carga bacteriana en esputo y, en algunos pacientes, una erradicación del germen tratado. Esta práctica consigue también disminuir tanto los ingresos hospitalarios como el número de estancias y mejorar la calidad de vida. Dados los buenos resultados en esta enfermedad, la utilización de antibióticos inhalados se está extendiendo de forma progresiva a otras formas de bronquiectasias distintas de la fibrosis quística para el tratamiento de la infección crónica por P. aeruginosa101-105.
Dada la aparición de evidencias que parecen avalar unos buenos resultados utilizando esta vía de administración, y teniendo en cuenta que se alcanzan concentraciones de antibiótico en esputo muy elevadas106 (25 veces la CIM, con una concentración media suero/esputo de 0,01), que la absorción sistémica escasa y que los efectos adversos importantes son infrecuentes70, parece razonable pensar que esta vía de administración pueda abrir nuevas posibilidades terapéuticas futuras en el tratamiento de las infecciones crónicas respiratorias. Sethi et al107, en un trabajo muy reciente en el que se comparó a pacientes con EPOC estable y exfumadores con exfumadores sin EPOC y con sujetos sanos no fumadores, han puesto de manifiesto que la colonización, incluso en pacientes con EPOC no fumadores activos, es una importante vía de generación de inflamación, y afirman que puede contribuir a la progresión de la enfermedad. Un aspecto muy importante de este estudio es el uso del lavado brocoalveolar en vez del esputo, lo que permite en consecuencia valorar una zona fundamental en los pacientes con EPOC: la vía aérea fina. La importancia de la colonización en la EPOC y otras enfermedades respiratorias debería generar la necesidad de nuevos esfuerzos terapéuticos. Es evidente que conseguir vacunas eficaces podría ser un arma fundamental en este aspecto, pero no es menos cierto que sería muy interesante disponer de grandes estudios que evaluaran la utilidad del tratamiento con antibióticos inhalados.
Otro aspecto que ha de considerarse es el posible uso de macrólidos de 14-15 átomos (eritromicina, roxitromicina, claritromicina, acitromicina) en el tratamiento de enfermedades crónicas respiratorias. Varios estudios83,108-126 han mostrado una variedad de acciones beneficiosas de estos fármacos en dichas enfermedades, tales como efectos antiinflamatorios por acción sobre mediadores de la inflamación (neutrófilos, citocinas, óxido nítrico), reducción de la hiperreactividad bronquial, mejoría de las propiedades reológicas del moco y, recientemente, disminución de la hiperproducción de moco por una menor síntesis de mucina127. También se han descrito otros efectos interesantes, como la inhibición de la motilidad, de los factores de virulencia y de la formación de biopelícula por parte de P. aeruginosa128,129. Cepas mucoides de P. aeruginosa forman una biopelícula alrededor de la bacteria y se adhieren a la mucosa de las vías aéreas; de este modo se incrementa la resistencia a la actividad fagocítica del huésped, aumenta la viscosidad del esputo y se dificulta la penetración del antibiótico, lo que facilita la persistencia del germen en las vías aéreas, es decir, la colonización. A este respecto se ha descrito130 una proteína reguladora del paso de cepas de P. aeruginosa sensibles hacia cepas resistentes a los antibióticos, formadoras de biopelícula. La actuación sobre componentes de esta proteína puede ser importante en tratamientos futuros. Recientemente se ha demostrado in vivo (y también in vitro) por primera vez, en lavado broncoalveolar de pacientes con fibrosis quística, la presencia de H. influenzae no tipificable y formador de biopelícula en las vías aéreas inferiores131.
Interesantes observaciones muestran que la inducción de la expresión de interleucina-8 por las células epiteliales de las vías aéreas por la interacción de H. influenzae, tanto en fase de exacerbación como de colonización, se inhibe tras la exposición a eritromicina o azitromicina132. También es conocido que los macrólidos de 14 y 15 carbonos pueden facilitar la penetración de la biopelícula bacteriana por ciprofloxacino, eliminando la bacteria dentro de aquélla133. Estos macrólidos se han mostrado útiles clínicamente en enfermedades como la panbronquiolitis difusa123,134, la fibrosis quística108,110,111,114-117,135,136 y las bronquiectasias108,1119,137-145.
Conclusiones
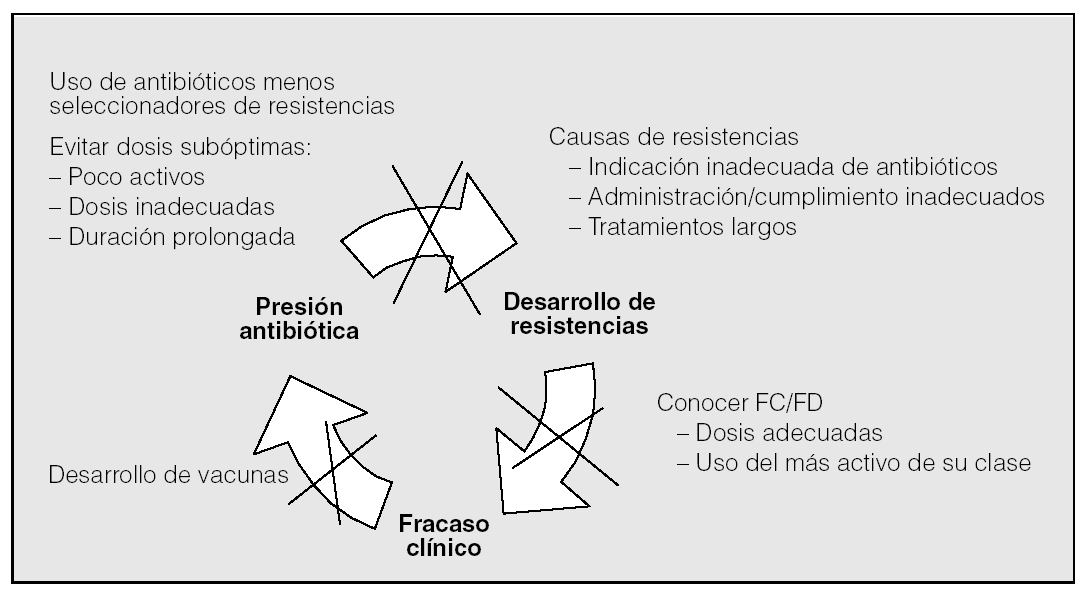
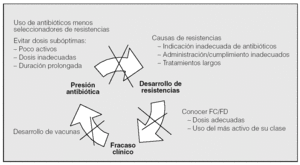
Podemos concluir que en el momento actual el incremento de las resistencias bacterianas a los antibióticos supera claramente a las perspectivas de desarrollo a corto-medio plazo de nuevos antimicrobianos. Debemos enfrentarnos a las infecciones respiratorias sobre la base de planteamientos clínicos y guías rigurosas146,147, lo que con alguna frecuencia implicará una modificación en nuestras estrategias a la hora de acometer un tratamiento antiinfeccioso. Habrá que elegir siempre los fármacos no sólo efectivos, sino también los menos seleccionadores de resistencias; evitar dosis subóptimas y duraciones demasiado prolongadas; educar a la población en contra de la autoprescripción y de la cumplimentación inadecuada, así como profundizar en el conocimiento de la farmacocinética y farmacodinamia de los diferentes fármacos y en el desarrollo de vacunas efectivas frente a los patógenos respiratorios más importantes. El escenario de la batalla también está claro: la medicina ambulatoria y, en especial, la atención primaria, donde el primer motivo de consulta son las infecciones y donde se consume el 80-95% de los antibióticos, el 80% de los cuales se prescriben para infecciones respiratorias16. Allí está el origen de la inmensa mayoría de las resistencias. Tendríamos que preguntarnos si hacemos correcto uso de las normativas con el fin de conseguir antes la estabilidad de los pacientes148, y también si utilizamos y recomendamos utilizar adecuadamente las vacunas disponibles, tanto la antigripal como las antineumocócicas, cuyo uso disminuye no sólo el consumo de antibióticos, sino también las infecciones por cepas resistentes en los niños y ancianos149. Debemos comprometernos en la lucha contra el círculo vicioso que forman presión antibiótica, incremento de resistencias, fracaso clínico y mayor presión antibiótica (fig. 2). En nuestras manos está.
Fig. 2. El círculo vicioso de las resistencias a antibióticos: mecanismos para minimizarlo. FC: farmacocinética; FD: farmacodinamia.
Correspondencia: Dr. S. Bello Dronda.
Hospital Universitario Miguel Servet.
P.º Isabel la Católica, 1-3. 50009 Zaragoza. España.
Correo electrónico: sbello@meditex.es
Recibido: 4-9-2006; aceptado para su publicación: 31-10-2006.