El sarcoma sinovial primario del pulmón (SSPP) es una neoplasia rara (representa menos del 0,5% de las neoplasias pulmonares malignas y el 10% de los sarcomas pulmonares primarios). Puede originarse en el parénquima pulmonar, en el árbol traqueobronquial, en la pleura, en la pared torácica, en el mediastino o en la arteria pulmonar. En cualquier caso, no se origina en la membrana sinovial, sino en elementos mesenquimatosos inmaduros1-4.
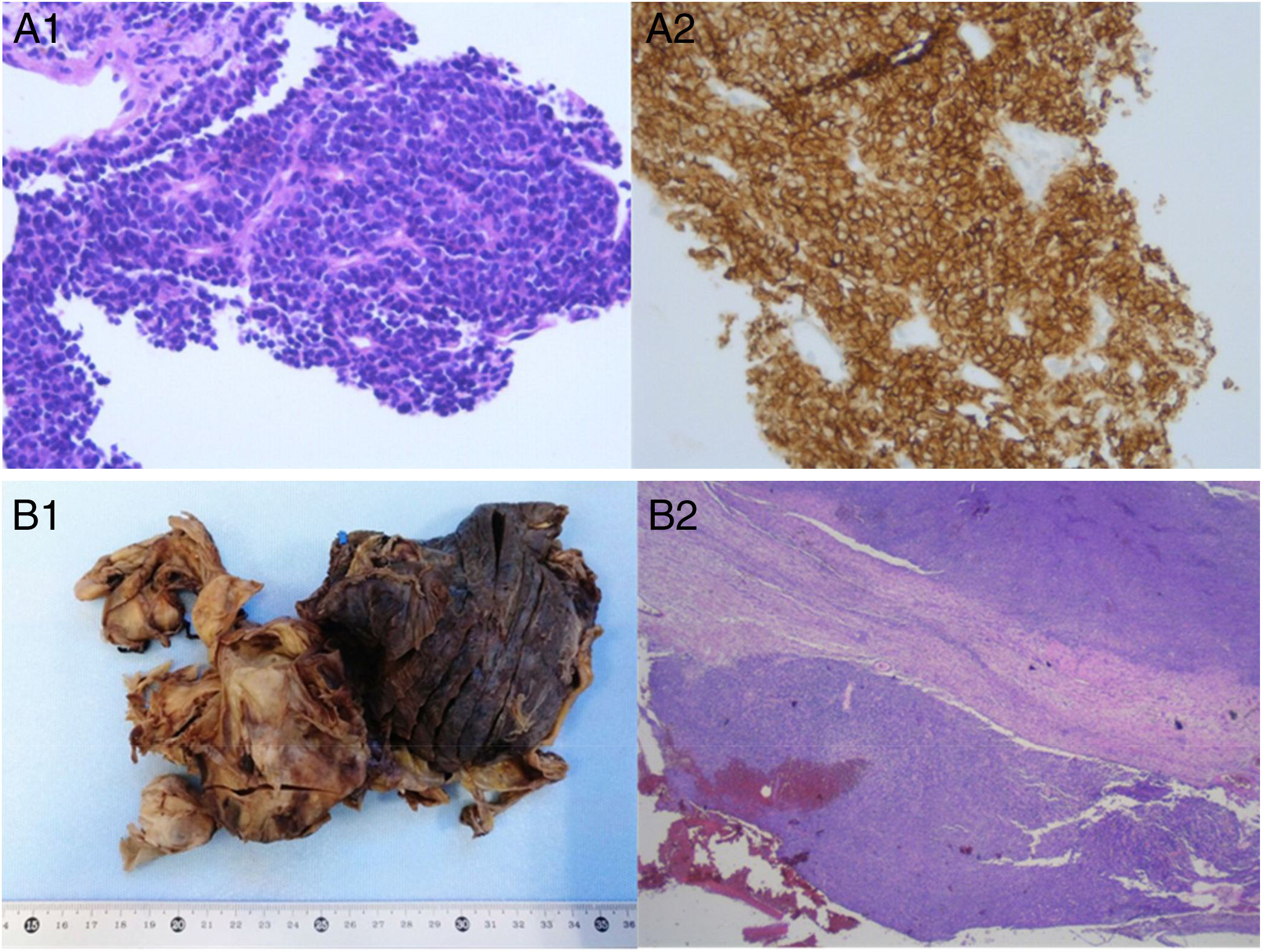
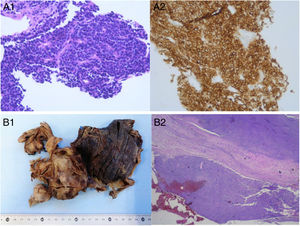
Presentamos el caso de una mujer de 67 años, fumadora, que ingresó por un cuadro de disnea progresivamente creciente hasta hacerse de reposo, acompañado de síndrome constitucional. La radiografía de tórax mostraba un extenso derrame pleural derecho. En la tomografía computarizada (TC) torácica se objetivó, además, una masa sólida multilobulada en el lóbulo inferior derecho, de 13×9×8cm, contornos parcialmente bien definidos, heterogénea y con múltiples áreas de necrosis y hemorragia, indicativa de neoplasia maligna pulmonar primaria. La toracocentesis mostró un líquido serohemático con características de exudado de predominio linfocitario y la citología fue negativa para malignidad. La biopsia con aguja gruesa de la masa pulmonar permitió obtener un diagnóstico anatomopatológico de carcinoma microcítico (inmunohistoquímica: CD56 positivo, TTF-1/STAT6 negativo, Ki67 60%) (fig. 1 A). En la tomografía de emisión de positrones-TC se confirmó que la lesión mostraba una captación patológica significativa, no evidenciándose afectación ganglionar ni a distancia. Ante estos hallazgos, se inició tratamiento con quimioterapia (QT) con carboplatino-VP16 (etopósido). Tras 2 ciclos de QT, la paciente ingresó por aumento de su disnea y dolor torácico pleurítico derecho. En las pruebas de imagen se observó una progresión local de la masa pulmonar derecha. Ante las características del cuadro (no afectación ganglionar ni metastásica a distancia, TTF-1 negativo) y la evolución atípica (progresión tumoral tras 2 ciclos de QT), se revisó, por petición clínica, el caso en el servicio de Anatomía Patológica, ampliándose el panel inmunohistoquímico realizado. Ante la sospecha de sarcoma sinovial (tinción débil para CD99 y positividad para EMA), se solicitó un estudio de citogenética molecular mediante hibridación in situ con fluorescencia (FISH) para el gen SYT. Con dicha sospecha, a la espera de los resultados, se pautó una nueva línea de QT con epirrubicina-ifosfamida, teniendo que suspender la ifosfamida por encefalopatía y toxicidad hematológica. Posteriormente, se recibió la confirmación anatomopatológica de la existencia de un reordenamiento positivo para el gen SYT, compatible con un sarcoma sinovial monofásico pulmonar, con inmunohistoquímica negativa para cromogranina/sinaptofisina/CD45/CK AE1-AE3 y positividad débil y focal para CD99. Con dicha información, se pautó QT con adriamicina-ciclofosfamida, que también provocó toxicidad hematológica tras el primer y el segundo ciclo, aunque en las pruebas de imagen se objetivó un menor componente sólido de la masa pulmonar. Dada la evolución, se decidió realizar una lobectomía inferior derecha con pleurectomía parietal. En la anatomía patológica de la muestra intraoperatoria (fig. 1 B), se confirmó que el tumor estaba limitado a la pleura y no afectaba al parénquima pulmonar, siendo la inmunohistoquímica positiva para CD56, WT1 (débil), EMA (focal) y CD99 (débil y focal), y negativa para CKAE1/AE3, CK7, CK8/18, CK19, CD34, S100, calretinina y STAT6.
A) Biopsia con aguja gruesa de la masa pulmonar: anatomía patológica microscópica de la muestra, estableciéndose un diagnóstico de carcinoma microcítico por la presencia de células de pequeño tamaño con núcleo hipercromático oval o fusiforme finamente granular, con nucléolo poco llamativo, membrana nuclear fina, citoplasma escaso y poco teñido, estroma escaso y vascular (A1), e inmunohistoquímica positiva para CD56 (A2). B) Muestra intraoperatoria (lobectomía inferior derecha y pleurectomía parietal): anatomía patológica macroscópica (B1); visión panorámica de la anatomía patológica microscópica de la muestra intraoperatoria, objetivándose un tumor limitado a la pleura sin afectación del parénquima pulmonar (B2).
El SSPP es una neoplasia muy agresiva1-3. Los pacientes pueden no tener síntomas evidentes durante las etapas iniciales. A medida que progresa la enfermedad, pueden presentar disnea, dolor torácico, tos, hemoptisis o derrame pleural ipsolateral2,3,5. La radiografía y la TC torácicas suelen mostrar una gran masa intratorácica, mayor de 5cm, con márgenes bien definidos y heterogénea1-3, que a menudo se calcifica y presenta invasión de la pleura1,3. La necrosis y la hemorragia casi siempre están presentes en su interior2. El cáncer de pulmón primario puede ser indistinguible del SSPP en la TC. Sin embargo, la ausencia de linfadenopatía significativa con un tumor circunscrito grande en un adulto joven, puede indicar la existencia de un SSPP1,4.
Desde el punto de vista histológico, el SSPP se compone esencialmente de 2tipos de células, epiteliales y fusiformes2. A nivel histopatológico, tiene un amplio espectro histológico con 3variantes: patrón monofásico con células fusiformes, que es el más frecuente; patrón bifásico, con células fusiformes y componente epitelial frecuentemente glandular, y patrón pobremente diferenciado, con un alto índice mitótico, con células sólidas ovales o en forma de huso de pequeño tamaño, de aspecto intermedio entre células epiteliales y fusiformes, con poca diferenciación, simulando el carcinoma microcítico de pulmón. Este último patrón es el que tiene un curso más agresivo y peor pronóstico2–4.
La citología puede no ser concluyente2. La inmunohistoquímica es útil para la detección del subtipo tumoral2; siendo los sarcomas sinoviales positivos para vimentina, TLE-1 y bcl-2 (casi uniformemente), CD99 (90%), EMA (55-91% de los casos), citoqueratina (70%) y S-100 (30%)2,3 y negativos para desmina, SMA y marcadores tumorales vasculares4. Las pruebas citogenéticas se pueden realizar cuando el diagnóstico no está claro3. La presencia de la translocación cromosómica específica t (X; 18) (p11.2; q11.2) mediante FISH es el sello citogenético del sarcoma sinovial. Está presente en más del 90% de los casos y produce la fusión del gen SYT en el cromosoma 18 con el gen SSX1 o SSX2, o más raramente con el gen SSX4, en el cromosoma X1,3-5.
El pronóstico del SSPP es muy pobre, con una tasa de supervivencia del 50% a los 5 años del diagnóstico2,4. Entre los factores de mal pronóstico se encuentran: tamaño mayor de 5cm, sexo masculino, edad por encima de 20 años, necrosis tumoral extensa, tasa mitótica alta (más de 10 figuras mitóticas/10 campos de alta potencia), invasión neurovascular y presencia del gen de fusión SYT-SSX12,4.
El tratamiento del SSPP requiere un abordaje integral, con cirugía, radioterapia y QT6. La resección quirúrgica radical con un margen suficientemente amplio es la intervención estándar, al igual que en otros sarcomas de tejidos blandos. La radioterapia adyuvante se recomienda generalmente después de una resección incompleta. La QT adyuvante usando doxorrubicina ± ifosfamida es beneficiosa en términos de supervivencia libre de enfermedad y general a los 5 años en los casos de sarcoma de tejidos blandos7.