Se presenta una paciente de 72 años con artritis reumatoide evolucionada que fue diagnosticada de granulomatosis pulmonar compatible con sarcoidosis tras 49 meses de tratamiento con etanercept. El cuadro clínico y radiológico remitió al suspender el tratamiento contra el factor de necrosis tumoral (TNF) y con tratamiento corticoideo. Hasta la actualidad se han descrito 27 casos de sarcoidosis pulmonar, comprobados histológicamente, durante el tratamiento con antagonistas del TNF, siendo más frecuente con etanercept que con los anticuerpos monoclonales anti-TNF infliximab y adalimumab. Se discuten los probables mecanismos patogénicos de esta acción paradójica de los antagonistas del TNF. Es importante para el clínico reconocer esta infrecuente complicación del tratamiento anti-TNF.
We report on a 72 year-old woman with long-standing rheumatoid arthritis diagnosed as granulomatosis due to pulmonary sarcoidosis after 49 months of treatment with etanercept. A clinical and radiological improvement was seen after tumor necrosis factor (TNF) antagonist withdrawal plus a course of steroids. Currently, 27 cases of histological proven sarcoidosis with pulmonary involvement have been reported in relation to anti-TNF therapy, with etanercept being more frequent in comparison with the anti-TNF monoclonal antibodies infliximab and adalimumab. Potential pathogenic mechanisms of the paradoxical effect of anti-TNF treatment is discussed. It is important for clinicians to be aware of this potential and uncommon complication of biological therapy with TNF antagonists.
La sarcoidosis es una enfermedad granulomatosa sistémica de etiología desconocida. Se ha descrito la asociación entre sarcoidosis y enfermedades autoinmunes tales como el síndrome de Sjögren, el lupus eritematoso sistémico, la polimiositis, la espondilitis anquilosante, la miositis con cuerpos de inclusión y la esclerodermia1, así como con la artritis reumatoide (AR), aunque dicha asociación parece excepcional2. En los últimos años se han documentado casos de granulomatosis compatible con sarcoidosis en pacientes con AR y otras enfermedades inflamatorias durante el tratamiento con antagonistas del factor de necrosis tumoral (TNF)3.
Se presenta el caso de una paciente con AR en la que se detectó la presencia de sarcoidosis pulmonar a los 49 meses de tratamiento con el receptor soluble del TNF, etanercept (ETN). Se realiza una revisión de la bibliografía de los casos descritos de granulomatosis sarcoidea con afectación pulmonar en pacientes tratados con antagonistas del TNF y se sugieren hipótesis fisiopatológicas.
Caso clínicoMujer de 72 años con historia de AR seropositiva y erosiva de 10 años de evolución, que había realizado tratamiento con antiinflamatorios no esteroideos, glucocorticoides y diversos fármacos antirreumáticos modificadores de enfermedad (sales de oro, metotrexato y leflunomida) que fueron retirados por escasa eficacia. En 2002 inició tratamiento con infliximab (INF), retirado por pérdida de la eficacia, y en agosto de 2004 inició tratamiento con ETN en dosis de 25mg/2 veces por semana en monoterapia con muy buena respuesta clínica. Como secuela de su enfermedad, la paciente requirió artroplastia total de ambas rodillas. Entre otros antecedentes, destacaban la hipertensión arterial y la osteoporosis con fractura del fémur y fractura vertebral a nivel L5.
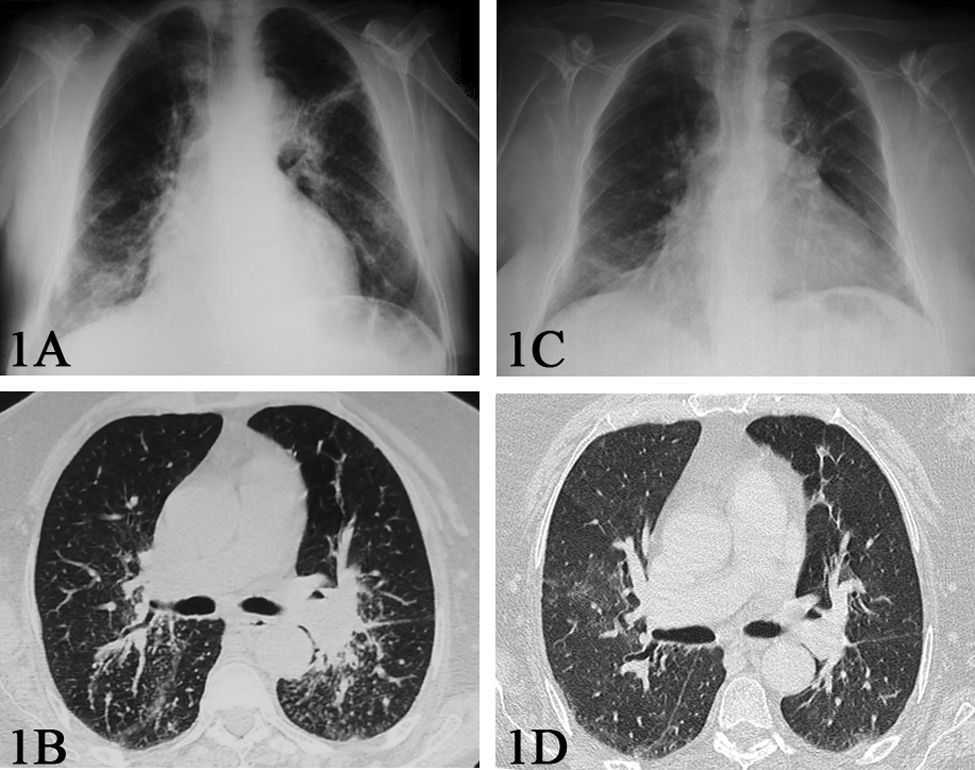
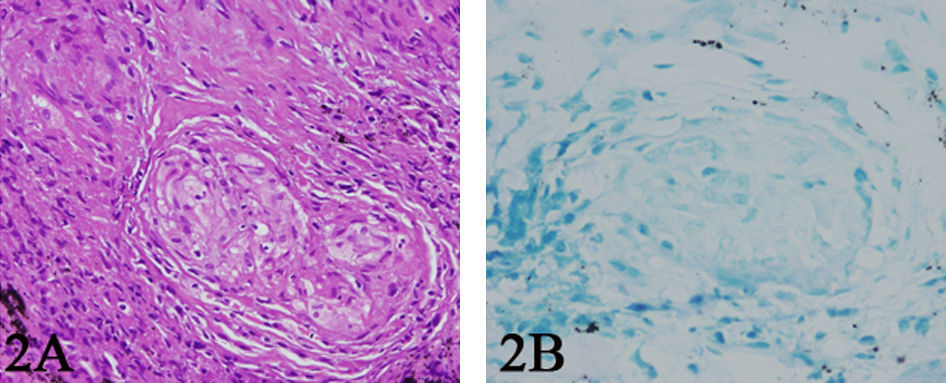
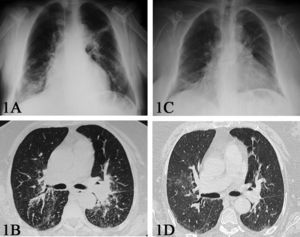
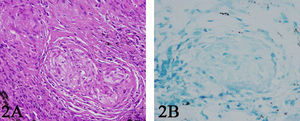
En septiembre de 2008, la paciente presentó un cuadro de 10 semanas de disnea progresiva y astenia. La paciente presentaba taquipnea. La auscultación respiratoria era normal, y la exploración articular mostró tumefacción de la tercera articulación metacarpofalángica de la mano derecha. Se realizó una radiografía de tórax que evidenció infiltrados reticulonodulillares a nivel parahiliar izquierdo y en el lóbulo inferior derecho (fig. 1A). La tomografía computarizada (TAC) torácica de alta resolución mostró un patrón nodulillar difuso con conglomerados perihiliares (fig. 1B). Los análisis sanguíneos mostraron una VSG de 96mm/h, una PCR de 4,26mg/dl y una hemoglobina de 9,9g/dl, con función renal y hepática normal. Los niveles de la enzima conversiva de la angiotensina (ECA) fueron de 49UI (valor normal<60UI). El factor reumatoide fue de 49UI/l (valor normal<25UI/l) y los anticuerpos frente a los péptidos citrulinados de 731UI (valor normal<25UI). Tanto los marcadores tumorales como el resto de los autoanticuerpos fueron negativos (incluidos los anticuerpos antimembrana basal, anti-ADN y ANCA), así como la prueba cutánea de Mantoux. La exploración funcional respiratoria mostró una alteración ventilatoria restrictiva (FVC de 1,95 l [el 69% de los valores de referencia], FEV1 de 1,38l [el 67% de los valores de referencia], FEV1/FVC del 98% y disminución de la capacidad de transferencia para el monóxido de carbono de 13,9ml/min/mmHg [el 65% de los valores de referencia]). La gasometría arterial evidenció hipoxemia (PaO2 de 75mmHg, PaCO2 de 35mmHg y saturación basal de oxígeno del 97%). Los hemocultivos y el análisis del esputo fueron negativos. Se le realizó una fibrobroncoscopía que mostró inflamación difusa de la mucosa bronquial. El análisis microbiológico del lavado broncoalveolar (cultivo para bacterias y hongos, tinción de Ziehl-Nielsen, tinción de plata, PCR de micobacterias y cultivo de Lowenstein) fue negativo. El análisis citológico del lavado broncoalveolar mostró un aumento del cociente linfocitos CD4/CD8 de 5,7 (valores de referencia de 1,6–1,8). Se realizó una biopsia transbronquial que demostró la presencia de granulomas con células histiocitarias y células gigantes multinucleadas sin necrosis ni caseum compatible con el diagnóstico de sarcoidosis (fig. 2A y B).
A) Radiografía de tórax en el momento del diagnóstico, en la que se observan infiltrados reticulonodulillares a nivel parahiliar izquierdo y en el lóbulo inferior derecho. B) Tomografía computarizada que muestra conglomerados adenopáticos peribroncoalveolares. C) Radiografía de tórax al año. D) Tomografía computarizada al año, sin conglomerados adenopáticos.
A) Biopsia transbronquial con tinción hematoxilina-eosina (×20) en la que se observa un granuloma con células histiocitarias, células gigantes multinucleadas (sin necrosis ni caseum) compatible con el diagnóstico de sarcoidosis. B) Tinción de Zielh-Nielsen (×40) de la biopsia transbronquial, sin demostración de bacilos de Koch.
Se retiró el tratamiento con ETN y se inició tratamiento con prednisona en dosis de 40mg al día con reducción progresiva de la dosis. Al mes de iniciar el tratamiento con corticoides, la paciente estaba asintomática y la TAC mostró la resolución de los conglomerados adenopáticos. A los cinco meses del inicio del tratamiento corticoideo, y a pesar del tratamiento con dosis bajas de prednisona (5mg), se produjo una reactivación moderada de la artritis, por lo que se inició tratamiento con leflunomida (10mg/día) con buena respuesta clínica. A los 12 meses de seguimiento, la radiografía de tórax mostró una mejoría de los infiltrados pulmonares (fig. 1C) y en la TAC (fig. 1D) no se evidenciaron adenopatías.
RevisiónSe describe el caso de una paciente con AR que desarrolló una sarcoidosis pulmonar mientras recibía tratamiento con ETN, un fármaco biológico antagonista del TNF. El cuadro clínico respiratorio y los infiltrados pulmonares mejoraron con la retirada del tratamiento biológico y el inicio del tratamiento con glucocorticoides, por lo que se considera que el ETN podría tener un papel en el desarrollo de la enfermedad granulomatosa en esta paciente.
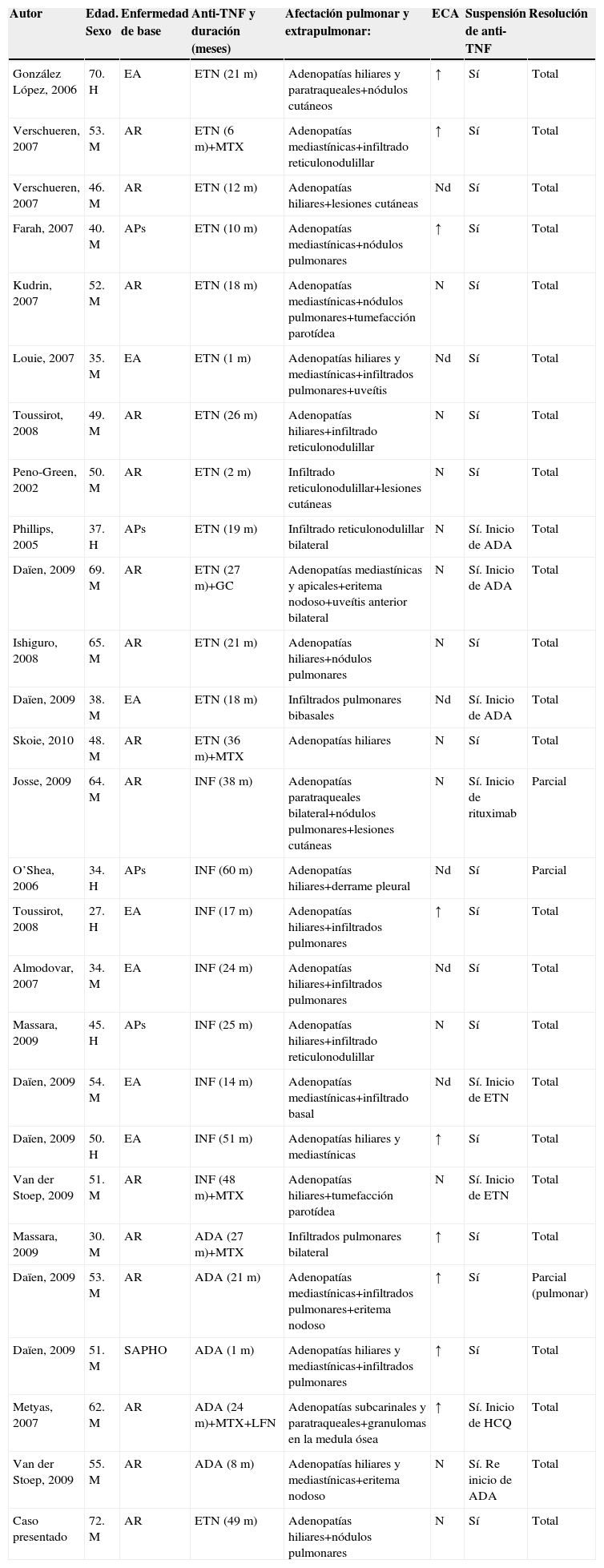
Se han descrito 27 casos, incluido el caso presentado en el artículo, de sarcoidosis con confirmación histopatológica inducida por tratamiento con antagonistas del TNF en pacientes con enfermedades reumáticas inflamatorias. En la tabla 1 se resumen los principales datos de estos pacientes. La mayoría eran mujeres (78%) con una media de edad de 49 años (rango de 27–72 años). Quince pacientes tenían AR, 7 espondiloartropatía, 4 artritis psoriásica y un paciente síndrome de sinovitis, acné, pustulosis, hiperostosis y osteítis. El antagonista del TNF más empleado fue el ETN (en el 52% de los casos), seguido de INF (30%) y adalimumab (18%). La media de meses de tratamiento biológico antes del diagnóstico de sarcoidosis fue de 23 meses (rango de 1–60 meses). Un 41% de los pacientes tenía afectación extrapulmonar concomitante, destacando la afectación cutánea, seguida de la ocular y parotídea. Las adenopatías mediastínicas y paratraqueales fueron las afectaciones pulmonares más frecuentes (85%), seguidas del infiltrado reticulonodulillar y los nódulos pulmonares (67%). Un 33% presentaba un patrón radiológico de Siltzbach en estadio i, un 52% un patrón radiológico en estadio ii y un 15% en estadio iii; ningún paciente presentaba fibrosis pulmonar. Los valores de la ECA estaban aumentados en 9 de los 21 pacientes (43%) en que se analizó. En todos los pacientes se suspendió el tratamiento biológico y en un 52% se añadió tratamiento con glucocorticoides. El 26% de los pacientes requirió tratamiento biológico con otro fármaco por reactivación de la artritis, excepto un caso, indicado por afectación pulmonar sarcoidea. La evolución de la sarcoidosis fue satisfactoria con resolución completa en su mayoría (89%), excepto en 3 pacientes en que fue parcial.
Pacientes con sarcoidosis pulmonar inducidas por el tratamiento con antagonistas del factor de necrosis tumoral13–19
| Autor | Edad. Sexo | Enfermedad de base | Anti-TNF y duración (meses) | Afectación pulmonar y extrapulmonar: | ECA | Suspensión de anti-TNF | Resolución |
| González López, 2006 | 70. H | EA | ETN (21m) | Adenopatías hiliares y paratraqueales+nódulos cutáneos | ↑ | Sí | Total |
| Verschueren, 2007 | 53. M | AR | ETN (6m)+MTX | Adenopatías mediastínicas+infiltrado reticulonodulillar | ↑ | Sí | Total |
| Verschueren, 2007 | 46. M | AR | ETN (12m) | Adenopatías hiliares+lesiones cutáneas | Nd | Sí | Total |
| Farah, 2007 | 40. M | APs | ETN (10m) | Adenopatías mediastínicas+nódulos pulmonares | ↑ | Sí | Total |
| Kudrin, 2007 | 52. M | AR | ETN (18m) | Adenopatías mediastínicas+nódulos pulmonares+tumefacción parotídea | N | Sí | Total |
| Louie, 2007 | 35. M | EA | ETN (1m) | Adenopatías hiliares y mediastínicas+infiltrados pulmonares+uveítis | Nd | Sí | Total |
| Toussirot, 2008 | 49. M | AR | ETN (26m) | Adenopatías hiliares+infiltrado reticulonodulillar | N | Sí | Total |
| Peno-Green, 2002 | 50. M | AR | ETN (2m) | Infiltrado reticulonodulillar+lesiones cutáneas | N | Sí | Total |
| Phillips, 2005 | 37. H | APs | ETN (19m) | Infiltrado reticulonodulillar bilateral | N | Sí. Inicio de ADA | Total |
| Daïen, 2009 | 69. M | AR | ETN (27m)+GC | Adenopatías mediastínicas y apicales+eritema nodoso+uveítis anterior bilateral | N | Sí. Inicio de ADA | Total |
| Ishiguro, 2008 | 65. M | AR | ETN (21m) | Adenopatías hiliares+nódulos pulmonares | N | Sí | Total |
| Daïen, 2009 | 38. M | EA | ETN (18m) | Infiltrados pulmonares bibasales | Nd | Sí. Inicio de ADA | Total |
| Skoie, 2010 | 48. M | AR | ETN (36m)+MTX | Adenopatías hiliares | N | Sí | Total |
| Josse, 2009 | 64. M | AR | INF (38m) | Adenopatías paratraqueales bilateral+nódulos pulmonares+lesiones cutáneas | N | Sí. Inicio de rituximab | Parcial |
| O’Shea, 2006 | 34. H | APs | INF (60m) | Adenopatías hiliares+derrame pleural | Nd | Sí | Parcial |
| Toussirot, 2008 | 27. H | EA | INF (17m) | Adenopatías hiliares+infiltrados pulmonares | ↑ | Sí | Total |
| Almodovar, 2007 | 34. M | EA | INF (24m) | Adenopatías hiliares+infiltrados pulmonares | Nd | Sí | Total |
| Massara, 2009 | 45. H | APs | INF (25m) | Adenopatías hiliares+infiltrado reticulonodulillar | N | Sí | Total |
| Daïen, 2009 | 54. M | EA | INF (14m) | Adenopatías mediastínicas+infiltrado basal | Nd | Sí. Inicio de ETN | Total |
| Daïen, 2009 | 50. H | EA | INF (51m) | Adenopatías hiliares y mediastínicas | ↑ | Sí | Total |
| Van der Stoep, 2009 | 51. M | AR | INF (48m)+MTX | Adenopatías hiliares+tumefacción parotídea | N | Sí. Inicio de ETN | Total |
| Massara, 2009 | 30. M | AR | ADA (27m)+MTX | Infiltrados pulmonares bilateral | ↑ | Sí | Total |
| Daïen, 2009 | 53. M | AR | ADA (21m) | Adenopatías mediastínicas+infiltrados pulmonares+eritema nodoso | ↑ | Sí | Parcial (pulmonar) |
| Daïen, 2009 | 51. M | SAPHO | ADA (1m) | Adenopatías hiliares y mediastínicas+infiltrados pulmonares | ↑ | Sí | Total |
| Metyas, 2007 | 62. M | AR | ADA (24m)+MTX+LFN | Adenopatías subcarinales y paratraqueales+granulomas en la medula ósea | ↑ | Sí. Inicio de HCQ | Total |
| Van der Stoep, 2009 | 55. M | AR | ADA (8m) | Adenopatías hiliares y mediastínicas+eritema nodoso | N | Sí. Re inicio de ADA | Total |
| Caso presentado | 72. M | AR | ETN (49m) | Adenopatías hiliares+nódulos pulmonares | N | Sí | Total |
↑: elevado; ADA: adalimumab; APs: artritis psoriásica; AR: artritis reumatoide; EA: espondilitis anquilosante; ECA: enzima convertidora de la angiotensina; ETN: etanercept; H: hombre; HCQ: hidroxicloroquina; INF: infliximab; LFN: leflunomida; M: mujer; MTX: metotrexato; N: normal; Nd: no disponible; SAPHO: sinovitis, acné, pustulosis, hiperostosis y osteítis; TNF: factor de necrosis tumoral.
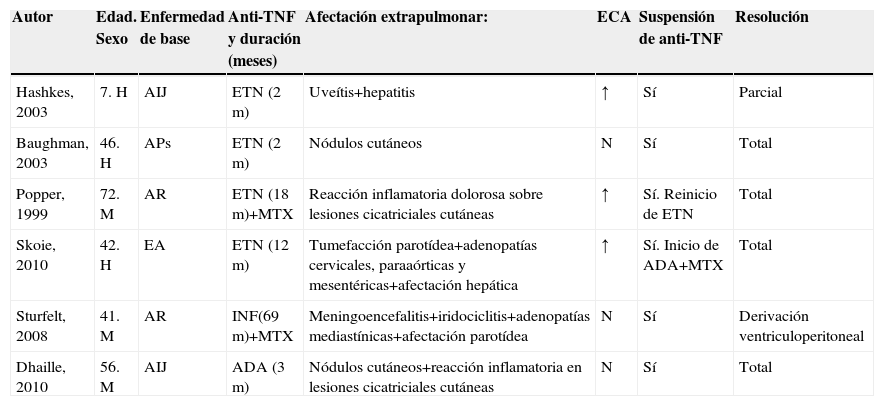
Además de los pacientes con sarcoidosis pulmonar inducida por el tratamiento biológico, se han descrito casos de granulomatosis sarcoidea, confirmada por histología, sin afectación pulmonar durante el tratamiento con antagonistas del TNF (tabla 2). Se han comunicado 6 casos (50% mujeres) con una media de edad 44 años (rango de 7–72 años), y en un 50% de los casos la concentración de la ECA estaba aumentada. El fármaco principalmente implicado fue también el ETN y la media de meses de tratamiento antes de la aparición de la sarcoidosis fue de 18 meses. Un paciente con artritis psoriásica tratado con los tres fármacos anti-TNF actualmente disponibles presentó nódulos cutáneos compatibles con sarcoidosis4.
Pacientes con sarcoidosis extrapulmonar inducida por el tratamiento con antagonistas del factor de necrosis tumoral5,14–16,20
| Autor | Edad. Sexo | Enfermedad de base | Anti-TNF y duración (meses) | Afectación extrapulmonar: | ECA | Suspensión de anti-TNF | Resolución |
| Hashkes, 2003 | 7. H | AIJ | ETN (2m) | Uveítis+hepatitis | ↑ | Sí | Parcial |
| Baughman, 2003 | 46. H | APs | ETN (2m) | Nódulos cutáneos | N | Sí | Total |
| Popper, 1999 | 72. M | AR | ETN (18m)+MTX | Reacción inflamatoria dolorosa sobre lesiones cicatriciales cutáneas | ↑ | Sí. Reinicio de ETN | Total |
| Skoie, 2010 | 42. H | EA | ETN (12m) | Tumefacción parotídea+adenopatías cervicales, paraaórticas y mesentéricas+afectación hepática | ↑ | Sí. Inicio de ADA+MTX | Total |
| Sturfelt, 2008 | 41. M | AR | INF(69m)+MTX | Meningoencefalitis+iridociclitis+adenopatías mediastínicas+afectación parotídea | N | Sí | Derivación ventriculoperitoneal |
| Dhaille, 2010 | 56. M | AIJ | ADA (3m) | Nódulos cutáneos+reacción inflamatoria en lesiones cicatriciales cutáneas | N | Sí | Total |
↑: elevado; ADA: adalimumab; AIJ: artritis idiopática juvenil; APs: artritis psoriásica; AR: artritis reumatoide; ECA: enzima convertidora de la angiotensina; ETN: etanercept; H: hombre; INF: infliximab; M: mujer; MTX: metotrexato; N: normal; TNF: factor de necrosis tumoral.
Al igual que el caso de los antagonistas del TNF, también se han descrito casos de sarcoidosis durante el tratamiento con interferón α3, fármaco utilizado en el tratamiento de neoplasias, esclerosis múltiple e infecciones por el virus de la hepatitis C5. Se ha sugerido que el interferón α, por su acción inmunomoduladora, podría inducir la activación de macrófagos y la formación de granulomas, produciendo lesiones tipo sarcoidosis5.
DiscusiónSe desconocen los mecanismos patogenéticos implicados en la aparición de la granulomatosis sarcoidea en pacientes tratados con antagonistas del TNF. De hecho, el TNF-α interviene en la formación y el mantenimiento del granuloma6,7, por lo que se ha postulado que los antagonistas del TNF podrían ser útiles para el tratamiento de enfermedades granulomatosas como la sarcoidosis8. En una serie de 9 pacientes con sarcoidosis pulmonar, el tratamiento con INF fue efectivo en todos los casos9. En un posterior estudio controlado a doble ciego en 138 pacientes se comprobó la eficacia de INF en esta enfermedad10. En este sentido, la inducción de la granulomatosis sarcoidea en el curso del tratamiento con antagonistas del TNF debería ser considerada como un efecto paradójico de difícil explicación. Además, podrían existir diferencias notables en cuanto al riesgo de esta complicación, que es más elevada en el curso del tratamiento con ETN. Apoyaría este incremento del riesgo el estudio prospectivo en fase ii con 17 pacientes con sarcoidosis pulmonar que fueron tratados con ETN y que fue cancelado antes de su finalización, ya que la mayoría de los pacientes tratados no mejoraron o incluso empeoraron11.
Aunque todos los fármacos anti-TNF ejercen su acción bloqueando a la citocina proinflamatoria TNF-α, tienen importantes diferencias tanto en su estructura como en las características farmacocinéticas y farmacodinámicas, lo que podría explicar, en parte, las diferencias que pueden observarse en cuanto a la eficacia clínica para un mismo paciente y a la distinta frecuencia o características de los posibles efectos adversos, incluida la inducción de lesiones granulomatosas6,12.
Este hecho podría explicar, en parte, la mayor incidencia de sarcoidosis con ETN en comparación con los anticuerpos monoclonales. El ETN, a diferencia del INF, se une solo de forma parcial al TNF transmembrana, dejando también libre la forma soluble monomérica, y no produce lisis celular, por lo que la inhibición del TNF no sería suficiente para preservar la formación del granuloma6,12. Por otra parte, hay que considerar que existen otras citocinas que también están implicadas en la formación y el mantenimiento del granuloma, como la IL-2, la IL-18 y el gammainterferón8. Se ha sugerido que los antagonistas del TNF podrían modular la expresión de estas citocinas, restableciendo una respuesta TH1. Así, el ETN ha demostrado que induce un incremento de la síntesis linfocitaria del gammainterferón. Se ha sugerido también que, por su particular cinética de unión entre el receptor soluble y la molécula del TNF, podría producirse una redistribución del TNF-α de los lugares de producción de la inflamación a otros tejidos6,12. Por otra parte, aunque con menor frecuencia, la sarcoidosis puede ser inducida por anticuerpos monoclonales anti-TNF, que, a su vez, incrementan la tasa TH1/TH2 en la sangre periferica6.
En resumen, se han descrito 27 casos de sarcoidosis pulmonar durante el tratamiento anti-TNF, la mayoría con ETN, que, por sus características y relación temporal, parecen ser consecuencia directa del tratamiento biológico. Es importante para el clínico reconocer esta posible complicación, que deberá contemplarse en el diagnóstico diferencial de las diversas formas de afectación pulmonar que pueden observarse en pacientes con enfermedades reumáticas inflamatorias, especialmente la AR.