En la relación entre las infecciones respiratorias de vías bajas (IRVB) y el desarrollo de asma y sibilancias durante la infancia, existen pocos datos con diseños prospectivos, de cohorte, desde el nacimiento y con población no seleccionada. El objetivo es determinar la prevalencia de asma y sibilancias recurrentes en la infancia, y establecer el efecto de las IRVB durante el primer año de vida.
Pacientes y métodosCohorte poblacional de 487 recién nacidos en el Hospital del Mar, Barcelona, con seguimiento hasta los 6 años de edad. Como variables dependientes se han estudiado: presencia de asma y sibilancias; como variables independientes: IRVB ocurridas en el primer año de vida y diversas covariables como prematuridad, peso al nacer, antecedentes maternos de asma y atopia, lactancia materna y exposición prenatal al tabaco.
ResultadosLa prevalencia de asma a los 6 años fue del 9,3%. Las variables asociadas al desarrollo de asma son: IRVB, ser prematuro, tener madre atópica y haber tomado lactancia artificial. Las IRVB en el primer año de vida también son un factor de riesgo relacionadas con las sibilancias recurrentes precoces y las sibilancias persistentes.
ConclusionesLos resultados confirman que las IRVB durante el primer año de vida están relacionadas con el diagnóstico de asma y con los fenotipos clínicos de sibilancias precoces y de sibilancias persistentes. Estos resultados concuerdan con el concepto de que las IRVB producidas en un período crítico del desarrollo, como los primeros años de vida, tienen un papel importante en la aparición posterior de asma y de sibilancias recurrentes.
There is limited knowledge on the relationship between lower respiratory tract infections (LRTI) and asthma and wheezing during infancy, as there are few studies with prospective design, birth cohort and in non selected population. The objectives of the present study were to determine the prevalence of asthma and recurrent wheezing in childhood and to analyse the relationship between LTRI during the first year of life and the development of asthma and/or wheezing in childhood.
Patients and MethodsProspective birth cohort study conducted in the Hospital del Mar (Barcelona). We recruited 487 children, followed up from the pregnancy to the 6th year of life. As outcomes we studied: the presence of asthma and wheezing. As independent variables we studied: LTRI occurring during the first year of life, and some covariables including, among others: prematurity, birth weight, maternal history of asthma and atopy, breastfeeding, prenatal exposure to tobacco.
ResultsThe asthma prevalence at 6 year of age was 9.3%. The variables associated with the development of asthma were LTRI, prematurity, atopic mother and formula breastfeeding. LTRI during the first year of life were also related with early recurrent wheezing and persistent wheezing.
ConclusionsOur results confirm that LTRI during the first year of life are related to the diagnosis of asthma and with the clinical phenotypes of early wheezing and persistent wheezing. These results are in accordance with the concept that LTRI occurring during a critical period of development, as are the first years of life, have an important role on in the later development of asthma and recurrent wheezing.
El asma es la enfermedad crónica más frecuente en los niños y su prevalencia está aumentando en los últimos años1, aunque las razones de este incremento no son concluyentes. En torno al asma pediátrico hay que tener también en cuenta la morbilidad asociada, la carga sanitaria, social y familiar, además de su posible relación con enfermedades respiratorias crónicas en la edad adulta.
El estudio del asma comporta una gran complejidad. La propia definición clínica de asma no es fácil, ya que puede manifestarse a cualquier edad, con un rango de fenotipos variado, con crisis más o menos graves y también con remisiones y agudizaciones. Asimismo, las sibilancias son una de las principales manifestaciones clínicas del asma, frecuentes en los niños menores de 3 años, generando una heterogeneidad clínica considerable. Sin embargo, algunos grupos de expertos han agrupado la presentación de sibilancias en la infancia en unas pocas categorías fenotípicas: sibilantes precoces, tardíos y persistentes. Según estas primeras definiciones fenotípicas de Martínez et al2, el asma no se clasifica en función exclusivamente de la edad de inicio, sino de acuerdo con la presentación de sibilancias en el curso de la infancia.
Además, su etiología es multifactorial, en la que distintos genes parecen estar implicados en la respuesta de los sistemas respiratorio e inmunológico, con el añadido de que esta susceptibilidad genética puede verse afectada por multitud de factores ambientales y hábitos de vida. Estudios recientes indican que los factores ambientales, especialmente aquellos que tienen lugar en los primeros años de la vida, podrían tener un papel importante en el desarrollo estructural o del sistema inmunitario. En este sentido, la exposición a diferentes factores y alérgenos, además de determinadas infecciones, podrían propiciar una mayor probabilidad alergias o asma.
La mayoría de las infecciones respiratorias durante la infancia afectan a las vías respiratorias altas, aunque no es despreciable la incidencia de las infecciones respiratorias de vías bajas (IRVB) como bronquitis, laringotraqueobronquitis, bronquiolitis o neumonías. En los países desarrollados, las IRVB se presentan entre un 20% y 39% de la población infantil3,4. Datos epidemiológicos indican que las infecciones respiratorias se relacionan con la posterior aparición de asma. Por ejemplo, los niños con asma presentaron una media de 2,5 episodios de IRVB cada año mientras que los otros niños sólo presentaron un sólo episodio, y además en torno al 70% de los episodios de IRVB antes de los 3 años se puede demostrar la presencia de virus respiratorios5. La relación temporal entre las infecciones respiratorias víricas y los procesos respiratorios acompañados de sibilancias en niños, también está establecida a través de estudios microbiológicos y serológicos sobre los virus más frecuentes (por ejemplo, VRS, rinovirus, metapneumovirus, bocavirus, virus parainfluenza, virus influenza)6–9. Otros estudios indican que la incidencia de crisis asmáticas asociadas a infecciones víricas está entre el 24% y el 54%10,11.
Sin embargo, en el estudio de la relación entre las IRVB y el desarrollo de asma y sibilancias durante la infancia, existen pocos datos epidemiológicos con diseños prospectivos, es decir, de cohorte desde el nacimiento y con población no seleccionada por antecedentes familiares de asma/atopia o haber sido atendidas en medio hospitalario. La identificación de los factores de riesgo, en población general, de presentar asma en la infancia y su relación con los fenotipos clínicos descritos puede permitir un mejor tratamiento del cuadro clínico agudo y la utilización de medidas preventivas a largo plazo, tanto farmacológicas como ambientales.
El objetivo del presente estudio es determinar en nuestra población la prevalencia de asma y sibilancias en el niño. Además, se estudia la influencia de las IRVB durante el primer año de vida como factor de riesgo en el desarrollo de asma y sibilancias a lo largo de la infancia.
MétodosSe reclutaron 487 niños de la zona de influencia del Hospital del Mar (Barcelona) entre 1996 y 1998, que fueron seguidos desde el nacimiento hasta el 6.° año de vida. Este grupo de niños formaba parte de una de las cohortes incluidas en el Asthma Multicenter Cohort Study (AMICS) que englobaba 4 localizaciones geográficas distintas: Ashford (Reino Unido), Barcelona y Menorca (España) y Munich (Alemania). La cohorte de seguimiento es la misma descrita previamente12. El estudio obtuvo la aprobación del Comité Ético de investigación clínica del hospital y los padres firmaron el consentimiento informado.
Asma y sibilanciasEl diagnóstico de asma se estableció clínicamente a partir de la respuesta afirmativa a la pregunta «¿algún médico le ha dicho alguna vez que su hijo tenía asma? El diagnóstico de sibilancia se estableció a partir de la respuesta afirmativa a la pregunta «¿algún médico le ha dicho alguna vez que su hijo tenía sibilantes o pitos en el pecho?» Esta información se obtuvo anualmente a través de cuestionarios validados, que incluían preguntas del International Study of Asthma and Allergy in Children (ISAAC)13. A cada niño se le asignó un fenotipo de sibilancias como los propuestos por Martínez et al2: nunca presentó sibilancias, sibilancias precoces y transitorias (el primer episodio se inicia antes del primer año y no refiere nuevos episodios después de los 3 años), sibilancias tardías (el primer episodio se inicia a partir de los 3 años de edad) y sibilancias persistentes (el primer episodio se inicia antes de los 3 años y sigue presentando a los 6 años de edad).
Infecciones respiratorias de vías bajasEl seguimiento activo de las IRVB se realizó durante el primer año de vida, siguiendo el siguiente protocolo de actuación: al día siguiente al parto los padres eran informados sobre los procesos respiratorios de vías bajas y los síntomas que debían notificar si los identificaban en su hijo; se facilitó un teléfono de contacto atendido por un contestador automático las 24h del día; el personal investigador contactaba con los padres para realizar una visita domiciliaria, entre las 24 y las 48h del inicio de los síntomas; la llamada era registrada como «no IRVB» o «sí IRVB» según si cumplían criterio de IRVB; en el domicilio, se procedía a la exploración clínica estandarizada, la confirmación del diagnóstico, la realización de un cuestionario sobre morbilidad respiratoria y la recogida de una muestra de moco nasofaríngeo. Además, para evitar pérdidas de procesos respiratorios de interés se realizaba una llamada telefónica mensual a las familias para verificar que en los últimos días no había habido síntomas y para reforzar el protocolo de actuación.
Las IRVB diagnosticadas, según las características clínicas definidas por Denny y Clyde14, fueron laringotraqueobronquitis, bronquitis, bronquiolitis y neumonía, además de IRVB–inespecífica cuando aquel proceso no se podía clasificar en alguna de las anteriores categorías.
La técnica de recogida de la muestra de moco nasofaríngeo, las técnicas de identificación virológica que se aplicaron y los resultados obtenidos de estas muestras están ampliamente detallados en una publicación anterior15.
CovariablesLas variables obtenidas a través de cuestionario fueron:
Personales: sexo del recién nacido; prematuridad (<37 semanas de gestación); peso al nacer (<2.500, 2.500–4.000 y >4.000 gramos); talla al nacer (<50 y >50cm); pequeño para la edad gestacional (o, 2.o y 3.er años de vida; tomó antibióticos para infecciones en el pecho en el 1.o, 2.o y 3.er años de vida.
Familiares: edad materna; país de procedencia de la madre; nivel socioeconómico (definido por la ocupación paterna y según la clasificación de 1990 del Registro General del Reino Unido (UK Registrar General's 1990); antecedentes de asma materna y paterna; antecedentes de atopia materna (cuando la madre refiere haber tenido rinitis y/o eccema); número de hermanos.
Ambientales del hogar: presencia de mascotas en casa en el 1.o y 4.o año.
Las determinaciones realizadas fueron:
Personales: inmunoglobulina E (IgE) total en sangre de cordón (Pharmacia CAP System low range FEIA, Pharmacia, Freiburg, Germany); IgE total en sangre del niño a los 4 años frente a Der p1 y Fel d1 (Pharmacia CAP System RAST-FEIA, Pharmacia, Freiburg, Germany); en ambos casos la IgE se definió como elevada cuando los niveles eran superiores a 0,35UI/ml; pruebas cutáneas de alergia a los 6 años de edad frente a los alérgenos: Der p1, Der p2, Fel d1, pelo de perro, parietaria, gramíneas, polen de árboles y polen de hierbas (Prick Test LETI, Laboratorios LETI SL, España), la respuesta se consideró positiva cuando la reacción a alguno de los alérgenos fue superior a 3mm; se midió el flujo espiratorio máximo (FEM) (MicroPeak, Micro Medical Ltd) antes y después del ejercicio, y la respuesta respiratoria al ejercicio se ha calculado como la variación del flujo espiratorio máximo FEM >15% y >20% (a los 16min) después del ejercicio en comparación con el FEM previo al inicio de la prueba.
Familiares: IgE específica frente a Der p1 en sangre materna (Pharmacia CAP System RAST-FEIA, Pharmacia, Freiburg, Germany), la IgE se definió como elevada cuando los niveles eran superiores a 0,35UI/ml.
Ambientales del hogar: cotinina en sangre de cordón y en de orina del niño al 4.o año mediante radioinmunoanálisis según el método descrito por Pichini y colaboradores16 (>14ng/ml distingue al recién nacido expuesto hijo de madre fumadora durante el embarazo); a los 6 meses de edad se analizaron muestras de polvo recogidas en las cunas de los recién nacidos y en el suelo del salón-comedor de su vivienda, para determinar mediante ELISA la concentración de aerolaérgenos (Der p1 y Fel d1)17 y se utilizaron las categorías de exposición sugeridas por Platts-Mills y de Weck18; también a los 6 meses se colocó, durante una semana en el salón-comedor, un monitor pasivo específico (Toyo Roshi NO2 filter badges, Tokio, Japan), para la determinación de la concentración de NO2, siguiendo el método descrito por Yanagisawa y Nishimura19.
Análisis estadísticoSe determinó la prevalencia de asma y de los fenotipos de sibilancias en el 6.o año de vida, así como la frecuencia de las sibilancias (nunca, ocasional, siempre) en cada año de seguimiento. Se empleó la prueba de Chi-cuadrado para comparar las prevalencias entre los grupos de estudio y el test de Mantel–Haenzel para analizar las tendencias entre categorías. Se calculó la odds ratio (OR) con su intervalo de confianza del 95% (IC 95%), mediante una regresión logística univariante para estimar la relación de las variables con diferencias estadísticamente significativas. Se realizaron modelos de regresión logística multivariante para valorar el efecto simultáneo entre las variables de estudio (diagnóstico de asma y fenotipos de sibilancias) y los factores de riesgo hallados en el análisis univariante. Cuando la variable de estudio fue el diagnóstico de asma a los 6 años de edad se utilizó el método por pasos hacia adelante (razón de verosimilitud), con entrada de las variables con p<0,10 y salida con p>0,20. Cuando la variable de estudio era alguno de los fenotipos de sibilancias, el método fue el multinominal. Para todos estos análisis multivariantes se incluyeron las variables que mostraran un valor de p<0,20 en el análisis univariante. La significación estadística en estos modelos se basó en la razón de verosimilitud. Todos los análisis se realizaron con el programa estadístico SPSS (SPSS versión 16.0, SPSS Inc, Chicago, IL, EE.UU).
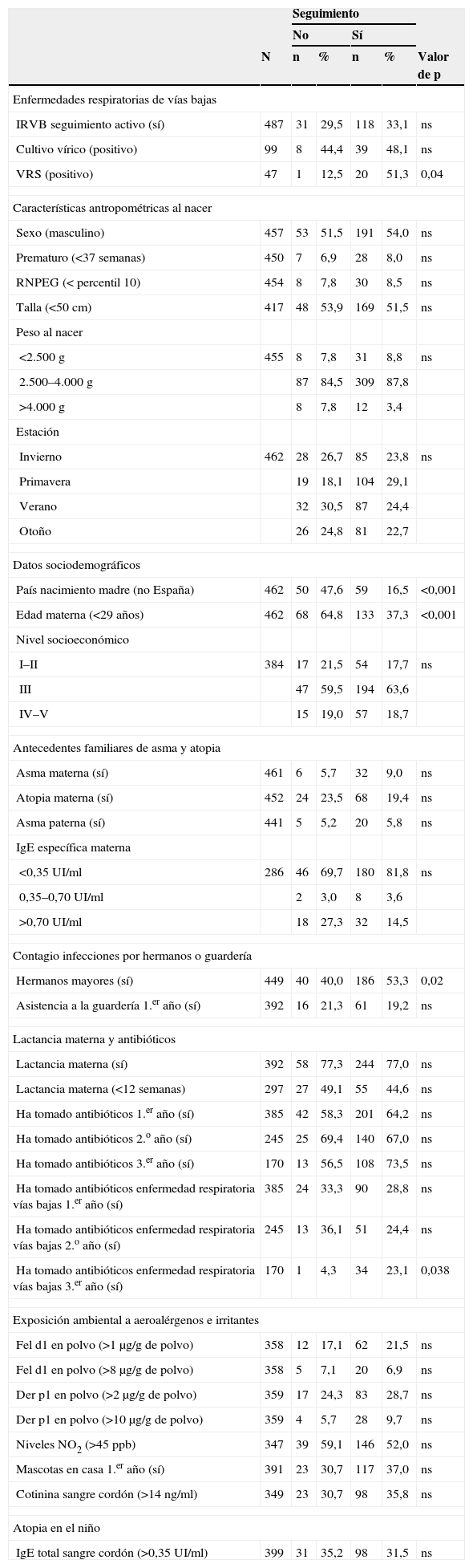
ResultadosSeguimiento de la cohorteDe los 487 recién nacidos incorporados al estudio se obtuvo información hasta el final del estudio de 368 niños (75,6%). Los motivos de abandono del estudio fueron la falta de teléfono de contacto actualizado y traslado del domicilio familiar fuera de Barcelona. Los niños que no finalizaron el estudio eran hijos de madres inmigrantes (p<0,001), de madres menores de 29 años de edad (p<0,001) y no tenían hermanos mayores (p=0,02). No se hallaron diferencias estadísticamente significativas para los otros factores de riesgo (tabla 1).
Datos de seguimiento de la cohorte (entrevista y muestras biológicas)
| Seguimiento | ||||||
| No | Sí | |||||
| N | n | % | n | % | Valor de p | |
| Enfermedades respiratorias de vías bajas | ||||||
| IRVB seguimiento activo (sí) | 487 | 31 | 29,5 | 118 | 33,1 | ns |
| Cultivo vírico (positivo) | 99 | 8 | 44,4 | 39 | 48,1 | ns |
| VRS (positivo) | 47 | 1 | 12,5 | 20 | 51,3 | 0,04 |
| Características antropométricas al nacer | ||||||
| Sexo (masculino) | 457 | 53 | 51,5 | 191 | 54,0 | ns |
| Prematuro (<37 semanas) | 450 | 7 | 6,9 | 28 | 8,0 | ns |
| RNPEG (< percentil 10) | 454 | 8 | 7,8 | 30 | 8,5 | ns |
| Talla (<50cm) | 417 | 48 | 53,9 | 169 | 51,5 | ns |
| Peso al nacer | ||||||
| <2.500g | 455 | 8 | 7,8 | 31 | 8,8 | ns |
| 2.500–4.000g | 87 | 84,5 | 309 | 87,8 | ||
| >4.000g | 8 | 7,8 | 12 | 3,4 | ||
| Estación | ||||||
| Invierno | 462 | 28 | 26,7 | 85 | 23,8 | ns |
| Primavera | 19 | 18,1 | 104 | 29,1 | ||
| Verano | 32 | 30,5 | 87 | 24,4 | ||
| Otoño | 26 | 24,8 | 81 | 22,7 | ||
| Datos sociodemográficos | ||||||
| País nacimiento madre (no España) | 462 | 50 | 47,6 | 59 | 16,5 | <0,001 |
| Edad materna (<29 años) | 462 | 68 | 64,8 | 133 | 37,3 | <0,001 |
| Nivel socioeconómico | ||||||
| I–II | 384 | 17 | 21,5 | 54 | 17,7 | ns |
| III | 47 | 59,5 | 194 | 63,6 | ||
| IV–V | 15 | 19,0 | 57 | 18,7 | ||
| Antecedentes familiares de asma y atopia | ||||||
| Asma materna (sí) | 461 | 6 | 5,7 | 32 | 9,0 | ns |
| Atopia materna (sí) | 452 | 24 | 23,5 | 68 | 19,4 | ns |
| Asma paterna (sí) | 441 | 5 | 5,2 | 20 | 5,8 | ns |
| IgE específica materna | ||||||
| <0,35UI/ml | 286 | 46 | 69,7 | 180 | 81,8 | ns |
| 0,35–0,70UI/ml | 2 | 3,0 | 8 | 3,6 | ||
| >0,70UI/ml | 18 | 27,3 | 32 | 14,5 | ||
| Contagio infecciones por hermanos o guardería | ||||||
| Hermanos mayores (sí) | 449 | 40 | 40,0 | 186 | 53,3 | 0,02 |
| Asistencia a la guardería 1.er año (sí) | 392 | 16 | 21,3 | 61 | 19,2 | ns |
| Lactancia materna y antibióticos | ||||||
| Lactancia materna (sí) | 392 | 58 | 77,3 | 244 | 77,0 | ns |
| Lactancia materna (<12 semanas) | 297 | 27 | 49,1 | 55 | 44,6 | ns |
| Ha tomado antibióticos 1.er año (sí) | 385 | 42 | 58,3 | 201 | 64,2 | ns |
| Ha tomado antibióticos 2.o año (sí) | 245 | 25 | 69,4 | 140 | 67,0 | ns |
| Ha tomado antibióticos 3.er año (sí) | 170 | 13 | 56,5 | 108 | 73,5 | ns |
| Ha tomado antibióticos enfermedad respiratoria vías bajas 1.er año (sí) | 385 | 24 | 33,3 | 90 | 28,8 | ns |
| Ha tomado antibióticos enfermedad respiratoria vías bajas 2.o año (sí) | 245 | 13 | 36,1 | 51 | 24,4 | ns |
| Ha tomado antibióticos enfermedad respiratoria vías bajas 3.er año (sí) | 170 | 1 | 4,3 | 34 | 23,1 | 0,038 |
| Exposición ambiental a aeroalérgenos e irritantes | ||||||
| Fel d1 en polvo (>1μg/g de polvo) | 358 | 12 | 17,1 | 62 | 21,5 | ns |
| Fel d1 en polvo (>8μg/g de polvo) | 358 | 5 | 7,1 | 20 | 6,9 | ns |
| Der p1 en polvo (>2μg/g de polvo) | 359 | 17 | 24,3 | 83 | 28,7 | ns |
| Der p1 en polvo (>10μg/g de polvo) | 359 | 4 | 5,7 | 28 | 9,7 | ns |
| Niveles NO2 (>45ppb) | 347 | 39 | 59,1 | 146 | 52,0 | ns |
| Mascotas en casa 1.er año (sí) | 391 | 23 | 30,7 | 117 | 37,0 | ns |
| Cotinina sangre cordón (>14ng/ml) | 349 | 23 | 30,7 | 98 | 35,8 | ns |
| Atopia en el niño | ||||||
| IgE total sangre cordón (>0,35UI/ml) | 399 | 31 | 35,2 | 98 | 31,5 | ns |
IRVB: infecciones respiratorias de vías bajas; RNPEG: recién nacido pequeño para la edad gestacional; VRS: virus respiratorio sincitial; ns: no significativo; Nivel socioeconómico I: directivos y profesiones de 2.o y 3.er ciclos universitarios; II: profesiones de 1.er ciclo universitario y técnicos superiores; III: profesionales de gestión administrativa y financiera, y trabajadores por cuenta propia; IV: trabajadores manuales cualificados y semicualificados; V: trabajadores no cualificados.
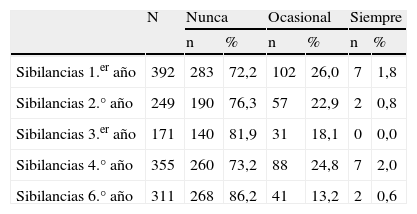
La prevalencia de asma a los 6 años de edad, fue del 9,3%. De ellos, en 26 niños, de los que se dispone datos completos sobre asma, cabe destacar que 5 (19,2%) ya fueron diagnosticados de asma en el primer año de vida, mientras que el resto fueron diagnosticados a lo largo de los 6 años de vida. En la tabla 2 se detalla la frecuencia de sibilancias en los 12 últimos meses (nunca, ocasional o siempre), según el año en que se realizó la entrevista. Al final del estudio se disponía de información sobre la presencia de sibilancias en cada uno de los años de seguimiento en 368 niños y permitió clasificarlos en los diferentes fenotipos de sibilancias: 191 niños (51,9%) nunca presentaron sibilancias, 66 (17,9%) presentaron sibilancias precoces, 50 (13,6%) presentaron sibilancias tardías y 61 (16,6%) presentaron sibilancias persistentes.
Frecuencia de presentar sibilancias en los 12 últimos meses, según el año de la entrevista
| N | Nunca | Ocasional | Siempre | ||||
| n | % | n | % | n | % | ||
| Sibilancias 1.er año | 392 | 283 | 72,2 | 102 | 26,0 | 7 | 1,8 |
| Sibilancias 2.° año | 249 | 190 | 76,3 | 57 | 22,9 | 2 | 0,8 |
| Sibilancias 3.er año | 171 | 140 | 81,9 | 31 | 18,1 | 0 | 0,0 |
| Sibilancias 4.° año | 355 | 260 | 73,2 | 88 | 24,8 | 7 | 2,0 |
| Sibilancias 6.° año | 311 | 268 | 86,2 | 41 | 13,2 | 2 | 0,6 |
Un total de 149 niños (30,6%) presentaron alguna IRVB en el primer año de vida. El número de cuadros clínicos registrados fueron 207, dado que un mismo niño podía presentar más de una IRVB en el periodo de seguimiento. La distribución de IRVB fue la siguiente: IRVB inespecífica (11,0%), bronquitis (85,5%), laringotraqueobronquitis (5,0%), bronquiolitis (13,5%) y neumonía (10,0%). Se pudo recoger una muestra de moco nasofaríngeo en 99 niños. Un 50% de las IRVB con muestra de moco disponible fueron positivas a algunos de los virus respiratorios estudiados, siendo el más frecuente el VRS (41%).
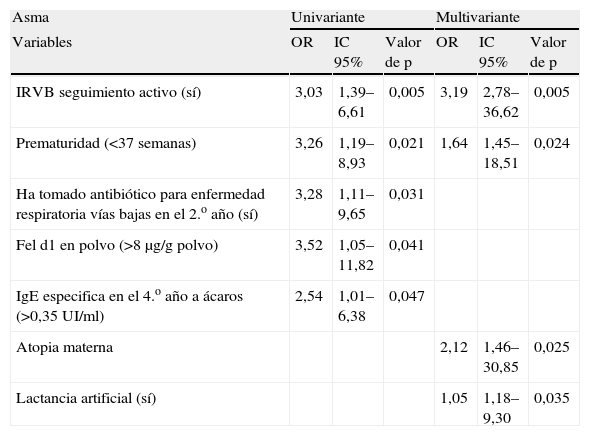
Relación entre las IRVB y asmaEl análisis univariante destaca como factores de riesgo para el desarrollo de asma a los 6 años de edad el haber sufrido IRVB en el primer año, ser prematuro, haber tomado antibióticos por IRVB durante el 2.° año de vida, presencia de aeroalergenos de epitelio de gato en el hogar y tener IgE específica frente a los ácaros en el 4.° año elevada. Sin embargo, el modelo final ajustado sólo confirma como factores de riesgo las IRVB, la prematuridad, ser hijo de madre atópica y haber recibido lactancia artificial (tabla 3).
Relación entre los factores de riesgo y asma
| Asma | Univariante | Multivariante | ||||
| Variables | OR | IC 95% | Valor de p | OR | IC 95% | Valor de p |
| IRVB seguimiento activo (sí) | 3,03 | 1,39–6,61 | 0,005 | 3,19 | 2,78–36,62 | 0,005 |
| Prematuridad (<37 semanas) | 3,26 | 1,19–8,93 | 0,021 | 1,64 | 1,45–18,51 | 0,024 |
| Ha tomado antibiótico para enfermedad respiratoria vías bajas en el 2.o año (sí) | 3,28 | 1,11–9,65 | 0,031 | |||
| Fel d1 en polvo (>8μg/g polvo) | 3,52 | 1,05–11,82 | 0,041 | |||
| IgE especifica en el 4.o año a ácaros (>0,35UI/ml) | 2,54 | 1,01–6,38 | 0,047 | |||
| Atopia materna | 2,12 | 1,46–30,85 | 0,025 | |||
| Lactancia artificial (sí) | 1,05 | 1,18–9,30 | 0,035 | |||
IRVB: infecciones respiratorias de vías bajas.
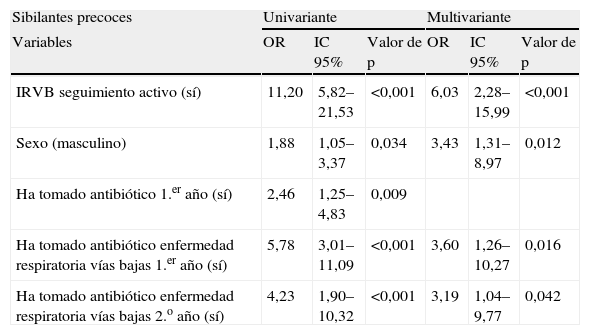
Los niños que presentaron IRVB, eran de sexo masculino y habían tomado antibióticos para enfermedades respiratorias de vías bajas en los 2 primeros años de vida tuvieron mayor riesgo de presentar sibilancias precoces (tabla 4).
Relación entre los factores de riesgo y sibilantes precoces
| Sibilantes precoces | Univariante | Multivariante | ||||
| Variables | OR | IC 95% | Valor de p | OR | IC 95% | Valor de p |
| IRVB seguimiento activo (sí) | 11,20 | 5,82–21,53 | <0,001 | 6,03 | 2,28–15,99 | <0,001 |
| Sexo (masculino) | 1,88 | 1,05–3,37 | 0,034 | 3,43 | 1,31–8,97 | 0,012 |
| Ha tomado antibiótico 1.er año (sí) | 2,46 | 1,25–4,83 | 0,009 | |||
| Ha tomado antibiótico enfermedad respiratoria vías bajas 1.er año (sí) | 5,78 | 3,01–11,09 | <0,001 | 3,60 | 1,26–10,27 | 0,016 |
| Ha tomado antibiótico enfermedad respiratoria vías bajas 2.o año (sí) | 4,23 | 1,90–10,32 | <0,001 | 3,19 | 1,04–9,77 | 0,042 |
IRVB: infecciones respiratorias de vías bajas.
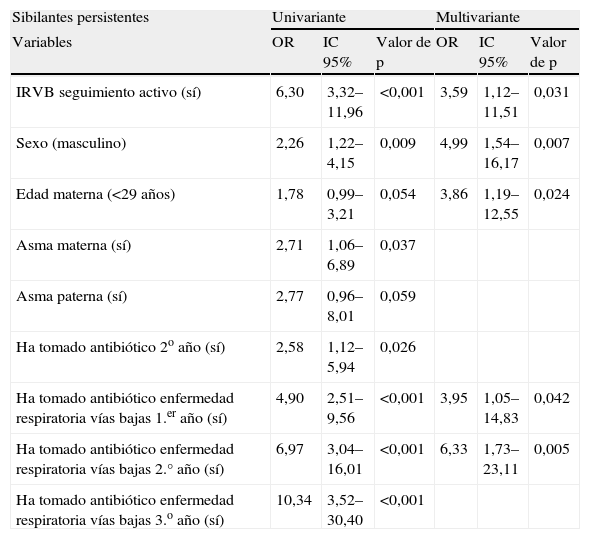
Los niños con sibilancias persistentes tuvieron IRVB, eran de sexo masculino, hijos de madres jóvenes (menores de 29 años) y habían tomado antibióticos para enfermedades respiratorias de vías bajas (tabla 5).
Relación entre los factores de riesgo y sibilantes persistentes
| Sibilantes persistentes | Univariante | Multivariante | ||||
| Variables | OR | IC 95% | Valor de p | OR | IC 95% | Valor de p |
| IRVB seguimiento activo (sí) | 6,30 | 3,32–11,96 | <0,001 | 3,59 | 1,12–11,51 | 0,031 |
| Sexo (masculino) | 2,26 | 1,22–4,15 | 0,009 | 4,99 | 1,54–16,17 | 0,007 |
| Edad materna (<29 años) | 1,78 | 0,99–3,21 | 0,054 | 3,86 | 1,19–12,55 | 0,024 |
| Asma materna (sí) | 2,71 | 1,06–6,89 | 0,037 | |||
| Asma paterna (sí) | 2,77 | 0,96–8,01 | 0,059 | |||
| Ha tomado antibiótico 2o año (sí) | 2,58 | 1,12–5,94 | 0,026 | |||
| Ha tomado antibiótico enfermedad respiratoria vías bajas 1.er año (sí) | 4,90 | 2,51–9,56 | <0,001 | 3,95 | 1,05–14,83 | 0,042 |
| Ha tomado antibiótico enfermedad respiratoria vías bajas 2.° año (sí) | 6,97 | 3,04–16,01 | <0,001 | 6,33 | 1,73–23,11 | 0,005 |
| Ha tomado antibiótico enfermedad respiratoria vías bajas 3.o año (sí) | 10,34 | 3,52–30,40 | <0,001 | |||
IRVB: infecciones respiratorias de vías bajas.
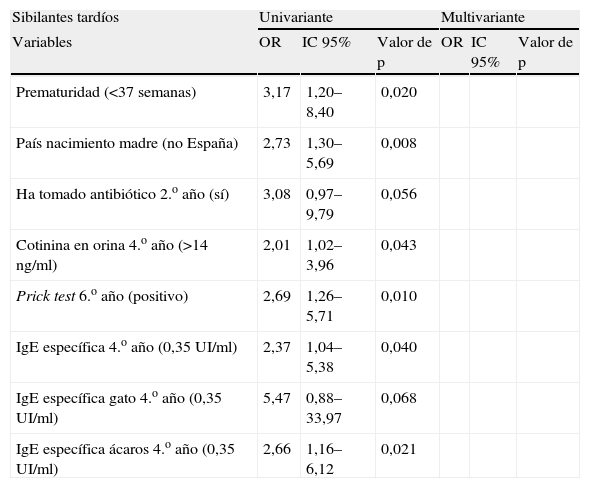
Sin embargo, no se halla ninguna relación entre las IRVB y el fenotipo de sibilancias tardías (tabla 6). Los datos sugieren que los niños que fueron prematuros, de madres inmigrantes, expuestos al humo ambiental de tabaco a los 4 años de edad, sensibilizados al epitelio de gato y a los ácaros del polvo, además de presentar pruebas cutáneas positivas y de haber tomado antibióticos (no solo para enfermedades respiratorias de vías bajas), fueron más propensos a desarrollar sibilancias tardías. No obstante, ninguna asociación se mantiene en el análisis multivariante.
Relación entre los factores de riesgo y sibilantes tardíos
| Sibilantes tardíos | Univariante | Multivariante | ||||
| Variables | OR | IC 95% | Valor de p | OR | IC 95% | Valor de p |
| Prematuridad (<37 semanas) | 3,17 | 1,20–8,40 | 0,020 | |||
| País nacimiento madre (no España) | 2,73 | 1,30–5,69 | 0,008 | |||
| Ha tomado antibiótico 2.o año (sí) | 3,08 | 0,97–9,79 | 0,056 | |||
| Cotinina en orina 4.o año (>14ng/ml) | 2,01 | 1,02–3,96 | 0,043 | |||
| Prick test 6.o año (positivo) | 2,69 | 1,26–5,71 | 0,010 | |||
| IgE específica 4.o año (0,35UI/ml) | 2,37 | 1,04–5,38 | 0,040 | |||
| IgE específica gato 4.o año (0,35UI/ml) | 5,47 | 0,88–33,97 | 0,068 | |||
| IgE específica ácaros 4.o año (0,35UI/ml) | 2,66 | 1,16–6,12 | 0,021 | |||
Este estudio se ha llevado a cabo con el fin identificar el efecto de las IRVB sobre el asma y las sibilancias, y controlar las numerosas covariables recogidas en diferentes momentos del seguimiento.
La prevalencia de asma obtenida es comparable a la de otros países mediterráneos pero menor respecto a los países anglosajones. En España, la prevalencia de asma a los 6 años oscila entre el 7% y el 13%, según los datos del estudio ISAAC-III de 200213. Referente a la prevalencia de los fenotipos de sibilancias en niños menores de 6 años de edad, nuestros resultados son muy similares a los aportados por Martínez et al2 en su cohorte infantil de Tucson.
Relación entre las IRVB con el diagnóstico de asma y el fenotipo de las sibilanciasLas IRVB presentaron una fuerte relación con el diagnóstico de asma a los 6 años de edad del niño, de acuerdo con los resultados de otros autores20–23. Además, este estudio aporta que los niños que presentaron los fenotipos de sibilancias precoces y persistentes también guardaban relación con las IRVB ocurridas en el primer año de vida. Sin embargo, no hallamos relación entre infecciones por VRS y asma, como señalan algunos estudios prospectivos24,25. Seguramente, ello es debido al escaso número de muestras dado que sólo se hizo seguimiento activo de cuadros respiratorios en el primer año de vida.
Se han propuesto algunas hipótesis para explicar la relación entre IRVB y asma. La primera sugiere que las infecciones víricas podrían alterar el desarrollo de la respuesta inmunitaria o interferir en el desarrollo del patrón neumológico y la regulación del tono de las vías respiratorias. En esta línea, los virus serían agentes causales en el inicio del asma («direct causation»). Una segunda hipótesis indica que los virus sólo son desencadenantes de la obstrucción de las vías respiratorias en sujetos que ya tienen una alteración funcional o estructural previa de las vías aéreas o una susceptibilidad para desarrollar una respuesta inmunitaria que predispone a la obstrucción («reverse causation»). Diferentes estudios avalan este último enfoque porque los niños con antecedentes familiares de asma o de atopia presentan más IRVB que los niños sin antecedentes20. La tercera y más reciente hipótesis, propuesta por Martinez26, supone que la respuesta a los diferentes virus asociados al asma dependería de los antecedentes genéticos, de la exposición a otros factores ambientales y del grado de maduración de los sistemas respiratorio e inmunitario. Ello explicaría lo que se observa en la relación asma-virus: no hay sólo un patrón de respuesta y de secuelas a largo plazo.
Relación entre las covariables y el diagnóstico de asma a los 6 añosAdemás de las IRVB otras variables halladas de forma independiente como factores de riesgo son: la prematuridad, la lactancia artificial y la atopia materna. Diversos autores apuntan que la prematuridad causaría un desarrollo pulmonar reducido27, con una afectación del calibre de las vías respiratorias que generaría un aumento de sibilancias durante las infecciones respiratorias y a su vez incrementaría el diagnóstico de asma. Sin embargo, otros autores no han hallado esta asociación, argumentando que es difícil separar los efectos de la prematuridad, en sí, de los efectos asociados a la ventilación mecánica que algunos de estos niños necesitan en el período perinatal. Ante esta discrepancia, una revisión sistemática reciente del tema que incluye un metaanálisis28 concluye que sí existe asociación, aunque débil.
En nuestro estudio la otra variable asociada al desarrollo de asma es la lactancia artificial, que coincide con los datos que aportan otros autores29. La flora intestinal predominante de Bifidobacterias y Lactobacilos en los niños que realizaron lactancia materna se ha considerado como beneficiosa para obtener una respuesta inmunitaria protectora frente a las alergias. Recientemente, Frediksson y colaboradores30 establecen una relación en U entre lactancia materna y asma, es decir, la menor prevalencia de asma se encuentra en los niños que lactaron entre 4 y 6 meses y la mayor presencia de síntomas respiratorios crónicos en los niños que lactaron entre 7 y 9 meses. Aunque los estudios epidemiológicos puedan aportar información contradictoria, la recomendación continúa siendo facilitar la lactancia materna por sus otros efectos beneficiosos demostrados sobre el desarrollo neurológico, la obesidad y la hipertensión.
Referente a la influencia de los antecedentes familiares de asma o atopia no existen aportaciones concluyentes. Hay estudios para los que el asma materna es un riesgo31 mientras que otros demuestran lo contrario32. En el nuestro, hay relación entre los niños diagnosticados de asma a los 6 años y los antecedentes atópicos de la madre. Según Ying et al33 esta relación existe porque la respuesta local del epitelio respiratorio está alterada en los niños asmáticos.
Relación entre las covariables y las sibilanciasEn varios estudios epidemiológicos se ha constatado el predominio del asma y la atopia en el sexo masculino antes de la pubertad. En este estudio no se puede confirmar esta relación en los niños diagnosticados de asma pero sí en los que presentaron sibilancias precoces y persistentes. Después de la pubertad para ser más frecuente entre las niñas. Algunos autores han determinado que el efecto se debe a que la testosterona es más antiinflamatorio que el estrógeno34. Otros autores han encontrado que los niños tienen un menor desarrollo de las vías respiratorias en comparación al mayor desarrollo del volumen pulmonar; es lo que se ha denominado desarrollo pulmonar disináptico35.
Recientemente, ha aumentado el interés por determinar si existe relación causal entre el uso de antibióticos y el desarrollo de asma o atopia. En nuestro estudio existe relación entre la toma de antibióticos y los niños que presentaron sibilancias precoces y persistentes. Es verdad que una explicación referente a esta asociación podría ser atribuible a un sesgo de memoria. Los padres de los niños con asma o sibilantes de nuestro estudio estarían más predispuestos a recordar la exposición a determinados factores, entre ellos la toma de antibióticos, al haber un seguimiento muy exhaustivo. Esta asociación ha sido también confirmada por otros autores en un reciente metaanálisis36. Resulta difícil explicar el posible mecanismo biológico subyacente. Si esta relación es causal, se ha barajado la posibilidad de que los antibióticos podrían aumentar el riesgo de desarrollar asma y atopia porque evitarían aquellas infecciones bacterianas que predispondrían a un desarrollo inmunitario hacia los linfocitos Th137. Otra posibilidad es que los antibióticos pudieran afectar a la flora intestinal, que también modula el sistema inmunitario.
En este estudio, los niños con sibilancias persistentes frecuentemente eran hijos de madres menores de 29 años, en comparación con los que nunca presentaron sibilancias. Está bien documentado que en las mujeres adolescentes algunos factores metabólicos y el nivel socioeconómico están asociados a unos peores efectos en el embarazo. Sin embargo, en nuestro estudio la edad materna es un factor de riesgo independiente de otros factores perinatales y sociodemográficos recogidos, por lo que no se puede desdeñar la posibilidad de que la edad materna fuese una probable varible confusora de algún otro indicador social aun no determinado.
Fortalezas y limitaciones del estudioLa validez de los resultados procedentes de esta cohorte estriba en que permite recoger información sobre factores de riesgo en edad temprana y aporta datos sobre la secuenciación de los eventos en la historia natural del asma y las sibilancias. Valora el papel de las IRVB en el primer año mediante un registro prospectivo y activo de las mismas, con el fin de evitar un sesgo de memoria de los padres. La tasa de seguimiento en el estudio es relativamente alta, dada la dificultad de fidelizar a los participantes en los estudios de cohorte. La distribución de las variables estudiadas son similares entre el grupo que abandonó el seguimiento y el que permaneció en el estudio, por lo que parece que las pérdidas no han introducido sesgo alguno de información relevante.
Es importante en este tipo de estudios el tamaño muestral del que se parte, dado que podría se una limitación del mismo. En el nuestro, algunos de los factores asociados a asma o a los difrentes fenotipos de sibilancias tienen estimaciones de asociación con intervalos de confianza amplios, que revelan que el tamaño muestral no es suficiente para ser más preciso. Nuestros resultados podrían no ser generalizables por tratarse de una población mediterránea, con un componente de inmigración destacado y con una amplia exposición al humo de tabaco (hasta un 60% de los niños de la cohorte estaban expuestos al humo de tabaco a partir de la madre fumadora u otros familiares).
Finalmente, desde el punto de vista clínico y preventivo es importante poder llegar a tener el más amplio conocimiento de la patogenia de las IRVB y el desarrollo de asma o sibilancias con el objetivo final de poder evitar, o reducir en la medida de lo posible, su progresión. En este sentido, el estudio demuestra el papel de las IRVB durante el primer año en el desarrollo de asma y sibilancias en la infancia. Pero además, nuestros resultados sugieren que esta relación es compleja y que probablemente dependa de otros factores y mecanismos, por lo que hace necesarias más investigaciones.
ConclusionesLos resultados obtenidos en este estudio confirman que las IRVB que tienen lugar durante el primer año de vida están relacionadas con el diagnóstico de asma y con los fenotipos clínicos de sibilancias precoces y de sibilancias persistentes. Estos resultados concuerdan con el concepto de que las IRVB producidas en un período crítico del desarrollo, como son los primeros años de vida, tienen un papel importante en la aparición posterior de asma y de sibilancias.