El estudio EPI-SCAN (Epidemiologic Study of COPD in Spain), realizado entre mayo de 2006 y julio de 2007, ha determinado que la prevalencia de la EPOC en España según los criterios GOLD es del 10,2% (IC95% 9,2–11,1) de la población de 40 a 80 años. Se desconoce la variabilidad geográfica actual de la EPOC en España.
ObjetivosDescribir la prevalencia de EPOC, su infradiagnóstico e infratratamiento, y los datos de tabaquismo y mortalidad en las once áreas participantes en el estudio EPI-SCAN. Se definió EPOC como un cociente FEV1/FVC posbroncodilatador <0,70 o menor del límite inferior de la normalidad (LIN).
ResultadosLa razón de prevalencias de EPOC según criterios GOLD entre áreas fue de 2,7 veces, con un máximo en Asturias (16,9%) y un mínimo en Burgos (6,2%) (p<0,05). La prevalencia de EPOC según el LIN fue del 5,6% (IC 95% 4,9–6,4) y la razón de prevalencias utilizando el LIN fue de 3,1 veces, pero con un máximo en Madrid-La Princesa (10,1%) y un mínimo en Burgos (3,2%) (p<0,05). El orden de prevalencias de EPOC por áreas no se mantuvo en ambos sexos ni por edades en cada área. Las variaciones en infradiagnóstico (58,6% a 72,8%) e infratratamiento por áreas (24,1% a 72,5%) fueron substanciales (p<0,05). La prevalencia de fumadores y ex-fumadores, y la exposición acumulada medida por paquetes-año, así como la estructura de edad de cada una de las áreas, no explican la variabilidad por áreas geográficas. Tampoco existe relación con las tasas de mortalidad publicadas por comunidad autónoma.
ConclusiónExisten importantes variaciones en la distribución de la EPOC en España, tanto en prevalencia como en infradiagnóstico e infratratamiento.
The EPI-SCAN study (Epidemiologic Study of COPD in Spain), conducted from May 2006 to July 2007, determined that the prevalence of COPD in Spain according to the GOLD criteria was 10.2% of the 40 to 80 years population. Little is known about the current geographical variation of COPD in Spain.
ObjectivesWe studied the prevalence of COPD, its under-diagnosis and under-treatment, smoking and mortality in the eleven areas participating in EPI-SCAN. COPD was defined as a post-bronchodilator FEV1/FVC ratio <0.70 or as the lower limit of normal (LLN).
ResultsThe ratio of prevalences of COPD among the EPI-SCAN areas was 2.7-fold, with a peak in Asturias (16.9%) and a minimum in Burgos (6.2 %) (P<0.05). The prevalence of COPD according to LLN was 5.6% (95% CI 4.9–6.4) and the ratio of COPD prevalence using LLN was 3.1-fold, but with a peak in Madrid-La Princesa (10.1%) and a minimum in Burgos (3.2%) (P<0.05). The ranking of prevalences of COPD was not maintained in both sexes or age groups in each area. Variations in under-diagnosis (58.6% to 72.8%) and under-treatment by areas (24.1% to 72.5%) were substantial (P<0.05). The prevalence of smokers and former smokers, and cumulative exposure as measured by pack-years, and the age structure of each of the areas did not explain much of the variability by geographic areas. Nor is there any relation with mortality rates published by Autonomous Communities.
ConclusionThere are significant variations in the distribution of COPD in Spain, either in prevalence or in under-diagnosis and under-treatment
El último informe de la Organización Mundial de la Salud sobre la situación del tabaco en el mundo indica que España, con sus 44,5 millones de habitantes y un 26% de fumadores diarios y un 3% de fumadores ocasionales, está aún en la fase iii de la curva epidémica del tabaco1. Se observa un descenso del tabaquismo en hombres pero un mantenimiento en mujeres, aún lejos de la fase iv de nuestros vecinos de Europa Occidental. La monitorización de las enfermedades crónicas relacionadas con el tabaco es un tema de interés, relevante y actual. Datos preliminares de diciembre 2009 de la Encuesta Europea de Salud indican un sorprendente incremento del tabaquismo en adultos en España hasta el 31,5% actualmente2.
El estudio EPI-SCAN ha determinado que la prevalencia actual de la EPOC en España según los criterios GOLD es del 10,2% (IC95% 9,2–11,1) de la población de 40 a 80 años3. Anteriormente, el estudio IBERPOC, realizado en 1997, determinó una prevalencia de EPOC del 9,1% (14,3% en hombres y 3,9% en mujeres), definida según los criterios antiguos de la European Respiratory Society como cociente posbroncodilatador FEV1/FVC<88% del teórico en hombres y <89% en mujeres, ya con importantes variaciones entre las siete áreas participantes4. En este sentido, el exceso de casos detectado en algunas áreas geográficas de IBERPOC solía corresponder a mujeres mayores de 55 años, no fumadoras, con antecedentes de enfermedades respiratorias en la infancia y que no padecían síntomas de expectoración o sibilantes5.
La comparación de los resultados espirométricos en IBERPOC y en EPI-SCAN ha sido descrita recientemente6. Sin embargo, se desconoce la variabilidad geográfica de la EPOC en España en la actualidad, y su relación con el hábito tabáquico y otros determinantes a nivel local. La denominada epidemiología geográfica o de áreas pequeñas7, favorece la diseminación local de datos de salud en comparación con poblaciones circundantes, lo que permite establecer las prioridades para ejecutar mecanismos correctores, tal como ha sido revisado recientemente8. Además debe permitir monitorizar y/o confirmar la implementación de las recomendaciones de estrategias comunitarias9. A nivel internacional, tanto la iniciativa PLATINO como BOLD ya han identificado diferencias substanciales en la distribución de la prevalencia de EPOC10,11, aunque en ambos el muestreo era en ciudades o áreas únicas por país, por lo que no es posible determinar la variabilidad intranacional o en áreas pequeñas. El objetivo de este artículo es determinar si existen variaciones en la prevalencia de EPOC y su infradiagnóstico e infratratamiento entre las once áreas participantes en EPI-SCAN, y analizar si esta variabilidad puede estar relacionada con algunos de sus determinantes, entre ellos el tabaquismo a nivel individual y las tasas de mortalidad por EPOC publicadas en las estadísticas oficiales por comunidades autónomas a nivel ecológico.
MétodosLa metodología y protocolo del estudio EPI-SCAN han sido descritos en detalle previamente12. Brevemente, EPI-SCAN es un estudio epidemiológico, observacional, transversal, multicéntrico, de ámbito nacional y de base poblacional con selección aleatoria de participantes mediante un muestreo en dos etapas y estratificado de acuerdo a las zonas próximas a los centros participantes. Los centros participantes fueron seleccionados de acuerdo a cuatro zonas geográficas (norte, levante, sur y centro) del territorio español, a saber: Barcelona, Burgos, Córdoba, Huesca, Madrid (dos centros), Oviedo, Sevilla, Valencia, Vic y Vigo. El muestreo del estudio fue bietápico, poblacional y aleatorio, mediante muestreo telefónico incluyendo hombres y mujeres de la población general, de edad entre 40 a 80 años y residentes en España. El trabajo de campo se realizó entre los meses de mayo de 2006 y julio de 2007. El estudio fue presentado y autorizado por los comités de ética de la investigación clínica correspondientes, siendo el del Hospital Clínic i Provincial de Barcelona el de referencia. Todos los participantes consintieron voluntariamente por escrito a la realización de las pruebas de estudio.
Se recogió información sobre datos sociodemográficos, hábito tabáquico, diagnóstico previo de enfermedades respiratorias y otras patologías, exacerbaciones de EPOC, escala de disnea, y tratamiento para enfermedades respiratorias, entre otras variables. La presencia de síntomas respiratorios (tos habitual al levantarse, esputos frecuentes, y presencia alguna vez de disnea y de sibilantes) fue recogida mediante el cuestionario CECA en su versión española13. Se realizó espirometría forzada con un equipo Master Scope CT (VIASYS Healthcare®, Hoechberg, Alemania), empleándose los criterios de aceptabilidad y reproducibilidad, así como la selección de la maniobra propuestos en las recomendaciones American Thoracic Society/European Respiratory Society (ATS/ERS)14 más recientes, y se utilizaron los valores de referencia de la CECA15. Las maniobras se repitieron 15–30min después de la inhalación de 200mcg de salbutamol. Siguiendo el criterio de las guías ATS/ERS16, se consideró positiva la prueba broncodilatadora cuando se registró un incremento del FEV1 o de la FVC >200ml y mayor del 12% con respecto al valor basal.
En el presente análisis, se definió EPOC de dos maneras: como un cociente posbroncodilatador FEV1/FVC<0,70 o como límite inferior de la normalidad14, que es el percentil 5 de la distribución de la variable FEV1/FVC en la población general, según los valores de referencia de la CECA15.
La tasa de mortalidad por comunidad autónoma y género, ajustada para la población europea/100.000 habitantes fue recogida a partir de estadísticas oficiales17.
Análisis estadísticoEl estudio EPI-SCAN se realizó según el siguiente cálculo del tamaño muestral: se estimó una prevalencia de EPOC del 12%, con una precisión de ±1%, y asumiendo un 20% de pérdidas el número teórico de individuos a incluir en el estudio fue de 5,071. Considerando a posteriori, que entre las 11 áreas en EPI-SCAN la media de participantes fue de 345 por área, con un máximo de 439 en Burgos y un mínimo de 136 en Asturias, existe potencia estadística para la mayoría de comparaciones de áreas respecto a la media. Además el estimador y su intervalo de confianza del 95% se presentan en la mayoría de los análisis. Los resultados de cada variable se presentan como media y desviación estándar, en el caso de las variables continuas, y utilizando el recuento de casos por cada categoría y la frecuencia relativa al total de respuestas en el de las variables categóricas. La prevalencia de EPOC y su intervalo de confianza al 95% se calculó de acuerdo a dos criterios espirométricos (GOLD y LIN)14.
La significación estadística en las tablas 1 y 2 se compara en cada variable por área respecto al global EPI-SCAN, realizando una ANOVA inicial y posteriormente un test bilateral para las variables contínuas, y una Chi2 para las categóricas. La correlación de Spearman se utilizó para determinar la asociación entre las prevalencias de EPOC por área y los paquetes-año por área y las tasas de mortalidad publicadas por comunidad autónoma17, respectivamente. En todas las pruebas estadísticas realizadas se utilizó un nivel de significación estadística inferior al 0,05.
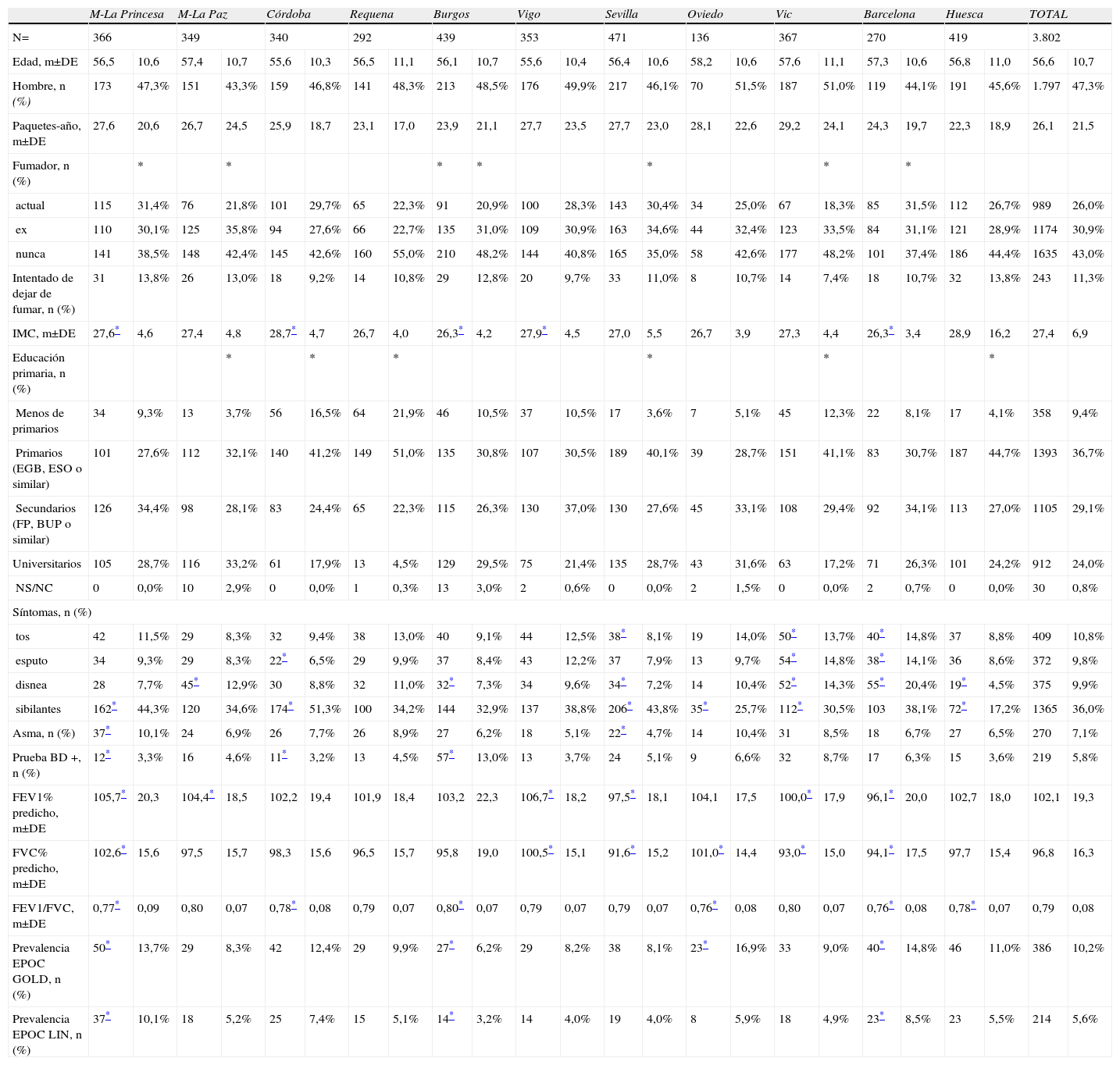
Características sociodemográficas y clínicas en participantes del estudio EPI-SCAN, por áreas
| M-La Princesa | M-La Paz | Córdoba | Requena | Burgos | Vigo | Sevilla | Oviedo | Vic | Barcelona | Huesca | TOTAL | |||||||||||||
| N= | 366 | 349 | 340 | 292 | 439 | 353 | 471 | 136 | 367 | 270 | 419 | 3.802 | ||||||||||||
| Edad, m±DE | 56,5 | 10,6 | 57,4 | 10,7 | 55,6 | 10,3 | 56,5 | 11,1 | 56,1 | 10,7 | 55,6 | 10,4 | 56,4 | 10,6 | 58,2 | 10,6 | 57,6 | 11,1 | 57,3 | 10,6 | 56,8 | 11,0 | 56,6 | 10,7 |
| Hombre, n (%) | 173 | 47,3% | 151 | 43,3% | 159 | 46,8% | 141 | 48,3% | 213 | 48,5% | 176 | 49,9% | 217 | 46,1% | 70 | 51,5% | 187 | 51,0% | 119 | 44,1% | 191 | 45,6% | 1.797 | 47,3% |
| Paquetes-año, m±DE | 27,6 | 20,6 | 26,7 | 24,5 | 25,9 | 18,7 | 23,1 | 17,0 | 23,9 | 21,1 | 27,7 | 23,5 | 27,7 | 23,0 | 28,1 | 22,6 | 29,2 | 24,1 | 24,3 | 19,7 | 22,3 | 18,9 | 26,1 | 21,5 |
| Fumador, n (%) | * | * | * | * | * | * | * | |||||||||||||||||
| actual | 115 | 31,4% | 76 | 21,8% | 101 | 29,7% | 65 | 22,3% | 91 | 20,9% | 100 | 28,3% | 143 | 30,4% | 34 | 25,0% | 67 | 18,3% | 85 | 31,5% | 112 | 26,7% | 989 | 26,0% |
| ex | 110 | 30,1% | 125 | 35,8% | 94 | 27,6% | 66 | 22,7% | 135 | 31,0% | 109 | 30,9% | 163 | 34,6% | 44 | 32,4% | 123 | 33,5% | 84 | 31,1% | 121 | 28,9% | 1174 | 30,9% |
| nunca | 141 | 38,5% | 148 | 42,4% | 145 | 42,6% | 160 | 55,0% | 210 | 48,2% | 144 | 40,8% | 165 | 35,0% | 58 | 42,6% | 177 | 48,2% | 101 | 37,4% | 186 | 44,4% | 1635 | 43,0% |
| Intentado de dejar de fumar, n (%) | 31 | 13,8% | 26 | 13,0% | 18 | 9,2% | 14 | 10,8% | 29 | 12,8% | 20 | 9,7% | 33 | 11,0% | 8 | 10,7% | 14 | 7,4% | 18 | 10,7% | 32 | 13,8% | 243 | 11,3% |
| IMC, m±DE | 27,6* | 4,6 | 27,4 | 4,8 | 28,7* | 4,7 | 26,7 | 4,0 | 26,3* | 4,2 | 27,9* | 4,5 | 27,0 | 5,5 | 26,7 | 3,9 | 27,3 | 4,4 | 26,3* | 3,4 | 28,9 | 16,2 | 27,4 | 6,9 |
| Educación primaria, n (%) | * | * | * | * | * | * | ||||||||||||||||||
| Menos de primarios | 34 | 9,3% | 13 | 3,7% | 56 | 16,5% | 64 | 21,9% | 46 | 10,5% | 37 | 10,5% | 17 | 3,6% | 7 | 5,1% | 45 | 12,3% | 22 | 8,1% | 17 | 4,1% | 358 | 9,4% |
| Primarios (EGB, ESO o similar) | 101 | 27,6% | 112 | 32,1% | 140 | 41,2% | 149 | 51,0% | 135 | 30,8% | 107 | 30,5% | 189 | 40,1% | 39 | 28,7% | 151 | 41,1% | 83 | 30,7% | 187 | 44,7% | 1393 | 36,7% |
| Secundarios (FP, BUP o similar) | 126 | 34,4% | 98 | 28,1% | 83 | 24,4% | 65 | 22,3% | 115 | 26,3% | 130 | 37,0% | 130 | 27,6% | 45 | 33,1% | 108 | 29,4% | 92 | 34,1% | 113 | 27,0% | 1105 | 29,1% |
| Universitarios | 105 | 28,7% | 116 | 33,2% | 61 | 17,9% | 13 | 4,5% | 129 | 29,5% | 75 | 21,4% | 135 | 28,7% | 43 | 31,6% | 63 | 17,2% | 71 | 26,3% | 101 | 24,2% | 912 | 24,0% |
| NS/NC | 0 | 0,0% | 10 | 2,9% | 0 | 0,0% | 1 | 0,3% | 13 | 3,0% | 2 | 0,6% | 0 | 0,0% | 2 | 1,5% | 0 | 0,0% | 2 | 0,7% | 0 | 0,0% | 30 | 0,8% |
| Síntomas, n (%) | ||||||||||||||||||||||||
| tos | 42 | 11,5% | 29 | 8,3% | 32 | 9,4% | 38 | 13,0% | 40 | 9,1% | 44 | 12,5% | 38* | 8,1% | 19 | 14,0% | 50* | 13,7% | 40* | 14,8% | 37 | 8,8% | 409 | 10,8% |
| esputo | 34 | 9,3% | 29 | 8,3% | 22* | 6,5% | 29 | 9,9% | 37 | 8,4% | 43 | 12,2% | 37 | 7,9% | 13 | 9,7% | 54* | 14,8% | 38* | 14,1% | 36 | 8,6% | 372 | 9,8% |
| disnea | 28 | 7,7% | 45* | 12,9% | 30 | 8,8% | 32 | 11,0% | 32* | 7,3% | 34 | 9,6% | 34* | 7,2% | 14 | 10,4% | 52* | 14,3% | 55* | 20,4% | 19* | 4,5% | 375 | 9,9% |
| sibilantes | 162* | 44,3% | 120 | 34,6% | 174* | 51,3% | 100 | 34,2% | 144 | 32,9% | 137 | 38,8% | 206* | 43,8% | 35* | 25,7% | 112* | 30,5% | 103 | 38,1% | 72* | 17,2% | 1365 | 36,0% |
| Asma, n (%) | 37* | 10,1% | 24 | 6,9% | 26 | 7,7% | 26 | 8,9% | 27 | 6,2% | 18 | 5,1% | 22* | 4,7% | 14 | 10,4% | 31 | 8,5% | 18 | 6,7% | 27 | 6,5% | 270 | 7,1% |
| Prueba BD +, n (%) | 12* | 3,3% | 16 | 4,6% | 11* | 3,2% | 13 | 4,5% | 57* | 13,0% | 13 | 3,7% | 24 | 5,1% | 9 | 6,6% | 32 | 8,7% | 17 | 6,3% | 15 | 3,6% | 219 | 5,8% |
| FEV1% predicho, m±DE | 105,7* | 20,3 | 104,4* | 18,5 | 102,2 | 19,4 | 101,9 | 18,4 | 103,2 | 22,3 | 106,7* | 18,2 | 97,5* | 18,1 | 104,1 | 17,5 | 100,0* | 17,9 | 96,1* | 20,0 | 102,7 | 18,0 | 102,1 | 19,3 |
| FVC% predicho, m±DE | 102,6* | 15,6 | 97,5 | 15,7 | 98,3 | 15,6 | 96,5 | 15,7 | 95,8 | 19,0 | 100,5* | 15,1 | 91,6* | 15,2 | 101,0* | 14,4 | 93,0* | 15,0 | 94,1* | 17,5 | 97,7 | 15,4 | 96,8 | 16,3 |
| FEV1/FVC, m±DE | 0,77* | 0,09 | 0,80 | 0,07 | 0,78* | 0,08 | 0,79 | 0,07 | 0,80* | 0,07 | 0,79 | 0,07 | 0,79 | 0,07 | 0,76* | 0,08 | 0,80 | 0,07 | 0,76* | 0,08 | 0,78* | 0,07 | 0,79 | 0,08 |
| Prevalencia EPOC GOLD, n (%) | 50* | 13,7% | 29 | 8,3% | 42 | 12,4% | 29 | 9,9% | 27* | 6,2% | 29 | 8,2% | 38 | 8,1% | 23* | 16,9% | 33 | 9,0% | 40* | 14,8% | 46 | 11,0% | 386 | 10,2% |
| Prevalencia EPOC LIN, n (%) | 37* | 10,1% | 18 | 5,2% | 25 | 7,4% | 15 | 5,1% | 14* | 3,2% | 14 | 4,0% | 19 | 4,0% | 8 | 5,9% | 18 | 4,9% | 23* | 8,5% | 23 | 5,5% | 214 | 5,6% |
NOTA: Media y desviación estándar, salvo especificado lo contrario. BD: broncodilatadora; IMC: Índice de masa corporal; LIN: LÍmite inferior de la normalidad; M: Madrid; NS/NC: No sabe/no contesta.
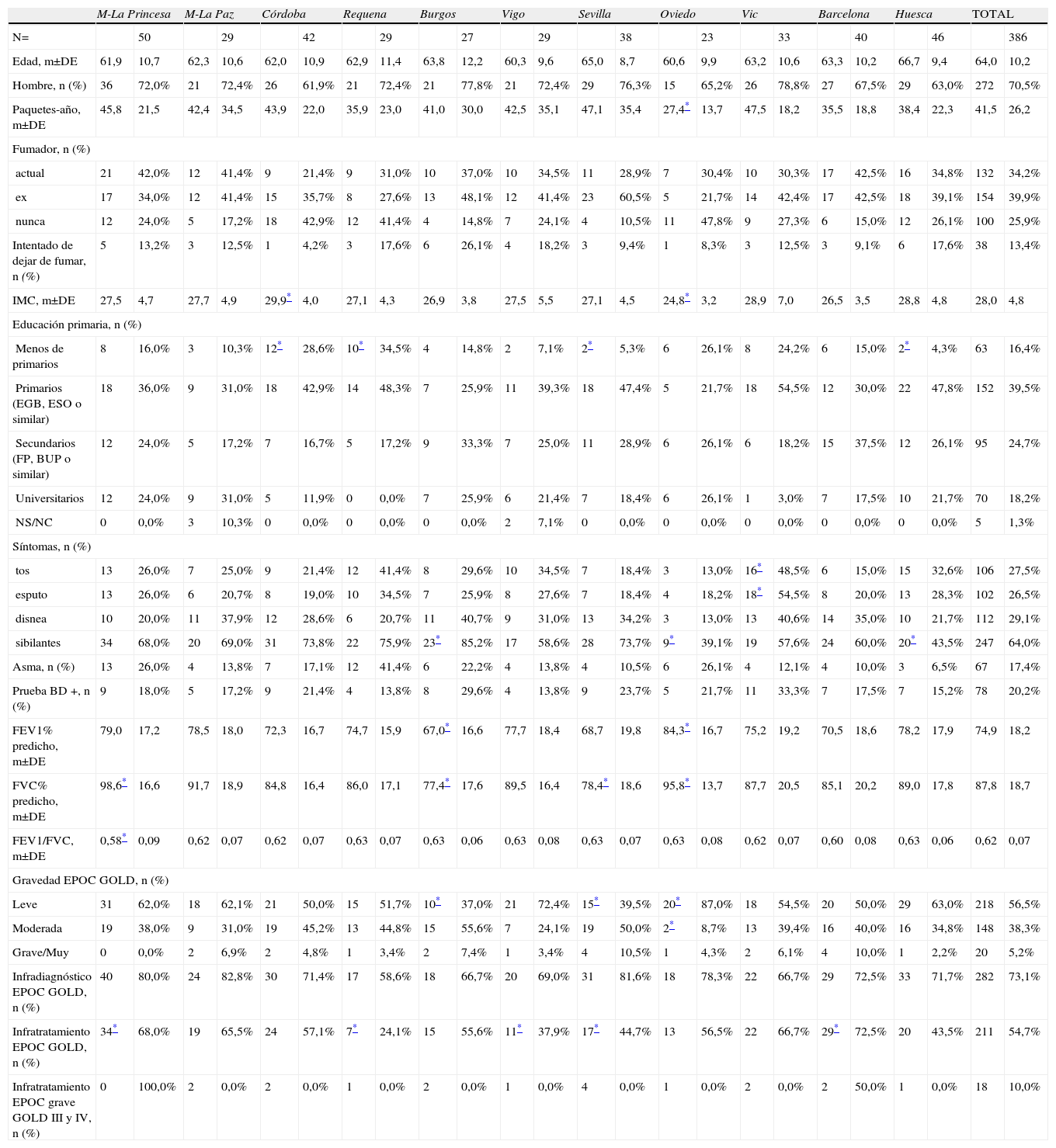
Características de los individuos EPOC (según GOLD) del estudio EPI-SCAN, por áreas
| M-La Princesa | M-La Paz | Córdoba | Requena | Burgos | Vigo | Sevilla | Oviedo | Vic | Barcelona | Huesca | TOTAL | |||||||||||||
| N= | 50 | 29 | 42 | 29 | 27 | 29 | 38 | 23 | 33 | 40 | 46 | 386 | ||||||||||||
| Edad, m±DE | 61,9 | 10,7 | 62,3 | 10,6 | 62,0 | 10,9 | 62,9 | 11,4 | 63,8 | 12,2 | 60,3 | 9,6 | 65,0 | 8,7 | 60,6 | 9,9 | 63,2 | 10,6 | 63,3 | 10,2 | 66,7 | 9,4 | 64,0 | 10,2 |
| Hombre, n (%) | 36 | 72,0% | 21 | 72,4% | 26 | 61,9% | 21 | 72,4% | 21 | 77,8% | 21 | 72,4% | 29 | 76,3% | 15 | 65,2% | 26 | 78,8% | 27 | 67,5% | 29 | 63,0% | 272 | 70,5% |
| Paquetes-año, m±DE | 45,8 | 21,5 | 42,4 | 34,5 | 43,9 | 22,0 | 35,9 | 23,0 | 41,0 | 30,0 | 42,5 | 35,1 | 47,1 | 35,4 | 27,4* | 13,7 | 47,5 | 18,2 | 35,5 | 18,8 | 38,4 | 22,3 | 41,5 | 26,2 |
| Fumador, n (%) | ||||||||||||||||||||||||
| actual | 21 | 42,0% | 12 | 41,4% | 9 | 21,4% | 9 | 31,0% | 10 | 37,0% | 10 | 34,5% | 11 | 28,9% | 7 | 30,4% | 10 | 30,3% | 17 | 42,5% | 16 | 34,8% | 132 | 34,2% |
| ex | 17 | 34,0% | 12 | 41,4% | 15 | 35,7% | 8 | 27,6% | 13 | 48,1% | 12 | 41,4% | 23 | 60,5% | 5 | 21,7% | 14 | 42,4% | 17 | 42,5% | 18 | 39,1% | 154 | 39,9% |
| nunca | 12 | 24,0% | 5 | 17,2% | 18 | 42,9% | 12 | 41,4% | 4 | 14,8% | 7 | 24,1% | 4 | 10,5% | 11 | 47,8% | 9 | 27,3% | 6 | 15,0% | 12 | 26,1% | 100 | 25,9% |
| Intentado de dejar de fumar, n (%) | 5 | 13,2% | 3 | 12,5% | 1 | 4,2% | 3 | 17,6% | 6 | 26,1% | 4 | 18,2% | 3 | 9,4% | 1 | 8,3% | 3 | 12,5% | 3 | 9,1% | 6 | 17,6% | 38 | 13,4% |
| IMC, m±DE | 27,5 | 4,7 | 27,7 | 4,9 | 29,9* | 4,0 | 27,1 | 4,3 | 26,9 | 3,8 | 27,5 | 5,5 | 27,1 | 4,5 | 24,8* | 3,2 | 28,9 | 7,0 | 26,5 | 3,5 | 28,8 | 4,8 | 28,0 | 4,8 |
| Educación primaria, n (%) | ||||||||||||||||||||||||
| Menos de primarios | 8 | 16,0% | 3 | 10,3% | 12* | 28,6% | 10* | 34,5% | 4 | 14,8% | 2 | 7,1% | 2* | 5,3% | 6 | 26,1% | 8 | 24,2% | 6 | 15,0% | 2* | 4,3% | 63 | 16,4% |
| Primarios (EGB, ESO o similar) | 18 | 36,0% | 9 | 31,0% | 18 | 42,9% | 14 | 48,3% | 7 | 25,9% | 11 | 39,3% | 18 | 47,4% | 5 | 21,7% | 18 | 54,5% | 12 | 30,0% | 22 | 47,8% | 152 | 39,5% |
| Secundarios (FP, BUP o similar) | 12 | 24,0% | 5 | 17,2% | 7 | 16,7% | 5 | 17,2% | 9 | 33,3% | 7 | 25,0% | 11 | 28,9% | 6 | 26,1% | 6 | 18,2% | 15 | 37,5% | 12 | 26,1% | 95 | 24,7% |
| Universitarios | 12 | 24,0% | 9 | 31,0% | 5 | 11,9% | 0 | 0,0% | 7 | 25,9% | 6 | 21,4% | 7 | 18,4% | 6 | 26,1% | 1 | 3,0% | 7 | 17,5% | 10 | 21,7% | 70 | 18,2% |
| NS/NC | 0 | 0,0% | 3 | 10,3% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 2 | 7,1% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 5 | 1,3% |
| Síntomas, n (%) | ||||||||||||||||||||||||
| tos | 13 | 26,0% | 7 | 25,0% | 9 | 21,4% | 12 | 41,4% | 8 | 29,6% | 10 | 34,5% | 7 | 18,4% | 3 | 13,0% | 16* | 48,5% | 6 | 15,0% | 15 | 32,6% | 106 | 27,5% |
| esputo | 13 | 26,0% | 6 | 20,7% | 8 | 19,0% | 10 | 34,5% | 7 | 25,9% | 8 | 27,6% | 7 | 18,4% | 4 | 18,2% | 18* | 54,5% | 8 | 20,0% | 13 | 28,3% | 102 | 26,5% |
| disnea | 10 | 20,0% | 11 | 37,9% | 12 | 28,6% | 6 | 20,7% | 11 | 40,7% | 9 | 31,0% | 13 | 34,2% | 3 | 13,0% | 13 | 40,6% | 14 | 35,0% | 10 | 21,7% | 112 | 29,1% |
| sibilantes | 34 | 68,0% | 20 | 69,0% | 31 | 73,8% | 22 | 75,9% | 23* | 85,2% | 17 | 58,6% | 28 | 73,7% | 9* | 39,1% | 19 | 57,6% | 24 | 60,0% | 20* | 43,5% | 247 | 64,0% |
| Asma, n (%) | 13 | 26,0% | 4 | 13,8% | 7 | 17,1% | 12 | 41,4% | 6 | 22,2% | 4 | 13,8% | 4 | 10,5% | 6 | 26,1% | 4 | 12,1% | 4 | 10,0% | 3 | 6,5% | 67 | 17,4% |
| Prueba BD +, n (%) | 9 | 18,0% | 5 | 17,2% | 9 | 21,4% | 4 | 13,8% | 8 | 29,6% | 4 | 13,8% | 9 | 23,7% | 5 | 21,7% | 11 | 33,3% | 7 | 17,5% | 7 | 15,2% | 78 | 20,2% |
| FEV1% predicho, m±DE | 79,0 | 17,2 | 78,5 | 18,0 | 72,3 | 16,7 | 74,7 | 15,9 | 67,0* | 16,6 | 77,7 | 18,4 | 68,7 | 19,8 | 84,3* | 16,7 | 75,2 | 19,2 | 70,5 | 18,6 | 78,2 | 17,9 | 74,9 | 18,2 |
| FVC% predicho, m±DE | 98,6* | 16,6 | 91,7 | 18,9 | 84,8 | 16,4 | 86,0 | 17,1 | 77,4* | 17,6 | 89,5 | 16,4 | 78,4* | 18,6 | 95,8* | 13,7 | 87,7 | 20,5 | 85,1 | 20,2 | 89,0 | 17,8 | 87,8 | 18,7 |
| FEV1/FVC, m±DE | 0,58* | 0,09 | 0,62 | 0,07 | 0,62 | 0,07 | 0,63 | 0,07 | 0,63 | 0,06 | 0,63 | 0,08 | 0,63 | 0,07 | 0,63 | 0,08 | 0,62 | 0,07 | 0,60 | 0,08 | 0,63 | 0,06 | 0,62 | 0,07 |
| Gravedad EPOC GOLD, n (%) | ||||||||||||||||||||||||
| Leve | 31 | 62,0% | 18 | 62,1% | 21 | 50,0% | 15 | 51,7% | 10* | 37,0% | 21 | 72,4% | 15* | 39,5% | 20* | 87,0% | 18 | 54,5% | 20 | 50,0% | 29 | 63,0% | 218 | 56,5% |
| Moderada | 19 | 38,0% | 9 | 31,0% | 19 | 45,2% | 13 | 44,8% | 15 | 55,6% | 7 | 24,1% | 19 | 50,0% | 2* | 8,7% | 13 | 39,4% | 16 | 40,0% | 16 | 34,8% | 148 | 38,3% |
| Grave/Muy | 0 | 0,0% | 2 | 6,9% | 2 | 4,8% | 1 | 3,4% | 2 | 7,4% | 1 | 3,4% | 4 | 10,5% | 1 | 4,3% | 2 | 6,1% | 4 | 10,0% | 1 | 2,2% | 20 | 5,2% |
| Infradiagnóstico EPOC GOLD, n (%) | 40 | 80,0% | 24 | 82,8% | 30 | 71,4% | 17 | 58,6% | 18 | 66,7% | 20 | 69,0% | 31 | 81,6% | 18 | 78,3% | 22 | 66,7% | 29 | 72,5% | 33 | 71,7% | 282 | 73,1% |
| Infratratamiento EPOC GOLD, n (%) | 34* | 68,0% | 19 | 65,5% | 24 | 57,1% | 7* | 24,1% | 15 | 55,6% | 11* | 37,9% | 17* | 44,7% | 13 | 56,5% | 22 | 66,7% | 29* | 72,5% | 20 | 43,5% | 211 | 54,7% |
| Infratratamiento EPOC grave GOLD III y IV, n (%) | 0 | 100,0% | 2 | 0,0% | 2 | 0,0% | 1 | 0,0% | 2 | 0,0% | 1 | 0,0% | 4 | 0,0% | 1 | 0,0% | 2 | 0,0% | 2 | 50,0% | 1 | 0,0% | 18 | 10,0% |
NOTA: Media y desviación estándar, salvo especificado lo contrario; Prevalencia EPOC GOLD si FEV1/FVC<0,70. BD: broncodilatadora; IMC: índice de masa corporal; LIN: lÍmite inferior de la normalidad; M: Madrid; NS/NC: no sabe/no contesta.
De un total de 4.274 sujetos elegidos al azar por contacto por teléfono en los once centros, 3.885 (90,9%) aceptó participar en el estudio y finalmente una muestra de 3.802 (88,9%) estaba disponible para el análisis (conjunto mínimo de datos sobre el sexo, la edad y la función pulmonar). Tal como se ha presentado previamente3, los 389 (9,1%) individuos que se negaron a participar en la encuesta eran ligeramente mayores y más frecuentemente mujeres, incluyendo más nunca-fumadores y ex-fumadores. Las características sociodemográficas y clínicas de los 3.802 participantes por área en el estudio EPI-SCAN se presentan en la tabla 1. No existieron diferencias por áreas en la distribución por edad, sexo o paquetes-año, aunque sí hubo diferencias significativas por estatus tabáquico, índice de masa corporal (IMC) o nivel de estudios en algunas áreas respecto al total (p<0,05).
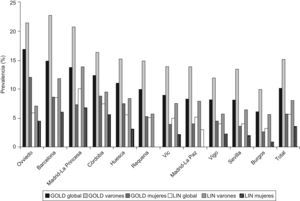
La prevalencia de EPOC según GOLD fue de 10,2% (IC 95% 9,2–11,1) y según el LIN de 5,6% (IC 95% 4,9–6,4). La razón de prevalencias de EPOC según criterios GOLD entre las áreas participantes en EPI-SCAN fue de 2,7 veces, con un máximo en Asturias (16,9%) y un mínimo en Burgos (6,2%) (p<0,05) (tabla 1); asimismo, la razón de prevalencias de prevalencias utilizando el LIN fue de 3,1 veces, pero con un máximo en Madrid-La Princesa (10,1%) y un mínimo en Burgos (3,2%) (p<0,05).
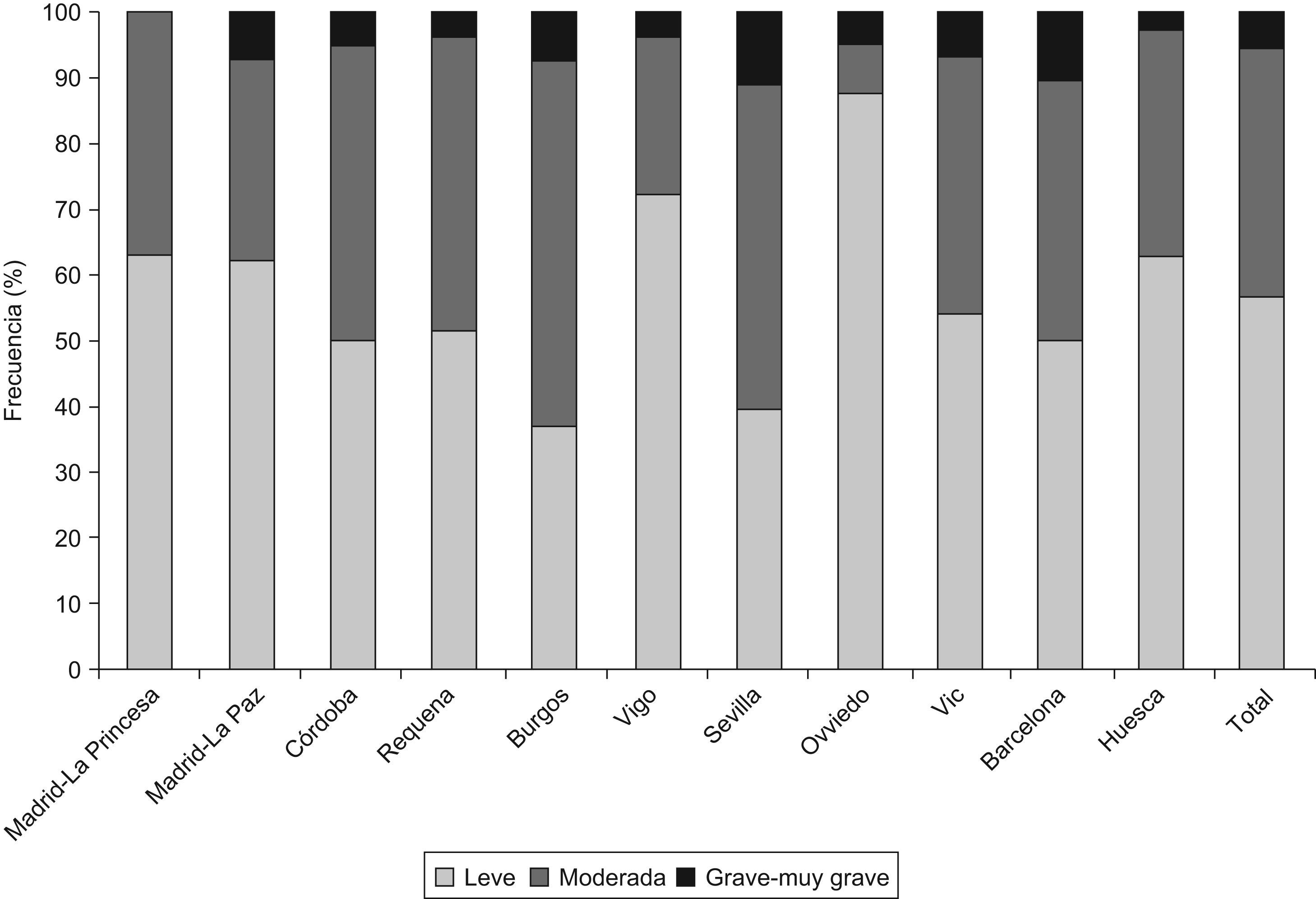
En la tabla 2 se presentan las características de los individuos EPOC (según GOLD) del estudio EPI-SCAN. De nuevo existen sutiles diferencias por áreas en comparación con el total, aunque menores. Así respecto al global, en Oviedo sus pacientes con EPOC presentaban una menor media de paquetes-año, en Córdoba y Oviedo tenían un menor IMC, y se mantenían las diferencias en nivel de estudios (p<0,05). Es de interés destacar que las variaciones en gravedad de EPOC (fig. 1), infradiagnóstico (58,6 a 72,8%) e infratratamiento por áreas (24,1 a 72,5%) fueron substanciales (p<0,05). Por el contrario, puede comprobarse que la estructura por edad y sexo de los individuos con EPOC es casi idéntica en todas las áreas, y que las variaciones en talla, peso, IMC y nivel de estudios son mínimas. Las variaciones en la distribución de fumadores y exfumadores, tanto en la muestra de participantes poblacionales (tabla 1), como en aquellos con obstrucción al flujo aéreo compatible con EPOC (tabla 2) son también menores.
Una prueba broncodilatadora positiva se observó en el 5,8% de los participantes y en un 20,2% de aquellos con EPOC. Como se aprecia en las tablas 1 y 2, las variaciones por área en la prueba broncodilatadora positiva fueron amplias y sin consistencia. En el total de participantes, una diferencia de cuatro veces se aprecia en la prueba broncodilatadora positiva entre el máximo de 13,0% en Vigo y el mínimo de 3,2% en Córdoba (tabla 1). Sin embargo, en aquellos con EPOC la diferencia es solo de 2,1 veces entre el máximo de 29,6% en Vigo y el mínimo de 13,8% en Burgos (tabla 2).
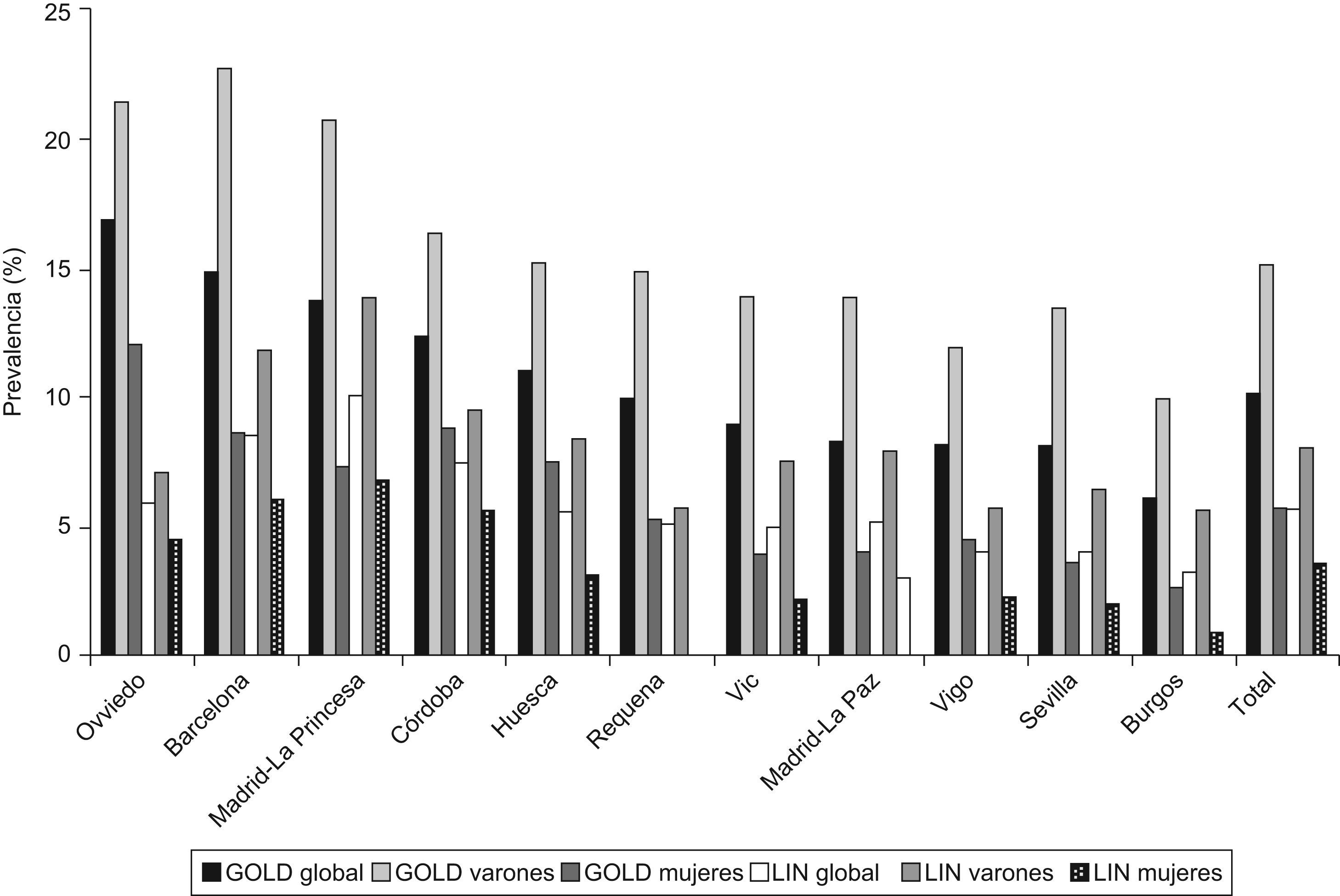
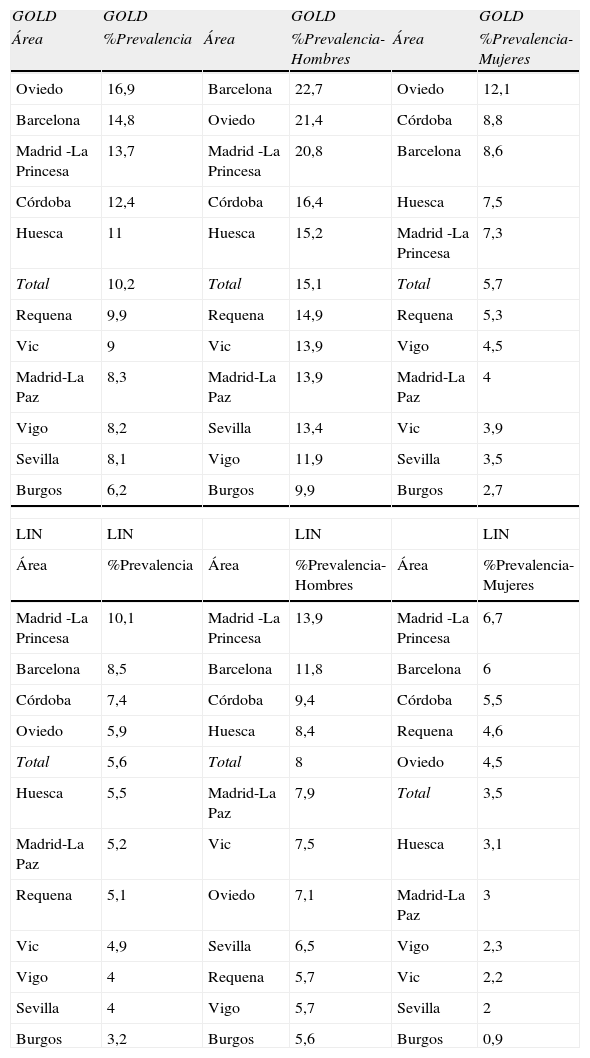
El orden de prevalencias de EPOC por áreas no se mantuvo en ambos sexos ni por edades en cada área (tabla 3 y fig. 2) con ninguna de las definiciones utilizadas, a excepción de Burgos, que consistentemente fue el área con prevalencia de EPOC más baja, estimada tanto con GOLD como con LIN, y en ambos sexos.
Ranking de prevalencias de EPOC por área según GOLD y LIN, total y por sexo
| GOLD | GOLD | GOLD | GOLD | ||
| Área | %Prevalencia | Área | %Prevalencia-Hombres | Área | %Prevalencia-Mujeres |
| Oviedo | 16,9 | Barcelona | 22,7 | Oviedo | 12,1 |
| Barcelona | 14,8 | Oviedo | 21,4 | Córdoba | 8,8 |
| Madrid -La Princesa | 13,7 | Madrid -La Princesa | 20,8 | Barcelona | 8,6 |
| Córdoba | 12,4 | Córdoba | 16,4 | Huesca | 7,5 |
| Huesca | 11 | Huesca | 15,2 | Madrid -La Princesa | 7,3 |
| Total | 10,2 | Total | 15,1 | Total | 5,7 |
| Requena | 9,9 | Requena | 14,9 | Requena | 5,3 |
| Vic | 9 | Vic | 13,9 | Vigo | 4,5 |
| Madrid-La Paz | 8,3 | Madrid-La Paz | 13,9 | Madrid-La Paz | 4 |
| Vigo | 8,2 | Sevilla | 13,4 | Vic | 3,9 |
| Sevilla | 8,1 | Vigo | 11,9 | Sevilla | 3,5 |
| Burgos | 6,2 | Burgos | 9,9 | Burgos | 2,7 |
| LIN | LIN | LIN | LIN | ||
| Área | %Prevalencia | Área | %Prevalencia-Hombres | Área | %Prevalencia-Mujeres |
| Madrid -La Princesa | 10,1 | Madrid -La Princesa | 13,9 | Madrid -La Princesa | 6,7 |
| Barcelona | 8,5 | Barcelona | 11,8 | Barcelona | 6 |
| Córdoba | 7,4 | Córdoba | 9,4 | Córdoba | 5,5 |
| Oviedo | 5,9 | Huesca | 8,4 | Requena | 4,6 |
| Total | 5,6 | Total | 8 | Oviedo | 4,5 |
| Huesca | 5,5 | Madrid-La Paz | 7,9 | Total | 3,5 |
| Madrid-La Paz | 5,2 | Vic | 7,5 | Huesca | 3,1 |
| Requena | 5,1 | Oviedo | 7,1 | Madrid-La Paz | 3 |
| Vic | 4,9 | Sevilla | 6,5 | Vigo | 2,3 |
| Vigo | 4 | Requena | 5,7 | Vic | 2,2 |
| Sevilla | 4 | Vigo | 5,7 | Sevilla | 2 |
| Burgos | 3,2 | Burgos | 5,6 | Burgos | 0,9 |
GOLD: Global Initiative for Obstructive Lung Disease; LIN: Límite inferior de la normalidad.
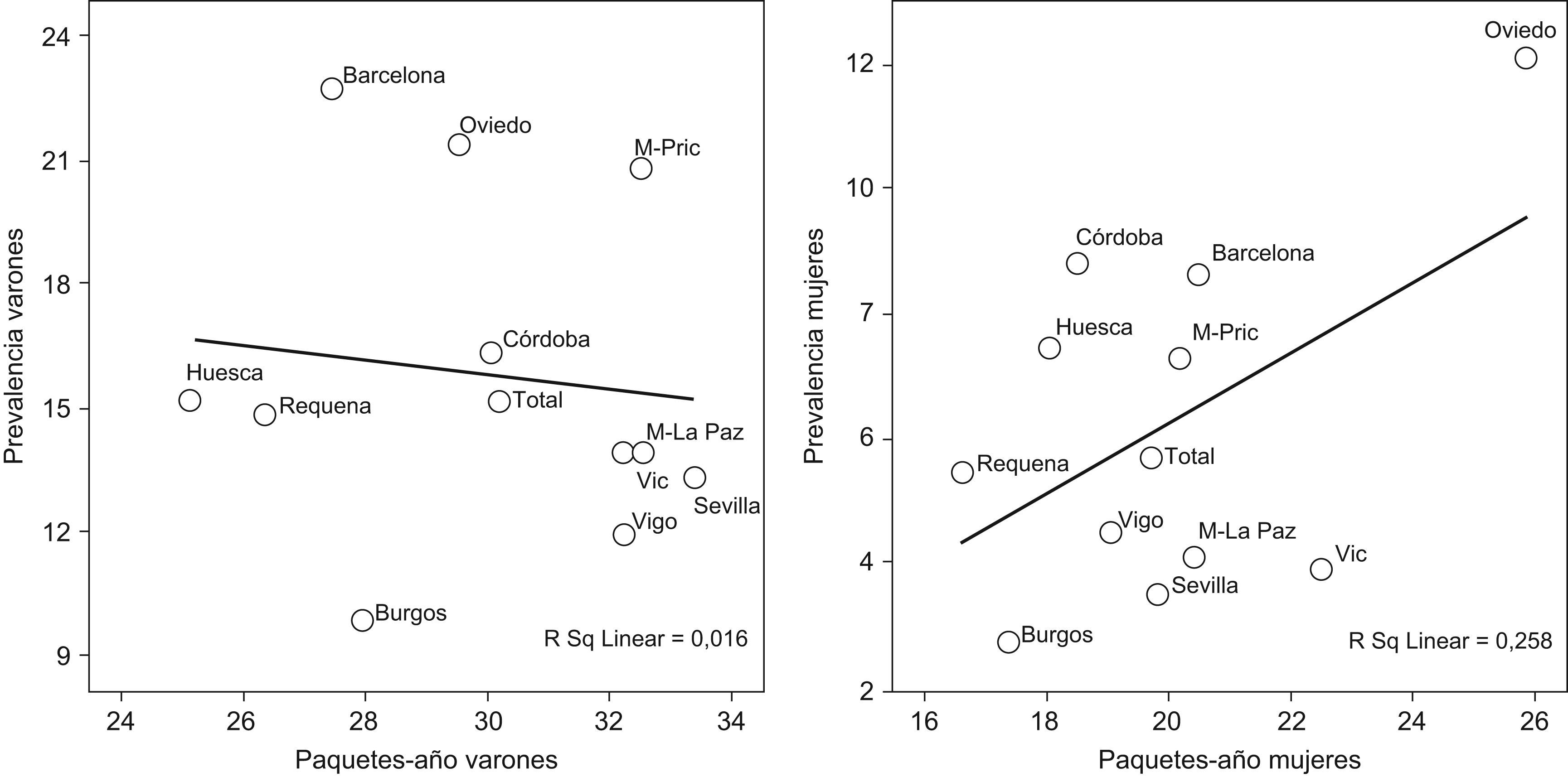
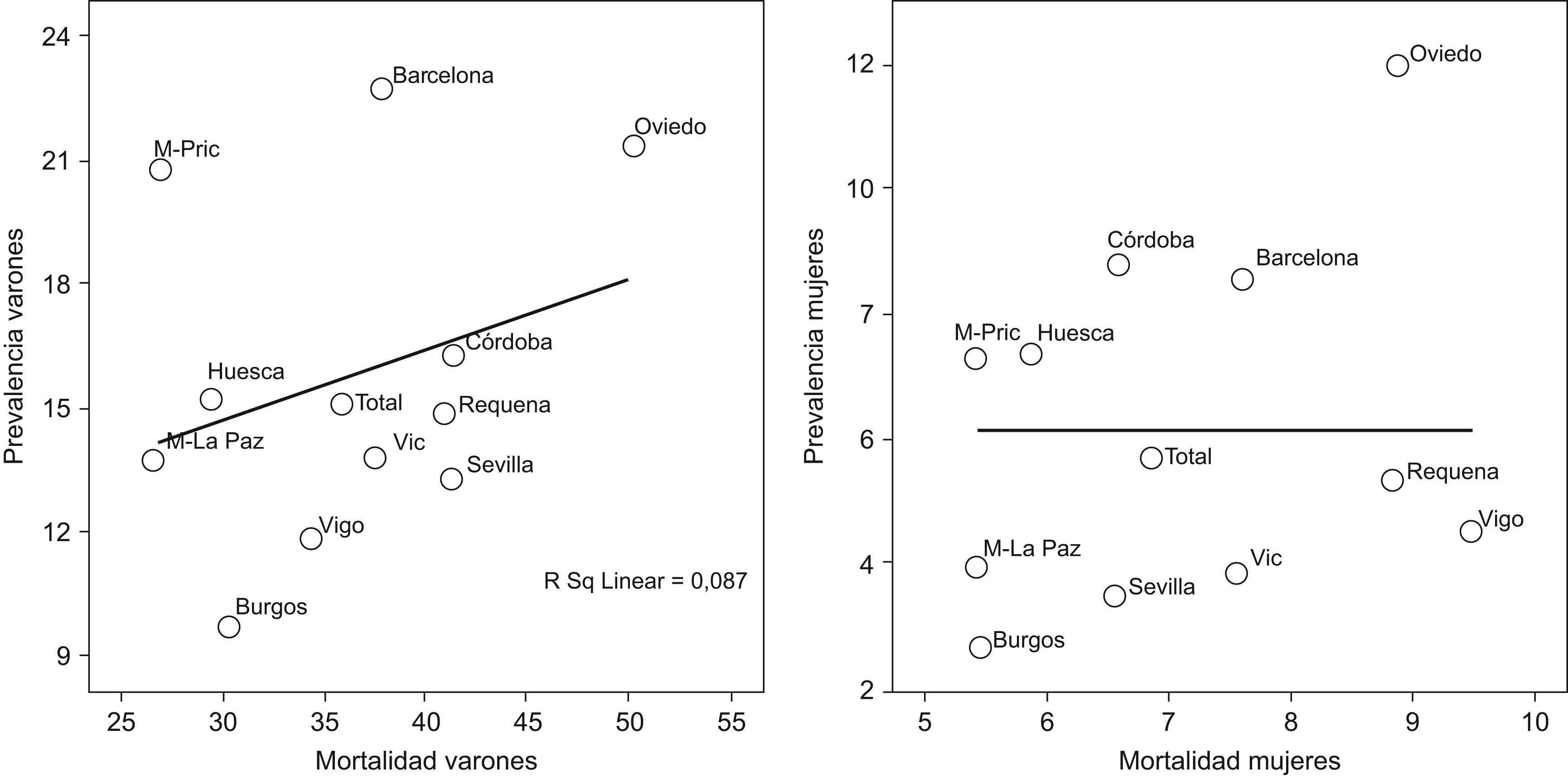
Es por ello de interés observar que la exposición acumulada al tabaco medida por paquetes-año [correlación de Spearman −0,305 en hombres p=0,336 y Spearman 0,210 en mujeres p=0,513] (fig. 3), no explica en gran parte la variabilidad por áreas geográficas de la prevalencia de EPOC. Tampoco se observa correlación entre las prevalencias por áreas con las tasas de mortalidad publicadas por comunidad autónoma, con coeficientes de Spearman 0,193 en hombres p=0,547 y de 0,190 en mujeres p=0,555 (fig. 4).
Este estudio describe importantes variaciones geográficas en la distribución actual de la prevalencia de EPOC en España, con una magnitud de entre el doble y el triple respecto al área de menor prevalencia. La falta de homogeneidad de la distribución poblacional de la EPOC, tanto a nivel internacional como nacional, ya ha sido descrita previamente por otros autores, al igual que ocurre en el asma. Sin embargo, entre las aportaciones novedosas de este artículo se incluyen el determinar que esta variabilidad de la prevalencia de EPOC por áreas es cambiante en hombres y mujeres y también según la definición espirométrica utilizada, con absoluta falta de consistencia entre los listados por intervalo, y que la exposición acumulada de tabaco medida por paquetes-año a nivel individual no puede por sí sola explicar esta variabilidad. Tampoco se encontró una relación con la mortalidad registrada por EPOC en un análisis ecológico. Es interesante observar en un sistema de salud gratuito y universal como el español, que tanto el infradiagnóstico como el infratratamiento de EPOC por área también sufrían una gran variabilidad no explicada por estos factores.
LimitacionesEste subanálisis del estudio EPI-SCAN presenta una serie de limitaciones a considerar. La variabilidad observada se refiere a las once áreas participantes, que no pretenden ser representativas de España, pues el reclutamiento de centros e investigadores se hizo por conveniencia. Es posible que existan áreas no muestreadas con prevalencias de EPOC más extremas, por lo que el intervalo verdadero en España puede ser aún mayor del 2,4 o 2,7 observado. Aunque la tasa de respuesta global del estudio fue muy satisfactoria (89,1%) es posible que la tasa de no respuesta dentro de cada área sea diferencial, y genere un sesgo de información de difícil interpretación. El tamaño muestral del EPI-SCAN se realizó en base a la prevalencia global nacional esperada, y aunque el cálculo de poder estadístico a posteriori es razonable, se presentan el intervalo de confianza para la mayoría de estimadores por área, pues la escasa (y variable) muestra por zona geográfica implica una menor precisión. Variaciones en variables confusoras y determinantes de EPOC y otras enfermedades crónicas, así como la diferente distribución de variables como la edad, sexo, tabaquismo o contaminación entre otras, pueden estar sesgadas pero se espera produzcan un error no diferencial. El fenotipo asma puede ser un confusor adicional en la explicación de la variabilidad en la prevalencia de EPOC en las 11 áreas participantes en EPI-SCAN. Se conoce que las sibilancias no son un síntoma exclusivo de asma, sino que ocurren con frecuencia en EPOC10,11. Así, casi dos de cada tres participantes EPI-SCAN con obstrucción aérea compatible con EPOC (64,0%) refieren sibilancias alguna vez, aunque se observa una gran variabilidad por área (tabla 2). En cualquier caso, las prevalencias de respuesta broncodilatadora positiva halladas en todas las áreas resultan inferiores al 53,9% descrito en pacientes clínicos con diagnóstico previo de EPOC incluidos en un reciente ensayo multinacional18. De manera similar, el 7,1% de los participantes y un 17,4% de aquellos con EPOC declararon padecer/haber padecido asma, de nuevo resultados razonables según los estudios ECRHS-Estudio Europeo del Asma en España y otros, existiendo una vez más enormes variaciones por área e inconsistencias. Debe pues resaltarse la ausencia de consistencia en la distribución por áreas entre las frecuencias respectiva de sibilancias, asma autodeclarada y prueba broncodilatadora, y que aunque a nivel individual y clínico su evaluación es fundamental, a nivel poblacional las definiciones actuales de EPOC se basan en un diagnóstico espirométrico únicamente.
Deben resaltarse las diferencias encontradas en la prevalencia de EPOC entre algunos centros de una misma comunidad autónoma, en Madrid en Hospital de La Princesa frente a Hospital La Paz, y en Catalunya en Barcelona frente a Vic, que en parte pueden ser debidas a variaciones en la estructura de sexo, edad, tabaquismo, asma o a otras variables no estudiadas tales como hábitat urbano o rural, exposiciones ambientales, laborales u otras. Finalmente, y aunque existen datos de mortalidad en áreas menores en algunas comunidades, la actual es una comparación ecológica con tasas de mortalidad por comunidades autónomas, con probablemente muchos factores de confusión no estudiados.
Resumen de la literatura previaTal como se mencionado previamente, aunque existen otros estudios puntuales en España, resumidos en otras fuentes9,19, el único estudio previo que ha determinado variaciones geográficas en España es el estudio IBERPOC. IBERPOC describió en 1997 importantes variaciones geográficas en la prevalencia de EPOC entre sus siete áreas participantes (Burgos, Cáceres, Madrid, Manlleu, Oviedo, Sevilla y Vizcaya)4, desde solo el 4,9% en Cáceres hasta 18% en Manlleu, es decir un intervalo de 3,7, posiblemente relacionadas con factores ambientales o laborales no estudiados. Probablemente tenga poco sentido plantear de nuevo hipótesis sobre posibles influencias atribuibles a diferencias en el hábito de fumar, los factores ambientales y de diagnóstico, o las prácticas de codificación, o que también pueden existir diferencias biológicas o genéticas en el riesgo de EPOC por área en España4. Es posible y probable que la variabilidad en la distribución de las enfermedades crónicas en la población sea en parte explicada por factores conocidos o desconocidos aún, pero parece una variabilidad real. Por ejemplo, la variación en la distribución de EPOC en las cinco ciudades latinoamericanas participantes en el estudio PLATINO se ha relacionado con la altura sobre el nivel del mar10. Al contrario que en otras enfermedades20, la literatura respiratoria existente es muy pobre en lo que respecta a variaciones de función pulmonar en áreas pequeñas, centrándose en estudios de contaminación ambiental casi exclusivamente21. Por ejemplo, en los Estados Unidos se ha descrito que la recurrencia de síncope del 9,4% presenta una elevada variación regional en todos los subgrupos raciales/étnicos y persiste después del ajuste por las características individuales del paciente22. El desarrollo de nuevos métodos estadísticos, ya aplicados en mortalidad por EPOC en el Reino Unido, sin duda serán bienvenidos23. En Dinamarca, el uso de oxigenoterapia domiciliaria (OTD) por EPOC oscila entre 14 y 53 por 100.000 en sus 16 condados, y el uso fue mayor en los condados donde los médicos generalistas prescriben OTD. La adhesión a las directrices nacionales para la OTD fue del 34,4% para el conjunto de Dinamarca, pero variaba a nivel regional del 14 al 63%. Probablemente, proyectos en curso como la primera auditoría clínica en EPOC que se va a realizar en España (AUDIPOC)24 o el de la validación de los estándares de calidad asistencial de la EPOC (VESALIO)25, y otros estudios futuros, permitan determinar la distribución heterogénea de la EPOC y sus determinantes en España.
En aquellas enfermedades con un elevado infradiagnóstico como es el caso de la EPOC, puede ocurrir el llamado «fenómeno del iceberg», metáfora en la que el número de casos conocidos de la enfermedad se ve descompensado por el peso de los que quedan por descubrir. La EPOC se asocia con un infradiagnóstico y un diagnóstico erróneo importantes, y en consecuencia con infratratamiento o mal tratamiento26. El fenómeno del iceberg a menudo frustra los intentos de evaluar la carga de la enfermedad, en comparación con otras enfermedades crónicas. También dificulta determinar la necesidad de servicios de salud, así como la selección de casos representativos para el estudio y la inclusión en ensayos clínicos. Esto conduce a lo que se ha denominado la «falacia clínica» que es una visión errónea de la naturaleza y causas de una enfermedad por los resultados del estudio de una minoría de pacientes que reciben tratamiento clínico. Solo un enfoque poblacional puede superar la «falacia clínica» de nuestro conocimiento actual de la distribución y la historia natural de la EPOC.
ConclusionesExisten importantes variaciones en la distribución de la EPOC en España, tanto en prevalencia como en infradiagnóstico e infratratamiento. La confirmación de estas variaciones e indagar en las causas de esta heterogeneidad deben permitir, no solo una distribución más racional de recursos sanitarios, sino también la instauración de iniciativas educacionales y correctivas para reducir los efectos del tabaco y otros factores causantes de EPOC.
El promotor del estudio EPI-SCAN es GlaxoSmithKline S.A. Debe reconocerse el enorme trabajo de todos los investigadores y colaboradores en cada centro, y agradecer la colaboración desinteresada y voluntaria de los participantes.
Julio Ancochea, Hospital La Princesa (Madrid)
Guadalupe Sánchez, Departamento Médico, GlaxoSmithkline S.A. (Madrid)
Enric Duran-Tauleria, Institut Municipal d’Investigació Mèdica (IMIM) (Barcelona)
Francisco García Río, Hospital La Paz (Madrid)
Marc Miravitlles, Hospital Clínic (Barcelona)
Luis Muñoz, Hospital Reina Sofía (Córdoba)
Vıctor Sobradillo-Peña, Hospital de Cruces (Bilbao)
Joan B Soriano, Fundació Caubet-CIMERA Illes Balears (Mallorca)
Julio Ancochea, Hospital La Princesa (Madrid)
Luis Borderías, Hospital San Jorge (Huesca)
Francisco García Río, Hospital La Paz (Madrid)
Jaime Martínez, Hospital Central de Asturias (Oviedo)
Teodoro Montemayor, Hospital Virgen de la Macarena (Sevilla)
Luis Muñoz, Hospital Reina Sofía (Córdoba)
Luis Piñeiro, Hospital Xeral Cies (Vigo)
Joan Serra, Hospital General de Vic (Vic, Barcelona)
Juan José Soler-Cataluña, Hospital General de Requena (Requena, Valencia)
Antoni Torres, Hospital Clínic (Barcelona)
Jose Luis Viejo, Hospital General Yagüe (Burgos)


![Prevalencia de EPOC por área (eje Y) según paquetes-año del área (eje X), [correlación de Spearman −0,305 en hombres p=0,336 y Spearman 0,210 en mujeres p=0,513]. Prevalencia de EPOC por área (eje Y) según paquetes-año del área (eje X), [correlación de Spearman −0,305 en hombres p=0,336 y Spearman 0,210 en mujeres p=0,513].](https://static.elsevier.es/multimedia/03002896/0000004600000010/v1_201305150259/S0300289610001900/v1_201305150259/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w98FxLWLw1xoW2PaQDYY7RZU=)
![Prevalencia de EPOC por área (eje Y) según tasa de mortalidad ajustada en la Comunidad Autónoma (Estrategia) (eje X) [correlación de Spearman 0,193 en hombres p=0,547 y Spearman 0,190 en mujeres p=0,555]. Prevalencia de EPOC por área (eje Y) según tasa de mortalidad ajustada en la Comunidad Autónoma (Estrategia) (eje X) [correlación de Spearman 0,193 en hombres p=0,547 y Spearman 0,190 en mujeres p=0,555].](https://static.elsevier.es/multimedia/03002896/0000004600000010/v1_201305150259/S0300289610001900/v1_201305150259/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w98FxLWLw1xoW2PaQDYY7RZU=)








