La linfangioleiomiomatosis (LAM) es una enfermedad rara caracterizada por la proliferación anormal de células musculares lisas inmaduras y una destrucción quística del pulmón, que condiciona el pronóstico de la enfermedad. Los angiomiolipomas renales suelen ser muy frecuentes en esta enfermedad, generalmente de curso asintomático, salvo complicaciones.
Ante la ausencia de un tratamiento curativo, las últimas publicaciones reflejan resultados esperanzadores en la terapia molecular para evitar el deterioro funcional y el control del tamaño de los angiomiolipomas. Entre estas terapias destacan los inhibidores del complejo mTOR, sobre todo sirolimus.
Presentamos un caso clínico de una paciente diagnosticada de LAM sometida a trasplante pulmonar con reducción del tamaño del angiomiolipoma renal tras el tratamiento con el inhibidor mTOR everolimus.
Lymphangioleiomyomatosis (LAM) is a rare disease characterized by abnormal proliferation of immature smooth muscle cells and cystic lung destruction, which determines the prognosis of the disease. The kidney angiomyolipomas are usually very common in this disease and are usually asymptomatic unless complications arise. In the absence of a curative treatment, recent publications show promising results in molecular therapy to prevent functional decline and to control the size of the angiomyolipomas. These therapies include mTOR complex inhibitors, especially sirolimus.
We report a case of a patient diagnosed with LAM who underwent lung transplantation with reduction of renal angiomyolipoma size after treatment with the mTOR inhibitor everolimus.
La linfangioleiomiomatosis (LAM) es una enfermedad rara, casi exclusiva de mujeres en edad fértil y caracterizada por la proliferación anormal de células musculares lisas inmaduras y una destrucción quística del pulmón. Es una enfermedad con una base genética en la que se ven implicados los genes TSC1 y 2 (tuberous sclerosis complex). Estos genes, a través del complejo enzimático mTOR (mammalian target of rapamycin), son los encargados del control de la proliferación y supervivencia celular1-3.
La afectación pulmonar suele ser la responsable de la clínica mientras que la afectación extrapulmonar, fundamentalmente angiomiolipomas renales, suele ser asintomática. En la actualidad no existe un tratamiento curativo. En pacientes con mala evolución clínica y progresión hacia la insuficiencia respiratoria, el trasplante pulmonar (TxP) puede ser una alternativa. Las últimas publicaciones reflejan resultados esperanzadores en la terapia molecular1-6, entre ellos los inhibidores del complejo mTOR —sirolimus y everolimus—. Sin embargo, estos fármacos no están exentos de potenciales efectos adversos y su aplicación no se ha generalizado fuera de los ensayos clínicos.
Casi todas las publicaciones que tratan sobre LAM y fármacos inhibidores del complejo mTOR se refieren a rapamicina (sirolimus). En esta publicación presentamos un caso clínico de una paciente diagnosticada de LAM sometida a TxP con reducción del tamaño del angiomiolipoma renal tras el tratamiento con el inhibidor mTOR everolimus.
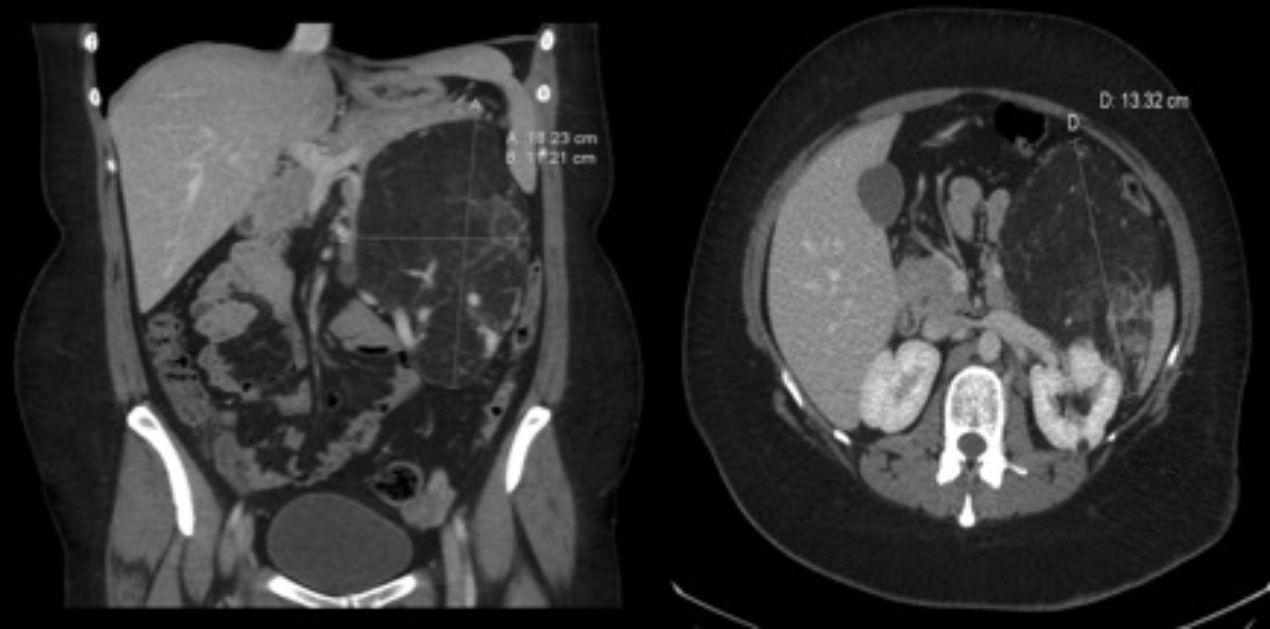
Observación clínicaMujer de 33 años derivada como candidata a TxP por neumotórax derecho persistente a pesar de drenaje endotorácico. Entre sus antecedentes destacaba el ser exfumadora con consumo acumulado poco significativo, neumotórax derecho en el año previo a la consulta y recidiva precoz tras la retirada del drenaje endotorácico. Inicialmente no presentaba insuficiencia respiratoria y en la espirometría se detectó una obstrucción grave con atrapamiento aéreo e hiperinflación. En los estudios radiológicos era evidente el patrón intersticial bilateral con presencia de múltiples quistes de pequeño tamaño y paredes finas que afectaban a la totalidad del parénquima pulmonar, estando preservada su arquitectura. Con la sospecha clínica de LAM, la paciente presentó un neumotórax izquierdo con colapso pulmonar, realizándose pleurodesis mecánica y una biopsia pulmonar abierta que confirmó el diagnóstico. Ante el deterioro de la función pulmonar y la presencia de un nuevo neumotórax derecho con fuga persistente, se derivó a la paciente a nuestra Unidad de Trasplante Pulmonar. Durante su evaluación, una TC abdominal detectó una masa de densidad heterogénea en riñón izquierdo compatible con un angiomiolipoma renal (fig. 1) y lesiones quísticas en hígado. Se la incluyó en lista de espera para TxP en situación de preferencia nacional y, días más tarde, se le realizó un trasplante unipulmonar derecho sin complicaciones inmediatas.
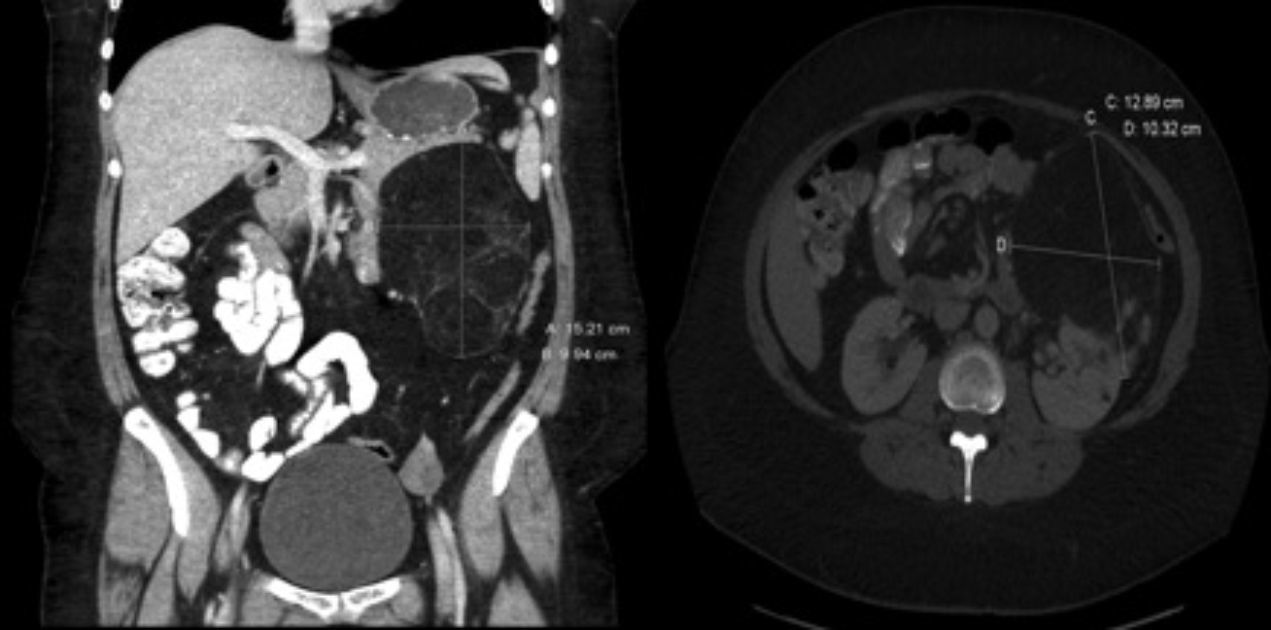
La inmunosupresión inicial fue una triple terapia con anticalcineurínicos (ciclosporina), antiproliferativos (mofetil micofenolato) y esteroides. Seis meses más tarde se modificó la pauta de la inmunosupresión, sustituyendo el mofetil micofenolato por everolimus con el doble objetivo de controlar una disfunción renal leve postrasplante y valorar la respuesta del angiomiolipoma al tratamiento farmacológico. La dosificación de los inmunosupresores se individualizó para alcanzar niveles plasmáticos cercanos a 5ng/ml de everolimus y 100ng/ml de ciclosporina. Durante su seguimiento la función renal y pulmonar permaneció estable, en estadio 0 de síndrome de bronquiolitis obliterante. Tras 6 meses de tratamiento con everolimus se solicitó nueva TC abdominal que demuestra, tras la reconstrucción, una disminución significativa del tamaño del angiomiolipoma renal (fig. 2).
DiscusiónLa LAM es una patología encuadrada dentro del grupo de enfermedades raras cuyas manifestaciones clínicas son fundamentalmente respiratorias. Puede aparecer de forma esporádica (S-LAM) o asociada a esclerosis tuberosa (TSC-LAM), un síndrome neurocutáneo autosómico dominante con la formación de hamartomas a nivel del sistema nervioso central, piel, ojos, órganos abdominales —especialmente el riñón— y el pulmón.
En estas patologías, la alteración abdominal más frecuente es la presencia de angiomiolipomas, generalmente asintomáticos y de localización predominantemente renal. Afectan al 40% de las pacientes con S-LAM y hasta el 80% en la TSC-LAM7. En el primer caso los angiomiolipomas suelen ser unilaterales, pequeños, solitarios y restringidos al riñón, mientras que en las pacientes con TSC-LAM son más grandes, bilaterales, múltiples, multiorgánicos y con mayor tendencia a la hemorragia8. En nuestro caso se trataba de un gran angiomiolipoma renal no complicado en el contexto de S-LAM.
Ambas enfermedades, de base genética, involucran a los genes TSC1 y 2, los cuales codifican las proteínas hamartina y tuberina. Estos genes tienen un importante papel supresor tumoral. El papel principal del complejo hamartina-tuberina es inhibir el complejo mTOR, un elemento regulador central del crecimiento celular a través de la síntesis proteica9.
Apoyado en los nuevos conocimientos de la fisiopatología, se están ensayando agentes inhibidores específicos en las distintas vías patogénicas. Una de estas vías, la inhibición de la mTOR, ha hecho recobrar esperanzas sobre el uso de fármacos que eviten la progresión de la enfermedad. Entre ellos están la rapamicina (sirolimus) y el everolimus, agentes inmunosupresores usados para prevenir el rechazo en pacientes trasplantados dado su potente efecto inhibitorio de la activación linfocitaria. Los resultados preliminares reflejados en estudios de casos y en un ensayo clínico publicado en 2008 son esperanzadores4-6, tanto en la disminución del volumen de las tumoraciones renales como en el declinar de la función pulmonar.
A pesar de la escasa experiencia en TxP por LAM —el 1% del total de casos según el registro de la International Society for Heart and Lung Transplantation (ISHLT)10—, existen unos criterios específicos para la selección de candidatos a TxP en esta patología11. Por otro lado, los resultados en supervivencia y en calidad de vida postrasplante de estos pacientes son superponibles, o incluso mejores, que en el resto de indicaciones del TxP12,13. Por el escaso número de pacientes no se puede inferir cuál es la mejor pauta de inmunosupresión en este subgrupo. Hoy día, la tendencia en la mayoría de los grupos de trasplante es la individualización de la pauta de inmunosupresión según factores de riesgo14. Este concepto es generalmente conocido como tailoring immunosuppression. Dada la alta incidencia de tumoraciones abdominales en la LAM y los resultados comunicados en la disminución del tamaño de las mismas tras el tratamiento con inhibidores de mTOR4 (I-mTOR), es posible que, en el futuro, estos fármacos formen parte del protocolo de inmunosupresión recomendado en pacientes con LAM.
Hasta nuestro conocimiento, en LAM todas las publicaciones son referidas al I-mTOR sirolimus. Similarmente, en el registro internacional de la ISHLT, todas las pautas de inmunosupresión que incluyen I-mTOR están referidas a sirolimus10. Everolimus es un fármaco del mismo grupo terapéutico pero con un perfil farmacocinético y una biodisponibilidad oral mayor que sirolimus15. En las últimas fechas está aumentando la experiencia clínica de este fármaco en trasplantes de órganos sólidos, incluidos el pulmón16-18, pero aún no se ha definido con claridad su lugar en la pauta de inmunosupresión de los pacientes con TxP. La experiencia creciente con estos fármacos10 se debe a su utilidad en el rechazo agudo de repetición, en la pérdida de función del injerto como reflejo de rechazo crónico, para el control de la disfunción renal crónica por anticalcineurínicos, en el control de las infecciones repetidas por el citomegalovirus y en el manejo de las neoplasias postrasplante.
El papel antitumoral o de control en el crecimiento celular de estos fármacos hace muy esperanzadora su utilidad en casos de angiomiolipoma renal en el contexto de LAM. Las ventajas farmacológicas que everolimus aporta hacen pensar que el uso de este fármaco sea creciente entre los grupos de trasplante, particularmente en los subgrupos de pacientes con mayor beneficio esperado. A este respecto, comunicamos el buen resultado en términos de función pulmonar y renal y disminución del tamaño del angiomiolipoma en nuestra paciente con LAM sometida a TxP.