Determinar la prevalencia de vacunación antigripal en una muestra poblacional de pacientes EPOC y la efectividad de la vacunación.
MetodologíaEstudio de cohortes retrospectivo. Se identificaron los antecedentes de vacunación antigripal (campaña 2011-2012) en 899 pacientes con EPOC confirmada obtenidos mediante muestreo aleatorio simple a partir de todos los EPOC identificados a 31 de diciembre de 2011 en Cantabria. Las agudizaciones graves (ingresos por agudización EPOC) y la mortalidad por todas las causas durante el año 2012 fueron tratadas como variables dependientes, calculándose odds ratios ajustadas (ORa) como medida de asociación y fracciones de prevención ajustadas en los expuestos (PFe-ajustada) como medida de impacto.
ResultadosLa prevalencia global de vacunación fue del 62,7%. Esta prevalencia fue menor en EPOC muy grave en base al FEV1 (52,0%). La vacunación antigripal mostró un efecto protector estadísticamente significativo sobre el riesgo de agudizaciones graves al año siguiente: ORa: 0,54 (IC95%: 0,35-0,84); PFe-ajustada: 0,46 (IC95%: 0,16-0,65). El riesgo de mortalidad fue menor, pero sin alcanzar significación estadística: Ora: 0,76 (IC95%: 0,41-1,40). Al estratificar en función de la gravedad de la EPOC, el efecto protector para el riesgo de ingreso por agudización fue mayor en EPOC más graves: Ora: 0,23 (IC95%: 0,11-0,48); PFe-ajustada: 0,77 (IC95%: 0,52-0,89).
ConclusionesNuestros resultados apoyan el efecto protector de la vacunación antigripal, disminuyendo el riesgo de ingreso por agudización. A pesar de nuestros resultados protectores, la prevalencia global de vacunación antigripal fue subóptima, especialmente en los EPOC con un estadio más grave.
To determine the prevalence of influenza vaccination in chronic obstructive pulmonary disease (COPD) patients, and the effectiveness of the procedure.
MethodsRetrospective population-based cohort study. On 31 December 2011, influenza vaccination history was retrieved from 899 patients with confirmed COPD selected by simple random sampling from all COPD patients in Cantabria (northern Spain). Severe exacerbations (hospitalization due to COPD exacerbation) and overall mortality during 2012 were treated as dependent variables. Odds ratios (OR) were estimated by logistic regression, adjusting for age, sex, smoking status, severity of COPD, and frequency of exacerbations during the previous year. Prevented fraction among the exposed (PFe-adjusted) was determined as a measure of impact.
ResultsOverall prevalence of influenza vaccination was 62.7%, but this rate fell in patients classified as more severe according to FEV1 (52.0%). Influenza vaccination showed a statistically significant protective effect against severe exacerbations in the following year: Ora: 0.54 (95%CI: 0.35-0.84); FPe-adjusted: 0.46 (95%CI: 0.16-0.65). A non-significant protective effect for overall mortality was observed: Ora: 0.76 (95%CI: 0.41-1.40). When stratified according to COPD severity (FEV1), the protective effect against risk of hospitalization was higher in more severe COPD patients: Ora: 0.23 (95%CI: 0.11-0.48); FPe-adjusted: 0.77 (95%CI: 0.52-0.89).
ConclusionsWe found that influenza vaccination has a protective effect and reduces the risk of hospitalization due to exacerbations in the following year. Despite the evidence for protection, prevalence of vaccination was not optimal, especially in more severe COPD patients.
Existen diversas revisiones sistemáticas y metaanálisis recientes que apoyan la seguridad y los beneficios de la vacunación antigripal en población general adulta. Estos beneficios en población general en cuanto a síntomas gripales y días de trabajo recuperados serían moderados1,2.
En relación a subgrupos específicos de riesgo, como los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), a pesar del consenso generalizado a favor de la vacunación antigripal, los estudios publicados son más escasos3.
Adicionalmente, en países desarrollados los porcentajes de vacunación en pacientes con EPOC son heterogéneos, y en su mayoría describen prevalencias de vacunación subóptimas4,5. La prevalencia de EPOC parece asimismo variar según las series en función del país y la zona de estudio, según las guías de consenso internacional6.
Por ello, la mayoría de estudios y revisiones centrados en EPOC7-13 concluyen que todavía son necesarios más trabajos para tratar de determinar la efectividad de la vacunación antigripal en diferentes áreas geográficas y en distintos subgrupos de pacientes.
Esta heterogeneidad en los porcentajes de vacunación parece ser mayor en España, donde las prevalencias de vacunación de los últimos estudios publicados muestran un rango entre el 52,2%13 y el 87,2%14,15. Igualmente, la prevalencia de EPOC parece variar en España en función de la zona de estudio16.
El objetivo principal del presente trabajo fue determinar la prevalencia de vacunación antigripal en una muestra poblacional de pacientes EPOC en Cantabria, y la efectividad de la vacunación en la disminución del riesgo de agudizaciones graves.
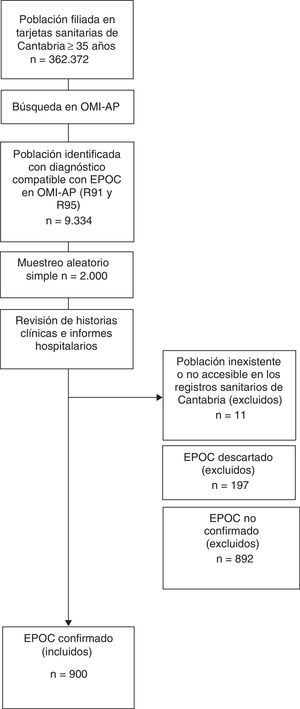
MetodologíaDiseño y población de estudioEstudio de cohortes retrospectivo. El diagrama de flujo para la selección de la muestra a estudio se muestra en la figura 1.
Entre la población a estudio (362.372 usuarios sanitarios de ≥35años registrados con tarjeta sanitaria en Cantabria a 31 de diciembre de 2011), se identificaron los códigos Clasificación Internacional de Atención Primaria (CIAP)17 compatibles con la definición de EPOC (códigos R91 y R95). El total de casos prevalentes identificados fue de 9.334. Entre estos, se llevó a cabo un muestreo aleatorio simple que reclutó 2.000 pacientes.
La información se recogió a partir de la revisión individualizada de las historias clínicas de los centros de salud, usando la base de datos OMI-AP y el Visor Corporativo (eVISOR), que muestra informes de urgencias, altas y consultas externas de los hospitales de Cantabria.
En 11 casos no fue posible acceder al historial clínico individualizado de estos pacientes sin poder filiar la causa, incluso consultando en el sistema CIVITAS, de información poblacional, donde se registran altas y bajas (fallecimientos, traslados, pérdida de cobertura, etc.).
Tras una búsqueda activa en las historias clínicas de los 1.989 pacientes accesibles, en 70 pacientes constó haberse realizado al menos una espirometría con posbroncodilatación que descartó el diagnóstico de EPOC (patrón obstructivo reversible). Las espirometrías de otros 127 pacientes mostraron un patrón no obstructivo y permitieron también descartar el diagnóstico.
En 315 pacientes no constó la realización de ninguna espirometría, por lo que el diagnóstico no se pudo ni confirmar ni descartar. En 577 pacientes constó la realización de al menos una espirometría con patrón obstructivo, pero o bien fue sin posbroncodilatación o no constó si fue o no con posbroncodilatación, por lo que el diagnóstico tampoco se pudo confirmar.
Así pues, el diagnóstico de EPOC se confirmó en el 45,3% (n=900) de los pacientes incluidos en la muestra, tras la comprobación de datos espirométricos compatibles (FEV1/FVC<70% tras prueba broncodilatadora). Se decidió priorizar una estrategia de análisis que primara la validez interna, restringiendo el análisis a esta población.
VariablesPara cada paciente se recogieron sus características sociodemográficas incluyendo sexo, edad, hábito tabáquico y consumo de alcohol, comorbilidades, años desde el diagnóstico de EPOC, tratamientos y antecedentes de vacunación antineumocócica 23-V y antigripal (campañas 2011-2012 y 2012-2013), así como el número y la gravedad de las agudizaciones de la EPOC.
El concepto «agudización de la EPOC» (AEPOC) se definió como aquel episodio que provocó en el paciente un aumento de los síntomas basales de su EPOC (tos, expectoración y/o disnea) y que conllevó la prescripción de un antibiótico y/o un corticoide sistémico (agudización moderada), o que acarreó un ingreso hospitalario de más de 24h (agudización grave)18-20.
Se cuantificó la frecuencia de agudizaciones totales (moderadas y graves) el año previo (año 2011) y el año siguiente (año 2012). Se definió el concepto de «fenotipo agudizador» como el paciente que presentó al menos 2 exacerbaciones en un año, tomando la definición usada en las principales guías nacionales e internacionales6,13,18,20. «Fenotipo no agudizador» fue aquel que tuvo una agudización o ninguna en un año.
Cada agudización debió estar separada al menos 4 semanas desde la finalización del tratamiento de la agudización previa, para diferenciar un nuevo evento de un fracaso terapéutico anterior.
Se computó la mortalidad por todas las causas en el año 2012.
Los pacientes en estudio fueron clasificados en 2 cohortes según si habían recibido o no la vacunación antigripal en la campaña 2011-2012 (del 18 de octubre al 30 de noviembre). Se obtuvo información para esta variable en 899 de los 900 pacientes.
Los pacientes fueron asimismo categorizados en función del grado de obstrucción bronquial basado en los datos obtenidos en el FEV1, según la guía GOLD6: leve: ≥80%; moderado: ≥50-<80%; grave: ≥30-<50%; muy grave: <30% (estadios GOLD 1-4).
Análisis estadísticoPara las variables categóricas y discretas se estimaron proporciones utilizando la prueba ji-cuadrado de Pearson para realizar comparaciones, o el test exacto de Fisher cuando fue necesario. Las variables cuantitativas se expresaron en forma de media y desviación estándar [DE] usando la t de Student para las comparaciones, previa comprobación de la normalidad de las mediante la prueba de Saphiro-Wilk.
La variables dicotómicas: «al menos un ingreso por AEPOC», «mortalidad por todas las causas» y «fenotipo agudizador o no» durante el año 2012 fueron tratadas como variables dependientes (efecto). El tamaño muestral final (n=899) tendría potencia suficiente (1−β>90%) para detectar riesgos relativos ≥1,16 como significativos para un riesgo del efecto en no expuestos del 50%, considerando una razón no expuestos/expuestos=1, mediante un ji-cuadrado bilateral con un nivel alfa <0,05.
Como medida de asociación se estimaron odds ratios crudas (ORc) mediante regresión logística no condicional, junto con sus intervalos de confianza al 95% (IC95%), así como odds ratios ajustadas (ORa) por edad (variable continua), sexo y hábito tabáquico (variable ordinal: no fumador, exfumador, fumador actual), así como un «propensity score» que incluyó: severidad de la EPOC (estadios GOLD 1-4), frecuencia y severidad de las agudizaciones el año previo y presencia de comorbilidades (diabetes mellitus e insuficiencia cardíaca).
Las asociaciones para el antecedente de vacunación antigripal en la campaña 2011-2012 se estratificaron en función de la gravedad de la EPOC (estadios GOLD 1-2 frente a estadios GOLD 3-4.)
Como medida de impacto se calculó la fracción de prevención ajustada en los expuestos (PFe-ajustada) mediante la fórmula (1−ORa), junto con su IC95% mediante la fórmula [(1−Límite superior IC95% de la ORa) a (1−Límite inferior IC95% de la ORa)].
El error alfa se fijó en 0,05, y todas las p fueron bilaterales. Todos los análisis estadísticos se hicieron con el paquete SPSS v22.0 de IBM.
El protocolo de investigación fue aprobado por el Comité Ético en Investigación Clínica de Cantabria, y los datos fueron anonimizados previamente al análisis estadístico.
ResultadosEn la tabla 1 se presenta la cobertura de la vacunación antigripal durante la campaña 2011-2012 en función de los principales antecedentes clínicos y sociodemográficos.
Vacunación antigripal durante la campaña 2011/2012 en función de los principales antecedentes clínicos y sociodemográficos
| Vacunados | No vacunados | Total | |||||
|---|---|---|---|---|---|---|---|
| n=564 | % fila | n=335 | % fila | n=899 | % columnaa | p | |
| Sexo | |||||||
| Hombres | 446 | 63,3 | 259 | 36,7 | 705 | 78,4 | 0,534 |
| Mujeres | 118 | 60,8 | 76 | 39,2 | 194 | 21,6 | |
| Edad | |||||||
| Media [DE] | 73,5 [7,9] | 67,3 [8,11] | 71,2 [9,10] | < 0,001 | |||
| IMC | |||||||
| Media [DE] | 29,2 [4,8] | 28,3 [2,5] | 28,9 [5,0] | 0,016 | |||
| Hábito tabáquico | |||||||
| Activo | 113 | 49,6 | 115 | 50,4 | 228 | 26,5 | < 0,001 |
| Exfumador | 318 | 63,9 | 180 | 36,1 | 498 | 57,8 | |
| No fumador | 108 | 80,0 | 27 | 20,0 | 135 | 15,7 | |
| Desconocido | 23 | 59,0 | 15 | 38,5 | 39 | 4,3 | |
| Hábito alcohólico | |||||||
| Bebedor | 146 | 62,4 | 88 | 37,6 | 234 | 27,6 | 0,826 |
| Exbebedor | 64 | 65,3 | 34 | 34,7 | 98 | 11,6 | |
| No bebedor | 332 | 64,5 | 183 | 35,5 | 515 | 60,8 | |
| Desconocido | 22 | 42,3 | 30 | 57,7 | 52 | 5,9 | |
| FEV1 | |||||||
| Media [DE] | 58,87 [5,16] | 58,85 [2,17] | 58,85 [16,8] | 0,988 | |||
| Estadio GOLD | |||||||
| Leve | 49 | 65,3 | 26 | 34,7 | 75 | 10,4 | 0,67 |
| Moderado | 276 | 63,7 | 157 | 36,3 | 433 | 60,0 | |
| Grave | 119 | 63,0 | 70 | 37,0 | 189 | 26,2 | |
| Muy grave | 13 | 52,0 | 12 | 48,0 | 25 | 3,5 | |
| Desconocido | 107 | 60,5 | 70 | 39,5 | 177 | 19,7 | |
| Comorbilidad | |||||||
| HTA | 373 | 68,9 | 168 | 31,1 | 541 | 60,2 | < 0,001 |
| Diabetes | 166 | 67,2 | 81 | 32,8 | 247 | 27,5 | 0,088 |
| Insuf. cardíaca | 118 | 66,3 | 60 | 33,7 | 178 | 19,8 | 0,273 |
| Fibril. auricular | 118 | 67,4 | 57 | 32,6 | 175 | 19,5 | 0,153 |
| C. isquémica | 115 | 73,2 | 42 | 26,8 | 157 | 17,5 | 0,003 |
| S. metabólico | 38 | 71,7 | 15 | 28,3 | 53 | 5,9 | 0,164 |
| Osteoporosis | 59 | 70,2 | 25 | 29,8 | 84 | 9,3 | 0,135 |
| Cáncer pulmón | 25 | 61,0 | 16 | 39,0 | 41 | 4,6 | 0,811 |
| Ant. psiquiátricos | 193 | 62,9 | 114 | 37,1 | 307 | 34,1 | 0,954 |
| Vacunación antineumocócica 23-V | |||||||
| No | 60 | 24,2 | 188 | 75,8 | 248 | 27,6 | <0,001 |
| Sí | 504 | 77,4 | 147 | 22,6 | 651 | 72,4 | |
| Agudizaciones 2011 | |||||||
| Media [DE] | 1,52 [1,7] | 1,34 [1,7] | 1,46 [1,7] | 0,134 | |||
| Fenotipo agudizador 2011 | |||||||
| ≥ 2 agudizac. | 225 | 67,0 | 111 | 33,0 | 336 | 37,4 | 0,043 |
| Ingresados por EPOC 2011 | |||||||
| ≥ 1 agudiz. grave | 107 | 63,3 | 62 | 36,7 | 169 | 18,8 | 0,863 |
El 21,6% fueron mujeres. La edad media global fue de 71,2años [DE=10,9]. Un 15,7% de los casos de EPOC confirmada no presentaron hábito tabáquico. En cuanto a la severidad de la EPOC, en orden decreciente, la mayoría de los pacientes (60%) presentaban un grado moderado de EPOC, el 26,2% un estadio grave, el 10,4% un estadio leve y el 3,5% un estadio muy grave.
La prevalencia global de vacunación fue del 62,7% (564/899). Esta prevalencia de vacunación fue ligeramente superior en el estadio leve (65,3%) (49/75), y fue disminuyendo conforme avanzó la gravedad de la EPOC: estadio moderado (63,7%) (276/433), estadio grave (63,0%) (119/189), estadio muy grave (52,0%) (13/25), si bien estas diferencias no alcanzaron significación estadística (p=0,67).
El porcentaje de vacunación antigripal fue similar en mujeres y hombres. Los pacientes de mayor edad se vacunaron más, siendo de media 6,2años mayores los vacunados (p<0,001). El 80% de los no fumadores se vacunó. El grupo de exfumadores se vacunó en menor medida (63,9%), siendo los fumadores en activo el colectivo que menos se vacunó (49,6%) (p<0,001). La presencia de comorbilidades estudiadas se asoció a una mayor vacunación antigripal. Los pacientes con una mayor historia de agudizaciones por EPOC durante el año 2011 se vacunaron en mayor medida (p=0,043). Los pacientes con un historial de vacunación antineumocócica 23-V se vacunaron en mayor porcentaje de la vacunación antigripal (p<0,001).
En la tabla 2 se presenta un análisis descriptivo de las principales variables relativas al seguimiento durante el año 2012 en función del antecedente vacunación antigripal durante la campaña 2011-2012. Los pacientes vacunados de la gripe en la campaña 2011-2012 se vacunaron en mayor medida en la siguiente campaña (2012-2013) (p<0,001).
Descriptivo de las principales variables relativas al seguimiento durante el año 2012 en función del antecedente vacunación antigripal durante la campaña 2011/2012
| Vacunados | No vacunados | Total | |||||
|---|---|---|---|---|---|---|---|
| n=564 | % columna | n=335 | % columna | n=899 | % columna | p | |
| Vacunación antigripal (campaña 2012-2013) | |||||||
| No | 119 | 21,1 | 276 | 82,4 | 395 | 43,9 | < 0,001 |
| Sí | 445 | 78,9 | 59 | 17,6 | 504 | 56,1 | |
| Agudizaciones 2012 | |||||||
| Media [DE] | 1,51 [1,7] | 1,27 [1,6] | 1,43 [1,7] | 0,041 | |||
| Fenotipo agudizador 2012 | |||||||
| ≥ 2 agud. | 224 | 39,7 | 107 | 32,3 | 331 | 36,8 | 0,019 |
| Ingresados por AEPOC 2012 | |||||||
| ≥ 1 agud. grave | 85 | 9,5 | 63 | 7,0 | 148 | 16,5 | 0,144 |
| Fallecidos 2012 por todas las causas | |||||||
| 45 | 5,0 | 24 | 2,7 | 69 | 7,7 | 0,657 | |
En la tabla 3 se presentan las asociaciones crudas y ajustadas del antecedente de vacunación antigripal durante la campaña 2011-2012, con relación al riesgo de «ingreso por agudización de la EPOC» (AEPOC) al año siguiente (2012). La vacunación antigripal en la campaña 2011-2012 mostró un efecto protector estadísticamente significativo sobre el riesgo de agudizaciones graves (ingreso por AEPOC) al año siguiente: ORa: 0,54 (IC95%; 0,35-0,84); PFe-ajustada: 0,46 (IC95%: 0,16-0,65) (tabla 3).
Medidas de asociación crudas y ajustadas del antecedente de vacunación antigripal, con relación al riesgo de «ingreso por agudización de la EPOC» (AEPOC), en pacientes con EPOC confirmada
| Agudizaciones graves (ingresos por AEPOC) | ||||||
|---|---|---|---|---|---|---|
| Ninguno | Al menos 1 | |||||
| n=751 | n=148 | ORc | (IC 95%) | ORa | (IC 95%) | |
| Vacunación antigripal (campaña 2011-2012) | ||||||
| Total (n=899) | ||||||
| No | 272 | 63 | 1 | – | 1 | – |
| Sí | 479 | 85 | 0,77 | 0,54-1,1 | 0,54 | 0,35 0,84 |
| Leves-moderados (n=508) | ||||||
| No | 156 | 27 | 1 | – | 1 | – |
| Sí | 275 | 50 | 1,05 | 0,63-1,75 | 0,86 | 0,47-1,55 |
| Graves-muy graves (n=214) | ||||||
| No | 50 | 32 | 1 | – | 1 | – |
| Sí | 109 | 23 | 0,33 | 0,18-0,62 | 0,23 | 0,11-0,48 |
ORa: odds ratio ajustada por edad (variable continua), sexo, hábito tabáquico (variable ordinal: no fumador, exfumador, fumador actual), así como un «propensity score» que incluyó: severidad de la EPOC (estadios GOLD 1-4), frecuencia y severidad de las agudizaciones el año previo y presencia de comorbilidades (diabetes mellitus e insuficiencia cardíaca); ORc: odds ratio cruda.
En cuanto al riesgo de mortalidad, la vacunación antigripal en la campaña 2011-2012 se asoció a un menor riesgo ajustado de mortalidad por todas las causas al año siguiente, pero sin alcanzar significación estadística: ORa: 0,76 (IC95%: 0,41-1,40) (tabla 4).
Medidas de asociación crudas y ajustadas de antecedentes de vacunación antigripal, con relación al riesgo de mortalidad por todas las causas al año siguiente (en 2012), en pacientes con EPOC confirmada
| Vivos | Fallecidos | |||||
|---|---|---|---|---|---|---|
| n=831 | n=68 | ORc | (IC 95%) | ORa | (IC 95%) | |
| Vacunación antigripal (campaña 2011-2012) | ||||||
| Total (n=899) | ||||||
| No | 311 | 24 | 1 | – | 1 | – |
| Sí | 519 | 45 | 1,12 | 0,67-1,88 | 0,76 | 0,41-1,40 |
| Leves-moderados (n=508) | ||||||
| No | 170 | 13 | 1 | – | 1 | – |
| Sí | 298 | 27 | 1,19 | 0,60-2,36 | 0,86 | 0,40-1,90 |
| Graves-muy graves (n=214) | ||||||
| No | 74 | 8 | 1 | – | 1 | – |
| Sí | 123 | 9 | 0,68 | 0,25-1,83 | 0,60 | 0,20-1,80 |
ORa: odds ratio ajustada por edad (variable continua), sexo, hábito tabáquico (variable ordinal: no fumador, exfumador, fumador actual), así como un «propensity score» que incluyó: severidad de la EPOC (estadios GOLD 1-4), frecuencia y severidad de las agudizaciones el año previo y presencia de comorbilidades (diabetes mellitus e insuficiencia cardíaca); ORc: odds ratio cruda.
En cuanto al riesgo de ser «fenotipo agudizador» al año siguiente, la vacunación antigripal mostró una asociación cruda positiva que desapareció tras ajustar en los modelos multivariables: ORa vacunación antigripal (campaña 2011-2012): 1,05 (tabla 5).
Medidas de asociación crudas y ajustadas del antecedente de vacunación antigripal, en relación al riesgo de ser «fenotipo agudizador» al año siguiente (2012), en pacientes con EPOC confirmada
| Fenotipo no agudizador | Fenotipo agudizador | |||||
|---|---|---|---|---|---|---|
| n=568 | n=331 | ORc | (IC 95%) | ORa | (IC 95%) | |
| Vacunación antigripal (campaña 2011-2012) | ||||||
| Total (n=899) | ||||||
| No | 228 | 107 | 1 | – | 1 | – |
| Sí | 340 | 224 | 1,40 | 1,06-1,87 | 1,05 | 0,74-1,50 |
| Leves-moderados (n=508) | ||||||
| No | 122 | 61 | 1 | – | 1 | – |
| Sí | 191 | 134 | 1,40 | 0,96-2,05 | 1,29 | 0,83-2,00 |
| Graves-muy graves (n=214) | ||||||
| No | 43 | 39 | 1 | – | 1 | – |
| Sí | 77 | 55 | 0,79 | 0,45-1,37 | 0,61 | 0,32-1,15 |
ORa: odds ratio ajustada por edad (variable continua), sexo, hábito tabáquico (variable ordinal: no fumador, exfumador, fumador actual), así como un «propensity score» que incluyó: severidad de la EPOC (estadios GOLD 1-4), frecuencia y severidad de las agudizaciones el año previo y presencia de comorbilidades (diabetes mellitus e insuficiencia cardíaca); ORc: odds ratio cruda.
Al estratificar en función de la gravedad de la EPOC de acuerdo al FEV1 (EPOC leve y moderado frente a EPOC grave y muy grave; estadios GOLD1 y 2 frente a3 y 4), la vacunación antigripal en la campaña 2011-2012 mostró un mayor efecto protector para el riesgo de ingresos por AEPOC (agudizaciones graves) en EPOC más graves: ORa: 0,23 (IC95%: 0,11-0,48); PFe-ajustada: 0,77 (IC95%: 0,52-0,89). Este mayor efecto protector de la vacunación en EPOC más graves fue menos aparente para el riesgo de mortalidad por todas las causas y para el riesgo de ser «fenotipo agudizador» al año siguiente (tablas 3-5).
La vacunación antineumocócica 23-V no mostró un efecto protector significativo ni para agudizaciones graves, ni para mortalidad por todas las causas ni para el riesgo de ser «fenotipo agudizador» (tabla 6).
Medidas de asociación crudas y ajustadas del antecedente de vacunación antineumocócica, con relación al riesgo de «ingreso por agudización de la EPOC» (AEPOC), de mortalidad por todas las causas, y de ser «fenotipo agudizador» al año siguiente (2012), en pacientes con EPOC confirmada
| Agudizaciones graves (ingresos por AEPOC | |||||||
|---|---|---|---|---|---|---|---|
| Ninguno | Al menos 1 | ||||||
| n =751 | n = 148 | ORc | (IC 95%) | ORa | (IC 95%) | ||
| Vacunación antineumocócica 23-V | |||||||
| Total (n = 899) | |||||||
| No | 217 | 31 | 1 | – | 1 | – | |
| Sí | 534 | 117 | 1,53 | 1-2,35 | 1,05 | 0,62-1,77 | |
| Leves-moderados (n = 508) | |||||||
| No | 121 | 15 | 1 | – | 1 | – | |
| Sí | 310 | 62 | 1,61 | 0,88-2,95 | 1,13 | 0,56-2,31 | |
| Graves-muy graves (n = 214) | |||||||
| No | 40 | 12 | 1 | – | 1 | – | |
| Sí | 119 | 43 | 1,20 | 0,58-2,51 | 0,85 | 0,36-1,97 | |
| Vivos | Fallecidos | ||||||
| n = 831 | n = 68 | ORc | (IC 95%) | ORa | (IC 95%) | ||
| Vacunación antineumocócica 23-V | |||||||
| Total (n = 899) | |||||||
| No | 235 | 13 | 1 | – | 1 | – | |
| Sí | 595 | 56 | 1,7 | 0,91-3,17 | 1,10 | 0,50-2,42 | |
| Leves-moderados (n = 508) | |||||||
| No | 128 | 8 | 1 | – | 1 | – | |
| Sí | 340 | 32 | 1,51 | 0,68-3,35 | 0,91 | 0,35-2,35 | |
| Graves-muy graves (n = 214) | |||||||
| No | 50 | 2 | 1 | – | 1 | – | |
| Sí | 147 | 15 | 2,55 | 0,56-11,55 | 1,61 | 0,32-8,14 | |
| Fenotipo no agudizador | Fenotipo agudizador | ||||||
| n = 568 | n = 331 | ORc | (IC 95%) | ORa | (IC 95%) | ||
| Vacunación antineumocócica 23-V | |||||||
| Total (n = 899) | |||||||
| No | 174 | 74 | 1 | – | 1 | – | |
| Sí | 394 | 257 | 1,53 | 1,12-2,1 | 1,00 | 0,67-1,48 | |
| Leves-moderados (n = 508) | |||||||
| No | 94 | 42 | 1 | – | 1 | – | |
| Sí | 219 | 153 | 1,56 | 1,03-2,38 | 1,16 | 0,71-1,89 | |
| Graves-muy graves (n = 214) | |||||||
| No | 29 | 23 | 1 | – | 1 | – | |
| Sí | 91 | 71 | 0,98 | 0,52-1,85 | 0,64 | 0,30-1,36 | |
ORa: odds ratio ajustada por edad (variable continua), sexo, hábito tabáquico (variable ordinal: no fumador, exfumador, fumador actual), así como un «propensity score» que incluyó: severidad de la EPOC (estadios GOLD 1-4), frecuencia y severidad de las agudizaciones el año previo y presencia de comorbilidades (diabetes mellitus e insuficiencia cardíaca); ORc: odds ratio cruda.
La prevalencia global de vacunación antigripal en la campaña 2011-2012 fue del 62,7%. Nuestros resultados sugieren que la vacunación antigripal tiene un efecto protector sobre el riesgo de específico de agudizaciones graves (ingreso por AEPOC) al año siguiente, con una PFe-ajustada del 50%. Es decir, nuestros resultados sugieren que si los 335 pacientes que no se vacunaron en la campaña 2011-2012 se hubieran vacunado, se hubieran evitado aproximadamente el 50% de los ingresos por AEPOC (entre 30 y 31 ingresos)21.
La evidencia obtenida a través de los 6 ensayos clínicos identificados en la última revisión Cochrane publicada en pacientes EPOC en 20068 sugirió una reducción del riesgo de hospitalización que apoyaba los resultados de los primeros estudios basados en grandes cohortes, como el de Nichol et al.7. Los resultados más recientes de otras cohortes prospectivas, como la de Seo et al.12, apoyarían también estos resultados, si bien, como variable respuesta, incluyeron ingresos por causa cardiaca (isquemia cardiaca) añadidos a los ingresos de causa respiratoria. Por último, estudios con un diseño de datos emparejados, como el de Menon et al.9, en el que se comparó la incidencia de diferentes eventos antes y después de la vacunación, también han mostrado un efecto protector sobre el riesgo de ingresos.
A nivel nacional, un reciente estudio de cohortes retrospectivo en el Área Básica de Salud de Mollerussa (Lleida)13, basado en la historia clínica informatizada, ha reportado un efecto protector superior: OR ajustada: 0,09 (IC95%: 0,05-0,17), con una PFe-ajustada del 90,8% (IC95%: 83,5-94,8%). No obstante, este estudio únicamente contabilizó los pacientes hospitalizados por agudización de la EPOC entre el 1 de diciembre de 2011 y el 15 de marzo de 2012 en las cohortes de vacunados y no vacunados durante la campaña 2011-2012.
En este estudio el efecto protector de la vacunación antigripal ha sido mayor en los pacientes con un patrón de EPOC más grave en base al FEV1, hecho descrito también por otros autores en estudios observacionales9,13 y ensayos clínicos22.
En cuanto a mortalidad por todas las causas, nuestros resultados tanto para vacunación antigripal como antineumocócica, a pesar de no alcanzar significación estadística, apoyarían los resultados del estudio publicado por Schembri et al.11, que encontraron un efecto protector para la vacunación antigripal pero no para la antineumocócica. En España, un estudio de cohortes prospectivo publicado en pacientes EPOC mayores de 65años encontró también un efecto protector no significativo: hazard ratio (HR) ajustado: 0,76 (IC95%: 0,52-1,06)10.
Por último, la vacunación antigripal no pareció mostrar un efecto protector sobre el riesgo de ser «fenotipo agudizador» el año siguiente (2012). Estos resultados estarían apoyados por el estudio de cohortes de Ting et al.23 en que, tras emparejar por sexo, edad, severidad de la EPOC y comorbilidades, no se observaron diferencias significativas en el número global de agudizaciones.
A pesar de nuestros resultados protectores para el riesgo de agudizaciones graves y mortalidad, la prevalencia de vacunación antigripal fue subóptima, coincidiendo con prevalencias subóptimas reportadas clásicamente en países desarrollados4,5, incluyendo España13. Nuestros resultados apoyan asimismo la hipótesis de que existe un perfil de paciente que tiende a vacunarse (el 79% de los que se vacunaron en 2011 lo hicieron también en 2012), mientras que otro perfil de paciente tiende a rechazar la vacuna (el 82% de los que no se vacunaron en 2011 tampoco lo hicieron en 2012). Se he reportado un rechazo a la vacunación en estos pacientes por miedo a exacerbaciones o reacciones adversas debidas a la propia vacuna, que podría explicar el mayor rechazo a la vacunación en el grupo de mayor gravedad en base al FEV1 en nuestra muestra4,13,23. Diferentes estudios, como el de Tata et al.24 o el de Ting et al.23, apoyan no obstante la seguridad de la vacuna, descartando una mayor incidencia de exacerbaciones en las primeras semanas tras la vacunación.
En nuestro trabajo se ha observado que los pacientes con mayor comorbilidad asociada suelen vacunarse más, apreciación también descrita por otros autores13,25. También se debe señalar que los pacientes fumadores se vacunan menos que los no fumadores, tal y como han señalado otros estudios13,26,27.
Las cepas vacunales de la temporada 2011-2012 tuvieron buena concordancia con el virus circulante H1N1, moderada con el H3N2 (que fue el predominante junto con el H1N1) y escasa con el del grupoB (que fue más frecuente en otros países). La actividad gripal en España en la temporada 2011-2012 se consideró moderada y comenzó su ascenso en la semana 50/2011, alcanzándose el pico máximo de incidencia de gripe en la semana 7/2012 (del 13 al 19 de febrero), para tomar valores pre-epidémicos a partir de la semana 11/201228,29. La temporada 2012-2013 fue una temporada más tardía, comenzando el ascenso en la semana 2/2013 y alcanzándose el pico en la semana 8/201330. Diversos estudios han utilizado como variable dependiente (outcome) el ingreso hospitalario restringido a los meses de máxima actividad gripal, argumentando que ese sería el periodo de mayor riesgo de ingreso por virus gripal. Estos estudios han mostrado mayores beneficios de la vacunación13. Una de las limitaciones de nuestro estudio es que se contabilizaron los ingresos durante el año 2012, pero no computó la fecha de ingreso, por lo que no se ha podido realizar un análisis de sensibilidad restringido a los primeros meses de 2012. No obstante, dado que estos estudios han mostrado mayores beneficios de la vacunación, creemos que nuestros resultados, en todo caso, serían conservadores31. Por otro lado, que las tasas de incidencia de gripe tomaran valores pre-epidémicos a partir de la semana 11/2012 no significa que la actividad gripal estuviera ausente, sino que esta se encontró por debajo del umbral basal, que en el caso de la temporada 2011-2012 fue 4,21 veces menor con respecto a la tasa en pico epidémico.
Otra limitación sería el escaso tamaño muestral para pacientes con estadio GOLD más grave (n=25). Esto es consecuencia del muestreo aleatorio simple, que ha conducido a una muestra representativa de la población en cuanto a severidad de la EPOC.
En cuanto a las fortalezas de nuestro estudio, una de las ventajas es que el grupo de comparación se compuso también de enfermos de EPOC no vacunados procedentes aleatoriamente de la misma población base. Esto es una ventaja frente a otros estudios que han usado otros grupos de comparación (población general…) o que han se restringido a poblaciones de mayor edad (>65años). Todas estas deficiencias metodológicas tenderían a sobreestimar los beneficios de la vacunación32-35.
Otra ventaja de nuestro estudio es el control de la confusión. Se ha sugerido asimismo que los pacientes vacunados contra la gripe es probable que estén más vacunados de la antineumocócica 23-V, pudiendo actuar la vacunación antineumocócica 23-V como otra variable confusora13. En nuestro estudio sí se ha podido obtener información sobre este antecedente en cada uno de los pacientes, descartando su efecto confusor.
En conclusión, los resultados del presente estudio y la evidencia disponible apoyan el efecto protector de la vacunación antigripal con relación al riesgo de ingreso por agudización de la EPOC al año siguiente. A pesar de nuestros resultados protectores, la prevalencia global de vacunación antigripal fue subóptima, especialmente en los EPOC con un estadio más grave.
FinanciaciónEsta investigación no ha recibido financiación por parte de la industria privada o de convocatorias públicas.
AutoríaMS, RG, JMH, SA, JLGR y JL diseñaron el estudio. MS, RG y JL llevaron a cabo el análisis estadístico. MS escribió el manuscrito. RG, JMH, MR, SA, CB y CL contribuyeron a la adquisición de los datos, análisis e interpretación de resultados, revisaron críticamente el manuscrito contribuyendo intelectualmente al mismo y dieron la aprobación final para su publicación. JLGR y JL supervisaron el análisis, contribuyeron a la redacción y edición del manuscrito y dieron la aprobación final para su publicación.
Conflicto de interesesEl Dr. García Rivero ha recibido honorarios por asesoría científica y/o por impartir conferencias de Almirall, Boehringer Ingelheim, Pfizer, Astra Zeneca, Chiesi, GlaxoSmithKline, Menarini, Takeda, Teva, Ferrer y Novartis. El Dr. Helguera ha recibido honorarios por impartir conferencias de GlaxoSmithKline, Boehringer, Novartis, Mundipharma y Astra Zeneca. La Dra. Bonnardeaux ha recibido honorarios por impartir conferencias de GlaxoSmithKline, Boehringer, Ferrer, Astra Zeneca, Teva, y Chiesi. El resto de autores declaran no tener ningún conflicto de intereses.
Al Servicio Cántabro de Salud por el apoyo y las facilidades recibidas.