La discinesia ciliar primaria (DCP) se caracteriza por una alteración en la estructura ciliar que dificulta el aclaramiento de las secreciones respiratorias1,2. Su herencia es autosómica recesiva y se han descrito hasta 40 genes causales en >70% de los pacientes3. Con las técnicas disponibles actualmente el diagnóstico de confirmación de la DCP es difícil y las guías europeas recomiendan una combinación de pruebas4. La detección de óxido nítrico nasal (NOn) bajo es útil como prueba de cribado4,5, pero solo está validada en mayores de 5años y puede ser normal en algunos casos4,5. La ultraestructura ciliar con microscopia electrónica (ME) tiene falsos positivos, relacionados con alteraciones secundarias por infecciones respiratorias, y falsos negativos, pudiendo ser normal en el 21% de los casos4. El estudio del batido ciliar con videomicroscopia óptica de alta velocidad es muy útil para el diagnóstico4,6, pero también tiene falsos positivos por infecciones respiratorias, existe una falta de estandarización en la preparación de las muestras, necesita interpretación por personal con experiencia y tiene un componente de subjetividad4.
Además del diagnóstico molecular3, se ha publicado que la inmunofluorescencia puede contribuir a definir el defecto específico de la DCP y mejorar su diagnóstico7. El objetivo de este artículo es presentar dos casos (hermanas) que muestran la utilidad de la combinación de estas técnicas para llegar al diagnóstico preciso del defecto proteico y molecular causante de la DCP.
El estudio fue aprobado por el Comité de Ética, y se solicitó la autorización de los padres y las pacientes para su inclusión en el mismo.
Caso 1. Mujer de 16 años, nacida a término. Ingresó a los 3días de vida por bronquiolitis. Posteriormente presentó otitis recurrentes, rinitis crónica, bronquitis de repetición y bronquiectasias en el lóbulo medio. A los 4años de edad, el estudio por ME mostró una pérdida del 40% del brazo externo de dineína (ODA) y del 70% del brazo interno (IDA), diagnosticándose de DCP. En los cultivos de esputo se aíslan habitualmente Haemophilus influenzae y Pseudomonas aeruginosa, por lo que es tratada con colistina nebulizada, y realiza fisioterapia respiratoria y suero salino hipertónico al 7% nebulizado. La espirometría (valores de referencia GLI-20128,9) muestra FVC3,36l (z-score −0,08), FEV12,23l (z-score −2,21), FEV1/FVC66% (z-score −2,83), FEF25-75%1,42l/s (z-score −3,19).
Caso 2. Mujer de 13 años, nacida a término. Ingresó a los 11días de vida por bronquiolitis. Posteriormente presentó neumonía en el lóbulo superior derecho y bronquitis de repetición. A los 12meses, el estudio por ME mostró una pérdida del 30% del ODA y del 70% del IDA, por lo que se diagnosticó también de esta enfermedad. En la tomografía computarizada torácica presenta atelectasias en el lóbulo medio y en la língula, engrosamiento peribronquial y patrón de aireación heterogéneo. Los cultivos de esputo son positivos para H.influenzae. Es tratada con fisioterapia respiratoria y nebulizaciones con suero hipertónico al 7%. La espirometría muestra FVC 1,97l (z-score −0,91), FEV11,45l (z-score −2,18), FEV1/FVC73% (z-score −2,18), FEF25-75%0,98l/s (z-score −3,12).
En el último año se han reevaluado a las pacientes mediante nuevas técnicas diagnósticas disponibles. El valor de NOn fue muy bajo en ambas: 53,3ppb (V’NO15,2nl/min) y 61ppb (V’NO17,2nl/min). Se recogió muestra de epitelio respiratorio ciliado en el meato nasal inferior con un cepillo de 2mm de diámetro para estudio de videomicroscopia e inmunofluorescencia, y una muestra de sangre periférica para el estudio genético.
Se analizó la frecuencia y el patrón de batido ciliar con una cámara de grabación de alta velocidad (MotionPro®X4, IDT, CA, EE.UU.) acoplada a un microscopio óptico, observándose en las dos hermanas ausencia de motilidad ciliar.
Para realizar el estudio genético se extrajo el ADN genómico de sangre periférica de las dos pacientes y sus progenitores. Las muestras de una de las hermanas y de los padres se analizaron con la metodología TruSight One Sequencing Panel (Illumina, San Diego, CA, EE.UU.) y se secuenciaron con la plataforma MiSeq (Illumina). Este panel incluía 20 genes relacionados con la DCP. Los resultados se analizaron mediante los programas VariantStudio v2.2.1, Alamut Visual v2.11, VarSome y diferentes predictores de patogenicidad. Se consultó la frecuencia alélica (Genome Aggregation Database) y la evidencia científica de patogenicidad en Human Gene Mutation Database. Las variantes candidatas se confirmaron, incluyendo la otra hermana, mediante secuenciación Sanger. Las hermanas son heterocigotas compuestas en el gen DNAH5 para las variantes probablemente patogénicas no descritas anteriormente c.4625_4628delGAGA:p.(Arg1542ThrfsTer6) y c.12706-2A>T. Los padres son heterocigotos para una de las mutaciones. Este gen codifica una de las cadenas pesadas del ODA y es esencial para la función ciliar10.
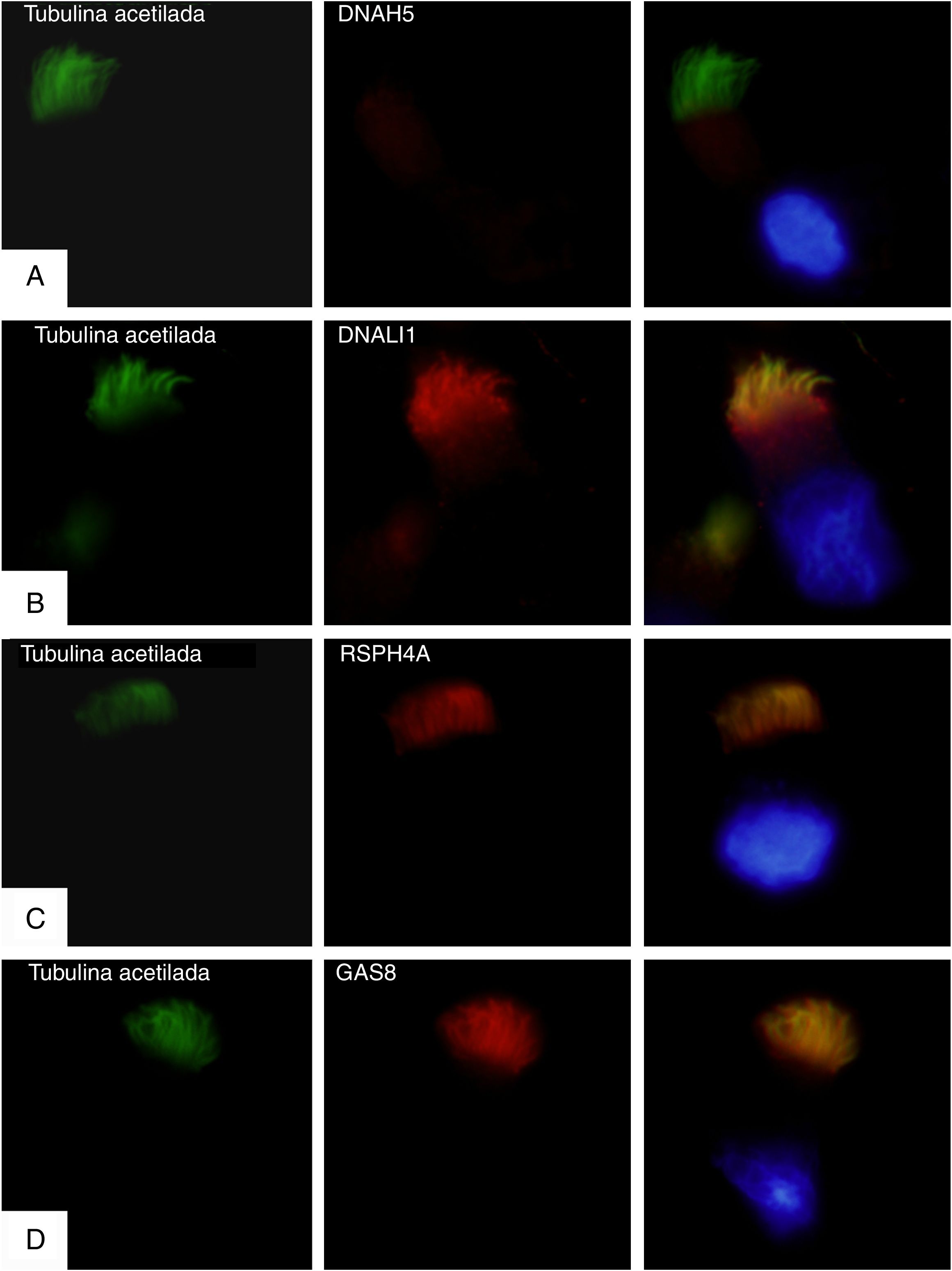
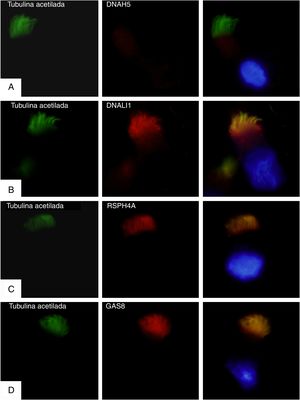
Para confirmar si se expresaba o no la proteína mutada DNAH5 se realizaron estudios de inmunofluorescencia en células del epitelio respiratorio. Se usaron anticuerpos primarios (Sigma Aldrich, St. Louis, MO, EE.UU.) contra la tubulina acetilada ciliar y cuatro proteínas de la estructura ciliar: DNAH5 (ODA); DNALI1 (IDA); RSPH4A (conexiones radiales), y GAS8 (nexina-complejo regulador de la dineína). Los resultados mostraron una completa ausencia de la proteína DNAH5 en el axonema ciliar (fig. 1A) y presencia de DNALI1, RSPH4A y GAS8 que colocalizan con la tubulina acetilada ciliar (fig. 1B-D).
Análisis por inmunofluorescencia de la ultraestructura ciliar. En la primera columna se muestra la presencia de cilios en la célula mediante tubulina acetilada (en verde), en la segunda el resultado de la incubación con anticuerpos primarios contra las proteínas ciliares (en rojo) y en la tercera el merge de la tubulina con cada proteína ciliar y el núcleo marcado con DAPI (azul). A)Ausencia de la proteína DNAH5 (componente de brazos externos de dineína) en el axonema ciliar. B-D)Presencia y colocalización de la tubulina y las proteínas del axonema ciliar (en amarillo): B)DNALI1 (componente de brazos externos de dineína); C)RSPH4A (componente brazos radianes), y D)GAS8 (componente de la nexina-complejo regulador de la dineína).
Los resultados de la inmunofluorescencia concuerdan con el estudio genético y confirman que las mutaciones descritas causan una completa falta de expresión de la proteína DNAH5 en el axonema ciliar y provocan un defecto del ODA11,12. En nuestro análisis de videomicroscopia se ha observado inmovilidad ciliar, concordante con lo descrito en estos casos11. El hallazgo por ME de alteración en IDA además de en ODA podría explicarse por la alteración de los IDA por cambios secundarios a infecciones respiratorias13, por el hecho de que en sujetos sanos pueden no observarse los IDA en más del 50% de los dobletes14, o por artefactos de procesamiento15.
La inmunofluorescencia tiene limitaciones4,7, como no disponer de anticuerpos para todas las proteínas defectuosas, o fallo de la técnica por ausencia de cilios o por interferencia del moco o sangre en la muestra, pero junto al estudio molecular, puede aproximarnos de manera adecuada al diagnóstico de esta enfermedad y hallar el defecto específico que la causa, lo que será necesario confirmar en estudios más amplios.
FinanciaciónEl presente trabajo ha sido financiado parcialmente por una ayuda de Acción Estratégica en Salud del Instituto de Salud CarlosIII (PI16/01233), una beca de la Sociedad Española de Neumología Pediátrica y una beca de la Fundació Catalana de Pneumologia (FUCAP).
Conflicto de interesesAMG ha recibido fondos por participar en asesorías de Abbvie, y ha recibido ayudas para viajes e inscripción a congresos médicos de Abbvie, Actelion y Novartis, todas ellas sin relación con este trabajo. SR ha recibido ayudas para viajes e inscripción a congresos médicos de Abbvie, TEVA y Novartis, todas ellas sin relación con este trabajo. Los demás autores declaran no tener ningún conflicto de intereses.
Los autores participan en la Action COST BM1407 Translational research in primary ciliary dyskinesia: bench, bedside, and population perspectives (BEAT PCD). Este trabajo se ha realizado en el marco del programa de doctorado de Pediatría, Obstetricia y Ginecología de la Universitat Autònoma de Barcelona.