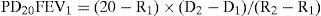La primera normativa sobre los test de provocación bronquial inespecífica auspiciada por SEPAR fue publicada en 19871. Años después, en 2004, tuvo lugar una actualización de la misma bajo el formato de Manual de Procedimientos2. Transcurrido ya un tiempo prudencial, el Comité Científico y de Investigación de nuestra Sociedad solicitó recientemente al Área de Asma la elaboración de una nueva puesta al día sobre el tema, procurando recoger lo que la práctica diaria y la experiencia acumulada han ido poniendo en valor. De acuerdo con ello, el presente documento tiene como propósito la descripción y la metodología del estudio de la hiperrespuesta bronquial asmática mediante la utilización de estímulos inespecíficos directos e indirectos centrándonos en los más utilizados en clínica: metacolina, adenosina, manitol, ejercicio, hiperventilación eucápnica y salino hipertónico. Pero antes de pasar a su relato pormenorizado conviene recordar brevemente algunos puntos generales y claves relacionados con la materia que nos ocupa.
Hiperrespuesta bronquial: consideraciones generalesHiperrespuesta bronquial (HB) es el término con el que se define el estrechamiento excesivo de la luz aérea ante estímulos físicos o químicos que habitualmente solo provocan una reducción escasa o nula del calibre de la vía respiratoria3. Este comportamiento anómalo formaliza una de las singularidades significativas del asma pero no una característica exclusiva de ella3,4. La HB también puede detectarse, de forma transitoria o permanente, acompañando a otras situaciones (exposición a polucionantes e irritantes medioambientales, infecciones víricas del tracto respiratorio, bronquitis crónica, rinitis, sarcoidosis, estenosis mitral, displasia broncopulmonar, etc.), o incluso en sujetos aparentemente sanos3,4. De hecho, los trabajos epidemiológicos llevados a cabo sobre la población general han demostrado su existencia en el 16-30% de los niños y en el 10-16% de los adultos, indicando además que el grado de respuesta bronquial tiene una distribución continua unimodal log-normal; los asmáticos ocupan la porción extrema de la curva donde se observan los mayores niveles de hiperrespuesta5-7.
Aunque ese patrón de distribución podría hacernos pensar que la HB no constituye una condición patológica per se, la verdad es que la prevalencia de síntomas respiratorios resulta más elevada cuando aquella está presente8,9, y que los individuos asintomáticos y con HB tienen un riesgo alto de desarrollar asma en el futuro, máxime si a la vez hay atopia9-13. Ahora bien, HB y atopia no son 2 sucesos invariablemente asociados (hay atopia sin HB e HB sin atopia), y ello sugiere que ambos poseen, al menos en parte, determinantes genéticos independientes9.
Tipos de estímulosEn cualquier caso, y a pesar de la falta de especificidad, es en el asma donde el análisis de la HB ha alcanzado un mayor desarrollo. Su evaluación supone, de cara a la práctica diaria, una herramienta de gran ayuda en el proceso diagnóstico de dicha entidad y permite monitorizar la respuesta terapéutica y el grado de control conseguido14,15. El estudio se realiza en el laboratorio de exploración funcional utilizando sustancias que, como la metacolina o la histamina, causan broncoconstricción al actuar directamente sobre las células implicadas en la génesis de la limitación al flujo (músculo liso de la vía aérea [MLVA], endotelio vascular, células productoras de moco, etc.)14,15. Pero la HB puede ser puesta de manifiesto por igual con agentes (alérgenos, adenosina, manitol, ejercicio, etc.) que ocasionan la reducción del calibre de la vía aérea de manera indirecta, estimulando inicialmente células inflamatorias o neuronales que, una vez activadas, generan los mediadores adecuados para provocar la disminución de la luz bronquial16,17. Esta diferencia justifica que el grado de correlación entre estímulos directos e indirectos diste mucho de ser perfecto, y lo más importante: que la información aportada por cada uno de ellos proporciona visiones complementarias de las alteraciones existentes en el tracto respiratorio del paciente asmático14,15. Los estímulos directos rastrean mejor el funcionalismo del MLVA, y los indirectos reflejan con mayor precisión la magnitud de la carga inflamatoria. Asimismo, y en contraste con los estímulos directos, el broncoespasmo inducido por los estímulos indirectos queda prevenido con la toma de cromonas, furosemida inhalada o heparina, y tras una segunda exposición el fenómeno de taquifilaxia resulta mucho más pronunciado y precoz16. A modo de resumen, la tabla 1 muestra las características que mejor diferencian a unos de otros18.
Comparación entre estímulos directos e indirectos en la prueba de provocación bronquial en el asma
| Directos | Indirectos | |
| Función MLVA | ++++ | ++ |
| Calibre de la vía aérea | ++++ | ± |
| Inflamación | ++ | ++++ |
| Dosis necesaria | Baja | Alta |
| Limitación de dosis | No | Sí |
| Sensibilidad | Alta | Baja |
| Especificidad | Mediana | Alta |
| Diagnóstico | Descartan | No descartan |
MLVA: músculo liso de la vía aérea.
Modificada de Cockcroft y Davies18.
Dejando aparte su mecanismo de base (directo o indirecto), los estímulos que traslucen el estado de HB se clasifican tradicionalmente en específicos e inespecíficos. Los específicos solo dan resultados positivos en los individuos sensibles o intolerantes a ellos. Los inespecíficos directos (metacolina, histamina) e indirectos (adenosina, manitol, ejercicio, hiperventilación eupcápnica, aerosoles iso-hipertónicos, etc.) denotan la hiperrespuesta en cualquier sujeto con HB, sea cual fuere la causa subyacente18,19. El término inespecífico no implica que los efectos de un estímulo se correlacionen siempre con los inducidos por otro. Por ejemplo, algunos asmáticos, sobre todo los intolerantes a antiinflamatorios no esteroideos, son relativamente más sensibles a la metacolina que a la prostaglandina F2α, y muchos pacientes con enfermedad pulmonar obstructiva crónica (EPOC) responden a la metacolina pero no a la hiperventilación19.
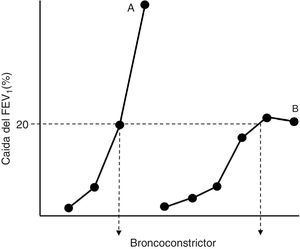
Patogenia de la hiperrespuesta bronquial en el asmaTodos los autores admiten que, a semejanza de lo que ocurre en los modelos in vitro de interacción fármaco-receptor, la HB es el corolario de 2 factores bien definidos: la hipersensibilidad y la hiperreactividad19-21. El aumento de la sensibilidad (contracción del reactivo farmacológico ante concentraciones de estímulo más bajas que en condiciones de normalidad) implica: a)modificaciones en el número y/o la afinidad de los receptores a contracturantes; b)cambios en la absorción o en el metabolismo de los mismos, o c)circunstancias locales que favorecen la accesibilidad del ligando a sus lugares de actuación. Por su parte, la hiperreactividad (el desarrollo de una mayor respuesta contráctil) está ocasionada por modificaciones en las propiedades y comportamiento del propio tejido excitable (más cantidad de músculo, presencia de factores que facilitan su acortamiento y disfunciones en la maquinaria contráctil)19-21. La hipersensibilidad y la hiperreactividad son identificables en el laboratorio de exploración funcional si construimos curvas dosis-respuesta «completas» a un agonista broncoconstrictor en el sujeto normal y en el asmático y comparamos su posición a lo largo del eje de ordenadas y sus morfologías (fig. 1). La aparición de una meseta en el efecto máximo observado puede no manifestarse si el asma es moderada-grave, y su ausencia refleja una situación particular de estrechamiento excesivo de la vía aérea, con una mayor morbilidad21.
Representación simplificada de curvas dosis-respuesta a un agonista broncoconstrictor en un paciente asmático (A) y en un sujeto normal (B). El desplazamiento hacia la izquierda de la curva A y su mayor pendiente respecto a la curva B reflejan, respectivamente, una mayor hipersensibilidad e hiperreactividad. La dosis que ocasiona una caída del 20% en el volumen espirado forzado en el primer segundo (FEV1) para ambas curvas (PD20) se refleja en el punto de cruce con estas de la línea discontinua horizontal.
De igual modo, la mayoría de los autores coinciden a la hora de afirmar que, en el caso del asma, la génesis de la HB está ligada a la inflamación/reparación que experimenta la pared bronquial durante el curso de la enfermedad, coexistiendo aquí 2 formas de hiperrespuesta: una basal y bastante persistente y otra transitoria21,22. La basal está presente en la mayoría de los pacientes con asma crónica, y la transitoria o variable acontece superpuesta a ella como producto de la exposición a factores medioambientales (alérgenos, infecciones del tracto respiratorio, agentes ocupacionales). El componente variable reflejaría la inflamación de la vía aérea en un momento dado, mientras que la HB basal guardaría más relación con los cambios estructurales que acompañan al remodelado22.
Tomando como punto de partida estos postulados generales, a lo largo de los años se han propuesto un buen número de alternativas patogénicas concretadas en 3 grandes líneas de investigación, no excluyentes entre sí: a)la implicación de determinantes mecánicos; b)la disfunción del MLVA, y c)la pérdida de algún componente limitante de la contractilidad normal del MLVA. El lector interesado en el conocimiento pormenorizado de tales hipótesis puede consultar las referencias3,4,19,20,22–26.
Pruebas de provocación bronquial con estímulos inespecíficos directos: metacolinaFundamentos básicosLa metacolina y la histamina han sido las 2 sustancias tradicionalmente manejadas como estímulos inespecíficos directos, y en condiciones de medida similares consiguen efectos comparables27,28. Sin embargo, la metacolina es hoy la más utilizada, ya que ofrece 2 grandes ventajas27-29: a)puede emplearse a concentraciones hasta 200mg/ml sin efectos secundarios, mientras que concentraciones de histamina superiores a 32mg/ml son capaces de ocasionar eritema facial, cefalea, náuseas, disfonía o incluso edema de glotis, y b)la reproducibilidad de las pruebas de provocación bronquial (PPB) con metacolina resulta ser mayor que con histamina. Por todo ello, se recomienda la elección como agente broncoconstrictor de metacolina en lugar de histamina.
La metacolina es un derivado sintético de la acetilcolina (acetil-β-metilcolina), sin acción nicotínica, que actúa sobre los recetores colinérgicos del árbol bronquial y es biotransformada, al igual que la acetilcolina, por la acetilcolinesterasa, pero a una velocidad menor28. Esta circunstancia permite alargar en el tiempo sus efectos y facilita la medida de las respuestas. La metacolina clorhidrato está catalogada como de categoría C para el embarazo. Se desconoce si puede causar daño en el feto o si afecta a la fertilidad. Solo se administrará a mujeres embarazadas cuando sea claramente necesario y no debe utilizarse en madres lactantes, ya que se ignora si, vía inhalada, pasa a la leche materna.
La metacolina se presenta como sal cristalina en polvo (sales de cloro o bromo de acetil-metil-colina) y ha sido aceptada para su uso en humanos (Provocholine™, viales de 20ml/100mg)28-30. La metacolina en polvo es higroscópica y debe mantenerse en lugar seco y cerrado, elaborándose las diluciones a medida que vayan a ser utilizadas30.
Direcciones de interés. Laboratorio distribuidor de metacolina: DIATER, S.A. Avda. Gregorio Peces Barba 2, Parque Tecnológico de Leganés, Leganés, 28918Madrid, España. Teléfono de contacto: +349149660 13. Fax: +34914966012. Página Web: http://www.diater.com. Dirección electrónica de contacto: info@diater.com.
Fundamentos técnicosPreparación de las dilucionesLas diluciones han de realizarse con cloruro sódico al 0,9% inyectable, usando viales vacíos y estériles de vidrio borosilicatado tipo i y agitando tras añadir el diluyente hasta la obtención de una solución límpida. La tarea es preferible que sea materializada por el Servicio de Farmacia del hospital. Diluciones de metacolina en suero salino isotónico superiores a 0,125mg/ml, a 4°C, mantienen la estabilidad durante 3 meses28,31. Si el disolvente contiene un preservante (p.ej., 0,4% de fenol, a fin de inhibir el crecimiento bacteriano) la estabilidad se reduce, y conviene utilizarla como máximo en las siguientes 2semanas desde su preparación. El pH de la metacolina en la solución salina resulta moderado o débilmente ácido, dependiendo de la concentración de la propia metacolina28,31. Los viales reconstituidos deben almacenarse en condiciones de frío (4°C), evitando la exposición a la luz solar, y utilizarse a temperatura ambiente. No hay que guardar ninguna precaución especial para la eliminación del producto sobrante30. La tabla 2 recoge los esquemas de diluciones a preparar.
Esquema de las diluciones de metacolina a preparar para los 2 métodos recomendados
| Tomar | Añadir ClNa (0,9%) | Dilución obtenida | |
| A. Lista de soluciones, para el método de respiración continua durante 2 min, partiendo de un vial de 100mg de la sal de metacolina | |||
| 100 mg | 100 mg | 6,25 ml | A: 16 mg/ml |
| 3ml de dilución A | 3 ml | B: 8 mg/ml | |
| 3ml de dilución B | 3 ml | C: 4 mg/ml | |
| 3ml de dilución C | 3 ml | D: 2 mg/ml | |
| 3ml de dilución D | 3 ml | E: 1 mg/ml | |
| 3ml de dilución E | 3 ml | F: 0,5 mg/ml | |
| 3ml de dilución F | 3 ml | G: 0,25 mg/ml | |
| 3ml de dilución G | 3 ml | H: 0,0625 mg/ml | |
| 3ml de dilución H | 3 ml | I: 0,031 mg/ml | |
| B. Esquema opcional de diluciones, para el método dosimétrico de 5 inhalaciones, partiendo de un vial de 100mg de la sal de metacolina | |||
| 100 mg | 100 mg | 6,25 ml | A: 16 mg/ml |
| 3ml de dilución A | 9 ml | B: 4 mg/ml | |
| 3ml de dilución B | 9 ml | C: 1 mg/ml | |
| 3ml de dilución C | 9 ml | D: 0,25 mg/ml | |
| 3ml de dilución D | 9 ml | E: 0,0625 mg/ml | |
De Crapo et al.28.
Para la realización de la PPB cabe utilizar 2métodos de inhalación: los sistemas de generación continúa de aerosol y la técnica dosimétrica28,31.
Los sistemas de generación continua emplean un nebulizador del tipo impactador de chorro dotado de válvula unidireccional (con entrada al nebulizador y salida provista de filtro al exterior) y acoplado a una fuente de aire comprimido cuyo flujo se ajusta buscando conseguir un débito constante entre 0,13 y 0,16ml/min28. El nebulizador ha de dispensar partículas con una mediana de masa aerodinámica de 1 a 3μm; de esta forma, aproximadamente el 80% de ellas alcanzan los bronquios más periféricos28,31. Aunque existen distintos procedimientos de calibración del nebulizador, por su disponibilidad y simplicidad se recomienda el método de la «doble pesada», que consiste en pesar el nebulizador antes y después de dispensar 3ml de solución, durante 2min, a temperatura ambiente y con un flujo de aire dado28. La calibración resulta necesaria al empezar a utilizar cada dispositivo y después, a intervalos regulares, ya que el output cambia con el uso y la limpieza del mismo. El sistema de generación continua requiere, pues, un equipamiento bastante sencillo pero comporta algunas desventajas: a)la dificultad para conseguir que pacientes ansiosos inhalen la solución a volumen corriente, y b)la imposibilidad de conocer a ciencia cierta la cantidad de agonista inhalado (véase más adelante).
En el caso de la técnica dosimétrica, el aerosol se genera solo durante un periodo de la inspiración mediante una válvula solenoide activada de forma eléctrica cuando el paciente inhala a través del nebulizador28. La utilización de dosímetros permite ajustar mejor la dosis administrada, que se determina en función del débito del nebulizador, la concentración del agonista, el tiempo de nebulización y el número de respiraciones. Además de la nebulización por pulsos, algunos dosímetros permiten la nebulización continua durante toda la inspiración, interrumpiendo automáticamente la administración del agonista una vez que se alcance la dosis programada. La técnica dosimétrica también plantea ciertos inconvenientes: a)mayor sofisticación del equipo; b)depósito significativo del agonista en la vía aérea superior si no se controlan los flujos inspiratorios, y c)posible efecto broncoprotector de la maniobra inspiratoria máxima28,31,32. Los sistemas de dosímetro necesitan calibración periódica siguiendo las instrucciones del fabricante.
Finalmente, conviene tener presente: a)que los resultados y puntos de corte obtenidos por ambos métodos no son del todo comparables (el método dosimétrico podría infraestimar el grado de HB), y b)que para poder interpretar la PPB resulta imprescindible detallar las características del nebulizador y la utilización o no de dosímetro32. Pese a la validez de los distintos métodos referidos, con objeto de homogeneizar el procedimiento, esta normativa recomienda el uso de dosímetro.
Registro de la respuestaLa respuesta inducida por un estímulo broncoconstrictor se puede evaluar registrando los cambios detectados en diversos parámetros de función respiratoria, entre los que se incluyen el volumen espiratorio forzado en el primer segundo (FEV1), el pico de flujo o la medida de la resistencia de las vías aéreas y de la conductividad específica33. De todos ellos, el más usado en la práctica diaria es el FEV1. Aun con ciertas limitaciones (requiere maniobras de espiración forzada capaces de inducir per se variaciones en el calibre de la vía aérea y no aporta información sobre el comportamiento de la vía aérea pequeña), se trata de una medida muy reproducible, con un coeficiente de variación bajo (<8%), de fácil realización y que no exige un equipo complejo33. El espirómetro empleado y la obtención de la espirometría cumplirán los requisitos exigidos por las normativas correspondientes34,35.
En niños pequeños o en sujetos poco colaboradores podría considerarse el uso de la presión transcutánea de oxígeno o de la oscilación forzada como alternativas para el registro de la respuesta28. Estas solo deberían ser utilizadas ante la incapacidad para obtener espirometrías válidas y en laboratorios con experiencia en su realización e interpretación.
ProcedimientosSe mantienen 2 métodos de provocación clásicos: la respiración a volumen corriente y las 5 inspiraciones con dosímetro, aunque también se han incorporado diversos procedimientos dosimétricos simplificados.
Método de respiración a volumen corrienteRequiere la utilización de un nebulizador del tipo impactador de chorro, modelo Wright o similar36. Una vez realizada la espirometría basal, se solicitará al paciente, sentado en una posición cómoda y provisto de pinza nasal, que respire relajado y tranquilo a través de una boquilla conectada al nebulizador. Como alternativa se puede considerar la utilización de una mascarilla, manteniendo también en este caso la pinza nasal. La prueba comienza con la inhalación del diluyente y continúa con la administración de concentraciones crecientes de metacolina (desde 0,03mg/ml hasta 16mg/ml) (tabla 3). En cada etapa de la prueba se colocan 3ml de la concentración correspondiente en el nebulizador, que será inhalada de forma continua por el paciente mientras respira a volumen corriente durante 2min. Acabada cada inhalación, el paciente se retirará del equipo y, transcurridos 30-90s, efectuará una espirometría (no más de 3 maniobras durante los 3min siguientes). Si el FEV1 cae un 20% o más, la PPB queda concluida. De lo contrario, se pasará a la concentración siguiente hasta alcanzar ese descenso o completar el resto de las preparaciones27,28. Para garantizar el efecto acumulativo de las dosis no deberán trascurrir más de 5min entre la administración de una concentración y la siguiente. Por razones de seguridad, una vez finalizada la prueba se administrará siempre un agonista adrenérgico β2 de acción corta (salbutamol o terbutalina), preferiblemente mediante cartucho presurizado, con el objeto de devolver al paciente a su situación basal.
Principales protocolos de provocación bronquial con metacolina
| Etapa | Concentración (mg/ml) | Tiempo nebulización (min) |
| Método de respiración a volumen corriente36 | ||
| Flujo nebulizador: 0,13 ml/min ± 10%; débito nebulizador en cada etapa: 90μl | ||
| 1 | 0,03 | 2 |
| 2 | 0,06 | 2 |
| 3 | 0,125 | 2 |
| 4 | 0,25 | 2 |
| 5 | 0,50 | 2 |
| 6 | 1 | 2 |
| 7 | 2 | 2 |
| 8 | 4 | 2 |
| 9 | 8 | 2 |
| 10 | 16 | 2 |
| Etapa | Concentración (mg/ml) | Inspiraciones (n) | Tiempo de nebulización (s) |
| Método de cinco inspiraciones con dosímetro38 | |||
| Flujo del nebulizador: 0,009ml durante 0,6 s ± 10%; débito nebulizador en cada etapa: 45μl | |||
| 1 | 0,0625 | 5 | 0,6 |
| 2 | 0,25 | 5 | 0,6 |
| 3 | 1 | 5 | 0,6 |
| 4 | 4 | 5 | 0,6 |
| 5 | 16 | 5 | 0,6 |
| Etapa | Concentración (mg/ml) | Inspiraciones (n) | Dosis (mg) | Dosis acumulada (mg) |
| Método dosimétrico de Chinn42 | ||||
| Dosímetro Mefar; débito nebulizador en cada inspiración: 0,010 ml | ||||
| Protocolo simplificado | ||||
| 1 | 0,39 | 4 | 0,0156 | 0,0156 |
| 2 | 1,56 | 3 | 0,0468 | 0,0625 |
| 3 | 6,25 | 3 | 0,1875 | 0,25 |
| 4 | 12,5 | 6 | 0,750 | 1,0 |
| 5 | 12,5 | 8 | 1,0 | 2,0 |
| Protocolo largo | ||||
| 1 | 0,39 | 2 | 0,0078 | 0,0078 |
| 2 | 0,39 | 2 | 0,0078 | 0,0156 |
| 3 | 1,56 | 1 | 0,0156 | 0,0312 |
| 4 | 1,56 | 2 | 0,0312 | 0,0625 |
| 5 | 6,25 | 1 | 0,0625 | 0,125 |
| 6 | 6,25 | 2 | 0,25 | 0,25 |
| 7 | 12,5 | 2 | 0,25 | 0,5 |
| 8 | 12,5 | 4 | 0,5 | 1,0 |
| 9 | 12,5 | 8 | 1,0 | 2,0 |
| Etapa | Concentración (mg/ml) | Nebulización | Dosis (mg) | Dosis acumulada (mg) |
| Método dosimétrico de Schulze44 | ||||
| Dosímetro APS pro; débito del nebulizador: 160-240 mg/min | ||||
| 1 | 16 | Por pulsos o continua | 0,01 | 0,01 |
| 2 | 16 | Por pulsos o continua | 0,10 | 0,11 |
| 3 | 16 | Por pulsos o continua | 0,40 | 0,51 |
| 4 | 16 | Por pulsos o continua | 0,80 | 1,31 |
| 5 | 16 | Por pulsos o continua | 1,60 | 2,91 |
El uso del diluyente sirve para familiarizar al sujeto con la técnica e identificar la existencia de labilidad bronquial. Una caída del FEV1 superior al 10% después de la inhalación del diluyente indica respuesta positiva28. El FEV1 post-diluyente será el valor de referencia para la comparación tras la administración de las distintas concentraciones de metacolina.
Dado que el procedimiento íntegro consume bastante tiempo, se han propuesto modificaciones que permiten comenzar la PPB con dosis de agente broncoconstrictor superiores a las recomendadas en el protocolo original, de modo que la primera concentración a administrar se decide considerando la presencia de síntomas respiratorios, la medicación habitual, el FEV1 basal y su caída tras la administración del diluyente (tabla 4)36. Si después de la primera concentración de metacolina no se produce una caída significativa en el FEV1 (disminución menor del 5% con respecto al valor de referencia) y no existen síntomas respiratorios, se puede hacer un salto de dosis y omitir la concentración inmediatamente posterior37. Se recomienda que esta simplificación del protocolo solo sea realizada por técnicos expertos.
Protocolo rápido para la realización de la prueba de provocación bronquial con metacolina
| Variables a considerar | Dosis inicial (mg/ml) |
| FEV1/FVC > 80% y FEV1> 70% y caída del FEV1basal tras la inhalación de la solución salina < 10% y síntomas bien controlados con: | |
| Corticoides inhalados u orales | 0,125 |
| Broncodilatadores diarios | 0,25 |
| Broncodilatadores ocasionales | 1 |
| Ninguna medicación | 2 |
| FEV1/FVC < 80% o FEV1< 70% y caída del FEV1basal tras la inhalación de la solución salina < 10% y síntomas bien controlados con: | |
| Corticoides inhalados u orales | 0,03 |
| Cualquier otra medicación o ninguna medicación | 0,125 |
| Caída del FEV1basal > 10% tras la inhalación de la solución salina o síntomas no controlados | 0,03a |
Modificada de Juniper et al.36
La omisión de concentraciones posteriores solo se puede realizar si, tras la concentración previa, la caída del FEV1 es menor del 5% y no han aparecido síntomas.
La principal limitación de este método radica en la dependencia del patrón respiratorio. De hecho, variaciones tanto en la frecuencia respiratoria como en la amplitud del volumen corriente pueden modificar la dosis administrada.
Método de 5 inspiraciones con dosímetroSe emplea un nebulizador de chorro conectado a un dosímetro, programado para nebulizar durante los primeros 0,6s de cada inspiración, generando un débito de 9μl±10% en dicho periodo27,28. Con este método se administra el diluyente y 5dosis crecientes de metacolina (de 0,0625 a 16mg/ml) (tabla 3)38.
Al acabar una espiración a volumen corriente, en situación de capacidad residual funcional (FRC), el sujeto se conectará a la boquilla y hará una inspiración lenta (durante 5s) hasta capacidad pulmonar total (TLC). Una vez alcanzada la inspiración máxima, mantendrá la apnea durante 5s, para espirar lentamente a continuación. Con periodos intermedios de respiración tranquila se repetirá este procedimiento hasta completar 5inhalaciones por cada concentración, en un periodo no superior a 2min. No deben transcurrir más de 5min entre las administraciones de cada nivel de concentración para que pueda producirse un efecto acumulativo27,28. Entre los 30-90s siguientes a la inhalación de cada concentración se realizará la espirometría. La secuencia de pasos a seguir hasta completar la prueba es idéntica a la descrita con anterioridad.
Se ha propuesto que las inspiraciones profundas y las fases de apnea que caracterizan este procedimiento pueden tener algún efecto broncoprotector en sujetos normales y pacientes con hiperrespuesta leve39. Por tanto, y aunque en la mayoría de pacientes con asma no existen grandes diferencias entre estos 2 métodos, en sujetos con hiperrespuesta leve las inspiraciones profundas pueden ser causa de falsos negativos al utilizar el método del dosímetro con respecto a la respiración a volumen corriente40,41.
Métodos dosimétricos simplificadosMinimizan el número de concentraciones a utilizar, disminuyendo así el trabajo del técnico y las posibles fuentes de error.
El método dosimétrico de Chinn fue diseñado para el European Community Respiratory Health Survey II, como protocolo abreviado (tabla 3)42. Se desarrolló para un dosímetro Mefar, que, programado para un tiempo de nebulización de 1s, determina un débito de 0,01ml de aerosol cada vez que es accionado43. La secuencia de cada inhalación requiere que, una vez conectado a la boquilla en FRC, el paciente inspire lentamente hasta TLC, manteniendo la apnea durante 3s, para desconectarse inmediatamente después de la boquilla. Se ha de procurar que la inspiración lenta y la apnea posterior sumen, al menos, 6s. Una vez realizada la espirometría basal, se llevarán a cabo 3inhalaciones del diluyente, repitiendo la espirometría a los 60s. Si el FEV1 disminuye >10% después del diluyente, se seguirá el protocolo largo (tabla 3). En el protocolo simplificado, se emplearán 4concentraciones para administrar 5dosis, realizando la espirometría 60s después de cada nivel de dosis e interrumpiendo la prueba si se registra una caída del FEV1 ≥20% con respecto al post-diluyente42,43. También en este caso, se administra un broncodilatador después de la última dosis.
El método dosimétrico de Schulze supone todavía una mayor simplificación, al utilizar una única concentración (16mg/min) para generar 5dosis crecientes (tabla 3) mediante dosímetros tipo APS, que permiten tanto la nebulización por pulsos como la continua44-46. Mientras que en adultos no existen diferencias entre ambos procedimientos, en niños se recomienda la nebulización continua por la mayor irregularidad del ciclo respiratorio46. En este método, la nebulización se realiza mientras el paciente respira a volumen corriente, con visión directa de su trazado respiratorio. Para garantizar un mayor depósito del aerosol en las vías aéreas se aconseja que el flujo inspiratorio no supere 0,5l/s46. Dos minutos después de la administración de cada dosis se efectúa la espirometría, manteniendo las mismas características de realización y finalización que en el resto de protocolos.
Medida e interpretación de los resultadosEl resultado de la PPB con metacolina se representa mediante una curva dosis-respuesta en la que el eje de abscisas refleja la dosis o la concentración acumulada de agonista inhalado y el de ordenadas, la modificación observada de la función pulmonar1,2,28,31,33.
El parámetro más clásico a estimar es la PD20, definida como la dosis acumulada de metacolina que reduce el FEV1 en un 20% (PD20FEV1) respecto al valor obtenido tras la administración del disolvente1,2,28,31,33. Para su cómputo recurriremos a la fórmula:
donde R1 es el porcentaje de FEV1 inmediatamente anterior a la caída ≥20%, R2 el porcentaje de caída de FEV1 ≥20%, D1 la dosis acumulada de metacolina inhalada en R1, y D2 la dosis acumulada de metacolina inhalada en R21,2,28,31,33,36.Los valores de PD20 son únicamente calculables cuando se utiliza dosímetro. En los sistemas de generación continua, y al desconocer con seguridad la dosis administrada, se empleará la fórmula anterior sustituyendo D1 y D2 por la concentración acumulada de agonista previa (C1) y la que induce la caída del FEV1 ≥20% (C2), respectivamente. El índice resultante se denominará PC20. PD20FEV1 y PC20FEV1 pueden también identificarse mediante interpolación directa desde la representación gráfica de los resultados28,36. Tanto los valores de PD20FEV1 como los de PC20FEV1 permiten clasificar la gravedad de la HB a la metacolina (tabla 5)28.
Otros parámetros de interés son la pendiente de la curva dosis-respuesta (que se obtiene aplicando un modelo de regresión lineal y nos informa sobre el grado de hiperreactividad bronquial) y la propia morfología de la curva, concretada por el valor de respuesta máxima o porcentaje de caída máxima del FEV1 que no aumenta a pesar de la inhalación de dosis crecientes del agonista31. La respuesta máxima se expresa como la media de los descensos de FEV1 que mantienen una variación inferior al 5% en 3concentraciones crecientes de agonista.
En los últimos años se ha propuesto trabajar con otros índices adicionales: deltaFVC, el índice de reactividad bronquial y el índice continuo de respuesta. DeltaFVC representa el porcentaje de descenso de la capacidad vital forzada cuando el FEV1 cae un 20% respecto a basal. DeltaFVC posiblemente diferencia mejor que PD20FEV1 o PC20FEV1 los niveles de gravedad del asma y refleja no solo la hipersensibilidad, sino también la afectación de la vía aérea pequeña y el atrapamiento aéreo47. Por su parte, el índice de reactividad bronquial y el índice continuo de respuesta podrían resultar más útiles para discriminar entre pacientes con HB asociada a asma o EPOC48, además de mantener una mejor relación con la calidad de vida relacionada con la salud de los asmáticos49.
Indicaciones, contraindicaciones y precauciones generalesLa indicación sustancial de las PPB inespecíficas en clínica es la de establecer o excluir el diagnóstico de asma, sobre todo cuando ni los síntomas ni la espirometría con broncodilatador permiten asegurar o descartar dicha contingencia. Ya se señaló líneas arriba que la PPB con estímulos directos resulta más útil para excluir asma (salvo en los casos de asma estacional u ocupacional sin exposición al agente causal), ya que tiene una mayor capacidad predictiva negativa que positiva18,28. El valor predictivo negativo máximo para descartar asma de una PPB con metacolina negativa ocurre cuando las probabilidades previas de asma oscilan entre el 30 y el 70%28,50. Las PPB inespecíficas mediante agentes inhalados sirven igualmente para monitorizar la respuesta terapéutica y el grado de control de la enfermedad, y es frecuente su utilización en estudios epidemiológicos, en ensayos clínicos controlados y en la valoración de enfermedades respiratorias de origen laboral (diagnóstico y seguimiento del asma ocupacional)28. La ausencia de respuesta bronquial a la metacolina en un paciente que haya estado expuesto a su ambiente laboral en las últimas 2semanas descarta el diagnóstico de asma ocupacional51. Por contra, los incrementos en la respuesta a metacolina, tras una exposición natural o provocada a un agente, sugieren su papel causal.
Establecida la indicación e informado de forma adecuada, el paciente ha de firmar el consentimiento correspondiente previa lectura del mismo y resolución de las dudas que se le presenten. Asimismo se le instruirá sobre la evitación de alimentos, bebidas estimulantes, medicamentos y otros factores susceptibles de modificar la respuesta broncomotora (tabla 6). En el momento de la prueba el paciente estará estable y libre de infecciones de la vía aérea durante las últimas 6semanas1,2,28.
Factores que alteran la dinámica bronquial e indicación del tiempo mínimo que debe transcurrir entre la exposición a los mismos y la realización de una PPB
| Factores que aumentan la hiperrespuesta bronquial | |
| Humo de tabaco | 2 h |
| Contaminantes atmosféricos | 1 semana |
| Vacunas con virus atenuados | 3-6 semanas |
| Infecciones virales respiratorias | 6 semanas |
| Sensibilizantes ocupacionales | 3 meses |
| Ejercicio intenso | 4 h |
| Factores que disminuyen la hiperrespuesta bronquial | |
| Betaadrenérgicos inhalados | |
| Acción rápida y corta | 12 h |
| Acción prolongada | 24 h |
| Betaadrenérgicos orales | 24 h |
| Bromuro de ipatropio | 12 h |
| Bromuro de tiotropio | 1 semana |
| Teofilinas (vía oral) | |
| De acción corta | 24 h |
| De acción prolongada | 48 h |
| Cromonas | 48 h |
| Antileucotrienos | 24 h |
| Antihistamínicos H1 | 72 h |
| Terfenadina, ceterizina, loratadina | 5 días |
| Astemizol | 30 días |
| Alimentos: café, té, bebidas de cola, chocolate | Día del estudio |
La PPB se llevará a cabo en una habitación bien ventilada y espaciosa y dispondrá de un equipo de resucitación cardiorrespiratoria en las inmediaciones. El diplomado/graduado en enfermería encargado de su realización contará con una formación de 6meses en un laboratorio acreditado de función pulmonar, tendrá los conocimientos necesarios para detectar y ayudar a resolver una urgencia respiratoria y habrá realizado con anterioridad al menos 25exploraciones supervisadas28. El médico responsable del laboratorio permanecerá cercano al lugar donde se lleve a cabo la exploración para atender cualquier imponderable que pueda presentarse. El personal facultado no debe ser asmático.
En cuanto a las contraindicaciones, estas se subdividen en absolutas y relativas (tabla 7)1,2,28. Algunos pacientes pueden presentar molestias faríngeas y tos seca. Los efectos son transitorios28,31. La aparición de una respuesta broncoconstrictora excesiva solo se detecta en contadas ocasiones52, sobre todo con los protocolos abreviados, pero es posible su prevención si determinamos los niveles de óxido nítrico en el aire exhalado (FENO) antes de realizar la PPB. Se ha señalado que valores de FENO inferiores a 19,5ppb descartan con razonable seguridad el desarrollo de esta circunstancia (sensibilidad del 80%, especificidad del 77%, valor predictivo negativo del 88%)53.
Contraindicaciones para la realización de la prueba de provocación bronquial con metacolina
| Absolutas |
| Limitación al flujo aéreo importante (FEV1 < 50% del valor de referencia o < 1 l) |
| Contraindicación o incapacidad, técnica o funcional, para realizar espiraciones forzadas reproducibles |
| Infarto de miocardio o accidente vascular cerebral en los 3 meses previos |
| Hipertensión arterial no controlada (sistólica > 200 o diastólica > 100mmHg) |
| Aneurisma de aorta |
| Arritmias cardiacas con síntomas o insuficiencia cardiaca |
| Epilepsia inestable |
| Relativas |
| Limitación al flujo aéreo moderada (FEV1 < 65% del valor de referencia o < 1,5 l) |
| Embarazo o lactancia materna |
| Utilización de medicación inhibidora de la colinesterasa |
| Epilepsia o cardiopatía estables |
La adenosina es un nucleósido endógeno implicado en numerosos procesos fisiológicos (control del tono vascular e intestinal, neurotransmisión, neurosecreción, etc.) y reacciones inflamatorias54. La síntesis tiene lugar dentro de las células a partir de la hidrólisis de la adenosina 5’-monofosfato (AMP) por la 5’-nucleotidasa, o por el catabolismo de la 5-adenosinhomocisteína. Cuando la concentración intracelular de AMP aumenta (hipoxia, activación celular), pasa al exterior para ser recaptada por la propia célula o unirse a receptores citoplásmicos de membrana (receptoresA)54-57. Se han detectado concentraciones elevadas de adenosina en el lavado broncoalveolar y en el condensado de aire exhalado de pacientes con asma y bronquitis crónica, comparado con el de individuos sanos, y modelos experimentales muestran que la adenosina se libera a la sangre como consecuencia de la provocación bronquial con alérgenos55,56.
La acción broncoconstrictora de la AMP inhalada es consecuencia de la liberación de histamina, interleucina-8, leucotrienoC4 y otros mediadores, a partir de los mastocitos, plaquetas, neutrófilos y células epiteliales, una vez activados sus receptoresA2B54,55. Otros mecanismos, como los neurosensoriales, el reflejo axónico y el estímulo colinérgico, también parecen importantes54,55,58.
Para la PPB, y por su mayor solubilidad en suero salino, se utiliza la sal disódica de AMP (adenosine 5’monophosphate sodiumsalt, Sigma Chem, St. Louis, MO, EE.UU.), que se dispensa como polvo seco de aspecto cristalino. El grado de pureza del producto es del 99-100%2. El preparado en polvo se mantiene almacenado en frigorífico con un desecante seco. La adenosina tiene la categoría de medicamento de claseC para el embarazo.
Direcciones de interés. Laboratorio distribuidor de la adenosina: Sigma-Aldrich Química, S.A. Calle Ronda de Poniente 3, 2. Tres Cantos. 28760, Madrid. Teléfono de contacto: +900101376. Fax: +900102028. Página Web: http://www.sigmaaldrich.com/spain/acerca.html. Dirección electrónica de contacto: esorders@sial.com.
Fundamentos técnicosPreparación de las dilucionesLa solución madre se prepara con el polvo de AMP y una solución de cloruro sódico al 0,9% estéril, obteniendo una concentración de AMP de 800mg/ml2,58. A partir de ella se habilitarán las diferentes concentraciones de AMP. Las recomendadas por la European Respiratory Society (ERS) son: 3,125, 6,25, 12,5, 25, 50, 100, 200 y 400mg/ml16. Otros autores utilizan concentraciones ligeramente diferentes (entre 0,03 y 256mg/ml)2. Las diluciones deben permanecer protegidas de la luz mediante frasco de topacio. Su estabilidad es de al menos 25semanas si las conservamos en nevera (4°C) y de menos de 10días si quedan expuestas a temperatura ambiente59. Por lo tanto, las diluciones se mantendrán siempre en frigorífico hasta 30min antes de su utilización.
EquipamientoSistemas de nebulizaciónAl igual que sucede con la metacolina, el test de adenosina puede ejecutarse mediante el sistema de generación continua o con la técnica dosimétrica, que es por la que se decanta la ERS16. Para las especificaciones generales de ambos métodos, véase el anterior párrafo «Sistemas de nebulización» en el apartado «Pruebas de provocación bronquial con estímulos inespecíficos directos: metacolina».
Registro de la respuestaEl registro de la respuesta evocada por la adenosina se realiza habitualmente analizando los cambios en FEV1 y sirven, por tanto, todos los comentarios generales realizados líneas arriba al exponer el registro de la respuesta cuando se recurre a la metacolina como agente broncoprovocador.
ProcedimientosEl procedimiento a seguir con la PPB con AMP, ya sea con respiración espontánea del aerosol o con dosímetro, es superponible al descrito para la metacolina. El primer aerosol estará compuesto por suero salino fisiológico al 0,9% y, si no se constata un descenso del FEV1 mayor del 20%, se iniciará la nebulización del AMP, en concentraciones dobles progresivas, desde la dosis inicial (3,125mg/ml) hasta la máxima (400mg/ml). Se medirá el FEV1 2min después de cada dosis, y la mayor medida de 3determinaciones reproducibles, con una variación menor de 100ml, será recogida para crear la curva dosis-respuesta2,16,58. La prueba quedará interrumpida cuando se observe una caída del FEV1 mayor o igual al 20% respecto al diluyente, una vez alcanzada la dosis máxima permitida, o en caso de síntomas o signos de broncoespasmo2,16,58.
Aunque este protocolo es el que con más éxito se ha practicado en niños y adultos, existe otra variante abreviada en la que se administran dosis cuádruples de la misma, consiguiendo idéntica reproducibilidad pero con un menor consumo de tiempo (25-30min) y sin más efectos adversos60.
Medida e interpretación de los resultadosAl igual que con la metacolina, se construirá una curva dosis-respuesta, considerando la caída del FEV1 y la dosis de AMP. El resultado de la exploración se expresa mediante PC20 o PD20 obtenidos por interpolación lineal. Si el FEV1 no desciende al menos un 20% tras la concentración máxima (400mg/ml), se otorga un valor de PC20 o PD20 >400mg/ml16,58. Ahora bien, los puntos de corte de PC20 o PD20AMP entre sanos y sujetos con HB son todavía arbitrarios (160-200mg/ml), dado que aún carecemos de análisis poblacionales suficientemente amplios58. El coeficiente de repetibilidad de la PPB con AMP oscila entre 1 y 1,2 dosis dobladas16,58 y los estudios publicados hasta la fecha coinciden en afirmar que se trata de un broncoconstrictor menos potente que la metacolina o la histamina tanto en asmáticos como en pacientes con EPOC o rinitis alérgica61.
Indicaciones, contraindicaciones y precauciones generalesPrácticamente todos los asmáticos, atópicos o no, responden con broncoconstricción a la inhalación de concentraciones de AMP ≤400mg/ml, aunque este hallazgo se observa igualmente en algunos individuos sanos y en la EPOC o rinitis alérgica58. Dicho de otro modo: la provocación con adenosina es mucho más específica que sensible: sirve para confirmar asma pero no descarta otras posibilidades diagnósticas. Más allá de ello, existen otros escenarios en los que su utilización puede estar bien justificada. Por ejemplo, la broncoconstricción observada tras inhalar AMP guarda una relación estrecha con la magnitud de la eosinofilia existente en el tracto respiratorio del asmático, refleja el estado de activación de los mastocitos y es un indicador de la carga y la actividad alergénica58,61. También parece claro que la respuesta a la adenosina se modifica de forma más precoz, sensible e intensa tras corticoides inhalados que la de la metacolina58,61.
Bajo tales premisas, no debe extrañar que la PPB con adenosina se haya planteado como una buena herramienta en 2contextos concretos58,61,62: a)para ensayos clínicos orientados a monitorizar la respuesta a corticoides, montelukast, omalizumab, evitación alergénica o inmunoterapia específica, y b)para identificar qué pacientes controlados con corticoides inhalados van a tolerar la reducción/retirada del tratamiento sin desestabilizarse o conocer cuál es su mínima dosis efectiva.
No existe limitación específica alguna para la adenosina, salvo la hipersensibilidad demostrada al propio producto, y aquí se aplica el listado de contraindicaciones absolutas y relativas ya señaladas para la PPB con metacolina2,58,61. Antes de la exploración con AMP se suspenderán antihistamínicos, agonistas β2-adrenérgicos, antimuscarínicos, teofilinas, cromonas y antileucotrienos, recordando además que la adenosina es extremadamente sensible al efecto de los glucocorticoides inhalados y que estos serán suprimidos 12h antes. Los técnicos y los médicos encargados de la exploración estarán debidamente entrenados en las técnicas de provocación bronquial y capacitados para manejar crisis asmáticas graves.
ManitolFundamentos básicosEsta sustancia es un alcohol hexahídrico de azúcar (C6H14O6), de masa molecular 182,17g/mol, esteroisómero del sorbitol63,64. Hasta los años veinte del siglo pasado su fuente fue manna, un producto derivado del calentamiento de la corteza del árbol Fraxinusornus. Actualmente es producido por hidrogenación de alta presión, pero la fabricación mediante fermentación está ya en camino63,65. Provisto de propiedades osmóticas, el manitol se ha venido aprovechando durante decenios como aditivo alimentario (en alimentos dietéticos y goma de mascar), introduciéndose —también hace años— en el campo médico para aliviar la hipertensión intracraneal, sustituir al plasma sanguíneo o como diurético63. Por vía inhalada, el manitol deshidrata la mucosa bronquial, y esa deshidratación se acompaña de un incremento de la osmolaridad en la mucosa y de liberación de mediadores inflamatorios desde los mastocitos, con un perfil muy similar al evocado por la adenosina17,64,66,67. Su uso como agente de provocación bronquial fue aprobado en 2006 en Australia y posteriormente en los países de la Unión Europea (2007), Asia y Estados Unidos (2010). En nuestro país la autorización data de julio de 2008.
En el mercado español y para el análisis de la HB, el manitol está comercializado en forma de cápsulas con dosis prefijadas de polvo seco (Osmohale™).
Los datos de uso de Osmohale™ durante el embarazo son limitados. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción. De todos modos, se desconocen los efectos de una posible reacción de hiperreactividad sobre la madre y/o el feto y, en consecuencia, no debería administrarse Osmohale™ a mujeres embarazadas68. En cuanto a la lactancia, no se prevén efectos en neonatos lactantes, puesto que la exposición sistémica al manitol en madres en periodo de lactancia es insignificante. Los estudios con manitol por vía oral no sugieren tampoco efectos sobre la fertilidad68.
Direcciones de interés. Laboratorio distribuidor de Osmohale™: Aldo-Unión, S.A. Baronesa de Maldá 73. 08950 Esplugues de Llobregat, Barcelona. Teléfono de contacto: +34933727111. Fax:+34933716198. Página Web: http://www.aldo-union.com/. Dirección electrónica de contacto: info@aldo-union.com. Información general sobre la prueba: http://www.aridol.info/spain.
Fundamentos técnicos, equipamiento y registro de la respuestaLa prueba del manitol exige menos equipamiento y es mucho más simple que los otros test indirectos (particularmente los relacionados con el ejercicio), aportando resultados razonablemente superponibles63. El kit Osmohale™ lo componen 19cápsulas (una sin producto activo, tres de 5, 10 y 20mg, respectivamente, y 15 de 40mg) acompañadas de dispositivo inhalador de polvo seco (Inhalator™, Boehringer Ingelheim, Alemania). Para el registro de la respuesta se emplea por lo común el FEV168.
ProcedimientosLos pasos a seguir son los siguientes68: a)con el paciente cómodamente sentado, se le coloca una pinza en la nariz y se le dan instrucciones para que respire por la boca; b)se inserta la cápsula con 0mg en el dispositivo y se perfora la cápsula presionando cuidadosamente los botones ubicados en los costados del dispositivo una sola vez, dado que una segunda perforación podría romperla; c)el paciente exhalará completamente fuera del inhalador, y a continuación inclinará ligeramente la cabeza hacia atrás, sosteniendo el dispositivo a 45° para realizar la maniobra de inspiración, que será profunda, rápida y corta; d)tras la inspiración, debe ponerse a funcionar un temporizador de 60s; el paciente debe contener la respiración durante 5s y exhalar por la boca antes de retirar la pinza nasal; e)pasados los 60s se realiza una espirometría, midiendo el FEV1 como mínimo por duplicado, con el fin de obtener 2 mediciones reproducibles; la lectura mayor será el valor basal del FEV1; f)se inserta la cápsula de 5mg en el inhalador y se procede según se ha indicado anteriormente, y g)las siguientes dosis a administrar serán: 10mg, 20mg, 40mg, 80mg (2cápsulas consecutivas de 40mg), 160mg (4cápsulas de 40mg) y 160mg (4cápsulas de 40mg); la prueba se detendrá cuando se alcance la dosis total de 635mg o aparezca en algún momento una respuesta positiva.
Después de la inhalación de cada dosis, hay que comprobar que la cápsula está vacía. Si no se ha vaciado por completo, se realizará una segunda inhalación68. Completada la prueba, se administrará una dosis estándar de un agonista β2-adrenérgico de acción rápida. La duración del test es variable y depende, lógicamente, de si se detecta HB (17±7min) o no (26±6min)69.
Medida e interpretación de los resultadosSe considera respuesta positiva cuando68: a)se objetiva una caída del FEV1 ≥15% respecto al valor basal (usando el valor del FEV1 tras la administración de 0mg como comparador) (PD15), o b)aparece una disminución incremental del FEV1 ≥10% entre 2dosis consecutivas. Algunos estudios aconsejan utilizar el dintel de caída del 10% (PD10) calculado por interpolación de la curva dosis-respuesta log-lineal y así clasifican la HB de los asmáticos en grave (0-75mg), moderada (75-315mg) o leve (315-635mg)70.
La repetibilidad de la prueba con manitol es similar o mejor que otras PPB que utilizan fármacos, tanto en adultos67,71 como en niños72,73. Sin embargo, tras pruebas repetidas en un corto espacio de tiempo hay un período refractario (lo mismo que ocurre con la broncoconstricción inducida por el ejercicio) debido a un fenómeno de taquifilaxia en la respuesta del MLVA a los mediadores contracturantes liberados desde los mastocitos74.
Indicaciones, contraindicaciones y precauciones generalesLa prueba con manitol traduce en buena medida la intensidad de la inflamación de la vía aérea asmática, se modifica por la acción de los corticoides inhalados y su PD15 mantiene una estrecha asociación con: a)las respuestas evocadas por otros estímulos indirectos (adenosina, ejercicio, hiperpnea eucápnica y salino hipertónico), y b)la cantidad de eosinófilos en esputo y laFENO63,66. La especificidad de manitol en el diagnóstico de asma está por encima del 95%, su sensibilidad en torno al 60% y sus valores predictivos dependen de la probabilidad pretest de asma63,66,75. La sensibilidad aumenta hasta casi el 90% cuando se excluye a los pacientes con tratamiento esteroideo69.
Así las cosas, la PPB con manitol se presenta como una herramienta de gran interés a la hora de evaluar la efectividad del tratamiento antiasmático y establecer el grado de control alcanzado e incluso monitorizar la evolución del asma ocupacional18,63,66,76. Paralelamente, la técnica facilita la colección de secreciones bronquiales (que aumentan tras su realización), lo cual proporciona, si se quiere, una fuente adicional de análisis de la inflamación bronquial en un momento determinado77.
Por último, y no menos importante, el test de manitol inhalado constituye una alternativa a considerar para el diagnóstico del asma de esfuerzo con una eficacia similar a la obtenida con la hiperventilación eucápnica63,78,79. En este sentido, el Comité Olímpico Internacional ha aprobado su uso para el estudio de la HB en atletas de élite y para justificar el empleo de agonistas β2-adrenérgicos antes de una competición deportiva64.
Manitol resulta un compuesto seguro y los efectos secundarios más comúnmente observados son la tos (83%), que en algunas ocasiones puede llegar a motivar la interrupción de la prueba, y la cefalea68,69. El efecto tusígeno está asociado al asma independientemente de la broncoconstricción y tiende a disminuir tras el tratamiento con esteroides inhalados. La cefalea suele aparecer con mayor frecuencia en los sujetos con una prueba negativa probablemente por el alto número de maniobras de espiración forzada realizadas68,69. El listado completo de sus efectos adversos aparece en la tabla 8.
Efectos adversos del manitol inhalado
| Frecuentes (afecta a < 1 de cada 10 personas, pero ≥ 1 de cada 100 personas) |
| Tosa |
| Cefalea |
| Nasofaringitis |
| Dolor laringofaríngeo |
| Rinorrea |
| Disnea |
| Náuseas, vómitos |
| Opresión torácica |
| Poco frecuentes (afecta a < 1 de cada 10 personas pero ≥1 de cada 1.000 personas) |
| Mareo |
| Irritación ocular |
| Ronquera |
| Epistaxis |
| Erotema, extremidades frías |
| Epigastralgia |
| Diarrea |
| Úlcera bucal |
| Prurito, hiperhidrosis |
| Dolor musculoesquelético |
| Fatiga, sensación de nerviosismo |
| Sed |
Modificada de Ficha técnica Osmohale™ polvo para inhalación68.
Para el test con manitol se deberán observar las precauciones generales relativas a la realización de espirometrías y PPB que ya han sido enumeradas in extenso en los apartados anteriores, incluidas precauciones adicionales en pacientes con hemoptisis de origen desconocido, neumotórax y cirugía abdominal o torácica reciente68.
EjercicioFundamentos básicosEl ejercicio físico provoca broncoespasmo en una proporción importante de pacientes asmáticos80. Además, resulta el único desencadenante en un grupo de enfermos que practican deporte o que ejercen una profesión con alta demanda de esfuerzo físico, definiendo así la entidad conocida como asma inducido por el ejercicio (AIE). La prevalencia de AIE se ha estimado en el 40-90% de los asmáticos, en el 10-50% de los atletas de élite, en el 20-35% de los patinadores de hielo, en el 30-50% de los competidores en esquí nórdico, en el 15% de los corredores de fondo y en el 11-28% de los nadadores de competición81. Como factores predisponentes tiene especial relevancia la atopia (en particular en corredores de fondo), la alta concentración de contaminantes procedentes de la ignición de combustibles fósiles en el aire inspirado y la inhalación de cloraminas en las piscinas. Si no se documenta la presencia de una obstrucción reversible, para el diagnóstico de AIE es necesario realizar una prueba de provocación bronquial por el ejercicio (PPBE) u otra provocación bronquial alternativa que esté adecuadamente acreditada para sustituirla28,81,82.
El desarrollo del broncoespasmo inducido por el ejercicio (BIE) se ha justificado mediante 3hipótesis patogénicas: la térmica, la osmolar y la capilar. La teoría térmica atribuye el broncoespasmo a un reflejo adrenérgico desencadenado por la pérdida de temperatura de las vías aéreas83. La hiperventilación originada por el ejercicio también aumenta la osmolaridad periciliar, por la deshidratación del líquido de revestimiento de la superficie de las vías aéreas, lo que podría favorecer la desgranulación de mastocitos y la liberación de mediadores inflamatorios84. Por último, la teoría hiperémica o capilar propone que la vasoconstricción microvascular debida al enfriamiento de la pared de las vías aéreas durante el ejercicio es seguida por un rápido recalentamiento en el periodo de recuperación, que determina hiperemia reactiva y edema de las vías aéreas85. Dado que ninguna de estas teorías fisiopatológicas explica completamente el fenómeno, se plantea que el mecanismo patogénico puede ser diferente para cada individuo, tipo de ejercicio y condición ambiental.
El BIE tiene, en la mitad de los pacientes, un periodo refractario consistente en la disminución de la respuesta broncoconstrictora cuando el esfuerzo se repite en un intervalo inferior a 2h80. Este fenómeno, que puede ser cruzado entre diversos estímulos indirectos16,71, se atribuyó a la depleción de los depósitos de mediadores inflamatorios por parte de los mastocitos16. Sin embargo, todavía se mantiene la controversia sobre su origen, e hipótesis más recientes consideran que puede ser debido a la ausencia de respuesta al estímulo hiperosmolar en el ejercicio repetido86.
Fundamentos técnicosIndicaciones, contraindicaciones y precauciones generalesLas principales indicaciones de la PPBE son82: a)confirmar el diagnóstico de AIE, especialmente en sujetos con espirometría normal y prueba de broncodilatador negativa con alta sospecha clínica, por su mayor sensibilidad que la hiperventilación isocápnica con aire frío; b)estratificar la gravedad del asma; c)prevención en profesiones y deportistas en los que un BIE puede poner en riesgo la vida propia o ajena; d)control de la terapia antiinflamatoria, y e)estudios epidemiológicos. En la tabla 9 se recogen las principales contraindicaciones de la prueba. Además de las recomendaciones habituales para la provocación bronquial inespecífica27,28, no se debe realizar una PPBE en pacientes con isquemia cardiaca inestable, arritmias malignas o limitación ortopédica que impida la realización de un ejercicio de alta intensidad87.
Contraindicaciones de la provocación bronquial por ejercicio
| Absolutas | Relativas |
| Limitación grave al flujo aéreo (FEV1 < 50% predicho o < 1,0 l) | Limitación moderada al flujo aéreo (FEV1 < 60% predicho o < 1,5 l) |
| Insuficiencia respiratoria | Estenosis coronaria principal izquierda o equivalente |
| Infarto de miocardio reciente (3-5 días) o angina inestable | Estenosis valvular moderada |
| Arritmia no controlada que provoca síntomas o compromiso hemodinámico | Hipertensión arterial grave no controlada (> 120/200mmHg) |
| Síncope | Taquiarritmias, bradiarritmias o bloqueo auriculoventricular de alto grado |
| Endocarditis activa | Cardiomiopatía hipertrófica |
| Miocarditis o pericarditis aguda | Hipertensión pulmonar moderada-grave |
| Estenosis aórtica grave sintomática | Gestación avanzada o complicada |
| Insuficiencia cardiaca no controlada o edema pulmonar | Alteraciones electrolíticas |
| Embolismo pulmonar agudo, infarto pulmonar o trombosis venosa profunda | Trastorno ortopédico que comprometa la realización de ejercicio |
| Sospecha de aneurisma disecante | |
| Otro trastorno que puede afectar a la realización de ejercicio o ser agravado por el mismo (infección, insuficiencia renal, tirotoxicosis) | |
| Deterioro cognitivo que incapacite para colaborar en la realización de la prueba |
La PPBE debe ser directamente supervisada, tanto durante el ejercicio como en el periodo de recuperación, por un médico o un técnico experimentado suficientemente entrenados para detectar problemas respiratorios o cardiacos relacionados con el ejercicio. En este último caso debe garantizarse la rápida disponibilidad de un médico para el tratamiento de cualquier complicación. Se recomienda la realización previa de un electrocardiograma (ECG) de 12derivaciones en pacientes mayores de 60años o con cualquier trastorno cardiovascular conocido28. A su vez, debe contarse con un carro de parada, suficientemente dotado, en la zona de realización de las pruebas de ejercicio.
Preparación del paciente y condiciones ambientalesEl paciente no debe haber realizado ejercicio físico vigoroso en las 4h previas al estudio, llevará ropa y calzado adecuados, habrá tomado una comida ligera con un tiempo de ayuno de 2h previas al estudio y debe haber cumplido el intervalo libre de tratamientos del asma. Es necesario tener presente que los corticosteroides inhalados e intranasales disminuyen la intensidad y la prevalencia del BIE, especialmente en niños88. Aunque no supone una contraindicación formal, sería recomendable que, en situación basal, el paciente tenga un FEV1 >75% del predicho o >80% del previo, con una variabilidad menor del 10%, y una saturación de oxihemoglobina (SpO2) >94%80. También se recomienda que hayan pasado más de 6semanas desde la última infección del tracto respiratorio y, en sujetos sensibilizados a pólenes, no hacer la prueba en época de polinización.
Un incremento de la humedad ambiental reduce el BIE89, mientras que el frío lo incrementa90. Por tanto, se recomienda registrar la humedad y la temperatura del aire inspirado en el momento de realizar la PPBE. Debe llevarse a cabo en condiciones ambientales de temperatura comprendida entre 20 y 25°C y con una humedad relativa menor al 50% (10mgH2O/l). La realización de la prueba en una habitación con aire acondicionado, programado para las condiciones de temperatura indicadas, puede resultar suficiente para alcanzar estos requisitos. Si no es posible obtener estas condiciones, se recomienda la respiración de un reservorio de aire medicinal seco a través de una válvula a demanda o de un regulador91.
ProcedimientosEl ejercicio debe durar de 6 a 8min, o hasta 6min en menores de 12años27. Además, se aconseja que los pacientes utilicen una pinza nasal, dado que la respiración nasal reduce la pérdida de agua desde las vías aéreas28. Para la monitorización de la intensidad del ejercicio en niños pueden utilizarse la ventilación o la frecuencia cardiaca. En adultos se recomienda registrar la ventilación, dado que, además de ser el desencadenante del BIE, resulta menos variable que la frecuencia cardiaca y no tan dependiente del grado de entrenamiento92.
Para el registro de la ventilación es preferible una boquilla y una pinza nasal, aunque si se opta por una mascarilla nasobucal debería incluirse un oclusor nasal. La intensidad del ejercicio debe garantizar que el paciente mantenga durante los últimos 4-6min una ventilación superior al 40-60% de su máxima ventilación voluntaria (calculada como FEV1[l]×35)27. El control de la frecuencia cardiaca debe realizarse de forma sistemática con un ECG de 3derivaciones, o de 12 si hay riesgo de síndrome coronario27. En caso de monitorización por frecuencia cardiaca, la intensidad del esfuerzo debe modularse para conseguir, en menos de 4min, una frecuencia cardiaca diana entre el 80 y el 90% (en deportistas de alto nivel se recomienda en torno al 95%) de la máxima frecuencia cardiaca estimada (calculada como 208–edad en años×0,7). También se recomienda la monitorización de la SpO2 durante todo el estudio, o al menos al inicio y al final del mismo28.
Para la realización de una PPBE se puede emplear tanto un cicloergómetro como un tapiz rodante. El rendimiento de ambos sistemas resulta equivalente para niveles similares de intensidad de ejercicio93. Si se dispone de ambos, debe emplearse el que mejor se adapte a la práctica deportiva desarrollada por el individuo estudiado. Con el tapiz rodante se adaptará la pendiente y la velocidad hasta lograr la ventilación o la frecuencia cardiaca dianas. Se comenzará aumentando la velocidad hasta un ritmo de marcha rápido pero cómodo y se irá incrementando progresivamente la pendiente durante los 2 o 3 primeros minutos hasta alcanzar la intensidad de ejercicio necesaria. Un protocolo típico es comenzar con una velocidad de 4,5km/h con una pendiente del 2,5%80. Para el cálculo de la carga de trabajo en cicloergómetro se propone utilizar: 53,76×FEV1[l]–11,0728. El 60% de la potencia (watios) así calculada deberá aplicarse en el primer minuto, el 75% en el segundo, el 90% en el tercero y el 100% en el cuarto28. Cuando el sujeto alcance el nivel de ventilación necesario, se mantendrá la potencia durante los siguientes 4min, aunque puede ser necesario reducirla ligeramente para lograr que soporte la ventilación diana durante 4-6min.
Las directrices de seguridad y las causas de detención de la PPBE son las propias de las pruebas de esfuerzo87. Aunque en algunos estudios epidemiológicos se ha utilizado la carrera libre como otra modalidad de provocación por ejercicio, alcanza una baja sensibilidad y especificidad para detectar BIE (60-67 y 47-67%, respectivamente)94, por lo que no existe suficiente evidencia para recomendarla como procedimiento diagnóstico. Además, no permite monitorizar la intensidad del ejercicio ni controlar la seguridad del paciente durante la provocación.
Valoración de la respuestaSe debe realizar una espirometría de referencia inmediatamente antes del ejercicio y repetirla a los 5, 10, 15, 20 y 30min de su finalización28. Si el FEV1 ha retornado a su valor basal (±5%) a los 20min, se puede evitar la espirometría de los 30min post-ejercicio28. En cada etapa del registro se obtendrán 2maniobras reproducibles para la variable de medida (diferencia FEV1<0,15l) y se elegirá la que tenga el mayor FEV128. Las maniobras espirométricas deben cumplir los criterios de aceptabilidad para el inicio de la maniobra34, aunque no es preciso prolongar el tiempo espiratorio más allá de los 2-3 primeros segundos28. La sospecha de disfunción de las cuerdas vocales constituye una excepción para esta recomendación. Ante la misma, es necesario obtener curvas flujo-volumen completas y lo antes posible después del ejercicio, para demostrar la existencia de limitación del flujo inspiratorio27.
Las espirometrías seriadas post-ejercicio no se detendrán a menos que el paciente presente una caída del FEV1>50%, en cuyo caso se administrarán broncodilatadores inhalados de forma inmediata. Ante la persistencia de una disminución del FEV1 al concluir las mediciones, se administrará un agonista ß2-adrenérgico de acción rápida y el paciente deberá permanecer en observación hasta que recupere el 95% de su valor basal27,28. No se recomienda el registro de la potencial respuesta tardía, puesto que la interpretación de una caída en la función pulmonar a las 3-8h de finalizado el ejercicio no es clara27.
Medida e interpretación de los resultadosEl resultado de la PPBE se expresa mediante una curva tiempo-respuesta, siendo la respuesta el porcentaje de caída del FEV1 respecto al valor previo al ejercicio. Se considera que una PPBE es positiva cuando el FEV1 disminuye más del 10% con respecto al basal28. A su vez, el BIE se clasifica como leve cuando la caída del FEV1 está comprendida entre el 10 y el 25%, moderado entre el 25 y el 50% y grave si es mayor del 50%95. En estudios epidemiológicos puede resultar de utilidad expresar la intensidad de la respuesta mediante la determinación del área bajo la curva tiempo-respuesta, utilizando un procedimiento trapezoidal sobre la representación gráfica95.
Siguiendo un protocolo estricto se logra asegurar generalmente una buena reproducibilidad en la caída del FEV1 con un coeficiente de variación del 15% en una semana y del 21% en un mes95. Para el diagnóstico de AIE, la PPBE aporta más especificidad que los estímulos directos, aunque es notablemente menos sensible16,58,96. En niños, alcanza una elevada especificidad para la detección de BIE, aunque su sensibilidad es más discreta97. En adultos, no aumenta la sensibilidad y la especificidad resulta menor que la obtenida en niños98.
Hiperventilación voluntaria eucápnicaFundamentos básicosLos mecanismos anteriormente mencionados que desencadenan broncoconstricción en respuesta al ejercicio intenso se pueden simular realizando una hiperventilación eucápnica99.
Fundamentos técnicosEquipamientoSe requiere que el sujeto hiperventile voluntariamente aire seco a temperatura ambiente (o frío) en un circuito de baja resistencia, que contiene un 5% de CO2 para mantener una pCO2 similar a la del esfuerzo. El aire inspirado debe ser seco y contener un 21% de O2, 4,9-5,1% de CO2 y resto balanceado de N2. Lo más sencillo es disponer de una botella con esta mezcla de gases conectada a un reservorio (balón meteorológico o similar, de 120l), del que respira el paciente a través de una válvula unidireccional de baja resistencia. Es posible añadir CO2 al aire inspirado, pero esto requiere medir la fracción end-tidal de CO2 para mantener la eucapnia, lo que añade complejidad a la prueba. También se puede enfriar el aire inspirado. En pacientes asmáticos, la respuesta a 4min de hiperventilación con aire frío es equivalente a la obtenida tras una hiperventilación con aire ambiente durante 8min100.
Durante la prueba se debe medir el volumen minuto, preferiblemente con un espirómetro de turbina, para verificar que se alcanza la ventilación minuto marcada como objetivo. Como en otras PPB, se realizarán espirometrías seriadas para evaluar la respuesta. El equipamiento requerido es similar al propuesto para la realización de una espirometría estándar34,35.
ProcedimientoLa prueba es susceptible de provocar en el paciente una situación incómoda, por lo que deben explicársele los motivos que la indican, lo que se espera conseguir, así como pedirle su colaboración en mantener una ventilación máxima durante el tiempo requerido y en la realización de las espirometrías. Se valorará la existencia de factores conocidos capaces de modificar la respuesta a la hiperventilación (tabla 5)28. Resulta de especial importancia indicar al paciente que no debe realizar ejercicio físico intenso en las 4h previas a la prueba (o mejor, el día de la prueba), ya que puede aparecer refractariedad101. Los broncodilatadores ß2-adrenérgicos de acción corta o larga y los anticolinérgicos pueden prevenir la respuesta a la hiperventilación102. También existe evidencia de que la administración de cromonas puede inhibir la respuesta a la hiperventilación isocápnica103. Estudios con pocos pacientes también han demostrado que la administración de montelukast 6h antes de la prueba tiene un efecto protector frente a la hiperventilación104. En cuanto a los corticoides inhalados, hay datos que muestran que la respuesta a la hiperventilación está disminuida, tanto con su uso crónico (6meses) como agudo (4h)99,105.
ProtocolosSe dispone de un protocolo de paso único y otro de varias etapas.
Protocolo de paso únicoEs el más utilizado, sobre todo para el estudio de atletas de élite con sospecha de AIE106. Requiere que el sujeto realice una hiperventilación voluntaria durante 6min manteniendo como objetivo una ventilación minuto mayor de 30×FEV1 (medido antes del comienzo de la prueba), que es equivalente al 85% de la máxima ventilación voluntaria (MVV). En algunos casos la prueba puede resultar positiva aun sin alcanzar este nivel de hiperventilación. Se llena inicialmente el balón meteorológico con 90l de gas y después se mantiene un llenado a un ritmo próximo a la ventilación minuto que el sujeto debe mantener. El sujeto respira a través de una válvula unidireccional, inspirando de la bolsa que se utiliza como reservorio y espirando al aire de la habitación. Una vez comenzada la hiperventilación, se debe animar al sujeto para que mantenga el ritmo de la ventilación utilizando como referencia la inflación y deflación del balón.
Protocolo de varios pasosEs más seguro y deber utilizarse cuando el FEV1 basal sea menor del 75% o haya sospecha de asma moderada-grave107. La tasa de ventilación se incrementa a lo largo de 3 pasos:
- -
Paso 1: 3min al 30% de la MVV.
- -
Paso 2: 3min al 60% de la MVV.
- -
Paso 3: 3min al máximo de ventilación.
Después de cada paso se evalúa la respuesta con la medida del FEV1 y, si resulta negativa, se realiza el siguiente paso.
La respuesta a una broncoprovocación con idéntica hiperventilación es reproducible cuando se realiza en días separados108.
Medida e interpretación de los resultadosLa broncoconstricción en respuesta a la hiperventilación se objetiva por el porcentaje de caída del FEV1. En el protocolo con un solo paso, la prueba se considera positiva si hay una caída del FEV1≥10%109. El estímulo se informa como la media de la ventilación minuto durante los 6min de la prueba, expresada como porcentaje de la MVV teórica (que se calcula multiplicando el FEV1 medido por 35). La ventilación máxima que alcanza una persona sana durante el ejercicio raramente excede el 60% de la MVV, y en el caso de atletas de elite, el 90%. La respuesta provocada por la hiperventilación se considera leve si el FEV1 cae un 10-19,9% con una ventilación igual o mayor al 60% de la MVV, moderada si cae entre un 20-29,9% y grave si la caída es ≥30% para cualquier grado de ventilación o si la caída es >10% con una ventilación menor del 30% de la MVV109.
En el protocolo por pasos, se evalúa la respuesta en los minutos 1, 3, 5, 7 y 10 después de cada paso. Si el FEV1 desciende más del 15%, se detiene la prueba. Si no desciende o se alcanza una meseta con valores inferiores al 15% después del minuto 5, se pasa al siguiente nivel. Después del tercer paso, se realizan espirometrías seriadas a los 5, 10, 20 y 30min o hasta que el FEV1 del sujeto haya vuelto a su valor basal. La ventilación minuto que provoca un 10% de caída del FEV1 (PVE10) se calcula por interpolación lineal, utilizando la respuesta a cada nivel de ventilación, y se expresa como porcentaje de la MMV teórica del sujeto.
Indicaciones, contraindicaciones y precauciones generalesLa PPB con hiperventilación voluntaria eucápnica está recomendada por el Comité Olímpico Internacional para el diagnóstico de AIE en atletas de élite. Constituye una alternativa a la PPBE, anteriormente descrita, que presenta falsos negativos por la dificultad de controlar las condiciones ambientales en el laboratorio. La hiperventilación eucápnica ofrece la posibilidad de realizar la evaluación en el laboratorio, con unas condiciones ambientales controladas (aire seco a temperatura ambiente o frío). En estudios de campo ha mostrado mayor capacidad para identificar el AIE que la provocación con ejercicio110. Las contraindicaciones de la hiperventilación voluntaria eucápica son las mismas que para la PPB con metacolina.
Como otras pruebas de broncoprovocación con estímulos indirectos, la hiperventilación eucápnica se correlaciona bien con la inflamación en la vía aérea y tiene una alta especificidad para el diagnóstico de asma. La hiperrespuesta a estímulos indirectos, que requiere la presencia de células inflamatorias en la vía aérea, se atenúa con el tratamiento con corticoides inhalados y, por tanto, puede utilizarse para medir el control de la inflamación111.
La hiperventilación voluntaria eucápnica presenta una mayor rentabilidad que la metacolina para identificar atletas con AIE112. En asmáticos no deportistas con síntomas de AIE existe una pobre concordancia entre ambas técnicas, con más resultados positivos al provocar mediante hiperventilación113.
Pruebas de provocación bronquial con salino hipertónicoFundamentos básicosLa inhalación de aerosoles salinos no isotónicos puede ocasionar broncoconstricción por la liberación de mediadores endógenos que causan contracción del MLVA y edema17. Los cambios en la osmolaridad de las vías aéreas originados por este tipo de aerosoles favorecen la liberación de mediadores, como la histamina, los leucotrienos y las prostaglandinas114,115, además de originar una alteración neural, con liberación de neuropéptidos y un incremento del tono parasimpático116. De hecho, fármacos que disminuyen la liberación de mediadores mastocitarios o que modifican la actividad neural no-colinérgica, como el nedocromil o la furosemida, desempeñan un papel protector frente a la HB por suero salino hipertónico27, al igual que sucede con los corticosteroides inhalados117.
Fundamentos técnicos, equipamiento, procedimiento y medida e interpretación de los resultadosPara la PPB con suero hipertónico se recomienda utilizar suero salino al 4,5%, que deberá ser administrado mediante nebulizadores ultrasónicos, puesto que generan un aerosol más denso que los nebulizadores de chorro27. Además, se requiere una válvula unidireccional de 2vías y un tubo de conexión con el nebulizador, que debe tener las paredes internas lisas y con una longitud y diámetro constante. Resulta conveniente que la válvula disponga de un colector de saliva, dado que la prueba suele ocasionar una salivación profusa. El nebulizador ultrasónico empleado debe generar un flujo de aerosol de al menos 1,2ml/min y disponer de una cubeta fácilmente desmontable con capacidad para 100-200ml de solución. Los nebulizadores más empleados habitualmente (Mistogen y De Vilbis Ultraneb) proporcionan un flujo de 1,5-3ml/min. En cualquier caso, se recomienda determinarlo pesando la cubeta y la tubuladura antes y después de una nebulización. Una vez establecido el flujo del nebulizador es posible determinar la dosis administrada en un periodo de funcionamiento.
El incremento de la dosis de suero salino hipertónico se obtiene aumentando progresivamente los tiempos de nebulización. En la primera etapa se nebuliza durante 30s, para seguir con 1, 2, 4 y 8min en las siguientes etapas. La respuesta broncoconstrictora se mide a los 30-90min mediante espirometría, y si la caída del FEV1 supera el 10% con respecto al valor basal, se repite el último tiempo de exposición en lugar de pasar al siguiente27. Se considera que la prueba es positiva cuando se produce una caída del FEV1>15%118,119, interrumpiéndola en dicho momento. Tanto en este caso como si se finaliza la prueba tras alcanzar la dosis máxima, se debe administrar un broncodilatador.
La respuesta bronquial al suero salino hipertónico se expresa mediante una curva dosis-respuesta que representa el cambio en el FEV1 (porcentaje de caída con respecto al valor basal) frente a la dosis acumulada de aerosol administrado (en ml). Por interpolación lineal, se determinará la PD15, que permite clasificar la gravedad de la HB en leve (PD15>6ml), moderada (PD15: 2,1-6,0ml) y grave (PD15<2,0ml)120. Todavía no se dispone de suficiente información para recomendar la determinación sistemática de índices de reactividad bronquial117,121.
La PPB con suero salino hipertónico puede resultar útil para el diagnóstico de asma, alcanzando una sensibilidad del 85% en adultos y del 75% en niños y una especificidad de prácticamente el 100%122,123. La respuesta al suero hipertónico mantiene una notable relación con la presencia de síntomas respiratorios y el consumo de medicación de rescate117,124. Además, en la detección de broncoespasmo inducido por el ejercicio podría alcanzar resultados similares a la provocación por el ejercicio125, e incluso ligeramente superiores en niños7. No obstante, en muchos casos su utilización clínica puede verse comprometida con la introducción de la PPB por manitol.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.