La neumonía intrahospitalaria (NIH) es la segunda causa de infección nosocomial y la que conlleva mayor movilidad y mortalidad. Hoy en dia se clasifica en tres grupos: NIH que no requiere ventilación artificial, NIH que requiere ventilación artificial y NIH adquirida durante la ventilación artificial (NAV). Las últimas normativas para el manejo de la NIH se han publicado en 2016 (IDSA/ATS) y el 2017 (ERS/ESCMID/ESICM y ALAT). Las últimas normativas españolas se publicaron en el año 2011 en Archivos de Bronconeumologia. Las normativas americanas del 2016 y las internacionales del 2017 presentan sus recomendaciones en un marco de gran aumento de resistencias de los microorganismos a los antibacterianos, tanto para Gram positivos y muy especialmente para Gram negativos. La SEPAR celebró en el 2019 el año de la neumonía y creyó conveniente actualizar las normativas publicadas en el 2011.En estas normativas han participado neumólogos, intensivistas,infectólogos y metodólogos. Se consensuó realizar las normativas con el siguiente esquema
- 1.
Formulación de preguntas
- -
¿Son similares la epidemiologia y microbiología de la NIH y la NAV
- -
Son válidos los factores de riesgo para predecir la etiología de las NIH y NAV causada por microorganismos multirresistentes (MDR) y extremadamente resistentes (XDR)
- -
¿Son efectivos los biomarcadores para el diagnóstico y para guiar la duración del tratamiento?
- -
Cuál es el algoritmo de tratamiento empírico actual?
- -
¿Influye la duración del tratamiento antibiótico de 7-8 dias vs 14 dias en el desenlace de los pacientes?
- -
Cual es la indicación más adecuada de los nuevos antibióticos?
- 2.
Cada pregunta contiene los siguientes apartados
- -
Controversia
- -
Evidencia
- -
Directrices
- -
Estudios para recomendados para resolver la controversia
- -
Todas las directrices se consensuaron por el 100% de los expertos
Hospital-acquired pneumonia (HAP) is the second leading cause of nosocomial infection, and increases morbidity and mortality. It is currently classified into three groups: HAP not requiring artificial ventilation, HAP requiring artificial ventilation, and HAP acquired during artificial ventilation, also known as ventilator-acquired pneumonia (VAP). The latest guidelines for the management of HAP were published in 2016 (IDSA/ATS) and 2017 (ERS/ESCMID/ESICM and ALAT). The latest Spanish guidelines were published in Archivos de Bronconeumologia in 2011. American guidelines from 2016 and international guidelines from 2017 present their recommendations in a context of significantly increased resistance of both Gram-positive and, in particular, Gram-negative microorganisms to antibacterial agents. In 2019, SEPAR celebrated Pneumonia Year, and we felt that this was an appropriate time to update the guidelines published in 2011. Pulmonologists, intensive care specialists, infectious disease specialists, and methodology experts participated in drawing up this document, and agreed to use the following scheme:
- 1.
Questions
- -
Are the epidemiology and microbiology of HAP and VAP similar?
- -
Are risk factors valid for predicting the etiology of HAP and VAP caused by multidrug-resistant (MDR) and extensively drug-resistant (XDR) microorganisms?
- -
Are biomarkers effective for diagnosis and for guiding the duration of treatment?
- -
What is the current algorithm for empirical treatment?
- -
Does the duration of antibiotic treatment (7-8 days vs 14 days) affect patient outcome?
- -
What is the most appropriate indication for the new antibiotics?
- 2.
Each question contains the following sections:
- -
Controversy
- -
Evidence
- -
Guidelines
- -
Studies recommended for resolving controversy
- -
A 100% consensus was reached by the experts for all guidelines.
La neumonía intrahospitalaria (NIH), o neumonía nosocomial, es un proceso inflamatorio pulmonar de origen infeccioso que está ausente en el momento del ingreso hospitalario, y que se desarrolla tras haber trascurrido más de 48horas del mismo. Se denomina neumonía asociada al ventilador (NAV) al subgrupo de NIH que aparecen en pacientes con vía aérea artificial, llegando a representar más del 80% de las neumonías adquiridas en la unidad de cuidados intensivos (UCI). Ambos tipos de neumonías son muy relevantes clínicamente, no solo por su elevada morbimortalidad (especialmente las infecciones causadas por gérmenes multirresistentes), sino también por el impacto en la calidad de vida, el aumento del gasto y el elevado consumo de recursos sanitarios.
ObjetivosEl objetivo principal de esta normativa sobre la NIH es proporcionar unas directrices que permitan a los profesionales de la salud tomar las mejores decisiones en la asistencia de los pacientes adultos con esta enfermedad, basadas en un resumen crítico de la literatura más actualizada. Esta normativa incluye directrices referentes a la NIH y a la NAV, pero no cubre la edad pediátrica, ni los pacientes adultos con inmunodeficiencia primaria o secundaria. El presente documento corresponde a una actualización de aquellos aspectos de la práctica clínica que han cambiado, a la luz de nuevas evidencias de calidad desde la anterior normativa sobre la neumonía nosocomial de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) publicada en 20111 y otras guías de práctica clínica relevantes2. Los grupos de profesionales a los que va dirigida son: médicos, neumólogos, internistas, infectólogos, microbiólogos, intensivistas y otros especialistas implicados en el tratamiento de los pacientes con NIH y NAV.
MetodologíaEl grupo de trabajo estaba constituido principalmente por neumólogos con amplia representación geográfica, además de un metodólogo experto y un documentalista del Centro Cochrane Iberoamericano, que participaron como asesores y efectuaron la búsqueda sistemática de la literatura (material suplementario). Los miembros del grupo priorizaron un total de 6 preguntas clínicas que la presente actualización debía contestar. Estas 6 preguntas eran las siguientes:
- 1.
¿Son similares la epidemiología y microbiología de la NIH y de la NAV?
- 2.
¿Son válidos los factores de riesgo para predecir una etiología de microorganismos multirresistentes (MDR) o extremadamente resistentes (XDR) a los antibióticos en la NIH y la NAV?
- 3.
¿Son efectivos para establecer los biomarcadores para el diagnóstico y la duración del tratamiento?
- 4.
¿Cuál es el algoritmo de tratamiento antibiótico empírico actual para la NIH y la NAV?
- 5.
¿Influye la duración del tratamiento antibiótico de 7-8 días vs. 14 días en el desenlace de los pacientes?
- 6.
¿Cuál es la indicación más adecuada de los nuevos antibióticos?
La respuesta a cada pregunta se estructura en los 4 apartados siguientes: a) controversia existente, incluyendo las recomendaciones de la normativa anterior; b) evidencia actual, en forma de un resumen de los hallazgos de los estudios más relevantes; c) directrices que se proponen; y d) estudios necesarios a efectuar para resolver las lagunas de conocimiento existentes.
¿Son similares la epidemiología y microbiología de la neumonía intrahospitalaria y de la neumonía asociada al ventilador?ControversiaEn la normativa SEPAR de neumonía nosocomial publicada en 20111 no se hace ninguna distinción entre NIH y NAV, aunque se menciona la intubación orotraqueal como factor de riesgo de neumonía nosocomial. Los principales factores de riesgo de la NIH son los que permiten la aspiración de microorganismos que colonizan la orofaringe o el tracto digestivo superior, así como la colonización anómala de la vía aérea superior. Como ejemplos se incluyen la presencia de diferentes enfermedades crónicas, el deterioro del estado de la conciencia, el uso de sondas nasogástricas o procedimientos diagnósticos o la administración de agentes antisecretores gástricos1.
Respecto a las recomendaciones del tratamiento de la NIH y la NAV en adultos de la Infectious Diseases Society of America (IDSA) y la American Thoracic Society (ATS) (IDSA/ATS)3 no proponen diferencias epidemiológicas entre NIH y NAV, aunque plantean un enfoque distinto en los factores de riesgo para patógenos MDR. Las normativas de 2016 de otras sociedades como la European Respiratory Society (ERS), la European Society of Intensive Care Medicine (ESICM), la European Society of Clinical Microbiology and Infectious Diseases (ESCMID) y la Asociación Latinoamericana de Tórax (ALAT)2 no analizan este punto y solo incluyen una breve reseña. En los últimos años la incidencia de NAV parecía haber disminuido posiblemente por avances en su prevención, aunque los cambios en la definición de NAV podrían haber subestimado la tasa real de casos2.
Evidencia actualLos datos de varios trabajos señalan un descenso en la incidencia de NAV, pero teniendo en cuenta los problemas diagnósticos, las diferencias en las poblaciones de estudio y las nuevas definiciones4 es difícil establecer comparaciones en los cambios de incidencia a lo largo del tiempo5. Los últimos estudios estiman una incidencia de NAV en Europa entre 5,82 a 18,3 casos por 1.000 días de ventilación mecánica6–8. Varias estrategias han demostrado ser eficaces para disminuir las tasas de NAV, entre ellas, la elevación de la cabecera de la cama, la interrupción de la administración intravenosa de sedantes, la práctica de pruebas de respiración espontánea durante la respiración asistida y la profilaxis tromboembólica. Los lavados orales con clorhexidina se han asociado a una mayor mortalidad durante la ventilación mecánica, mientras que la prevención de las úlceras por estrés con fármacos antisecretores ha demostrado aumentar la incidencia9. En unidades de cuidados intensivos (UCI) con tasas de resistencias antimicrobianas moderadas o elevadas, la descontaminación digestiva selectiva (DDS) no ha demostrado reducir las infecciones bacterémicas por bacilos gramnegativos MDR en pacientes con ventilación mecánica10. Sin embargo, en las UCI españolas la implementación de un paquete de 10 medidas para prevenir la NAV ha disminuido su incidencia en un 55,8%11(tabla 1 del material suplementario).
La incidencia de NIH es más difícil de cuantificar que la de NAV. En un estudio epidemiológico reciente, basado en una muestra de más de 7 millones de pacientes ingresados en hospitales de agudos en EE. UU. en 2012, la tasa de incidencia de la NIH era de 3,63 casos por 1.000 días-paciente12. Por otra parta, la presencia de una NIH aumenta la duración de la estancia hospitalaria, la mortalidad, el consumo de recursos y los costes correspondientes13,14. A pesar de que existen medidas que disminuirían la incidencia de NIH, tales como optimizar la higiene oral en las unidades de hospitalización o antes de la cirugía, elevar la cabecera de cama, primar la posición sentada de los pacientes, la deambulación precoz, realizar espirometrías forzadas o estimular la tos y las respiraciones profundas para mejorar el aclaramiento de secreciones y el volumen pulmonar15, no siempre se aplican.
Diferentes estudios han demostrado que la NIH aumenta la mortalidad. En un estudio de casos y controles las diferencias en la mortalidad eran del 15,5% frente al 1,6%, con la NIH incrementando el riesgo de muerte unas 8,4 veces13. En aquellos pacientes con NIH que precisan ingreso en la UCI se han descrito tasas de mortalidad del 36%, especialmente alta por la necesidad de ventilación asistida16. En un estudio longitudinal de pacientes con NIH ingresados en UCI francesas, la mortalidad a los 30 días era del 32% cuando se requería intubación orotraqueal, frente al 16% si ello no era necesario14. En este sentido, un estudio reciente que analizó varias bases de datos ha recomendado agrupar a los pacientes en NIH que no requiere ventilación, NIH que requiere ventilación y NAV17.
El diagnóstico etiológico se suele obtener en un 60% de los casos de NAV y en un 40% de NIH. Los patógenos causales de ambos tipos de neumonías son similares. Los más frecuentes incluyen Pseudomonas aeruginosa, Acinetobacter baumannii, Enterobacteriaceae y Staphylococcus aureus.
Las semejanzas y diferencias entre las NIH y las NAV están resumidas en la tabla 1.
Semejanzas y diferencias entre NIH y NAV
| NIH | NAV |
|---|---|
| Se desarrolla en pacientes que no reciben más de 48horas de ventilación mecánica | Se desarrolla en pacientes que reciben más de 48horas de ventilación mecánica |
| Incidencia de 3,63 casos por 1.000 días-paciente | Incidencia de 5,82 a 18,3 casos/1.000 días de ventilación mecánica |
| Existen medidas de prevención efectiva | Existen pocos estudios que evalúen la eficacia de las medidas de prevención |
| Menor tasa de diagnóstico etiológico (40%) | Mayor tasa de diagnóstico etiológico (60%) |
| Pseudomonas aeruginosa, Acinetobacter baumannii, Enterobacteriaceae y Staphylococcus aureus son los agentes causales más comunes | |
| Mayor mortalidad para aquellos pacientes que requieren ventilación mecánica posterior al diagnóstico. | Menor mortalidad que aquellas NIH que requieren ventilación mecánica, pero mayor que aquellas NIH que no se ventilan |
NAV: neumonía asociada al ventilador; NIH: neumonía intrahospitalaria.
La NIH y la NAV presentan una microbiología similar. Sin embargo, en la consideración de la mortalidad asociada a las mismas, hay que distinguir las NIH que no requieren ventilación asistida, las NIH que precisan ventilación asistida y las NAV. Es necesario implementar estrategias de prevención en todos los pacientes (higiene oral, elevar la cabecera de la cama, estimular la tos y las respiraciones profundas y primar la posición sentada) tratando de evitar aquellas medidas que pueden ser perjudiciales (lavados orales con clorhexidina, fármacos antisecretores), con el fin de disminuir la incidencia de complicaciones.
Estudios para resolver la controversiaSe requieren constantes actualizaciones para conocer cambios en la incidencia y prevalencia de NIH, así como para evaluar la eficacia de las medidas preventivas propuestas.
¿Son válidos los factores de riesgo para predecir una etiología de microorganismos multirresistentes o extremadamente resistentes a los antibióticos en la neumonía intrahospitalaria y la neumonía asociada al ventilador?ControversiaEn las anteriores guías1,2 no se hacía mención específica a los factores de riesgo para microrganismos MDR y XDR. La NIH y la NAV están causadas principalmente por bacterias grampositivas (S. aureus resistente a la meticilina [SARM] o sensible a la meticilina) o gramnegativas (enterobacterias, P. aeruginosa y A. baumannii)18, habiéndose demostrado que no existen diferencias etiológicas entre la NIH y la NAV16. Asimismo, se sabe con certeza que el patrón microbiológico de la NIH y de la NAV difiere en función de las áreas geográficas, hospitales y unidades, de modo que una recomendación primordial de las últimas normativas2,3 es determinar el perfil microbiológico de las infecciones intrahospitalarias de cada servicio, para mejorar el porcentaje de tratamientos empíricos adecuados. Sin embargo, la aparición de microorganismos resistentes a los antibióticos, en forma de MDR, XDR y panresistencia (PDR)19 ha complicado enormemente la terapia empírica adecuada, empeorando los desenlaces de las NIH y NAV, sobre todo si no se administra un tratamiento empírico apropiado de forma temprana.
Las guías de práctica clínica más recientes2,3 incluyen algoritmos de tratamiento antibiótico empírico basados en la gravedad de la neumonía, y en la presencia o ausencia de factores clínicos de riesgo para infecciones por microorganismos MDR, XDR o PDR. Cuando existen factores de riesgo se recomienda administrar 2 antibióticos con actividad frente a P. aeruginosa y añadir un tercer antibiótico con actividad frente a SARM, en función de la prevalencia local de este microorganismo.
No obstante, el uso de criterios clínicos como forma de abordar el tratamiento inicial de estas infecciones puede determinar un exceso de tratamientos antibióticos innecesarios y, en algunas ocasiones, déficit de cobertura. Por otra parte, es muy difícil encontrar factores de riesgo que sean muy específicos para microorganismos muy concretos y con patrones de resistencia concretos (p. ej. enterobacterias resistentes a carbapenems). Por lo tanto, existen dudas acerca de si este enfoque es el mejor modo de abordar el tratamiento empírico de estas infecciones.
Evidencia actualLos factores de riesgo para la NIH y la NAV causadas por microorganismos MDR y XDR descritos en las guías de la IDSA/ATS3 y ERS/ESICM/ESCMID/ALAT2 se incluyen en la tabla 2. En concreto, los factores de riesgo propuestos por la IDSA/ATS3 han sido validados en una cohorte de 316 pacientes con NIH o NAV ingresados en 6 UCI de un solo centro, siendo los factores más prevalentes la hospitalización previa durante 5 días o más (76%) y el uso de antibióticos intravenosos en los 90 días previos a la neumonía (63%)20. Ambos factores mostraron valores predictivos negativos muy aceptables, tanto para la NIH como para la NAV, y fueron óptimos para las neumonías causadas por SARM y P. aeruginosa MDR. También se estimó que si los clínicos siguieran las recomendaciones de la IDSA/ATS3, el porcentaje de pacientes infratratados empíricamente hubiera sido del 3% y el porcentaje de sobretratados del 60%20. tabla 3
Factores de riesgo para NIH y NAV causadas por microorganismos multirresistentes (MDR) o resistencia extrema (XDR) según las guías de práctica clínica
| Guía de ERS/ESICM/ESCMID/ALAT2 | Guía de IDSA/ATS3 |
|---|---|
| Shock séptico | Administración de antibióticos en los últimos 90 días o más |
| Administración previa de antibióticos | Shock séptico |
| Estancia hospitalaria previa≥5 días | Síndrome de distrés respiratorio agudo |
| Prevalencia≥25% de patógenos MDR en la unidad | Fallo renal agudo con terapia de reemplazamiento |
| Colonización previa por patógenos MDR |
ALAT: Asociación Latinoamericana de Tórax; ATS: American Thoracic Society; ERS: European Respiratory Society; ESCMID: European Society of Clinical Microbiology and Infectious Diseases; ESICM: European Society of Intensive Care Medicine; IDSA: Infectious Diseases Society of America; NAV: neumonía asociada al ventilador; NIH: neumonía intrahospitalaria.
Resumen de las directrices
| Los agentes etiológicos causantes de NIH y NAV son similares. Las NIH que requieren ventilación mecánica son las que presentan mayor mortalidad |
| El tratamiento empírico se debe basar en la presencia de factores de riesgo, aislamientos previos, severidad y tasa de resistencia de cada unidad |
| Los biomarcadores séricos no son de utilidad para el diagnóstico de NIH o NAV, ni para decidir el inicio del tratamiento antibiótico |
| En pacientes con buena respuesta clínica el tratamiento no debe exceder los 7 días, en aquellos casos con mala respuesta inicial se puede extender por más de 7 días y guiar la duración de acuerdo a los valores de PCT |
| Ceftobiprole podría ser de utilidad para el tratamiento de las NIH por SARM, ceftazidima-avibactam para el tratamiento de enterobacterias productoras de carbapenemasas y ceftolozano-tazobactan para las P. aeruginosa MDR |
MDR: microorganismos multirresistentes; NAV: neumonía asociada al ventilador; NIH: neumonía intrahospitalaria; PCT: procalcitonina; SARM: Staphylococcus aureus resistente a la meticilina.
Por otra parte, los factores de riesgo para NIH o NAV causada por microorganismos MDR, XDR o PDR propuestos en la guía ERS/ESICM/ESCMID/ALAT2 han sido validados en una cohorte de 314 pacientes con NIH21. El ingreso hospitalario en un ámbito con alta prevalencia de MDR/XDR (>25% de prevalencia) y el tratamiento antibiótico previo demostraron una elevada sensibilidad (91% y 84%, respectivamente) y unos valores predictivos negativos razonables (83% y 75%, respectivamente). La estancia hospitalaria previa mostró una sensibilidad del 78% y un valor predictivo negativo del 77%. El aislamiento previo en secreciones respiratorias de un microorganismo MDR, XDR o PDR tenía una especificidad y valor predictivo positivo del 100%, con un área bajo la curva de 0,80. La mejor combinación de factores para la predicción de neumonía por microorganismos MDR, XDR o PDR fue la asociación de la estancia hospitalaria previa con el aislamiento previo de un patógeno MDR, XDR o PDR, con una área bajo la curva de 0,80.
Los resultados de estos estudios muestran que los factores de riesgo propuestos son muy prevalentes en una población ingresada en la UCI que presenta NIH o NAV y que, en muchas ocasiones, se asocian a un exceso de tratamiento. El aislamiento previo de microorganismo MDR o XDR mejora el rendimiento en la aplicación de estos criterios.
Las limitaciones de estos estudios de validación es que se han efectuado retrospectivamente a partir de datos recogidos prospectivamente, incluidos en bases de datos y correspondientes a pacientes exclusivamente ingresados en la UCI.
DirectricesSe recomienda iniciar un tratamiento antibiótico empírico con doble cobertura para bacilos gramnegativos con actividad antipseudomónica, más un antibiótico antiestafilocócico activo frente a SAMR si la prevalencia local de SAMR es superior al 25%, en presencia de alguno de los siguientes criterios: ingreso hospitalario previo reciente, shock séptico, tratamiento antibiótico previo en los últimos 90 días, ingreso en una unidad con prevalencia de SAMR≥25% o aislamiento previo de un microorganismo MDR o XDR.
Estudios para resolver la controversiaEn primer lugar se requeriría una definición más precisa de alguno de los criterios. El término antibiótico previo (factor de riesgo en ambas normativas) es muy impreciso, y serían necesarios estudios futuros que permitieran mejorar el significado de esta variable, tanto en la duración como en el tipo de tratamiento. En la normativa ERS/ESICM/ESCMID/ALAT2 se consensuó una prevalencia local de microorganismos MDR o SDR>25% como factor de riesgo, aunque este dato provenía de un único estudio18 y, por tanto, precisaría una validación. Además, se requieren estudios de validación de los factores de riesgo en pacientes no ingresados en la UCI. Por último, sería necesario realizar estudios microbiológicos combinando técnicas microbiológicas moleculares y cultivos cuantitativos clásicos para detectar patógenos MDR o XDR y establecer su relación con los factores de riesgo.
¿Son útiles los biomarcadores para el diagnóstico y la duración del tratamiento?ControversiaEl diagnóstico de NIH continúa siendo un desafío para el clínico, por lo que existe gran interés en identificar biomarcadores sistémicos y/o en el líquido del lavado broncoalveolar (LBA) no solo para mejorar el diagnóstico, sino también para indicar el inicio y retirada del tratamiento antibiótico. Hasta el momento presente la procalcitonina (PCT) sérica es el biomarcador más estudiado. Las normativas, sin embargo, difieren respecto al uso de biomarcadores. En la guía de la SEPAR de 20111 se recomendaba el empleo de biomarcadores, proteína C reactiva (PCR) y/o PCT, y de la puntuación de la escala de valoración clínica de infección pulmonar (Clinical Pulmonary Infection Score) para el diagnóstico y la duración del tratamiento antibiótico. Las normativas ERS/ESICM/ESCMID/ALAT2 y IDSA/ATS3 no indican el uso de biomarcadores para el diagnóstico, aunque sugieren que la PCT puede ser útil para valorar la duración del tratamiento, así como para suspenderlo (IDSA/ATS3) o prolongarlo en determinadas circunstancias (ERS/ESICM/ESCMID/ALAT2).
Evidencia actualCon respecto al diagnóstico de NAV, en un análisis de una base de datos internacional se evaluó la capacidad de la PCR para diferenciar la traquebronquitis asociada al ventilador de la NAV22. A pesar de que observaron niveles de PCR más elevados en la NAV, existía un solapamiento en los niveles de PCR, por lo que este biomarcador no permitía discriminar entre ambas entidades. En un estudio prospectivo multicéntrico, la monitorización diaria de los niveles de PCR en pacientes con ventilación mecánica era útil para predecir el desarrollo de NAV23. En 2 cohortes prospectivas de pacientes ventilados mecánicamente incluidos en un estudio de la utilidad de los neutrófilos alveolares en el LBA, en algunos pacientes se analizó la PCT como marcador de infección bacteriana24. No se demostró que la PCT fuera útil como predictor de NAV, el recuento de neutrófilos en LBA<50% del total de las células ha demostrado un alto valor predictivo negativo de NAV (90%) en una cohorte prospectiva y de validación24. Dicho valor predictivo negativo aumenta si se asocia a una tinción negativa de Gram. Por otra parte, la determinación de α-amilasa en minilavado broncoalveolar ha demostrado ser útil como marcador de aspiración en pacientes que desarrollan NAV25.
En relación con la utilidad de los biomarcadores para determinar la duración del tratamiento con antibióticos, diferentes estudios han proporcionado evidencia al respecto (tabla 2 del material suplementario). En un estudio prospectivo controlado no aleatorizado se ha demostrado que en pacientes con NAV causada por bacilos gramnegativos, y con adecuada respuesta clínica al séptimo día de tratamiento, la duración del mismo se reduce si la administración de antibióticos se suspende según los niveles de la PCT26. En un ensayo clínico aleatorizado, controlado y multicéntrico, la determinación de PCT también aumentó significativamente los días libres de antibióticos evaluados a los 28 días del inicio de la NAV27. En pacientes críticos ingresados en la UCI 2 ensayos clínicos aleatorizados y controlados28,29 y 3 revisiones sistemáticas30–32 han demostrado que una estrategia de inicio y suspensión del tratamiento con antibióticos basada en valores predefinidos de PCT puede reducir la exposición a estos fármacos. No obstante, estos resultados corresponden a infecciones respiratorias adquiridas en la comunidad. Por el contrario, en un reciente estudio aleatorizado y controlado, en pacientes con sospecha de infección respiratoria adquirida en la comunidad, no se observaron diferencias significativas ni en la prescripción de antibióticos ni en la duración total del tratamiento33, si bien en esta población la mediana de tratamiento era de 4 días y no se reproduce la situación de la NAV.
DirectricesNo hay evidencia que apoye la utilidad de los biomarcadores séricos para el diagnóstico de NIH, ni para decidir el inicio del tratamiento antibiótico. Los datos sobre el uso de biomarcadores en el LBA son preliminares y no han sido validados. Los biomarcadores séricos no deben sustituir a los criterios clínicos o microbiológicos para el diagnóstico de NIH, ni tampoco los mejoran. Respecto a la duración del tratamiento la determinación de PCT sérica puede ser de utilidad cuando se precise un tratamiento de más de 8 días, ya sea por respuesta clínica inadecuada o difícilmente valorable o en pacientes con infecciones por microorganismos MDR.
Estudios para resolver la controversiaSe precisan estudios que analicen biomarcadores más específicos de infección para confirmar el diagnóstico de NAV. Asimismo, es preciso confirmar y validar la utilidad de la α-amilasa para establecer o excluir el diagnóstico de NAV en el subgrupo de pacientes con NAV de comienzo después de 72horas. Por otra parte, se requieren estudios dirigidos a suspender el tratamiento en pacientes con NAV causada por microorganismos MDR o en episodios con respuesta inadecuada cuando se prevea una duración del tratamiento superior a 7-8 días.
¿Cuál es el algoritmo de tratamiento antibiótico empírico actual para la neumonía intrahospitalaria y la neumonía asociada al ventilador?ControversiaA pesar de la existencia de mejores opciones terapéuticas para los pacientes con NHI o NAV en los últimos años, el mayor determinante de mejoría en la supervivencia se basa en el tratamiento adecuado de la infección34. El uso de algoritmos de tratamiento empírico probablemente pueda contribuir a un tratamiento inicial más adecuado2, teniendo en cuenta que muchos pacientes no presentan factores de riesgo para desarrollar una infección por microorganismos MDR. Sin embargo, la consideración de otros factores, como la ecología del centro sanitario, la gravedad del enfermo y el tipo de antibiótico previo utilizado, podría potencialmente mejorar las opciones de tratamiento35. En las guías anteriores1,2 no se tenían en cuenta factores de gravedad como el shock séptico para la elección del tratamiento empírico, y el factor tiempo (neumonía precoz o tardía) era el más determinante.
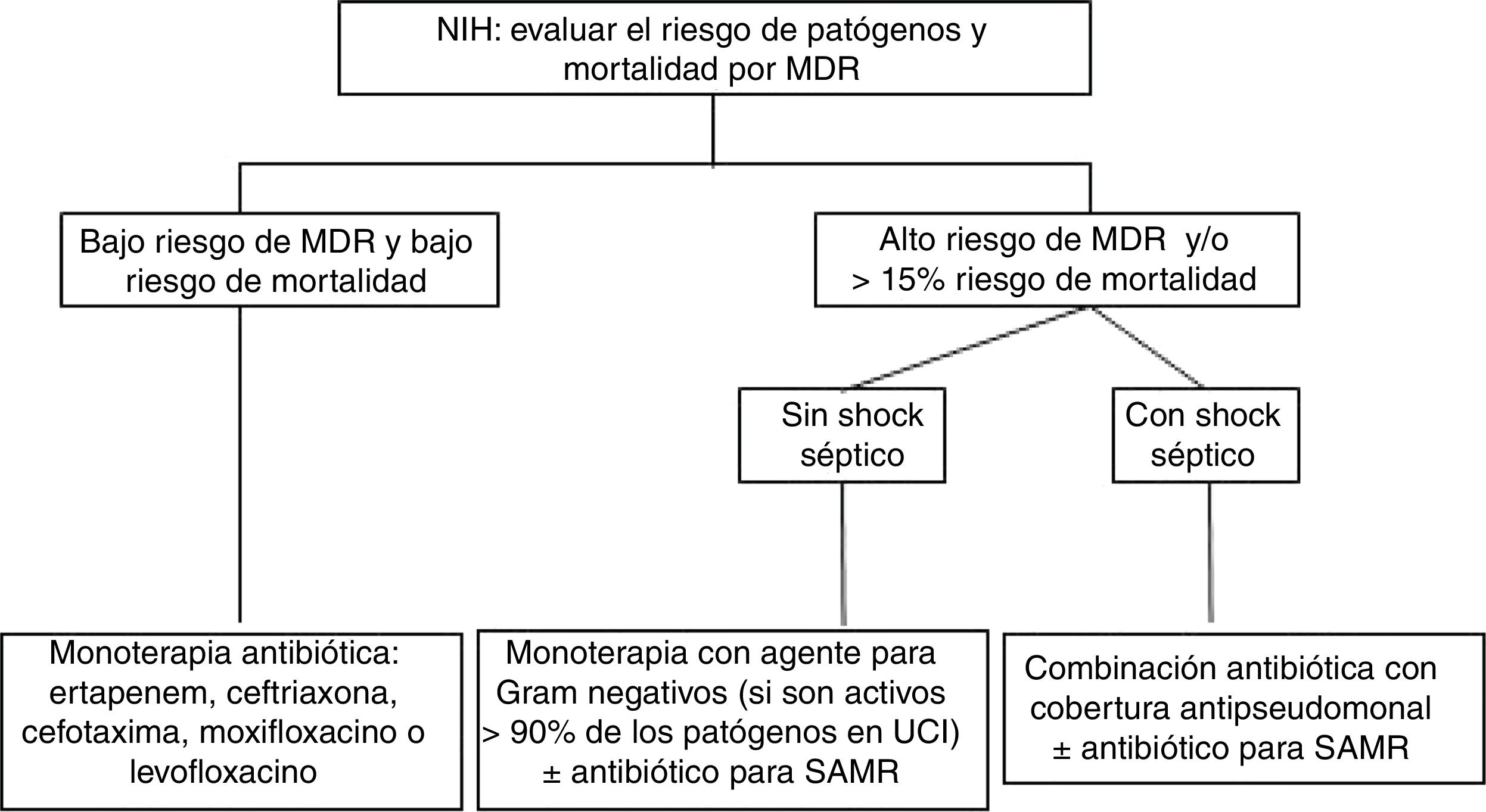
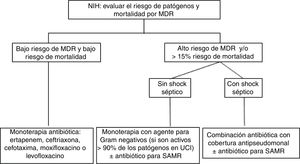
Evidencia actualEl aspecto más importante en el tratamiento de las infecciones respiratorias es el uso de un tratamiento antibiótico adecuado36. Asimismo, el número de pacientes con NIH o NAV causadas por bacterias MDR ha experimentado un aumento enorme. La presencia de más de un 25% de infecciones por uno de estos patógenos y de shock séptico son condicionantes de la estrategia de tratamiento empírico. En un análisis secundario del estudio EU-VAP/CAP (estudio prospectivo observacional efectuado en 27 UCI de 9 países europeos), un 50,7% de pacientes con NAV estaban infectados por gérmenes MDR en ausencia de factores de riesgo18. Por ello, los pacientes ingresados en centros con una prevalencia de MDR>25% o con síntomas de gravedad (shock séptico) deben ser considerados de alto riesgo para presentar una infección respiratoria causada por microorganismos MDR, por lo que el tratamiento empírico debe ser de amplio espectro para cubrir dichos microorganismos (fig. 1).
Algoritmo de tratamiento antibiótico para la neumonía intrahospitalaria (NIH). El bajo riesgo de mortalidad se define como ≤15% de probabilidad de exitus.
Factores de riesgo de MDR: uso previo de antibióticos, hospitalización reciente>5 días, shock séptico, centro con alta tasa de patógenos MDR (>25%) y colonización por patógenos MDR.
MDR: microorganismos multirresistentes; UCI: unidad de cuidados intensivos; SAMR: Staphylococcus aureus resistente a la meticilina.
Para determinar la terapia empírica adecuada hay que tener en cuenta si existen factores de riesgo importantes, tales como el uso previo de antibióticos, hospitalización reciente prolongada (>5 días) o colonización previa por patógenos MDR. En estas circunstancias, y si además el paciente está ingresado en una UCI con alta tasa de patógenos MDR (>25%), se aconseja elegir una terapia de amplio espectro con cobertura de microorganismos MDR, así como el uso de combinación antibiótica con cobertura frente a Pseudomonas spp. si el paciente tiene un alto riesgo de mortalidad y su situación clínica es grave (shock séptico). Se desaconseja el uso de los conceptos de neumonía temprana y/o neumonía tardía para la elección del tratamiento empírico. El uso de terapia empírica para el tratamiento del SAMR debe considerarse solamente si existe una alta tasa de incidencia de este patógeno en el hospital o en la unidad (>25%). Por último, una vez se conozca el resultado de los cultivos y la sensibilidad antibiótica, es aconsejable llevar a cabo un activo programa de política antibiótica, intentando el desescalamiento terapéutico, tan pronto como sea posible, en aquellos pacientes que muestren una adecuada respuesta al tratamiento.
Estudios para resolver la controversiaLa validación de protocolos antibióticos, en los que se incluya la ecología del centro sanitario y la gravedad del paciente, deben ser un objetivo prioritario de estudios futuros. Actualmente la presentación de pacientes con historia de múltiples ingresos hospitalarios, o de haber recibido varios cursos de antibióticos durante el mismo año, no es tan infrecuente como tiempo atrás. Asimismo, los pacientes ingresados en la UCI tienen una media de edad mayor y con mayor acceso y menores limitaciones al esfuerzo terapéutico por razones que hace años podrían ser factores de contraindicación de medidas terapéuticas extraordinarias.
¿Influye la duración del tratamiento antibiótico de 7-8 días vs. 14 días en el desenlace de los pacientes?ControversiaEn las guías anteriores1,2 la recomendación para la duración del tratamiento era de hasta 14 días o más. La duración del tratamiento antibiótico en la NIH tiene como objetivo mantener la pauta antibiótica el tiempo suficiente para eliminar la infección, sin prolongarlo innecesariamente para evitar efectos adversos en el paciente, cambios de flora microbiana y/o aparición de multirresistencia37,38. En una revisión sistemática con metaanálisis de 4 ensayos clínicos aleatorizados y controlados, que comparaban una pauta antibiótica corta (7-8 días) frente a una larga (10-15 días) en pacientes con NAV, no se hallaron diferencias en la mortalidad global, mortalidad a los 28 días o mortalidad a los 28 días en pacientes con infecciones por bacilos Gram negativos no fermentadores39. La pauta corta se asoció con más días libres de antibióticos (diferencia media de 3,4 días), aunque no hubo diferencias significativas en las recaídas, pero se observó una tendencia a un menor número de recaídas en la pauta larga39. El debate se centra en si una duración del tratamiento antibiótico de 7-8 días en NAV causada por bacilos Gram negativos no fermentadores puede conllevar más recaídas que la pauta larga, aunque no mayor mortalidad.
Evidencia actualLos estudios publicados sobre la duración del tratamiento antibiótico analizan diferentes resultados, como mortalidad, días sin antibiótico, días sin ventilación mecánica, recaídas, días de estancia en la UCI y, en menor medida, la erradicación de microorganismos. Estos trabajos se han llevado a cabo básicamente en pacientes con NAV y apenas hay datos para el resto de pacientes con NIH. En otra revisión sistemática de 6 ensayos clínicos, con un total de 1.088 pacientes con NAV, no se observaron diferencias en la mortalidad entre la administración de antibióticos 7-8 días y 10-15 días, pero la exposición a antibióticos fue menor en la pauta corta (diferencia media de 4 días)40. No obstante, en los casos de NAV causados específicamente por bacterias Gram negativas no fermentadoras, la pauta corta se asociaba con un mayor número de recidivas (odds ratio 2,18, intervalo de confianza del 95%: 1,14-4,16)40. En un análisis de 274 pacientes con NAV asignados aleatoriamente a tratamiento con dosis fijas de doripenem durante 7 días, o dosis fijas de imipenem-cilastatina durante 10 días, la mortalidad a los 28 días por cualquier causa, así como la mortalidad en el subgrupo de pacientes con NAV causada por P. aeruginosa, era superior en pacientes tratados con la pauta corta de doripenem41. En un estudio caso-control se analizaba mediante LBA la decisión de retirar el tratamiento antibiótico cuando se detectaban<10.000 unidades formadoras de colonias (ufc)/ml en la muestra de LAB obtenida al cuarto día (respondedores), en caso contrario el tratamiento se continuaba (no respondedores)42. No se observaron diferencias en la mortalidad o recidiva de la NAV, pero la duración del tratamiento fue significativamente inferior en los respondedores que en los no respondedores (media 9,8 vs. 16,7 días), incluyendo los casos de neumonía por bacilos no fermentadores (media 10,7 vs. 14,4 días) (p<0,001)42.
No obstante, no se han publicado estudios comparativos de pautas de tratamiento antibiótico cortas o largas en pacientes inmunodeprimidos, con neumonía necrosante o con MDR (P. aeruginosa resistente, A. baumannii resistente a carbapenem, enterobacterias resistentes a carbapenémicos), así como tampoco en casos de fracaso al tratamiento antibiótico previo o cuando se emplean antibióticos de segunda línea (colistina, tigeciclina). Por ello, las pautas cortas de 7-8 días en estos anteriores supuestos no se incluyen en las guías de práctica clínica3,43.
DirectricesEn pacientes con NAV con buena respuesta clínica la duración del tratamiento antibiótico de 7-8 días frente a 14 días no se asocia con más recaídas, ni una mayor tasa de mortalidad, y contribuye a menor presión antibiótica para la aparición de patógenos MDR. En pacientes con NAV causada por patógenos MDR, cuando no hay respuesta adecuada inicial o se presentan complicaciones como neumonía necrosante, absceso pulmonar o derrame pleural, se pueden requerir pautas de duración superior a los 7-8 días, siendo aconsejable individualizar el tratamiento según la respuesta clínica y biomarcadores. No hay evidencias cuando se emplean nuevos antibióticos o antibióticos de segunda línea.
Estudios para resolver la controversiaSe requieren estudios que comparen los desenlaces según las pautas de 7-8 días o de 15 días en pacientes con respuesta inadecuada al tratamiento y en infecciones causadas por patógenos MDR, ya que no hay evidencia en estas poblaciones. Asimismo, también se precisan estudios con antibióticos de segunda línea.
¿Cuál es la indicación más adecuada de los nuevos antibióticos?ControversiaEvidentemente en las guías anteriores1,2 no se hacía ninguna referencia a nuevos antibióticos. El incremento de las resistencias bacterianas demanda el desarrollo de nuevos antibióticos. Los microorganismos más conflictivos se agrupan bajo el acrónimo ESKAPE, que incluye los nombres de los 6 patógenos —Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter spp.—, frecuentemente asociados con resistencia antimicrobiana44,45. En la NIH los microorganismos más problemáticos incluyen SARM y sensibilidad disminuida a vancomicina, enterobacterias productoras de betalactamasas de espectro extendido (BLEE) y/o carbapenemasas y resistentes a fluorquinolonas y P. aeruginosa y A. baumannii resistentes a betalactámicos de amplio espectro, quinolonas, aminoglucósidos y colistina, por múltiples mecanismos intrínsecos y adquiridos.
Evidencia actualRecientemente se han comercializado en España varios antibióticos con interés para el tratamiento de la NIH, incluyendo ceftobiprole, ceftazidima-avibactam y ceftolozano-tazobactam.
El ceftobiprole es una cefalosporina de quinta generación con actividad in vitro frente a la mayoría de patógenos respiratorios, cuyo principal interés es su actividad frente a SARM y P. aeruginosa46. Aunque este antibiótico ha sido estudiado principalmente en el tratamiento de la NAV también hay experiencia en NIH. En un análisis retrospectivo post hoc de 2 ensayos de fase iii, el tratamiento con ceftobiprole se asociaba con una tasa de respuesta precoz superior al tratamiento comparador (ceftazidima±linezolid) en los siguientes grupos de alto riesgo: neumonía adquirida en la comunidad en pacientes de 75 años o más, neumonía adquirida en la comunidad en pacientes con enfermedad pulmonar obstructiva crónica, pacientes de alto riesgo con NIH y todos los pacientes con NIH con más de 10 comorbilidades47. En uno de estos ensayos de fase iii, de 781 pacientes con NIH incluyendo 120 con NAV, las tasas de curación y erradicación microbiológica de los pacientes tratados con ceftobiprole no fueron inferiores a la combinación ceftazidima/linezolid, con un perfil de seguridad similar, pero en pacientes con NAV las tasas de curación y erradicación fueron inferiores en el grupo tratado con ceftobiprole48. Ceftobiprole ha sido aprobado en Europa para el tratamiento en monoterapia de la NIH no asociada a ventilación mecánica, excluyendo por tanto la NAV.
Respecto a ceftazidima-avibactam, una combinación con actividad ante carbapenemasas clase A, C y en menor medida D, en un ensayo de fase iii de no inferioridad (REPROVE), en pacientes con NIH incluyendo NAV, la curación clínica y los efectos adversos no fueron inferiores a meropenem (antibiótico comparador)49. Hay que destacar que los microorganismos aislados principalmente eran bacilos gramnegativos (enterobacterias y P. aeruginosa), siendo el 28% resistentes a ceftazidima49.
Para la combinación ceftolozano-tazobactam, en el ensayo clínico ASPECT-NP en pacientes con NIH incluida la NAV, se comparó ceftolozano-tazobactam con meropenem. El ceftolozano-tazobactam fue no inferior al meropenem en términos de mortalidad a 28 días por todas las causas de y curación clínica50. Ceftolozano penetra bien en el líquido de revestimiento epitelial tras la infusión intravenosa de ceftolozano-tazobactam, casi el doble comparado con pipercilina-tazobactam51, y presenta actividad ante un gran porcentaje de cepas de P. aeruginosa MDR/XDR.
DirectricesCeftobiprole debe considerarse en el tratamiento de la NIH no asociada a ventilación mecánica en pacientes con factores de riesgo para infecciones por S. aureus y P. aeruginosa. Ceftazidima-avibactam debe considerarse en el tratamiento de la NIH no asociada a ventilación mecánica y en la NAV en pacientes con factores de riesgo para P. aeruginosa (similar a ceftobiprole) o enterobacterias productoras de carbapenemasas (KPC y oxa-48) por su buena actividad frente a estos patógenos. Por último, ceftolozano-tazobactam, en caso de confirmarse la no inferioridad frente a meropenem, debería considerarse en el tratamiento de la NIH no asociada a ventilación mecánica y la NAV con factores de riesgo para P. aeruginosa (similar a ceftobiprole), especialmente multirresistente.
Estudios para resolver la controversiaEs necesario confirmar los resultados de los nuevos antibióticos descritos en los ensayos clínicos en estudios observacionales que incluyan pacientes de la práctica clínica habitual. Por otra parte, se requieren estudios para valorar si es preciso que los nuevos fármacos se combinen con otros para aumentar la eficacia. La tolerabilidad de estos antibióticos debe confirmarse por estudios de farmacovigilancia. Finalmente, también serían necesarios estudios clínicos de NIH de otros antibióticos próximos a ser comercializados.
Resumen de las directricesLa microbiología es similar entre las NIH y las NAV, y la mortalidad se debe analizar individualizando las NIH que no requieren ventilación asistida, las NIH que requieren ventilación asistida y las NAV.
Se recomienda iniciar un tratamiento antibiótico empírico con doble cobertura para bacilos gramnegativos con actividad antipseudomónica, más un antibiótico antiestafilocócico activo frente a SAMR si la prevalencia local de SAMR es superior al 25%, en presencia de alguno de los siguientes criterios: ingreso hospitalario previo reciente, shock séptico, tratamiento antibiótico previo en los últimos 90 días o ingreso en una unidad con prevalencia de SAMR≥25%. Si existiera un aislamiento previo de un microorganismo MDR o XDR, solamente sería necesaria la presencia de un único factor de riesgo.
No hay evidencia que apoye la utilidad de los biomarcadores séricos para el diagnóstico de NIH, ni para decidir el inicio del tratamiento antibiótico.
La determinación de PCT sérica puede ser de utilidad cuando se precise un tratamiento de más de 8 días, ya sea por respuesta clínica inadecuada o difícilmente valorable, aparición de complicaciones de la neumonía (absceso o derrame pleural), o en pacientes con infecciones por patógenos MDR.
Para determinar la terapia empírica adecuada hay que tener en cuenta si existen factores de riesgo y si el paciente está ingresado en una UCI con alta tasa de patógenos MDR (>25%).
Se aconseja elegir una terapia de amplio espectro con cobertura de microorganismos MDR, así como el uso de combinación antibiótica con cobertura frente a P. aeruginosa si hay un alto riesgo de mortalidad y la situación clínica es grave (shock séptico).
En pacientes con NAV con buena respuesta clínica la duración del tratamiento antibiótico de 7-8 días frente a 14 días no se asocia con más recaídas, ni mayor mortalidad.
Los pacientes con NAV por patógenos MDR con respuesta inadecuada, o en presencia de complicaciones, pueden requerir tratamiento antibiótico durante más de 7-8 días.
Ceftobiprole debe considerarse en el tratamiento de la NIH no asociada a ventilación mecánica en pacientes con factores de riesgo para infección por S. aureus y P. aeruginosa.
Ceftazidima-avibactam debe considerarse en el tratamiento de la NIH no asociada a ventilación mecánica y en la NAV en pacientes con factores de riesgo para P. aeruginosa o enterobacterias productoras de carbapenemasas.
Ceftolozano-tazobactam podría considerarse en el tratamiento de la NIH no asociada a ventilación mecánica y la NAV con factores de riesgo para P. aeruginosa (especialmente MDR) si se confirmara la no inferioridad frente a meropenem. Un resumen de estas directrices se presenta en la tabla 3.
Conflictos de interesesA. Torres declara haber recibido fondos de Pfizer, Basilea, Biomerieux, Polyphor y MSD.
A la Dra. Marta Pulido por la corrección editorial del manuscrito.