El objetivo de actualizar la normativa de neumonía adquirida en la comunidad es proporcionar unas directrices, basadas en un resumen crítico de la literatura actualizada desde las normativas previas publicadas en 2010, que permita a los profesionales de la salud tomar las mejores decisiones en la asistencia de los pacientes adultos no inmunocomprometidos. La metodología se realizó utilizando 6preguntas PICO (relacionadas con estudios etiológicos, valoración de gravedad y decisión de ingreso, tratamiento antibiótico y su duración y vacuna conjugada antineumocócica) consensuadas por un grupo de trabajo constituido por neumólogos y por un metodólogo documentalista. Para cada pregunta PICO se realizó una exhaustiva revisión bibliográfica y se realizaron reuniones presenciales para su evaluación. Durante la preparación, se publicaron las normativas de la American Thoracic Society y se valoran sus recomendaciones conjuntamente. Se concluye que la investigación etiológica se debe realizar en los pacientes hospitalizados, con sospecha de microorganismos resistentes o con falta de respuesta. Para la valoración de la gravedad y decisión de ingreso, las escalas pronósticas como PSI, CURB 65 y CRB65 son útiles como apoyo al clínico. Se indican las diferentes pautas antibióticas según el ámbito de tratamiento —ambulatorio, hospitalario o Unidad de Cuidados Intensivos— y se recomienda calcular la posibilidad de microorganismos resistentes (puntuación PES). La duración de la pauta antibiótica con un mínimo de 5 días debe basarse en criterios de estabilidad clínica. Por último, se revisa la indicación de la vacuna conjugada 13-valente en inmunocompetentes con factores de riesgo y comorbilidad.
The guidelines for community-acquired pneumonia, last published in 2010, have been updated to provide recommendations based on a critical summary of the latest literature to help health professionals make the best decisions in the care of immunocompetent adult patients. The methodology was based on 6 PICO questions (on etiological studies, assessment of severity and decision to hospitalize, antibiotic treatment and duration, and pneumococcal conjugate vaccination), agreed by consensus among a working group of pulmonologists and an expert in documentation science and methodology. A comprehensive review of the literature was performed for each PICO question, and these were evaluated in in-person meetings. The American Thoracic Society guidelines were published during the preparation of this paper, so the recommendations of this association were also evaluated. We concluded that the etiological source of the infection should be investigated in hospitalized patients who have suspected resistance or who fail to respond to treatment. Prognostic scales, such as PSI, CURB 65, and CRB65, are useful for assessing severity and the decision to hospitalize. Different antibiotic regimens are indicated, depending on the treatment setting - outpatient, hospital, or intensive care unit - and the resistance of PES microorganisms should be calculated. The minimum duration of antibiotic treatment should be 5 days, based on criteria of clinical stability. Finally, we reviewed the indication of the 13-valent conjugate vaccine in immunocompetent patients with risk factors and comorbidity.
La neumonía adquirida en la comunidad (NAC) es la primera causa de muerte por infección y continúa siendo un problema de salud muy relevante, con una incidencia anual de 2-5 adultos por cada 1.000 habitantes1-4. Los conocimientos actuales indican que el impacto negativo de esta enfermedad persiste incluso tras el alta hospitalaria5. Es bien conocido que la enfermedad es más frecuente en varones, en los extremos de la vida y en personas con enfermedades concomitantes6. Los pacientes inmunodeprimidos no deben incluirse en este grupo ya que, en estos casos, el germen causal y el curso clínico dependen en gran medida de la enfermedad primaria. La elección correcta del tratamiento antimicrobiano es un factor pronóstico esencial, por lo que se requiere conocer el ambiente epidemiológico, las características del huésped y la gravedad del episodio clínico7. La prevención frente a esta infección es una prioridad de salud para evitar sus consecuencias a corto y largo plazo.
ObjetivosEl objetivo principal de esta normativa sobre la NAC es proporcionar unas directrices, basadas en un resumen crítico de la literatura más actualizada, que permita a los profesionales de la salud tomar las mejores decisiones en la asistencia de los pacientes adultos con esta patología. Dicha normativa no cubre la NAC en la edad pediátrica ni en los pacientes con inmunodeficiencia primaria o secundaria. El presente documento corresponde a la actualización de la normativa sobre la NAC de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) publicada en 20108. Los grupos de profesionales a los que va dirigida son: médicos de familia de atención primaria y atención especializada, neumólogos, intensivistas, internistas y otros especialistas implicados en el tratamiento de los pacientes con NAC.
MetodologíaEl grupo de trabajo estaba constituido principalmente por neumólogos con amplia representación geográfica, además de un metodólogo experto y un documentalista del Centro Cochrane Iberoamericano que participaron como asesores y efectuaron la búsqueda sistemática de la literatura (material suplementario [anexo]). Los miembros del grupo priorizaron un total de 6preguntas clínicas que la presente actualización debía contestar. Estas 6preguntas fueron seleccionadas por consenso y eran las siguientes:
- 1.
En el paciente hospitalizado, ¿es necesario realizar un estudio etiológico de la NAC incluyendo virus y bacterias atípicas?
- 2.
En la decisión de ingreso, ¿son útiles las escalas pronósticas clásicas de la NAC o mejoran la predicción las escalas de sepsis?
- 3.
En el tratamiento ambulatorio antibiótico, ¿hay que usar una combinación de un betalactámico y un macrólido o es suficiente la monoterapia?
- 4.
¿Existen diferencias de eficacia en las actuales pautas recomendadas en el tratamiento antibiótico de la NAC en pacientes hospitalizados?
- 5.
En pacientes hospitalizados con NAC, ¿es seguro reducir el tratamiento a 5 días sin aumentar las complicaciones o las recaídas o el fracaso terapéutico?
- 6.
En la prevención de la NAC, las nuevas vacunas conjugadas ¿mejoran la eficacia en la población no inmunodeprimida?
La respuesta a cada pregunta se estructura en los 4apartados siguientes: a) controversia existente, incluyendo las recomendaciones de la normativa anterior; b) evidencia actual, en forma de un resumen de los principales hallazgos; c) directrices que se proponen, y d) estudios necesarios a efectuar para resolver las lagunas de conocimiento existentes.
En el paciente hospitalizado, ¿es necesario realizar un estudio etiológico de la NAC incluyendo virus y bacterias atípicas?ControversiaEn la normativa SEPAR del 2010, no se recomendaba efectuar un estudio etiológico en los pacientes con NAC no grave que reciben tratamiento antibiótico ambulatorio8. Siguen siendo válidas las recomendaciones de llevar a cabo un estudio etiológico completo en pacientes con NAC que han requerido hospitalización, pacientes con NAC grave y pacientes con NAC que no responde al tratamiento. El diagnóstico microbiológico es fundamental para garantizar un tratamiento antibiótico adecuado. En la NAC menos grave y debido a la buena respuesta al tratamiento empírico, las recomendaciones de un diagnóstico completo siguen siendo controvertidas, disponer del diagnóstico microbiológico influirá poco en la estrategia antibiótica9. Por el contrario, el estudio etiológico completo es valioso en casos de NAC grave donde existe mayor probabilidad de cambiar el manejo clínico del paciente e instaurar una terapia adecuada a las resistencias antimicrobianas10.
Evidencia actualEl fundamento para recomendar un estudio etiológico completo depende de que exista la probabilidad de cambiar el tratamiento antibiótico empírico, reducir el fracaso del tratamiento y prevenir el uso excesivo de antibióticos10. Aunque diferentes estudios han demostrado que los diversos test diagnósticos en la NAC tienen un bajo rendimiento, la tinción de Gram del esputo es una técnica muy específica en el diagnóstico etiológico3,11, pero es difícil obtener muestras de buena calidad y el tratamiento previo con antibióticos afecta negativamente a su precisión12,13. A pesar del bajo porcentaje (5-14%) de detección bacteriana del hemocultivo, su valor diagnóstico es alto y proporciona información importante sobre la resistencia antimicrobiana. Amaro et al. encontraron un bajo rendimiento de los hemocultivos en pacientes hospitalizados con NAC neumocócica en mayores de 65 años, con enfermedad respiratoria crónica, residencia y con uso de corticoides inhalados y alto rendimiento en reacción en cadena de la polimerasa (PCR) ≥ 20mg/l, infiltrado multilobar y derrame pleural14. En la nueva normativa American Thoracic Society/Infectious Diseases Society of America (ATS/IDSA) se reserva para NAC grave o pacientes que requieran tratamientos empíricos de Staphylococcus aureus resistente a la meticilina (SARM) o Pseudomonas o infección previa por estos u hospitalización en los 90 días previos15.
La detección de antígenos urinarios de Legionella pneumophila (L. pneumophila) y Streptococcus pneumoniae (S. pneumoniae) es de utilidad, sin embargo, se deben conocer sus limitaciones. En las primeras fases de la neumonía el antígeno urinario de L. pneumophila puede ser falsamente negativo, sobre todo en neumonía leve. El antígeno urinario del neumococo puede ser falso positivo (3%) en casos de pacientes con vacunación antineumocócica reciente, colonización previa, como en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) o en aquellos con un episodio previo de neumonía o exacerbaciones de EPOC16.
La serología de bacterias atípicas tiene valor desde el punto de vista epidemiológico, pero la demostración de seroconversión o de un incremento significativo del título de inmunoglobulinas obliga a un diagnóstico tardío y no es útil en el manejo clínico del paciente.
Las técnicas de diagnóstico molecular, con sensibilidad entre el 70 y el 80% y una elevada especificidad del 99-100%, han mostrado una prevalencia creciente de virus respiratorios en la NAC y facilitado el diagnóstico de bacterias atípicas17. Permiten distinguir entre infección por bacterias y virus por la posibilidad de identificar y cuantificar múltiples patógenos en una misma muestra, proporcionan información sobre la susceptibilidad a los antibióticos y aportan información para la vigilancia de la NAC. Actualmente, la resistencia a los antimicrobianos del neumococo frente a macrólidos es alta (20-40%) y frente a fluoroquinolonas entre el 3-8%18. El clon PMEN3, conocido por expresar varios tipos capsulares y afectar principalmente a personas mayores con comorbilidades, representa un 10% de todos los aislamientos en la enfermedad neumocócica invasiva (ENI)19. Los resultados de los test rápidos pueden ser útiles en el manejo de decisiones de pacientes críticos, especialmente en el inicio precoz de la terapia antimicrobiana apropiada.
DirectricesSe debe realizar un estudio etiológico completo en los pacientes con NAC que han requerido hospitalización, en los pacientes con NAC grave, cuando no responden al tratamiento y en los que hay sospecha de microorganismos multirresistentes.
Las pruebas microbiológicas incluyen hemocultivos, tinción de Gram de esputo y cultivo y antígenos urinarios para Legionella y S. pneumoniae. El hemocultivo, la tinción de Gram de esputo y cultivo se recomiendan siempre en NAC grave o con sospecha de microorganismos multirresistentes y exudado nasal para SARM. El antígeno urinario de neumococo para NAC grave y el de Legionella además en sospecha epidemiológica. Nuestra recomendación incluye ambos antígenos en la NAC hospitalizada por la importancia microbiológica y mayor prevalencia de Legionella en España8. La nueva normativa ATS/IDSA recomienda hemocultivos y cultivo de esputo si hay factores de riesgo de SARM o Pseudomonas y en la NAC grave15. El diagnóstico por reacción en cadena de la polimerasa (PCR) para virus respiratorios y bacterias atípicas es especialmente útil en función de la epidemiología del entorno. En pacientes con NAC grave que precisan ser ingresados en una unidad de cuidados intensivos (UCI) es importante obtener una muestra respiratoria (p. ej., lavado broncoalveolar) que permita realizar cultivo microbiológico y un diagnóstico etiológico por PCR para detectar bacterias resistentes a los antibióticos e infecciones virus+bacteria. El estudio de Baudel et al.20, que evaluó el rendimiento de una PCR multiplex en muestras de lavado broncoalveolar en pacientes críticos con sospecha de neumonía, demostró que esta técnica proporciona una mayor tasa de identificación (66%) en comparación con las técnicas de diagnóstico convencionales (40%), especialmente en aquellos pacientes que recibieron tratamiento antimicrobiano.
Estudios para resolver la controversiaSi bien los resultados publicados recientemente de la utilidad de los test de diagnóstico molecular en la detección y cuantificación de patógenos, así como en la identificación de resistencias, son alentadores, continúan existiendo áreas de incertidumbre. Son necesarios más estudios para evaluar sistemáticamente y rigurosamente el rendimiento de estas pruebas, establecer cómo mejorarán el diagnóstico de patógenos respiratorios y el desescalado de tratamientos antimicrobianos por lo que incidirán en el manejo del paciente cuando se implementen en la práctica diaria.
En la decisión de ingreso, ¿son útiles las escalas pronósticas clásicas de la NAC o mejoran la predicción las escalas de sepsis?ControversiaEl lugar de atención del paciente con NAC es el mayor determinante de los resultados, tanto desde el punto de vista pronóstico, como de costes sanitarios. Para ayudar en esta toma de decisión, se han desarrollado escalas de predicción de mortalidad como el Pneumonia Severity Index (PSI) y CURB-65 (confusión, urea> 7 mmol/l, frecuencia respiratoria ≥ 30/min, presión arterial sistólica [< 90mmHg] o diastólica [≤ 60mmHg] y edad [≥ 65 años])21-24, empleando la necesidad de ingreso hospitalario como indicador subrogado. En paralelo a la aplicación de escalas específicas para NAC, se han desarrollado escalas genéricas como National Early Warning Score (NEWS) (actualizada en 2017)25 y quick-Sequential Organ Failure Assessment (q-SOFA)26. No obstante, existe controversia sobre si estas escalas genéricas de sepsis podrían mejorar el grado de predicción de las escalas clásicas.
Evidencia actualSe han publicado 5revisiones sistemáticas con 4metaanálisis que han evaluado la capacidad predictiva de las escalas. En 3revisiones se analizaba la predicción de mortalidad27-29 y en las otras 2, la predicción de ingreso en UCI30,31. Según estas revisiones, el índice de gravedad PSI21, el CURB-65 y el CRB-65 (confusión, respiratory rate, blood pressure, 65 years of age or older [confusión, frecuencia respiratoria, presión arterial, 65 años de edad o más]; como el anterior excluyendo urea)22 son las escalas más empleadas en la decisión de ingreso. El PSI identifica mejor los pacientes de bajo riesgo de mortalidad por lo que unido al juicio clínico es la recomendada en las nuevas normativas ATS/IDSA para la necesidad de ingreso hospitalario15. Para la predicción de ingreso en UCI, los criterios mayores y menores de la ATS/IDSA15 y las puntuaciones de la escala The Severe Community-Acquired Pneumonia (SCAP; España score)32 y SMART-COP (systolic blood pressure, multilobar infiltrates, albumin, respiratory rate, tachycardia, confusion, oxygen y pH) (acrónimo de 8 variables: 4 clínicas, 3 analíticas y radiológica)33 tienen mejor valor predictivo comparado con PSI21 y CURB-6522. Un estudio de metaanálisis, empleando un criterio mayor o 3menores de la ATS/IDSA encuentra una sensibilidad del 84% y especificidad del 78% para predecir ingreso en la UCI, y con solo criterios menores (3) una sensibilidad del 56% y una especificidad del 91%31.
En cuanto a las escalas genéricas, un estudio comparativo concluye que NEWS es inferior en la predicción de mortalidad y mejor en la predicción de ingreso en la UCI respecto a CURB-65 y PSI34. Con respecto a la comparación de escala q-SOFA con otras escalas específicas, se han revisado 7 artículos35-41 y una revisión sistemática con metaanálisis42, con hallazgos contradictorios. La mayoría de los estudios concluyen que la capacidad predictiva de q-SOFA es similar35,37,39 o inferior30,31 a las escalas PSI, CURB-65, CRB (confusion, respiratory rate, blood pressure [confusión, frecuencia respiratoria, presión arterial]) o CRB-65, excepto un estudio chino que muestra superioridad del q-SOFA, aunque tiene escasa validez externa por la diferente mortalidad36. Asimismo, q-SOFA mostró superioridad a CURB-65 en predecir la necesidad de ingreso en la UCI38. En la tabla 1 del material suplementario (anexo) se resumen las características principales de los estudios del q-SOFA.
DirectricesLas escalas pronósticas como PSI y la más sencilla CURB-65 son útiles en la decisión inicial de hospitalización como apoyo al juicio clínico. El uso de CRB-65 es preferible en el ámbito extrahospitalario. En la normativa ATS/IDSA para la decisión de ingreso se prefiere el PSI sobre el CURB6515. Nuestras recomendaciones incluyen ambas escalas dada la facilidad de emplear el CURB65 y, además, por disponer de una adaptación —CRB-65— para el ámbito extrahospitalario. Las escalas genéricas, como q-SOFA, tienen una capacidad predictiva moderada y su empleo puede estar justificado si no hay certeza diagnóstica de NAC, pero no se ha demostrado que mejoren el poder predictivo de escalas similares y específicas de NAC, como CRB o CRB-65. Para el ingreso en UCI, la normativa ATS/IDSA mantiene también los criterios ATS/IDSA mayores y menores, y no se hace referencia al q-SOFA15.
Estudios para resolver la controversiaSe recomienda realizar estudios prospectivos y multicéntricos que comparen el rendimiento de q-SOFA y de escalas específicas de NAC, además de evaluar su aplicabilidad en la práctica clínica. La incorporación de ciertos biomarcadores en las escalas pronósticas de NAC podría mejorar la capacidad predictiva de las mismas.
En el tratamiento ambulatorio antibiótico, ¿hay que usar una combinación de un betalactámico y un macrólido o es suficiente la monoterapia?ControversiaEn las guías actuales de tratamiento de la NAC, debido a la menor gravedad, posibilidad de tratamiento ambulatorio de este proceso e imposibilidad de obtener resultados microbiológicos, existe controversia respecto al tratamiento empírico. En las guías de las sociedades europea y británica, y de la Asociación Latinoamericana del Tórax, no se recomienda la cobertura de microorganismos atípicos por su escasa relevancia en la NAC. Por el contrario, en las últimas normativas de la IDSA/ATS del 200715 y SEPAR del 20108 se recomienda el uso de quinolonas en monoterapia o la combinación de un antibiótico betalactámico con un macrólido. Sin embargo, estudios recientes43,44 y un metaanálisis45 destacan el escaso efecto beneficioso de los macrólidos en el tratamiento de pacientes menos graves, a diferencia de los pacientes más graves. Por ello, se desconoce si la monoterapia con betalactámico sin añadir un macrólido puede ser igual de efectiva para los pacientes tratados ambulatoriamente.
Evidencia actualCuando se comparan diferentes pautas de tratamiento, ya sea usando un betalactámico en combinación con un macrólido o monoterapia con una fluoroquinolona o un betalactámico, los pacientes tratados con monoterapia no presentan mayor mortalidad a los 90 días que los tratados con la combinación46. En un estudio observacional con 2.845 pacientes en el que se comparaba la monoterapia con un macrólido frente a una quinolona, el grupo tratado con un macrólido precisó menos ingresos hospitalarios y una menor mortalidad (0,2% vs. 3,0%, p=0,02)47. Su so ha demostrado incluso buena evolución clínica a pesar de existir factores de riesgo de resistencia a neumococo48. Sin embargo, una revisión Cochrane49 publicada en 2014, en la que se incluyeron 11 ensayos clínicos con 3.352 pacientes de más de 12 años de edad tratados ambulatoriamente, no reveló diferencias estadísticamente significativas en cuanto a eficacia entre los diferentes antibióticos, concluyendo en la necesidad de realizar más estudios en este grupo de pacientes.
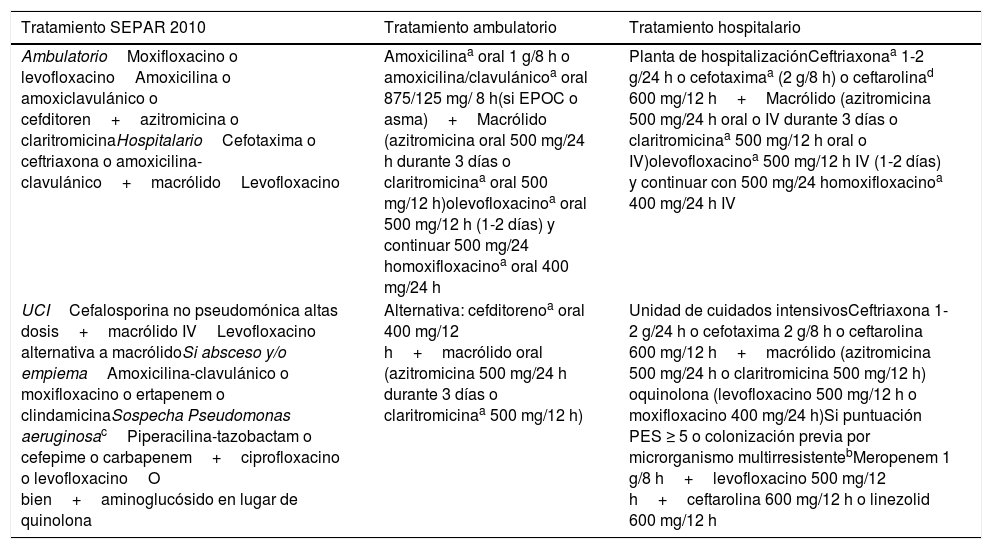
DirectricesA falta de ensayos clínicos aleatorizados y de acuerdo con la evidencia proporcionada por estudios observacionales, la combinación de un macrólido y un betalactámico deberían formar parte de la pauta de tratamiento empírico ambulatorio en pacientes con NAC, o bien considerar la administración de una quinolona en monoterapia (tabla 1). En pacientes con enfermedad respiratoria crónica de base (EPOC o asma), la amoxicilina con ácido clavulánico sería el betalactámico recomendado. En la nueva normativa ATS/IDSA, su recomendación incluye además monoterapia con macrólidos si la resistencia del neumococo es <25%, lo que no sucede en nuestro ámbito15.
Tratamiento empírico de la NAC en función del nivel de atención sanitario
| Tratamiento SEPAR 2010 | Tratamiento ambulatorio | Tratamiento hospitalario |
|---|---|---|
| AmbulatorioMoxifloxacino o levofloxacinoAmoxicilina o amoxiclavulánico o cefditoren+azitromicina o claritromicinaHospitalarioCefotaxima o ceftriaxona o amoxicilina-clavulánico+macrólidoLevofloxacino | Amoxicilinaa oral 1 g/8 h o amoxicilina/clavulánicoa oral 875/125 mg/ 8 h(si EPOC o asma)+Macrólido (azitromicina oral 500 mg/24 h durante 3 días o claritromicinaa oral 500 mg/12 h)olevofloxacinoa oral 500 mg/12 h (1-2 días) y continuar 500 mg/24 homoxifloxacinoa oral 400 mg/24 h | Planta de hospitalizaciónCeftriaxonaa 1-2 g/24 h o cefotaximaa (2 g/8 h) o ceftarolinad 600 mg/12 h+Macrólido (azitromicina 500 mg/24 h oral o IV durante 3 días o claritromicinaa 500 mg/12 h oral o IV)olevofloxacinoa 500 mg/12 h IV (1-2 días) y continuar con 500 mg/24 homoxifloxacinoa 400 mg/24 h IV |
| UCICefalosporina no pseudomónica altas dosis+macrólido IVLevofloxacino alternativa a macrólidoSi absceso y/o empiemaAmoxicilina-clavulánico o moxifloxacino o ertapenem o clindamicinaSospecha Pseudomonas aeruginosacPiperacilina-tazobactam o cefepime o carbapenem+ciprofloxacino o levofloxacinoO bien+aminoglucósido en lugar de quinolona | Alternativa: cefditorenoa oral 400 mg/12 h+macrólido oral (azitromicina 500 mg/24 h durante 3 días o claritromicinaa 500 mg/12 h) | Unidad de cuidados intensivosCeftriaxona 1-2 g/24 h o cefotaxima 2 g/8 h o ceftarolina 600 mg/12 h+macrólido (azitromicina 500 mg/24 h o claritromicina 500 mg/12 h) oquinolona (levofloxacino 500 mg/12 h o moxifloxacino 400 mg/24 h)Si puntuación PES ≥ 5 o colonización previa por microrganismo multirresistentebMeropenem 1 g/8 h+levofloxacino 500 mg/12 h+ceftarolina 600 mg/12 h o linezolid 600 mg/12 h |
EPOC: enfermedad pulmonar obstructiva crónica; IV: intravenosa; NAC: neumonía adquirida en la comunidad; calcular puntuación PES: índice de resistencia antibiótica (Pseudomonas aeruginosa, Enterobacteriacea productora de betalactamasa de espectro extendido y Staphylococcus aureus resistente a la meticilina.
La duración del tratamiento se individualiza según criterios de estabilidad clínica con un mínimo de 5 días.
Toma de muestras respiratorias para realizar cultivo, diagnóstico molecular y desescalar tratamiento empírico si se descartan patógenos PES.
Se precisan estudios de base poblacional de eficacia y seguridad del uso de macrólidos frente a quinolonas en monoterapia, así como de monoterapia con un betalactámico o combinado con un macrólido.
¿Existen diferencias de eficacia en las actuales pautas recomendadas en el tratamiento antibiótico de la NAC en pacientes hospitalizados?ControversiaLas guías actuales de tratamiento de los pacientes con NAC que precisan ingreso hospitalario, excluyendo ingreso en la UCI, con enfermedades concomitantes o factores de riesgo de resistencia al neumococo, recomiendan tratamiento con quinolonas en monoterapia o la combinación de un betalactámico y un macrólido6. La superioridad del uso de betalactámicos en monoterapia frente a la combinación con macrólidos aún no se ha establecido definitivamente50-52. En pacientes que por su gravedad requieren ingreso en la UCI, se recomienda la combinación de un betalactámico con un macrólido o una quinolona.
Evidencia actualEn un ensayo clínico aleatorizado de no inferioridad de monoterapia con betalactámicos frente a la combinación de un betalactámico y un macrólido en pacientes con NAC hospitalizados, no se observaron diferencias significativas entre ambas pautas, aunque los pacientes con PSI categoría iv tratados con monoterapia presentaron una evolución clínica más lenta44.
Un metaanálisis de 28 estudios observacionales con 9.850 pacientes diagnosticados de NAC grave demostraba una reducción de la mortalidad del 3% (riesgo relativo [RR] 0,82, p=0,02) cuando se incluía un macrólido en la pauta antibiótica frente a otras pautas sin macrólidos45. En estudios retrospectivos también se confirmaba la importancia de añadir un macrólido a un betalactámico en el tratamiento de pacientes con neumonía neumocócica bacteriémica51. En pacientes ingresados con NAC neumocócica y elevada respuesta inflamatoria sistémica, la combinación de un betalactámico con un macrólido reducía significativamente la mortalidad53.
En el ensayo clínico CAP-START50, aleatorizado, por conglomerados y cruzado en el que se comparaban 3pautas antibióticas (monoterapia con betalactámico, monoterapia con quinolona y combinación de betalactámico y macrólido), no se observaron diferencias en la mortalidad a los 90 días. No obstante, algunas limitaciones del estudio incluyen la falta de confirmación radiológica en una cuarta parte de los pacientes y el uso de antibióticos para cubrir patógenos atípicos en un porcentaje notable de pacientes (39% en el brazo de monoterapia con betalactámico) a pesar de que solo se identificaron microorganismos atípicos en un 2% de los pacientes. Estudios recientes incorporan las cefalosporinas de 5.a generación como tratamiento de primera línea y omadaciclina y lefamulina han sido aprobados por la Food and Drug Administration al demostrar no inferioridad frente a tratamiento con quinolonas (tabla 2)15,54,55.
Nuevos antibióticos en la NAC
| Característica | Ceftarolinaa | Ceftobiprol | Omadaciclina | Lefamulina |
|---|---|---|---|---|
| Formulación IV (dosis) | + (600 mg/12 h) | + (500 mg/8 h) | + (100 mg/12 h 1.er día; 100 mg/24 h) | +(150 mg/12 h) |
| Formulación oral (dosis) | − | − | +(300 mg/24 h) | +(600 mg/12 h) |
| Cobertura SARM | + | + | + | + |
| Cobertura Pseudomonas aeruginosa | − | + | − | − |
| Cobertura Legionella pneumophila y atípicas | − | − | + | + |
| Aprobación EMA | + | + | No | No |
EMA: European Medicines Agency (Agencia Europea del Medicamento); IV: intravenosa; NAC: neumonía adquirida en la comunidad; SARM: Staphylococcus aureus resistente a la meticilina.
En los pacientes con NAC que precisan ingreso hospitalario, se recomienda tratamiento con la combinación de un betalactámico y un macrólido o una quinolona56 (tabla 1). Cuando exista la posibilidad de infección por microorganismos multirresistentes, es aconsejable calcular la puntuación en en el índice de resistencia antibiótica PES, basada en los 3patógenos multirresistentes más frecuentes en la NAC (Pseudomonas aeruginosa, Enterobacteriacea productora de betalactamasa de espectro extendido y SARM)57. Si el resultado es ≥5 (sensibilidad del 70% para patógenos PES), se aconseja recoger muestras respiratorias para cultivo incluyendo técnicas de diagnóstico molecular si es posible, iniciar cobertura antibiótica empírica (meropenem+levofloxacino+ceftarolina o linezolid) y desescalar si se descartan patógenos PES tras los resultados microbiológicos (tabla 1). La nueva normativa ATS/IDSA recomienda tratamientos para SARM o Pseudomonas en pacientes con factores de riesgo que deben ser validados localmente y únicamente cobertura de anaerobios si sospecha de absceso o empiema15.
Por otra parte, los macrólidos (claritromicina o azitromicina) deben formar parte de las pautas terapéuticas de NAC principalmente en los pacientes más graves y que requieren ingreso en la UCI. Su comprobado beneficio puede ser debido al efecto antiinflamatorio de esta familia de antibióticos.
Estudios para resolver la controversiaLos datos disponibles hasta la fecha de las diferentes pautas de tratamiento antibiótico se basan en resultados de estudios observacionales. Por ello, es necesario efectuar ensayos clínicos aleatorizados y controlados para demostrar la eficacia de la combinación de un betalactámico y un macrólido frente a un betalactámico y una quinolona, en la población de pacientes con NAC confirmada radiológicamente y que requieran ingreso hospitalario, ya sea en la planta de hospitalización o en la UCI. En caso de infección neumocócica, cabe relacionarla con el fenotipo inflamatorio.
Asimismo, se precisa validación de la puntuación PES para limitar el tratamiento antibiótico en otras poblaciones, así como estudios a partir de grandes bases de datos y utilizando técnicas de machine learning (algoritmos de predicción) para identificar poblaciones que se puedan beneficiar de tratamiento empírico con antibióticos más dirigidos.
En pacientes hospitalizados con NAC, ¿es seguro reducir el tratamiento a 5 días sin aumentar las complicaciones o las recaídas o el fracaso terapéutico?ControversiaLa duración óptima del tratamiento antibiótico en la NAC no está bien establecida existiendo discrepancias entre las diferentes guías publicadas hasta la fecha9,58,59. En la última normativa SEPAR de la NAC se recomendaba entre 7-10 días de tratamiento antibiótico y hasta 14 días para aquellos pacientes que precisaran ingreso en la UCI8. Los efectos negativos de prolongar la duración de la administración de antibióticos son numerosos. Las pautas largas aumentan el desarrollo de resistencias, habiéndose observado un aumento de portadores nasofaríngeos de S. pneumoniae resistente a la penicilina con el uso de dosis bajas de betalactámicos durante más de 5 días en niños60. Los regímenes prolongados aumentan los costes del tratamiento y la posibilidad de efectos adversos como la infección por Clostridium difficile, así como pueden afectar a la adherencia al tratamiento61-63. Un estudio de cohortes retrospectivo de pacientes hospitalizados por NAC en 2012-2013 en hospitales de EE. UU. demostró que la duración media del tratamiento antibiótico excedía el tiempo recomendado en un 74 y un 71% de los pacientes de 18-64 años de edad y de ≥ 65 años, respectivamente64. De hecho, disminuir la duración del tratamiento antibiótico continúa siendo un desafío.
Evidencia actualEn un metaanálisis reciente que incluyó 15 ensayos clínicos aleatorizados y controlados con 2.796 pacientes con NAC leve-moderada no se observaron diferencias en la eficacia de pautas cortas de antibiótico <de 7 días frente ≥ 7 días65. En otro metaanálisis que incluyó 5ensayos clínicos en adultos con NAC leve-moderada, y en el que se compararon mismos tipos de antibióticos, no se detectaron diferencias en la tasa de curación de clínica, mortalidad y efectos adversos entre pautas cortas de 3 a 7 días y pautas largas de 7 a 10 días66. Recientemente, un nuevo metaanálisis comparando pautas ≤ 6 días frente a ≥ 7 días con la inclusión de 19 estudios ha proporcionado datos sorprendentes67. Con tasas de curación y recaídas similares, el grupo tratado con pauta corta no solo presentaba menos efectos adversos, sino también menor mortalidad respecto al grupo con pauta larga (RR 0,52, intervalo de confianza [IC] del 95%, 0,33-0,82). Asimismo, en un subanálisis de pacientes con neumonía grave, la mortalidad seguía siendo más baja en el grupo con pauta corta (el 2,2% frente al 4,7%)67. Los resultados pormenorizados de estos metaanálisis se describen en la tabla 2 del material suplementario (anexo). De forma novedosa, un ensayo clínico de no inferioridad con pacientes ingresados por NAC comparó las recomendaciones ATS/IDSA9 para la duración del tratamiento antibiótico con un mínimo de 5 días y suspendiendo el antibiótico tras 48 h de estabilidad clínica, con una pauta habitual decidida por los propios médicos68. A pesar de una diferencia significativa en la duración del tratamiento (mediana 5 días y 10 días, respectivamente, p <0,001), los porcentajes de curación clínica a los 10 y 30 días fueron similares.
Por último, el empleo de la procalcitonina (PCT) ha demostrado ser de gran interés para la disminución del tratamiento antibiótico. En el estudio PRORATA, llevado a cabo en pacientes críticos, se implementó un algoritmo para suspender la administración de antibióticos tras una reducción de la PCT al menos del 80% o con valores inferiores a 0,5 μg/l69. Los pacientes en el grupo de PCT presentaron más días libres de antibiótico con una diferencia absoluta de 2,7 días (IC del 95% 1,4-4,1, p <0,0001) en comparación con el grupo control. En otro ensayo clínico de características similares, la mediana de tratamiento con antibióticos era de 5 días en el grupo de la PCT frente a 7 días en el grupo control70. En este estudio se observó una diferencia significativa en la mortalidad en favor del grupo asignado a PCT, tanto en los análisis de la población por intención de tratamiento como por protocolo.
DirectricesLa duración del tratamiento antibiótico debe individualizarse y basarse en criterios de estabilidad clínica, con un mínimo de 5 días y pudiendo suspenderse tras 48 h de ausencia de fiebre (temperatura <37,8°C) y sin más de un signo de inestabilidad clínica (presión arterial sistólica <90mmHg, frecuencia cardiaca> 100 latidos/min, frecuencia respiratoria> 24/min, <90% aire ambiente). Esta recomendación de duración de 5 días coincide con la nueva normativa ATS/IDSA, que también considera necesario alcanzar la estabilidad clínica15. En caso de neumonía necrosante, absceso pulmonar, derrame pleural complicado, infecciones extrapulmonares o sospecha de gérmenes no comunes (P. aeruginosa, S. aureus, anaerobios, etc.), debe considerarse prolongar el tratamiento antibiótico. La PCT puede ser de utilidad para la ayuda a la toma de decisiones en la duración del antibiótico.
Estudios para resolver la controversiaSe precisan ensayos clínicos realizados en la población con neumonías más graves o gérmenes no habituales para evaluar las recomendaciones sobre duración de tratamiento antibiótico.
En la prevención de la NAC, las nuevas vacunas conjugadas ¿mejoran la eficacia en la población no inmunodeprimida?ControversiaEn la normativa anterior de la SEPAR de 20108, se recomendaba la vacuna heptavalente conjugada neumocócica de 13 serotipos (VCN13v) en niños y la vacuna polisacárida neumocócica de 23 serotipos (VPN23v) en personas mayores de 65 años de edad y en menores con inmunosupresión o factores de riesgo. Posteriormente, se ha publicado el consenso de vacunación VCN13v de 15 sociedades científicas71, el consenso de la SEPAR de vacunación en fumadores72 y las recomendaciones del Advisory Committee on Immunization Practices (ACIP)73 de EE. UU.
Evidencia actualVarios estudios y diferentes metaanálisis han aportado nuevas evidencias a la inmunogenicidad de las vacunas en la NAC. El estudio más extenso corresponde a un ensayo clínico aleatorizado y controlado (estudio CAPiTA)74 de la eficacia de la VCN13v frente a placebo en adultos ≥ 65 años de edad, con una muestra total de 84.496 participantes. Este estudio demostraba una eficacia de la vacuna del 45,6% (IC del 95%, 21,8-62,5) en la prevención de NAC causada por los serotipos vacunales, del 45% (IC del 95%, 14,2-65,3) en la NAC no bacteriémica y NAC no invasiva y del 75% (IC del 95%, 41,4-90,8) en la ENI, con una duración de la eficacia de hasta 3,97 años. En un subestudio de este ensayo, se confirmó que la eficacia de la vacuna se mantenía en sujetos inmunocompetentes con comorbilidades y en las 3cohortes de edad de 65-69 años, 70-79 años y ≥ 80 años75. Asimismo, en un análisis post hoc de un ensayo clínico de la eficacia de la VCN13v en adultos de más de 65 años de edad, la eficacia de la vacuna era independiente de la enfermedad de base referida por el paciente, incluyendo la presencia de diabetes, enfermedad cardiaca, enfermedad pulmonar, asma, enfermedad hepática y hábito tabáquico76. En un estudio en el que se utilizó el diseño test-negativo de casos y controles77, incluyendo a todos los pacientes ≥ 65 años hospitalizados por NAC en Louisville, Kentucky (EE. UU.) durante un año, la eficacia de la VCN13v para la protección frente a los serotipos vacunales fue del 72,8% (IC del 95% 12,8-91,5), manteniéndose dicha eficacia tras ajustar por índice de masa corporal, estado inmunitario, historia de gripe y de vacunación neumocócica polisacárida.
Cabe destacar que el 60% de los serotipos circulantes en España en pacientes adultos con NAC hospitalizados correspondía a los incluidos en la VCN13v78. En un estudio en pacientes con ENI, se demostró una reducción de episodios invasivos por serotipos contenidos en VCN13v en el periodo posterior a 2012 excepto para el serotipo 379.
Se han publicado varias revisiones sistemáticas con metaanálisis referidos a la eficacia de VPN23v, con apenas estudios de la VCN13v en el adulto78-86 (tabla 3 del material suplementario [anexo]). En un metaanálisis de 7 ensayos clínicos aleatorizados, la vacuna VPN23v proporcionaba una protección débil en adultos inmunocompetentes de más de 65 años de edad y en individuos de 19-64 años con factores de riesgo de NAC86. En este metaanálisis también se observó una tendencia a la disminución de la mortalidad, pero sin significación estadística por el escaso número de ensayos86. En general, no hay acuerdo entre los distintos metaanálisis de la VPN23v respecto a la protección de la vacuna en la NAC, excluyendo la ENI, y la duración de su eficacia se va desvaneciendo siendo solo precoz. En la ENI, la eficacia de la vacuna es superior. Asimismo, la vacunación se asocia con un menor riesgo de eventos cardiovasculares, pero el efecto protector se atenúa después de un año80. Una reciente revisión de la Cochrane en pacientes EPOC81 se concluye que la vacunación reduce la probabilidad de exacerbación con una calidad de la evidencia moderada. El número de sujetos a vacunar para prevenir una neumonía era de 21 y 8 para prevenir una exacerbación. Sin embargo, esta revisión no ha podido comparar la eficacia de las distintas vacunas antineumocócicas81.
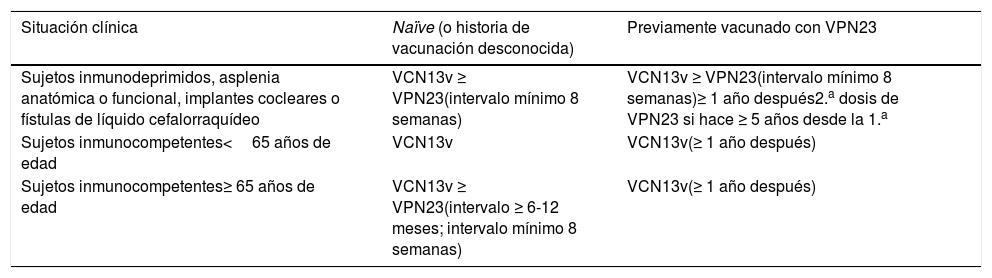
DirectricesLa VCN13v ha mostrado eficacia vacunal y de mayor duración que la polisacárida en sujetos inmunocompetentes con factores de riesgo para los serotipos vacunales en NAC no bacteriémica87, así como en la ENI. Los factores de riesgo incluyen enfermedades cardiacas, hepáticas, renales y respiratorias crónicas (incluye asma), cáncer, diabetes, alcoholismo crónico, tabaquismo, trasplante de órgano sólido o células hematopoyéticas, implantes cocleares, fístulas de líquido cefalorraquídeo, asplenia anatómica o funcional y antecedente de ENI. Las pautas de vacunación actualmente en vigor se presentan en la tabla 3, pendientes de una nueva valoración por el ACIP.
Pautas de vacunación antineumocócica
| Situación clínica | Naïve (o historia de vacunación desconocida) | Previamente vacunado con VPN23 |
|---|---|---|
| Sujetos inmunodeprimidos, asplenia anatómica o funcional, implantes cocleares o fístulas de líquido cefalorraquídeo | VCN13v ≥ VPN23(intervalo mínimo 8 semanas) | VCN13v ≥ VPN23(intervalo mínimo 8 semanas)≥ 1 año después2.a dosis de VPN23 si hace ≥ 5 años desde la 1.a |
| Sujetos inmunocompetentes<65 años de edad | VCN13v | VCN13v(≥ 1 año después) |
| Sujetos inmunocompetentes≥ 65 años de edad | VCN13v ≥ VPN23(intervalo ≥ 6-12 meses; intervalo mínimo 8 semanas) | VCN13v(≥ 1 año después) |
LCR: líquido cefalorraquídeo; VCN13v: vacuna conjugada antineumocócica 13-valente; VPN23: vacuna polisacárida antineumocócica 23-valente.
La monitorización de la evolución de los serotipos y la posibilidad de recambio es importante para valorar su eficacia en el futuro, ya que en algunos estudios se ha encontrado aumento de serotipos no vacunales88,89. En sujetos inmunocompetentes > 65 años de edad se mantiene la VPN23v después de la conjugada.
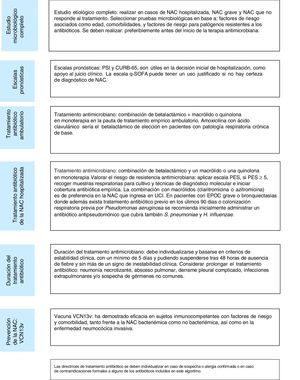
A modo de resumen, se presentan los aspectos claves del manejo clínico del paciente con NAC (fig. 1).
Resumen de las directrices- –
La investigación etiológica se debe realizar en los pacientes con episodios hospitalizados, de gravedad, con sospecha de microorganismos resistentes (puntuación PES) o con falta de respuesta al tratamiento.
- –
Las escalas pronósticas como PSI, CURB-65 y CRB-65 son útiles como apoyo al clínico en la decisión inicial de hospitalización. El uso de biomarcadores puede mejorar su capacidad predictiva.
- –
El tratamiento antibiótico empírico requiere cubrir los patógenos más frecuentes, lo que incluye y en casos graves, calcular la posibilidad de microorganismos resistentes (puntuación PES). En este grupo, la realización de estudios con los nuevos test multiplex rápidos puede ayudar en la indicación de tratamiento específico y su ajuste posterior.
- –
La duración de la pauta antibiótica con un mínimo de 5 días debe basarse en criterios de estabilidad clínica.
- –
La vacuna VCN13v ha demostrado su eficacia en sujetos inmunocompetentes con factores de riesgo y comorbilidad, tanto frente a la NAC no bacteriémica, así como en la ENI.
La Dra. Cillóniz recibió una beca posdoctoral (Plan Estratégico de Investigación e Innovación en Salud-PERIS 2016-2020), una beca SEPAR 2018 y una ayuda del Fondo de Investigación Sanitaria (beca PI19/00207). El Dr. Méndez recibió una beca Río Hortega (CM19/00182) del Instituto de Salud Carlos III y cofinanciada por el Fondo Social Europeo («El Fondo Social Europeo invierte en tu futuro»).
Conflicto de interesesR. Menéndez: Pfizer, Menarini, Zambón, MSD, Chiesi y Meiji.
P.P. España: Pfizer y Zambón.
A. Torres: Advisory Board: Pfizer, MSD, Polyphor, Biotest, Bioversys.
Resto de autores: sin conflicto.
Todos los autores excepto D. Rigau son miembros de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).