Las indicaciones de la membrana de oxigenación extracorpórea (ECMO), como soporte vital transitorio en pacientes con insuficiencia respiratoria o cardiaca graves, refractarias a tratamiento convencional, se han ampliado considerablemente en los últimos 20 años1. La ECMO puede utilizarse en el síndrome de distrés respiratorio agudo (SDRA) y en otras formas de insuficiencia respiratoria potencialmente reversible como puente a la recuperación, a una intervención quirúrgica definitiva2 o al trasplante3. Igualmente, se ha descrito la utilización de la ECMO en contextos de infecciones respiratorias graves como las causadas por virus influenza A H1N14 y, más recientemente, por coronavirus tipo 2 del síndrome respiratorio agudo grave5. Sin embargo, no existen muchos datos sobre su potencial uso en complicaciones debidas a infecciones parasitarias6,7. Presentamos el caso de un paciente con diagnóstico de quistes hidatídicos pulmonares bilaterales en tratamiento antiparisatorio previo a la intervención quirúrgica que sufrió la rotura de uno de los quistes y que precisó de soporte vital con ECMO como puente a la cirugía definitiva.
Se trata de un paciente de 21 años de origen peruano, alérgico a metamizol y diazepam, sin hábitos tóxicos ni antecedentes médicos de interés, que acudió al Servicio de Urgencias por tos y expectoración hemoptoica de 3 días de evolución, sin otra sintomatología acompañante. En la radiografía de tórax se objetivaron 2 masas de bordes bien definidos en ambos lóbulos inferiores y signos de hiperinsuflación pulmonar (fig. 1A). La tomografía computarizada torácica evidenció 2 lesiones quísticas pulmonares: una de 10,5×9,8cm en lóbulo inferior derecho y otra de 6,2×6,1cm en lóbulo inferior izquierdo. Los hallazgos radiológicos eran sugerentes de quistes hidatídicos pulmonares sin signos de complicación. Tras obtenerse el título positivo de anticuerpos frente a Echinococcus granulosus, se decidió iniciar tratamiento antiparasitario con albendazol (400mg/12h) y praziquantel (1.200mg/12h) previo a la intervención quirúrgica. Las pruebas de función respiratoria del paciente reflejaron una alteración ventilatoria restrictiva.
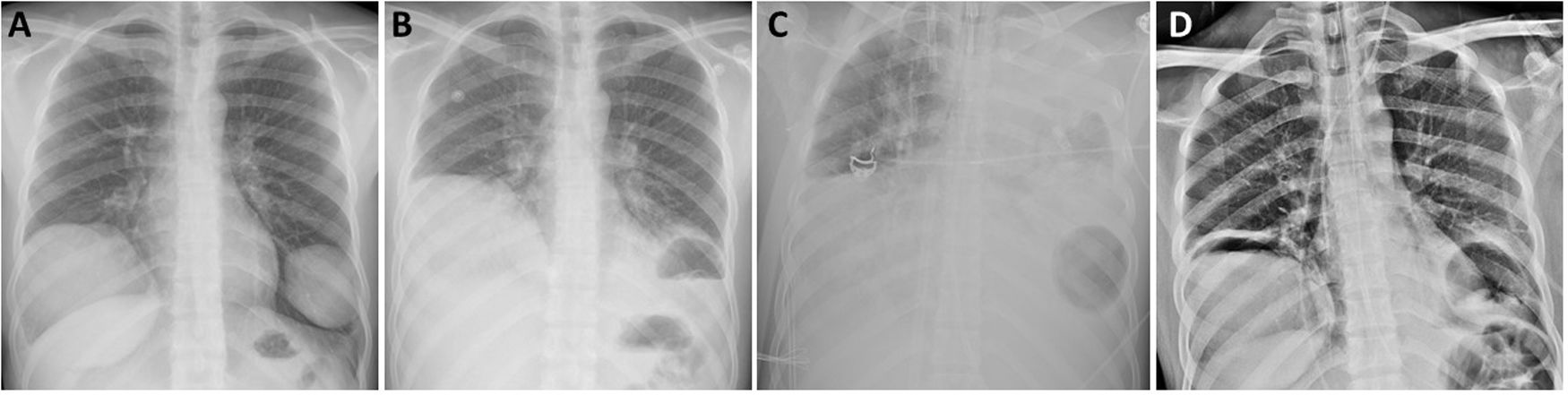
Radiografía de tórax al diagnóstico en la que se evidencian 2 lesiones quísticas no complicadas (A), tras rotura del quiste hidatídico de pulmón izquierdo (B) en la que se objetiva nivel hidroaéreo tras la colocación de ECMO, en la que se evidencia opacificación de todo el hemitórax izquierdo e imagen aérea basal izquierda (C) y una vez suspendido el soporte ventilatorio y de la ECMO (D).
Durante el período de espera para la intervención quirúrgica el paciente presentó de forma espontánea dolor en el hemitórax izquierdo y tos, seguidos de vómica escasa y expectoración hemoptoica. En la exploración física del paciente destacaba taquipnea (>25rpm), taquicardia (>130lpm), hipotensión (103/57mmHg) y SatO2: 92% con aporte de oxígeno en gafas nasales a 2l por minuto. La analítica destacaba leucocitosis de 11.420/μl, con 6,2% de eosinófilos y PCR de 4,36mg/dl. La radiografía de tórax mostró un nivel hidroaéreo en la región basal del hemitórax izquierdo compatible con quiste hidatídico complicado con comunicación con la vía aérea (fig. 1B). En pocas horas el paciente sufrió deterioro generalizado e insuficiencia respiratoria aguda y precisó ingreso en la unidad de cuidados intensivos (UCI) e intubación orotraqueal urgente. A pesar de llevar a cabo una ventilación pulmonar protectora, el paciente presentó empeoramiento progresivo con acidosis respiratoria, hipercapnia>70mmHg, PaO2/FiO2<100mmHg, gran dificultad para la ventilación y tendencia a la hipotensión arterial. Dada la persistencia de la mala situación respiratoria compatible con SDRA debido a la rotura del quiste hidatídico izquierdo, se decidió terapia de soporte con ECMO veno-venosa (fig. 1C). El paciente fue tratado con antibiótico empírico con piperacilina/tazobactam y linezolid, y los cultivos microbiológicos realizados descartaron sobreinfección bacteriana. Tras lograr la estabilización hemodinámica y respiratoria del paciente, la evolución posterior fue satisfactoria con disminución del soporte ventilatorio y de la ECMO hasta su completa retirada 10 días después de su colocación, y consiguiendo la extubación del paciente 3 días más tarde. El paciente fue dado de alta de la UCI a la planta de hospitalización con objeto de llevar a cabo un tratamiento rehabilitador basado en fisioterapia respiratoria previo a la intervención quirúrgica programada. Una semana después se llevó a cabo la resección quirúrgica de ambas lesiones pulmonares mediante toracotomía bilateral sin sección muscular; en el lado derecho se realizó una lobectomía inferior, mientras que en el lado izquierdo se llevó a cabo la resección atípica del segmento anterobasal. Durante el postoperatorio el paciente presentó como única complicación un síndrome confusional con desorientación y alteración del nivel de conciencia, por lo que solicitó valoración por el servicio de neurología que, tras la evaluación clínica y radiológica con resonancia magnética cerebral estableció el diagnóstico de microsangrado cerebral difuso en paciente críticamente enfermo en probable relación con la terapia con ECMO que no precisó tratamiento específico. El paciente fue dado de alta al séptimo día postoperatorio tras la resolución de cuadro neurológico, y remitido al Servicio de Enfermedades Infecciosas para control del tratamiento médico y seguimiento.
El SDRA asociado o no a shock anafiláctico tras rotura de un quiste hidatídico pulmonar es muy infrecuente, aunque se ha descrito en varios casos6,8,9. Sin embargo, su manejo con ECMO solo se ha descrito en un caso con anterioridad6. En este contexto el soporte con ECMO veno-venosa proporciona una adecuada oxigenación y ventilación, lo que permite mantener un apoyo ventilatorio mínimo, reduciendo así el barotrauma asociado a la ventilación mecánica10. Sin embargo, la terapia con ECMO no está exenta de complicaciones, siendo las más frecuentes las de índole hemorrágica o trombótica11.
Este caso pone de manifiesto la utilidad del ECMO en el manejo de pacientes con SDRA secundario a rotura de un quiste hidatídico pulmonar en el momento agudo como puente al tratamiento quirúrgico definitivo.