En los últimos años la inmunoterapia (particularmente los inhibidores de los puntos de control inmunitario) ha suscitado un gran interés en el tratamiento de los pacientes con cáncer de pulmón, revolucionando el manejo de los pacientes con tumores localmente avanzados/metastásicos y generando esperanzas entre los pacientes y los médicos que diagnostican y tratan a estos enfermos. Estos fármacos se han convertido (combinados o no con otras terapias) en el tratamiento estándar de muchos pacientes con cáncer de pulmón y se espera que su uso aumente significativamente en un futuro próximo. En este manuscrito revisaremos la importancia creciente de las técnicas de imagen en la valoración de respuesta al tratamiento con inmunoterapia de los pacientes con cáncer de pulmón, haciendo hincapié en los nuevos criterios radiológicos específicos de respuesta con inmunoterapia, en las respuestas radiológicas atípicas (seudoprogresión, respuestas disociadas, hiperprogresión) y en las principales manifestaciones radiológicas de los eventos adversos asociados a la inmunoterapia (reacciones sarcoideas, toxicidades pulmonares, etc.). Los neumólogos deben conocer no solo las respuestas radiológicas atípicas de la inmunoterapia y sus implicaciones pronósticas, sino también sus efectos secundarios y los nuevos criterios radiológicos de respuesta desarrollados para valorar la respuesta al tratamiento. En este trabajo se tratarán conceptos claves como «seudoprogresión», «respuesta paradójica», «hiperprogresión» o «progresión no confirmada» y su significado en el manejo de los pacientes con cáncer de pulmón tratados con inmunoterapia.
Immunotherapy (particularly immune checkpoint inhibitors) in the treatment of patients with lung cancer has aroused great interest in recent years, revolutionized the management of patients with locally advanced/metastatic disease, and given hope to both patients and treating physicians. These drugs, in combination or in monotherapy, have become the standard treatment for many patients with lung cancer, and their use is expected to increase significantly in the near future. In this article, we will review the growing importance of imaging techniques in the evaluation of therapeutic response to immunotherapy in lung cancer patients, with emphasis on the new specific radiological criteria on response to immunotherapy, atypical radiological responses (pseudoprogresion, dissociative responses, hyperprogresion), and the main radiological manifestations of adverse events associated with immunotherapy (sarcoid reactions, pulmonary toxicities, etc.). Pulmonologists must be familiar not only with atypical radiological responses to immunotherapy and their prognostic implications, but also with their effects and the new radiological criteria of response to assess treatment response. In this study, we will address key concepts such as “pseudoprogresion”, “paradoxical response”, “hyperprogresion”, or “unconfirmed progression”, and their significance in the management of patients with lung cancer treated with immunotherapy.
Basada en los trabajos de los recientes premios Nobel James P. Allison y Tasuku Honjo, la inmunoterapia es hoy una alternativa terapéutica para muchos pacientes con cáncer. Inicialmente explorada en melanoma, ha sido el cáncer de pulmón (CP) no microcítico el primero de los tumores de gran incidencia en el que ha demostrado su eficacia1.
El CP es una enfermedad caracterizada por un entorno fuertemente inmunosupresor. Siguiendo esa premisa, a lo largo de décadas cientos de pacientes fueron incluidos en ensayos clínicos (EC) testando sin éxito distintos tipos de vacunas. Sin embargo, los resultados iniciales de los ensayos con fármacos inhibidores de los puntos de control inmunitario (immune checkpoint inhibitors [ICI]) han despertado un enorme interés que se ha ido consolidando conforme se iba disponiendo de resultados más robustos, hasta el punto de formar parte del armamentario terapéutico actual en diferentes escenarios clínicos de pacientes con CP2.
La base de esta estrategia es que nuestro sistema inmunitario dispone de complejos mecanismos de control que permiten mantener la tolerancia a antígenos propios y evitar respuestas inapropiadas. Las células tumorales utilizan estos mecanismos para escapar del sistema inmunitario, lo que hasta ahora había supuesto una gran limitación al intentar utilizar estrategias de inmunoterapia. El descubrimiento de los puntos de control y de los ICI anti-CTLA4 (cytotoxic T lymphocyte-associated antigen-4), anti-PD-1 (programmed cell death protein 1) y anti-PD-L1 (programmed death ligand 1), que actúan eliminando ese freno y facilitando la activación de linfocitos, supuso el inicio de la revolución terapéutica que conocemos como inmunoterapia oncológica3.
Actualmente disponemos de 3fármacos aprobados como segunda línea en pacientes con CP avanzado: nivolumab, pembrolizumab y atezolizumab, los cuales han demostrado en EC aleatorizados beneficio en tasa de respuestas objetivas, supervivencia global y un mejor perfil de toxicidad frente al comparador (docetaxel). Bastantes similares en cuanto al diseño, los estudios CheckMate-017 y CheckMate-057 utilizaron nivolumab en CP escamoso y no escamoso4; el estudio KeyNote-010 utilizó pembrolizumab (sin distinción histológica) pero únicamente en tumores con expresión positiva de PD-L15 y el estudio OAK con atezolizumab incluyó ambas histologías sin preseleccionar a los pacientes con base en la expresión tumoral de PD-L16. Estos EC demostraron que la tasa de respuesta en población no seleccionada alcanzaba el 20% y que se lograban supervivencias a 3e incluso a 5años del 17 y el 16%, respectivamente, cifras insólitas con tratamientos convencionales con quimioterapia7,8. Recientemente se han comenzado a realizar múltiples EC (tanto monoterapia como en combinación) en diferentes estadios que han dado como resultado alternativas terapéuticas y cambios del tratamiento estándar en primera línea de CP y tras quimioterapia/radioterapia en pacientes con enfermedad localmente avanzada. Así, pembrolizumab está aprobado en primera línea para el 30% de pacientes cuyos tumores tienen una expresión de PD-L1 > 50% y en combinación con diferentes regímenes de quimioterapia en función de la histología9-11. Atezolizumab también se ha explorado en estudios fase iii con diferentes combinaciones de quimioterapia, cumpliendo todos ellos su objetivo principal en pacientes con CP avanzado12-14 y en pacientes con CP microcítico diseminado15. Por último, durvalumab ha demostrado un sustancial beneficio no solo en supervivencia libre de progresión, sino en supervivencia global tras el tratamiento estándar (con quimioterapia y radioterapia) en CP estadio iii16.
Criterios de respuestaEn las últimas décadas se han descrito varios criterios radiológicos de respuesta a diferentes tratamientos oncológicos17. Además de objetivos, estos criterios deben ser reproducibles y consistentes para permitir un lenguaje unificado y una valoración precisa los efectos de nuevas terapias18. Inicialmente, estos criterios (como los criterios de evaluación de respuesta en tumores sólidos [RECIST por sus siglas en inglés] o los criterios de la Organización Mundial de la Salud [WHO]) se basaron en tratamientos citotóxicos de quimioterapia y asumían que un aumento del tamaño de una lesión tumoral implicaba, invariablemente, una progresión de la enfermedad19,20. La aparición de la inmunoterapia ha puesto de manifiesto algunas limitaciones de los criterios convencionales (RECIST, WHO), los cuales pueden no detectar patrones de respuesta atípicos (como la seudoprogresión o la respuesta paradójica)21. En esta sección repasaremos los criterios radiológicos de respuesta con inmunoterapia descritos en los últimos años, los cuales comparten aspectos comunes, como la evaluación de lesiones diana y no diana en los estudios basales. La respuesta global se obtiene tras cuantificar el cambio en el tamaño de las lesiones diana, estimar el cambio en las lesiones no diana y documentar la aparición de lesiones nuevas. A su vez, la respuesta global se categoriza en 4grupos (respuesta completa [CR por sus siglas en inglés], respuesta parcial (PR), progresión de enfermedad [PD] y enfermedad estable [SD]). Las diferencias entre los criterios de respuesta con inmunoterapia residen, básicamente, en la forma de medir las lesiones medibles (mediciones uni o bidimensionales según se inspiren en los criterios RECIST o WHO, respectivamente), en la consideración de las lesiones nuevas (particularmente las no medibles) para definir PD y en la incorporación o no de las lesiones nuevas a la carga tumoral basal (tabla 1).
Comparación de los diferentes criterios radiológicos de respuesta
| RECIST 1.1 | irRC | irRECIST | iRECIST | imRECIST | |
|---|---|---|---|---|---|
| Número de lesiones diana | Dos por órgano (5 en total) | Cinco por órgano (hasta 10 lesiones viscerales y 5 cutáneas) | Dos por órgano (5 en total) | Dos por órgano (5 en total) | Dos por órgano (5 en total) |
| Tamaño medible y dimensión | Lesiones de órganos sólidos: 10mm (eje mayor). Adenopatías: 15mm (eje menor)Unidimensional | ≥5×5 mmBidimensional | Lesiones de órganos sólidos: 10mm (eje mayor). Adenopatías: 15mm (eje menor)Unidimensional | Lesiones de órganos sólidos: 10mm (eje mayor). Adenopatías: 15mm (eje menor).Unidimensional | Lesiones de órganos sólidos: 10mm (eje mayor). Adenopatías: 15mm (eje menor)Unidimensional |
| Carga tumoral | SDM de las lesiones diana | Suma de los productos de los 2diámetros mayores (perpendiculares entre sí) de las lesiones diana | SDM de las lesiones diana | SDM de las lesiones diana | SDM de las lesiones diana |
| Lesiones no medibles | 1. Lesiones no medibles no seleccionadas como lesiones diana.2. Enfermedad no medible, incluyendo lesiones demasiado pequeñas (< 10mm para lesiones de órganos sólidos o < 15mm para adenopatías)3. Otras lesiones difíciles de medir de una manera reproducible* | No definidas. Las lesiones no diana incluyen la linfangitis carcinomatosa, la afectación cutánea del cáncer de mama y las masas abdominales palpables pero no medibles | Como en RECIST 1.1 | Como en RECIST 1.1 | Como en RECIST 1.1 |
| Aparición de lesiones nuevas | La aparición de lesiones nuevas medibles implica PDLa progresión inequívoca de lesiones nuevas no medibles implica PD | La aparición de lesiones nuevas no implica necesariamente PD, y se incorporan a la carga tumoral totalLa aparición de lesiones nuevas no medibles no implica progresión pero impide alcanzar CR | La aparición de lesiones nuevas no implica necesariamente PD y se incorporan a la carga tumoral medida totalLa progresión inequívoca de lesiones nuevas no medibles implica PD (irPD) | La aparición de lesiones nuevas medibles se valora según los criterios de RECIST 1.1 pero se registran de forma separada y no se incluyen en la SDM de las lesiones diana identificadas en el estudio basal. La aparición de lesiones nuevas medibles se define como progresión no confirmada («iUPD»); dicha progresión se confirma («iCPD») solo si aparecen nuevas lesiones adicionales en estudios subsiguientes o si se demuestra un aumento del tamaño de las lesiones nuevas previas (≥5 mm para la suma de lesiones nuevas diana o cualquier aumento de las lesiones nuevas no diana)La aparición de lesiones nuevas no medibles se registra pero no se incluyen en la carga tumoral; implican iUPD. Para confirmar la progresión debe demostrarse un aumento en el tamaño o en el número de dichas lesiones en el plazo de 4-8 semanas) | La aparición de lesiones nuevas medibles no implica necesariamente PD, y se incorporan a la carga tumoral totalLa aparición de lesiones nuevas no medibles no implica progresión pero impide alcanzar CR |
| Valoración de respuesta | CR: resolución completa de las lesiones (las adenopatías deben tener un diámetro [eje corto] < 10 mm) | CR (irCR): desaparición completa de todas las lesiones (la cual debe confirmarse ≥ 4 semanas desde la primera constatación de desaparición) | CR (irCR): desaparición completa de todas las lesiones (medibles y no medibles); las adenopatías deben tener un diámetro [eje corto] < 10mm. La confirmación no es obligatoria | CR (iCR): resolución completa de todas las lesiones (confirmadas ≥ 4 semanas) | CR: desaparición completa de todas las lesiones (la cual debe confirmarse ≥ 4 semanas desde la primera constatación de desaparición) |
| PR: disminución ≥ 30% en la carga tumoral | PR (irPR): disminución de la carga tumoral ≥ 50% con respecto al estudio basal (la cual debe confirmarse ≥ 4 semanas desde su primera constatación) | PR (irPR): disminución ≥ 30% de la carga tumoral medida total con respecto al estudio basal. Las lesiones no diana se consideran irNN (ni respuesta completa [irCR] ni progresión [irPD]). Las lesiones nuevas no medibles no deben reflejar progresión inequívoca | PR (iPR): disminución ≥ 30% de la carga tumoral con respecto al estudio basal (en ausencia de lesiones de nueva aparición o de progresión de lesiones no diana) | PR: disminución ≥ 30% de la carga tumoral con respecto al estudio basal (en ausencia de lesiones de nueva aparición o de progresión de lesiones no diana) | |
| SD: no cumple criterios de CR, PR ni PD | SD (irSD): no cumple criterios de irCR o irPR, en ausencia de irPD | SD (irSD): no cumple criterios de irCR o irPR, en ausencia de irPD | SD (iSD): no cumple criterios de PR o PD en ausencia de lesiones nuevas o de progresión de lesiones no diana | SD: no cumple criterios de PR o PD en ausencia de lesiones nuevas o de progresión de lesiones no diana | |
| PD: definida como un aumento ≥ 20% en la SDM (siempre y cuando ese incremento absoluto sea ≥ 5 mm) con respecto al nadir (mejor respuesta); progresión inequívoca de las lesiones no diana; o aparición de lesiones nuevas. No se requiere confirmación de la PD y la situación clínica del paciente no se tiene en cuenta | PD (irPD): definida únicamente a partir de la enfermedad medible. La progresión no se confirma si se alcanza (más allá de las 4 semanas desde la constatación de PD) un status de «no progresión». La PD se alcanza cuando la suma de los productos de los 2 diámetros mayores perpendiculares entre sí sea ≥ 25% (con respecto al estudio basal/nadir) | PD (irPD): definida como un aumento ≥ 20% (con un incremento absoluto ≥ 5 mm) de la carga tumoral medida total con respecto al nadir (o irPD por lesiones no diana o por aparición de lesiones nuevas no medibles). Se recomienda la confirmación de PD al menos 4 semanas después de la primera constatación de irPD | PDiUPD: aumento ≥ 20% de la carga tumoral (con respecto al nadir), progresión de lesiones no diana, o aparición de lesiones nuevas. El status de iUPD requiere ser confirmado, lo cual puede alcanzarse mediante la constatación de un incremento adicional del tamaño (o del número de lesiones nuevas) en la categoría de lesión en la que se detectó inicialmente progresión (lesiones diana o no diana) o mediante la progresión (según criterios RECIST 1.1) en las categorías de lesión que no habían cumplido previamente criterios de progresión (según RECIST 1.1)La progresión se confirma en la categoría de «lesión diana» si en el siguiente control radiológico tras alcanzar el status de iUPD (4-8 semanas después) se confirma un incremento adicional en la suma de las medidas de la enfermedad diana (desde la consecución de iUPD, siempre y cuando este incremento adicional sea, en términos absolutos, de al menos 5 mm). La situación clínica del paciente se tiene en cuenta a la hora de decidir continuar o no con el tratamiento una vez se alcanza el status de iUPDiCPD: la progresión de enfermedad se confirma (iCPD) si en el control radiológico subsiguiente (realizado 4-8 semanas después de iUPD) se constata lesiones nuevas adicionales, un aumento progresivo del tamaño de lesiones nuevas detectadas previamente (un aumento de la suma de los diámetros de lesiones diana nuevas de al menos 5mm o cualquier incremento en las lesiones nuevas no diana), o un aumento progresivo de lesiones diana o no diana preexistentes desde iUPD | PD: definida únicamente a partir de la enfermedad medible. La progresión no se confirma si se alcanza (más allá de las 4 semanas desde la constatación de PD) un status de «no progresión». La PD se alcanza cuando la SDM (RECIST) sea ≥ 20% (con respecto al estudio basal/nadir) |
CR: respuesta completa (complete response); iCPD: progresión de enfermedad confirmada (immune confirmed progressive disease); iCR: respuesta completa inmunitaria (immune complete response); iPR: respuesta parcial inmunitaria (immune partial response); irCR: respuesta completa relacionada con la inmunidad (immune-related complete response); irNN: ni respuesta completa (irCR) ni progresión (irPD) (non-irCR and non-irPD); irPD: progresión de enfermedad relacionada con la inmunidad (immune-related progressive disease); irPR: respuesta parcial relacionada con la inmunidad (immune-related partial response); irSD: enfermedad estable relacionada con la inmunidad (immune-related stable disease); iSD: enfermedad estable inmune (immune stable disease); iUPD: progresión de enfermedad no confirmada (immune unconfirmed progressive disease); PD: progresión de enfermedad (progressive disease); PR: respuesta parcial (partial response); SD: enfermedad estable (stable disease); SDM: suma de diámetros máximos.
RECIST 1.1: esta versión se introdujo en 2009 y simplificó la valoración de la respuesta al tratamiento con respecto a la versión previa, al tiempo que describía mejor la valoración de las adenopatías e incorporaba técnicas de imagen metabólicas como la tomografía por emisión de positrones. Son los criterios más utilizados en la valoración de respuesta al tratamiento de los tumores sólidos y continúan siendo los únicos validados y aceptados por las principales agencias reguladoras19,22-24.
irRC (immune-related response criteria): los criterios irRC se introdujeron en 2009 y su principal aportación consistió en la incorporación de lesiones medibles de nueva aparición a las lesiones basales en un concepto denominado «carga tumoral total». Otra diferencia con respecto a los criterios convencionales es que cualquier PD debe confirmarse en un plazo mínimo de 4 semanas. Entre las limitaciones de irRC destacan: 1) su inspiración en los criterios WHO, que impiden su comparación con los criterios RECIST al utilizar mediciones bidimensionales; 2) una menor información de la enfermedad adenopática, y 3) una posible sobrestimación de la eficacia del tratamiento al no tener en cuenta lesiones nuevas no medibles25-27.
irRECIST 1.1 (immune-related RECIST): desarrollados en 2014 con la intención de alineal los criterios irRC con los RECIST 1.1, simplificaron la valoración de respuesta al tratamiento con inmunoterapia y permitieron su comparación con ensayos que utilizaban criterios RECIST (mediciones unidimensionales más reproducibles). En los criterios irRECIST, las lesiones nuevas medibles se suman a las basales en un concepto denominado «carga tumoral medida total». Al igual que con los criterios irRC, cualquier PD debe confirmarse radiológicamente en un plazo mínimo de 4 semanas28,29.
iRECIST (immune RECIST): introducidos en 2017, surgieron del consenso entre el grupo de trabajo RECIST, la industria farmacéutica y las agencias reguladoras, con la intención de estandarizar y validar criterios de respuesta con inmunoterapia. Suponen una guía de consenso que asegura un diseño y una recogida de datos consistentes y que permite un análisis comparado de los EC basados en inmunoterapia. Los postulados de iRECIST son similares a los RECIST 1.1 o irRECIST, pero las lesiones nuevas se registran de forma separada (no se incorporan a las basales). Un concepto clave es el de «progresión no confirmada» o immune unconfirmed progressive disease (iUPD), categoría que recibe la primera constatación de PD y que debe confirmarse en un plazo de 4-8 semanas27,30,31.
imRECIST (immune-modified RECIST): descritos en 2018 e inspirados en los principios de los criterios irRC, suponen una modificación de RECIST 1.1. Las lesiones nuevas medibles se incorporan a las lesiones diana basales (a diferencia de iRECIST). Los imRECIST relacionan los patrones de respuesta o progresión con la supervivencia global mediante criterios indirectos de valoración32.
Patrones atípicos de respuestaCon los criterios convencionales de respuesta se asumió que un aumento de la carga tumoral (o la aparición de lesiones nuevas) implicaban invariablemente PD y, por tanto, conllevaban la suspensión del tratamiento. Sin embargo, con la inmunoterapia se observó que a pesar de un incremento inicial/transitorio en la carga tumoral o de la aparición de una lesión nueva podía alcanzarse (en algunos pacientes) una CR, una PR o una SD21,33. Esta respuesta atípica recibe el nombre de seudoprogresión y, según los criterios convencionales, implicaría erróneamente PD. Otras respuestas atípicas que pueden observarse con inmunoterapia son las respuestas disociadas/paradójicas y las hiperprogresiones34-36. La importancia de conocer estas respuestas atípicas en pacientes con CP radica en que la aplicación de los criterios convencionales (p. ej., RECIST) infraestiman el beneficio de los ICI en un 11% de los casos, ya que estos criterios no interpretan correctamente los fenómenos de seudoprogresión y de respuesta disociada/paradójica37.
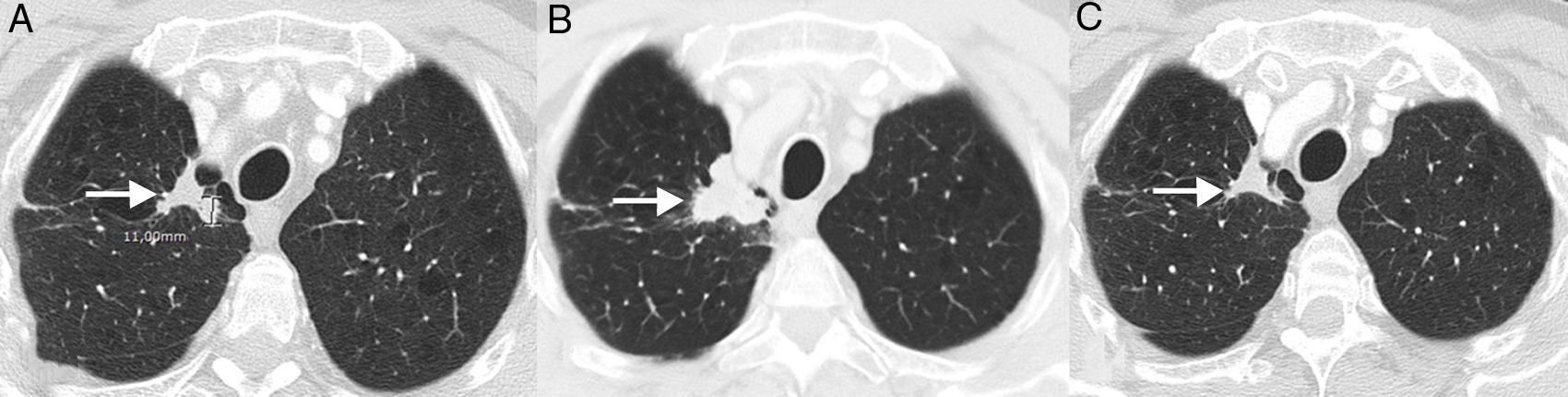
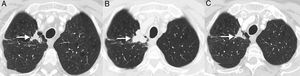
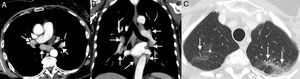
SeudoprogresiónEs un fenómeno bien documentado, caracterizado por una respuesta o estabilidad tras un aumento inicial de la carga tumoral o a pesar de la aparición de lesiones nuevas en pacientes tratados con inmunoterapia38. Representa una falsa progresión tumoral e implica que un crecimiento inicial/transitorio radiológico de la carga tumoral (o la aparición de lesiones nuevas) en pacientes con CP tratados con inmunoterapia deba confirmarse en un plazo de tiempo antes de asignar una progresión «real» de la enfermedad y de retirar el tratamiento (la mayor parte de los autores sugieren confirmar dicha progresión en un plazo de 4-8 semanas tras constatar una primera progresión radiológica). El mecanismo subyacente parece deberse al reclutamiento e infiltración transitoria de las lesiones tumorales por células inflamatorias, especialmente por linfocitos T (fig. 1)39. Este fenómeno suele aparecer en los primeros 3meses desde el comienzo de la inmunoterapia, aunque se han descrito presentaciones tardías40. La incidencia de seudoprogresión es variable (0,6-15,8%) en función del tipo de fármaco (más frecuente con anti-PD-1) y del tipo de cáncer tratado (mayor incidencia en melanoma)41; en CP afecta al 0,6-5,8% de los pacientes, por lo que la mayor parte de los pacientes con CP tratados con inmunoterapia que presentan progresión radiológica inicial van a experimentar una progresión real42. La implicación más importante de la seudoprogresión es que los pacientes tienen beneficio clínico y muestran una supervivencia mayor que los pacientes con progresiones verdaderas. En un estudio reciente de 160 pacientes con CP tratados con ICI se observó seudoprogresión en el 5%, presentando todos ellos beneficio clínico37. Algunos autores sugieren biopsiar las lesiones tumorales que muestran progresión para intentar diferenciar progresiones reales de seudoprogresiones; aunque la presencia de células inflamatorias en el material de biopsia sugiere seudoprogresión, no está claro cuál es el momento idóneo para la obtención de la muestra histológica ni cómo debe interpretarse la coexistencia de células tumorales e inflamatorias en una misma muestra tisular43. Además, no siempre es posible obtener material histológico en todos los pacientes con CP con sospecha de seudoprogresión. En los pacientes que experimentan seudoprogresión, no suele haber deterioro clínico, por lo que, aparte de la información radiológica e histológica, debe tenerse en cuenta la información clínica.
Ejemplo de seudoprogresión en paciente de 59 años con cáncer de pulmón no microcítico en progresión que inicia tratamiento de segunda línea con inmunoterapia (nivolumab). A) Imagen axial basal (preinmunoterapia) de TC de tórax (ventana de parénquima pulmonar) en la que se identifica una lesión tumoral primaria en vértice pulmonar derecho (flecha). B) Imagen axial de TC de tórax a las 8 semanas del inicio de tratamiento con nivolumab en la que se aprecia una progresión radiológica de la lesión tumoral pulmonar (flecha); esta aparente progresión tumoral no se acompaña de empeoramiento clínico, por lo que se decide continuar con el tratamiento. C) Imagen axial de TC de tórax obtenida 6 semanas después en la que se demuestra una reducción significativa del tamaño de la lesión (flecha), confirmándose una seudoprogresión. Según criterios convencionales de respuesta (RECIST), el tratamiento se habría interrumpido en cuanto se demuestra progresión radiológica.
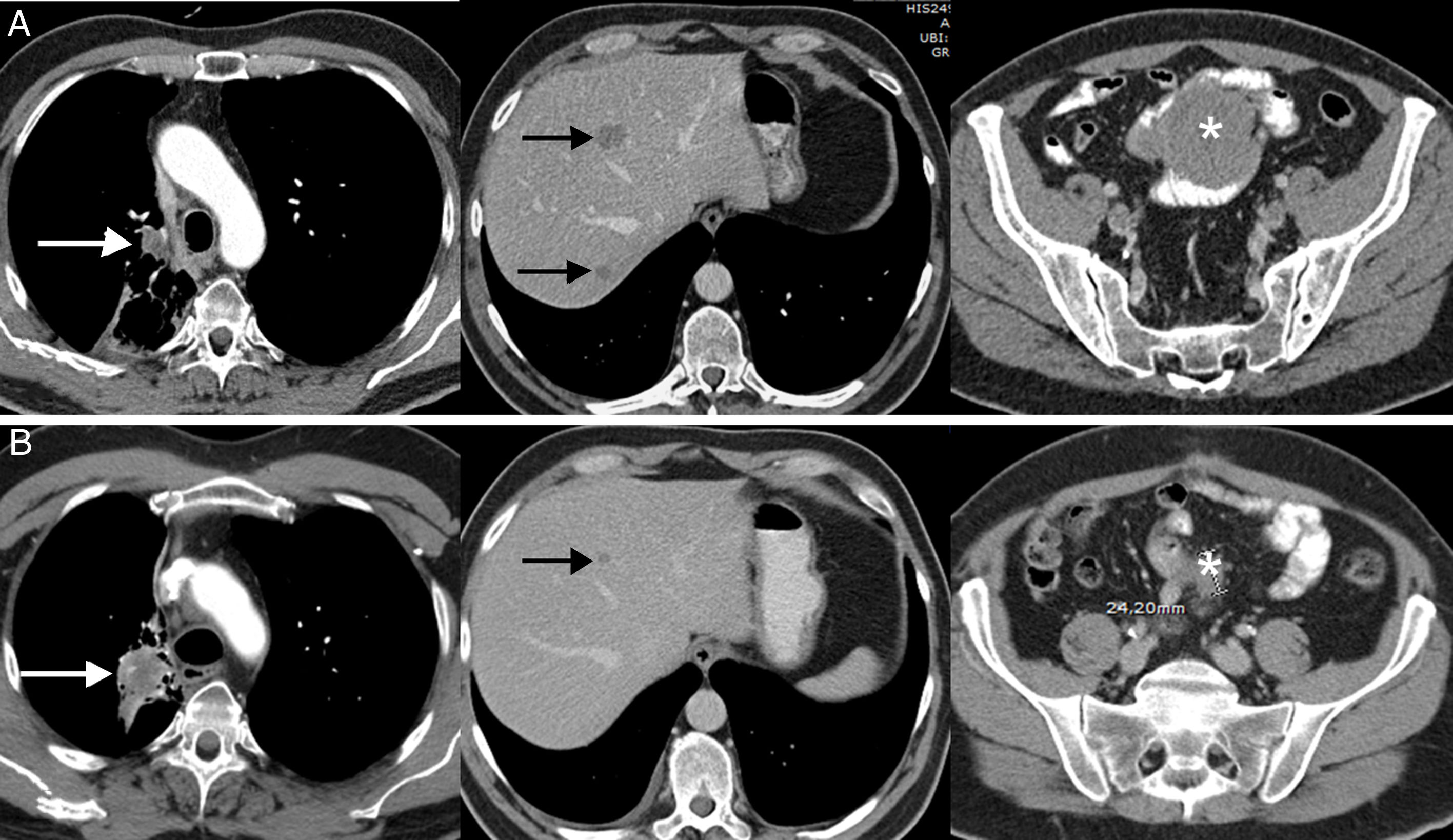
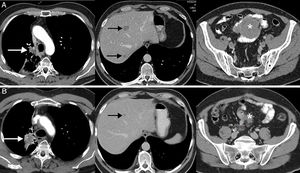
La respuesta disociada/paradójica consiste en una respuesta dispar de lesiones tumorales en un mismo paciente, observándose progresión en unas lesiones y respuesta en otras36. En pacientes con CP se han descrito tanto progresiones de lesiones tumorales primarias (la lesión pulmonar) con respuesta favorable de lesiones metastásicas como respuesta de lesiones primarias con progresión de lesiones secundarias36,37. Es un fenómeno menos estudiado que la seudoprogresión, aunque también suele aparecer en los primeros meses tras el comienzo de la inmunoterapia. La implicación más importante de la respuesta disociada/paradójica es que los pacientes obtienen cierto beneficio clínico, aunque menor que en los pacientes con seudoprogresión (suelen mostrar una supervivencia mayor que los pacientes con progresiones verdaderas). En un estudio reciente de 160 pacientes con CP tratados con ICI se observaron respuestas disociadas en el 8% de los casos, presentando beneficio clínico la mitad de ellos37. Este escenario plantea dilemas diagnósticos y terapéuticos, ya que en un mismo paciente coexisten signos de respuesta favorable y de progresión tumoral44; en algunos casos se puede proponer realizar una biopsia o un tratamiento local (cirugía, radioterapia estereotáxica, etc.) de la lesión tumoral que progresa, si bien cada caso exige una valoración multidisciplinar (fig. 2).
Ejemplo de respuesta disociada/paradójica en paciente de 57 años con cáncer de pulmón no microcítico en progresión que inicia tratamiento de segunda línea con inmunoterapia (pembrolizumab); la fila superior (A) corresponde a la TC basal (preinmunoterapia) mientras que la fila inferior (B) corresponde a la TC obtenida a las 8 semanas del inicio del tratamiento. A) Imágenes axiales basales (preinmunoterapia) de TC de tórax, abdomen y pelvis (de izquierda a derecha, respectivamente) en las que se observa el tumor pulmonar primario (flecha blanca), metástasis hepáticas (flechas negras) y una masa mesentérica (asterisco). B) Imágenes axiales de TC a las 8 semanas del inicio de tratamiento de tórax, abdomen y pelvis (de izquierda a derecha, respectivamente) en las que se aprecia una respuesta discordante de las lesiones tumorales: progresión pulmonar (flecha blanca) pero respuesta favorable de las metástasis hepáticas (flecha negra) y mesentérica (asterisco). Dado el buen estado general del paciente, se decidió resecar la lesión pulmonar, lográndose una respuesta completa del paciente en estudios radiológicos posteriores.
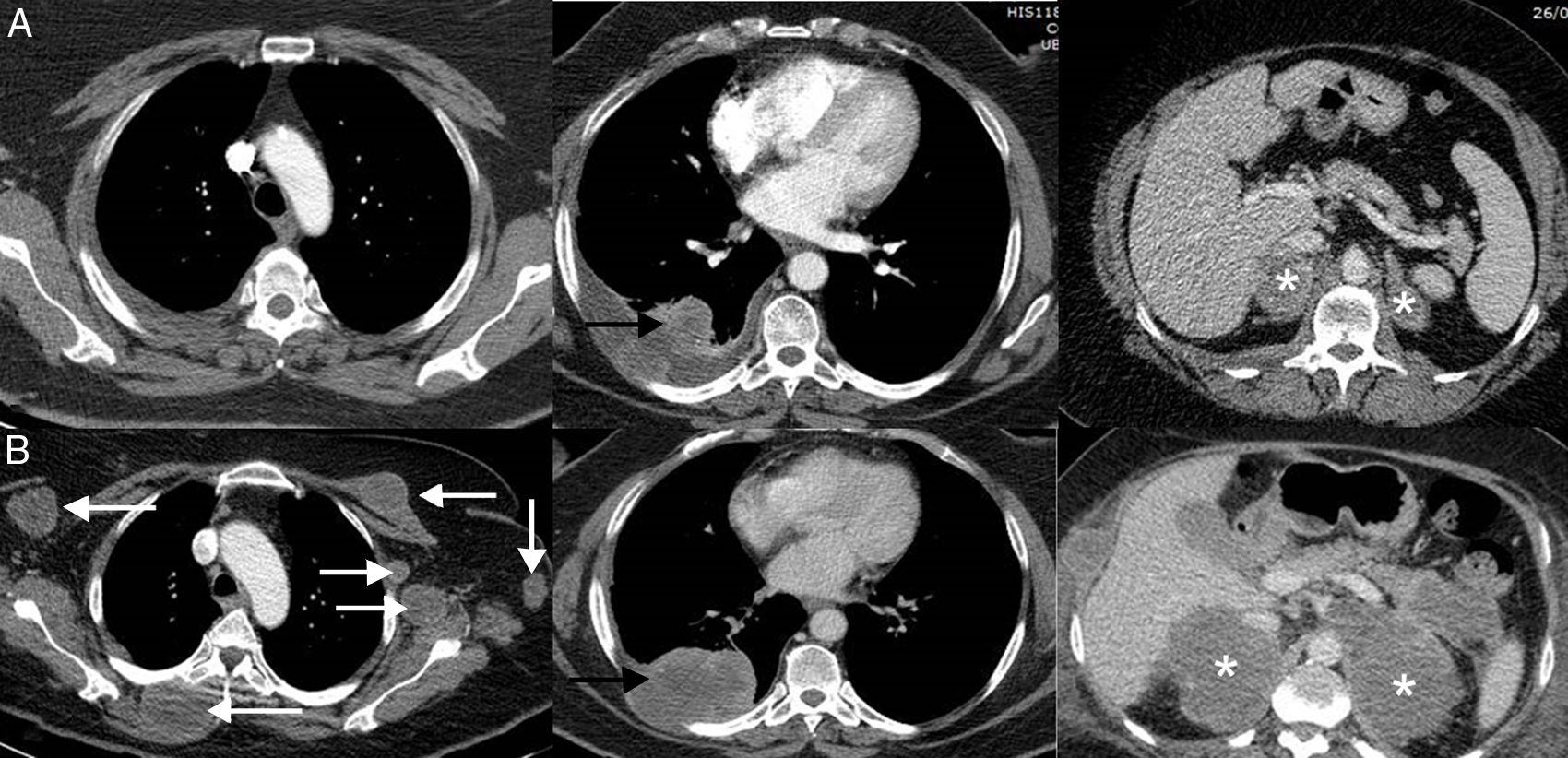
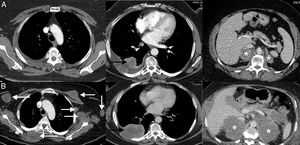
Consiste en una progresión dramática de la carga tumoral, generalmente con mal pronóstico, en un paciente que inicia tratamiento con inmunoterapia45. En la hiperprogresión se observa una progresión a un «ritmo» mayor del esperable o conocido para ese cáncer tras la instauración del tratamiento con inmunoterapia. Esta respuesta atípica no es exclusiva de la inmunoterapia, pero se ha documentado con mayor frecuencia que con otras terapias (9-16%)46. A diferencia de la seudoprogresión y de la respuesta disociada/paradójica, la implicación más importante es que los pacientes presentan una supervivencia mucho peor, falleciendo por lo general a las pocas semanas47,48. En un estudio de 406 pacientes con CP tratados con ICI, la hiperprogresión se describió en el 13,8% de los pacientes, falleciendo la mayoría en las 8 semanas siguientes al comienzo del tratamiento con inmunoterapia49. No están bien definidos los predictores para que un paciente desarrolle esta temible respuesta (fig. 3)50.
Ejemplo de hiperprogresión en una paciente de 73 años con cáncer de pulmón no microcítico en progresión que inicia tratamiento de segunda línea con inmunoterapia (pembrolizumab); la fila superior (A) corresponde a la TC basal (preinmunoterapia) mientras que la fila inferior (B) corresponde a la TC obtenida a las 8 semanas del inicio del tratamiento. A) Imágenes axiales basales (preinmunoterapia) de TC de tórax superior, tórax inferior y abdomen (de izquierda a derecha, respectivamente) en las que se observa el tumor pulmonar primario (flecha negra) y metástasis adrenales bilaterales (asteriscos). B) Imágenes axiales de TC a las 8 semanas del inicio de tratamiento de tórax superior, tórax inferior y abdomen (de izquierda a derecha, respectivamente) en las que se aprecia una llamativa progresión de las lesiones tumorales conocidas (flecha negra y asteriscos blancos), así como aparición de múltiples masas de partes blandas en partes blandas y axila izquierda (flechas blancas). La paciente falleció 3semanas después.
Debido a su particular mecanismo de acción, los ICI (fármacos «prototipo» de la inmunoterapia) se asocian a un espectro de reacciones adversas (immune-related adverse events [irAE]) que difieren de los efectos adversos de la quimioterapia citotóxica51. Estas irAE son atribuibles a la provocación de un estado «proinflamatorio»/autoinmune secundario a la potenciación indiscriminada del sistema inmunitario (especialmente de los linfocitos T) y pueden afectar a cualquier órgano, desde la piel y el tubo digestivo hasta el hígado, glándulas endocrinas o pulmón52. Algunas irAE son evidentes en la exploración física (como un rash cutáneo) pero otras pueden ser silentes y manifestarse radiológicamente (como una reacción sarcoidea, una fascitis o un desflecamiento de la grasa) antes de detectarse clínicamente41,53. Por tanto, es crucial que los radiólogos detecten precozmente estas reacciones y las comuniquen en sus informes, pues las irAE suelen tratarse retirando la inmunoterapia (de forma transitoria o definitiva, según su gravedad) y añadiendo corticoides (u otros inmunosupresores)54,55. Además, la importancia de su identificación radica también en la interesante observación de que la aparición de una irAE conlleva un mejor control de la enfermedad con respecto a los pacientes que no las desarrollan56. La incidencia, la gravedad y el tipo de las irAE varían en función del tipo de fármaco, pero oscilan entre el 54% con los anti-CTLA-4 y el 14% con los anti-PD-L157. Por su potencial impacto en la interpretación de las imágenes radiológicas en pacientes con CP, trataremos preferentemente las irAE que afectan al parénquima pulmonar.
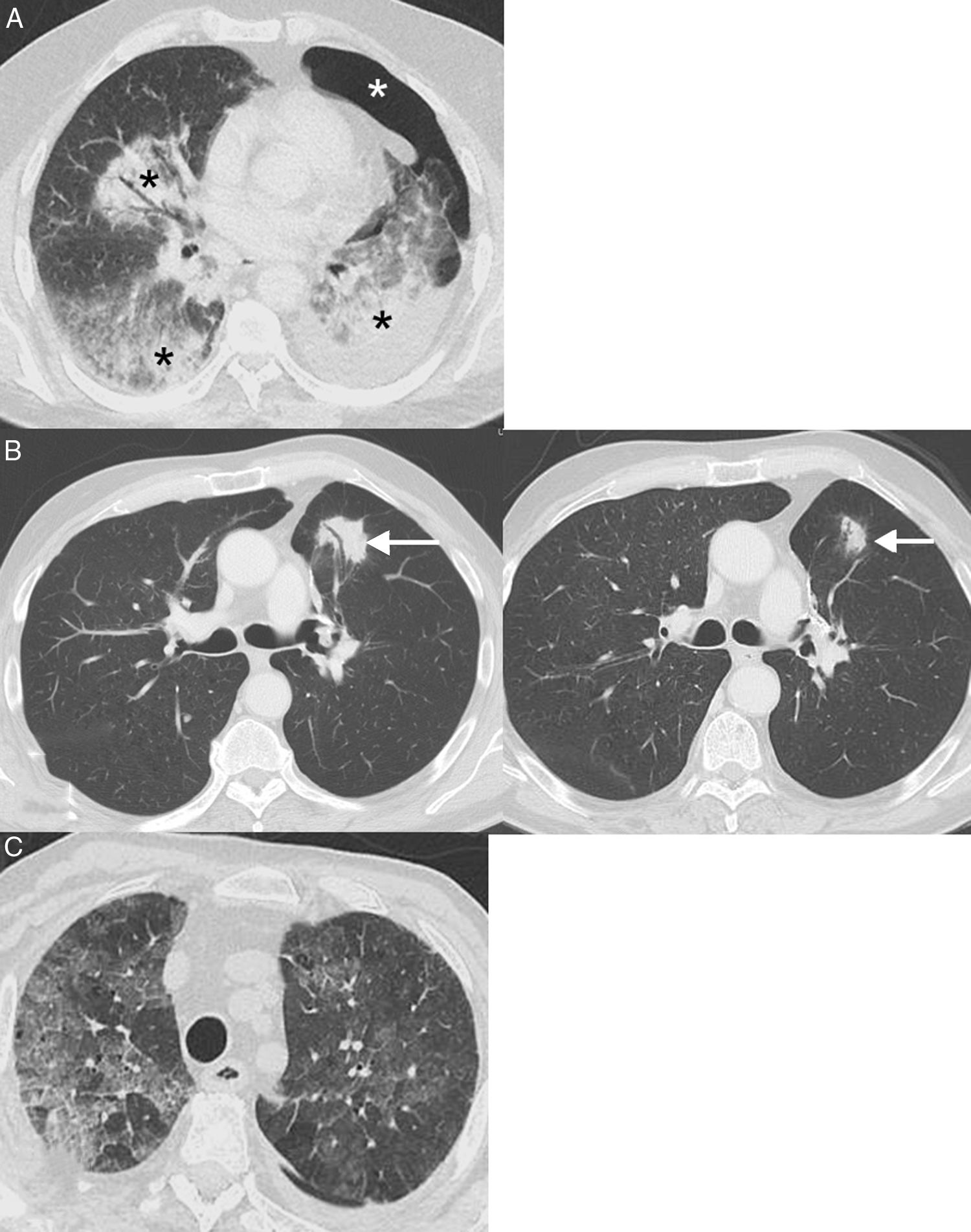
Neumonitis: esta irAE potencialmente mortal se ha descrito con cualquier tipo de inmunoterapia, aunque es más frecuente con los anti-PD-1 (pembrolizumab y nivolumab), documentándose una incidencia de hasta el 6%58. Un metaanálisis reciente demostró que la neumonitis ocurría más frecuentemente en pacientes con CP y carcinoma de células renales que en sujetos con melanoma, y con un tiempo medio de aparición de 3,8-7,8 meses desde la administración del fármaco59. Se han descrito 4patrones en tomografía computarizada (TC) de neumonitis por ICI: patrón de neumonía organizada (el más frecuente, consistente en la aparición de consolidaciones peribronquiales), patrón de neumonía intersticial no específica (aparición de opacidades bilaterales en vidrio deslustrado con o sin bronquiectasias de tracción), patrón de neumonitis por hipersensibilidad (nódulos centrolobulillares con o sin atenuación en mosaico del parénquima pulmonar) y patrón de neumonía intersticial aguda (el menos habitual, consistente en opacidades bilaterales parcheadas con atenuación en vidrio deslustrado)60 (fig. 4). En pacientes con CP, una neumonitis puede simular, clínica y radiológicamente, una progresión tumoral o una infección pulmonar. El diagnóstico se realiza combinando datos clínicos, analíticos y radiológicos, por lo que resulta imprescindible una estrecha colaboración multidisciplinar61.
Ejemplos de neumonitis (toxicidad pulmonar). A) Paciente de 64 años con cáncer de pulmón metastásico en tratamiento con inmunoterapia (nivolumab) en el que se observa la aparición en una TC de consolidaciones peribronquiales bilaterales (asteriscos negros). En este caso, se decidió realizar una biopsia pulmonar con aguja gruesa de una consolidación dominante en lóbulo inferior izquierdo, la cual demostró focos de neumonía organizada y ausencia de células tumorales; la biopsia se complicó con un neumotórax izquierdo (asterisco blanco). B) Paciente de 68 años con cáncer de pulmón localmente avanzado en tratamiento adyuvante con inmunoterapia (nivolumab); la imagen de la izquierda muestra la aparición en una TC de una lesión (flecha) con broncograma aéreo en pulmón izquierdo. En este caso se decidió tratamiento empírico con corticoides sistémicos y repetición de TC de tórax en 4 semanas (imagen de la derecha), en la que se confirmó una resolución parcial de la opacidad pulmonar (flecha). El patrón radiológico sugirió una neumonía organizada. C) Paciente de 76 años con cáncer de pulmón metastásico en tratamiento con inmunoterapia (pembrolizumab) que consultó en Urgencias por disnea. La TC de tórax mostró extensas opacidades bilaterales de atenuación en vidrio deslustrado (patrón de neumonitis intersticial no específica). El paciente mejoró tras la suspensión de la inmunoterapia y la administración de corticoides sistémicos.
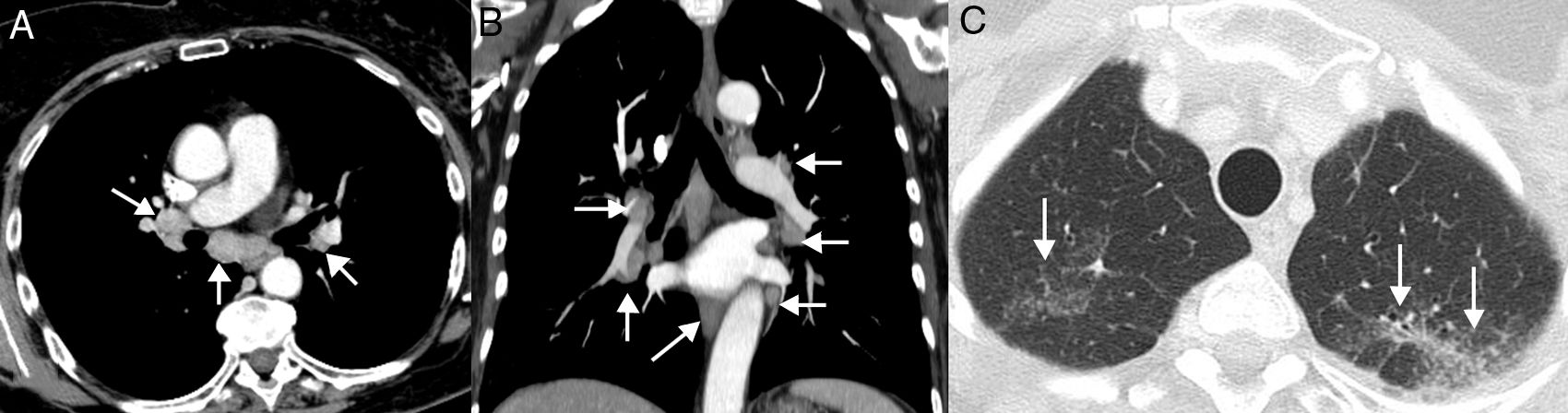
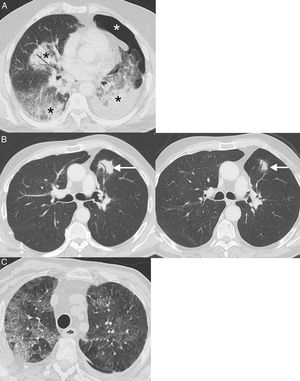
Reacciones sarcoideas: es una complicación sistémica poco frecuente cuya importancia radica en que puede simular PD en los pacientes con CP tratados con inmunoterapia62. Radiológicamente, se caracteriza por la aparición de adenopatías y pequeños nódulos pulmonares perilinfáticos, por lo que puede confundirse con una PD o una linfangitis carcinomatosa63. El diagnóstico de confirmación requiere la demostración de granulomas, aunque no siempre es factible y a menudo se realiza combinando datos clínicos y radiológicos tras haber descartado causas alternativas (como infecciones o progresión tumoral)64 (fig. 5). En general, los pacientes con reacciones sarcoideas tienen buena situación general, signos de respuesta tumoral en otros órganos, y responden rápidamente a los corticoides. A diferencia de la neumonitis, una reacción sarcoidea no requiere la suspensión de la inmunoterapia65.
Ejemplo de reacción sarcoidea. Paciente de 68 años diagnosticada de cáncer de pulmón metastásico en tratamiento con inmunoterapia (atezolizumab). La paciente presentaba una buena situación clínica y no había datos clínicos de progresión tumoral, aunque se quejaba de una tos seca de varias semanas de evolución. Durante el seguimiento con TC se observó la aparición de varias adenopatías en mediastino y en ambos hilios pulmonares (flechas) con una distribución relativamente simétrica (A y B, ventana de mediastino) y de varios nódulos pulmonares milimétricos (C, ventana de pulmón) con una distribución perilinfática en lóbulos superiores (flechas), sugiriéndose el diagnóstico radiológico de reacción sarcoidea. Una ecobroncoscopia confirmó la presencia de granulomas y descartó progresión tumoral. En este caso se decidió administrar corticoides pero no se suspendió la inmunoterapia, mejorando el cuadro clínico-radiológico.
La inmunoterapia ya es parte del arsenal terapéutico en pacientes con CP, pero existen numerosos retos que afrontar. Uno de los desafíos es conseguir una correcta evaluación radiológica de la carga tumoral mediante el desarrollo de unos criterios unificados de valoración de respuesta tumoral. El desarrollo de estos criterios se complica si se tiene en cuenta que los pacientes con CP podrán ser tratados con una combinación de terapias sistémicas (inmunoterapia mezclada o no con quimioterapia convencional, antiangiogénicos o terapias dirigidas) y de tratamientos locorregionales (radioterapia estereotáxica, radiofrecuencia, etc.), por lo que radiólogos y médicos nucleares tendrán que enfrentarse a desafíos interpretativos cada vez más complejos66. Estos criterios deberán tener en cuenta no solo el tamaño de las lesiones, sino también información volumétrica y metabólica/funcional de las mismas. En este sentido, debe destacarse el desarrollo de nuevos radiotrazadores (más allá de la 18F-fluorodeoxiglucosa) que permitirán estudiar procesos metabólicos como la replicación celular, el consumo de oxígeno o la muerte celular35. Entre estos radiotrazadores se encuentran anticuerpos monoclonales marcados con radioisótopos (que evalúan la expresión de los marcadores de superficie celular PD-1/PD-L1) y otras moléculas (marcadas con 64Cu o 89Zr) que posibilitan el marcaje de linfocitos T21. Estos radiotrazadores permitirán identificar de forma no invasiva pacientes respondedores antes de comenzar la inmunoterapia (en función de la expresión de PD-1/PD-L1) o diferenciar una seudoprogresión de una progresión real (en función de la activación o no de linfocitos T)35. La radiómica (un término nuevo que se utiliza para describir la extracción de características cuantitativas avanzadas a partir de imágenes radiológicas de TC o resonancia magnética) podrá correlacionarse con características moleculares y genéticas subyacentes (radiogenómica) y con el fenotipo de diferentes tumores, y ayudar en un futuro a desarrollar mejores biomarcadores67-69. La superación progresiva de estos retos mejorará el manejo diagnóstico de los pacientes y probablemente impactará positivamente en su supervivencia y calidad de vida; tal vez, permitirá vislumbrar también que la curación del CP metastásico no es solo un sueño.
Conflicto de interesesPilar Garrido-López realiza servicios de consultoría y asesoramiento (Roche, MSD, BMS, Boerhinger Ingelheim, Pfizer, Abbvie, Guardant Health, Novartis, Lilly, Astra-Zeneca, Jansen, Sysmex, Blueprint Medicines, Takeda), presentaciones públicas orales (Takeda, Astra Zeneca, Roche, MSD, BMS, Pfizer, Novartis, Boerhinger Ingelheim, Gilead, Rovi) y recibe soporte financiero para ensayos clínicos (Roche, MSD, BMS, Takeda, Lilly, Pfizer, Novartis, Pharmamar, Celgene, Sanofi, GSK, Theradex Oncology, BluePrint Medicines). Los restantes autores declaran no tener ningún conflicto de intereses.