Presentar una serie de intervenciones de implantación de endoprótesis para tratar el síndrome de vena cava superior (VCS) maligno.
Material y métodosEn una revisión del periodo comprendido entre octubre de 2005 y julio de 2013 se identificaron 56 pacientes consecutivos tratados por un síndrome de VCS maligno sintomático mediante implantación de endoprótesis.
ResultadosLa implantación de endoprótesis en la VCS se intentó en 56 pacientes (46 varones, 10 mujeres) de 34-84años de edad (media 59,3). La tasa de éxitos fue de 49/57 (86%). El éxito se asoció al tipo de obstrucción agrupada de la siguiente forma: grupo1 (a: estenosis de VCS, o b: oclusión de vena innominada unilateral con estenosis de vena innominada contralateral y VCS normal), grupo2 (oclusión de VCS y exclusión de oclusión de vena innominada bilateral) y grupo3 (oclusión de vena innominada bilateral con independencia del estado de la VCS). Las tasas de éxito fueron del 100% (39/39), del 75% (9/12) y del 16,6% (1/6), respectivamente. Estas diferencias eran significativas: grupo1 frente a grupo2+3 (p<0,001) y grupo2 frente a grupo3 (p=0,032). Se produjeron complicaciones agudas en 9 pacientes. Los pacientes en los que se dieron las complicaciones agudas fueron de mayor edad que los demás (67,8 frente a 57,6años, p=0,019). Hubo muertes relacionadas con la intervención en el 3,5% (n=2). Se produjo una oclusión de la endoprótesis en el 3,5% (n=2). La supervivencia de los pacientes fue baja (mediana 2,6; rango <1-29,6meses) e independiente del éxito de la implantación de endoprótesis.
ConclusionesLa implantación de endoprótesis para el síndrome de VCS maligno proporciona un alivio sintomático inmediato y sostenido que persiste hasta la muerte en este grupo de pacientes con una esperanza de vida corta y restablece el acceso venoso central para la administración de quimioterapia. El fallo técnico se asoció a oclusiones de la VCS y sobre todo a una oclusión de la vena innominada bilateral.
To report a series of stenting procedures for the treatment of malignant superior vena cava (SVC) syndrome.
Material and methodsA review conducted from October 2005 to July 2013 retrieved 56 consecutive patients treated for symptomatic malignant SVC syndrome with stenting.
ResultsSVC stenting was attempted in 56 patients (46 males, 10 females), aged 34-84years (mean 59.3).The success rate was 49/57 (86%). Success was associated with the type of obstruction classified as: group1 (a —SVC stenosis, or b —unilateral innominate vein occlusion with contralateral innominate vein stenosis and normal SVC), group2 (SVC occlusion excluding bilateral innominate vein occlusion) and group3 (bilateral innominate vein occlusion irrespective of SVC status). Success rates were 100% (39/39), 75% (9/12) and 16.6% (1/6), respectively. These differences were significant for group1 versus group2+3 (p<0.001) and for group2 versus group3 (p=0.032). Acute complications occurred in 9 patients. Patients in whom acute complications occurred were older than the others (67.8 vs. 57.6 years, p=0.019). The procedure-related death rate was 3.5% (n=2). Stent occlusion occurred in 3.5% (n=2). The patient survival was poor (median 2.6; range <1-29.6months), independently of the success of stenting.
ConclusionsStenting for malignant SVC syndrome provides immediate and sustained symptomatic relief that lasts until death in this set of patients with a short life expectancy and restores the central venous access for administration of chemotherapy. Technical failure was associated with SVC occlusions and primarily with bilateral innominate vein occlusion.
El síndrome de vena cava superior (VCS) es causado por una obstrucción del retorno venoso de la cabeza, cuello y extremidades superiores hacia la aurícula derecha. La obstrucción puede producirse en la VCS o en ambas venas innominadas. Alrededor del 95% de los casos se deben a una enfermedad maligna y el 5% a trastornos benignos. El síndrome de VCS maligno se da en el 3-5% de los pacientes con enfermedad maligna intratorácica avanzada1. La obstrucción del drenaje venoso es consecuencia de la compresión de la VCS por un tumor originado en el bronquio principal derecho o lobular superior derecho o bien por una linfadenopatía mediastínica grande de los ganglios linfáticos precarinales o paratraqueales derechos2. Tras ello puede producirse una trombosis venosa secundaria. La invasión de la VCS es infrecuente. Las manifestaciones clínicas consisten en edema facial, periorbitario, cervical y de extremidades superiores bilaterales, dilatación de las venas superficiales y rubor facial, disnea, tos, ronquera, disfagia, cefalea, visión borrosa y alteraciones cognitivas. Puede producirse la muerte como resultado del edema cerebral y el coma o una obstrucción de las vías aéreas a causa de un edema de glotis o bronquial. La gravedad depende del grado de obstrucción y de la rapidez de inicio. El tratamiento es paliativo. El tratamiento médico incluye el empleo de diuréticos, corticoides y anticoagulantes. La quimioterapia y la radioterapia tardan de una a 3semanas en resultar eficaces, comportan efectos secundarios importantes y tienen un porcentaje de éxitos del 77% en los casos de carcinoma de pulmón microcítico (CPMC) y del 60% en los casos de carcinoma pulmonar no microcítico (CPNMC), con tasas de recurrencia del 16,6% en el CPMC y del 11% en el CPNMC3. La implantación de endoprótesis puede compararse favorablemente con estos tratamientos, ya que produce un alivio, sin riesgos, en menos de 72h, una tasa de éxitos del 95%, con una tasa de recurrencias del 11% pero que pueden ser tratadas mediante una reintervención, y con una permeabilidad a largo plazo del 92%3. El tratamiento quirúrgico no es una opción en estos pacientes con una esperanza de vida corta y un mal estado general.
Material y métodosUna revisión llevada a cabo para el periodo comprendido entre octubre de 2005 y julio de 2013, retrospectiva hasta octubre de 2008 y prospectiva a partir de entonces, identificó a 56pacientes consecutivos tratados por un síndrome de VCS maligno sintomático con 57intervenciones de implantación de endoprótesis en la VCS. La implantación de endoprótesis en la VCS constituyó la intervención de primera línea ofrecida a todos los pacientes con el síndrome de VCS maligno, con independencia de la histología tumoral disponible o el uso en ese momento o la previsión de uso futuro de quimioterapia o radioterapia. Se excluyeron los pacientes que no podían permanecer en decúbito supino o semirrecostados (n=2), los que tenían un síndrome de VCS asintomático detectado en la tomografía computarizada (TC) (n=3) y los que presentaban un síndrome de VCS causado por un trastorno benigno (n=2). La TC confirmó el diagnóstico clínico. Se obtuvo una radiografía de tórax anteroposterior al día siguiente de la implantación de la endoprótesis con objeto de verificar su posición y expansión. Se realizó una TC si ello estaba justificado clínicamente. Se obtuvieron datos de los registros de las historias clínicas y del registro nacional de mortalidad. No se perdió el seguimiento de ninguno de los pacientes.
Análisis estadísticoEl análisis de las variables asociadas a la tasa de éxitos (TE) y a las complicaciones se realizó con la prueba exacta de Fisher para las variables nominales y con la prueba de t para las variables de escala. Se utilizó un análisis de regresión logística multivariante. Se calcularon los intervalos de confianza (IC) para los valores de TE con un modelo de distribución binomial. La supervivencia se estimó con el método de Kaplan-Meier y un análisis de las variables relacionadas con la prueba de log-rank. Se consideró estadísticamente significativo un valor de p<0,05. El análisis estadístico se llevó a cabo con el programa informático SPSS Statistics 20.0.
ProcedimientoLa implantación de endoprótesis en la VCS se realizó en el quirófano con el empleo de un sistema de imagen digital portátil (Philips, BV Endura). La obstrucción de la VCS se superó generalmente partiendo de una vía de acceso por la vena femoral, con una guía recubierta de PTFE y con punta en J o bien con una guía estándar hidrófila angulada de 0,035pulgadas, con el apoyo de un catéter vertebral o de Berenstein multifinalidad de 5F, y se orientó con los puntos de referencia anatómicos. Se realizó una primera flebografía de sustracción digital tras superar la obstrucción y por el catéter situado en una posición superior en la vena innominada o en la vena yugular. A continuación se inyectó un bolo intravenoso de heparina de 5.000UI. Se utilizó una dilatación con balón antes de la implantación de la endoprótesis para las lesiones muy estrechas. El tamaño de las endoprótesis se determinó mediante la TC y la flebografía de intervención. La presencia de una obstrucción en ambas venas innominadas se trató con una implantación de endoprótesis unilateral según lo descrito con anterioridad4. El lado a recanalizar fue el que tenía la vena yugular permeable. En el caso de que ambas venas yugulares fueran permeables, se prefirió el lado derecho, ya que tiene un trayecto recto. Se llevó a cabo una dilatación con balón posterior al despliegue, hasta alcanzar diámetros de 12 a 18mm. La flebografía realizada una vez completada la intervención evaluó el diámetro y el flujo en la VCS y en las arterias pulmonares (fig. 1). Los pacientes fueron dados de alta con un tratamiento de enoxaparina 40mg y ácido acetilsalicílico 100mg/día de por vida. En los casos en los que había una trombosis asociada, se utilizó enoxaparina en dosis terapéuticas plenas durante al menos 3meses y en dosis de 40mg a partir de entonces. En los pacientes con complicaciones hemorrágicas no se utilizó anticoagulación ni tratamiento antiagregante plaquetario durante un periodo de tiempo variable.
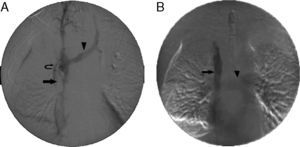
Implantación de endoprótesis en la vena cava superior (VCS). A)Flebografía inicial obtenida a través de la vía de acceso femoral con la punta del catéter colocada en la vena innominada derecha, que muestra una oclusión de la VCS (flecha), con llenado retrógrado de la vena innominada izquierda (punta de flecha) y circulación colateral (flecha curvada). B)Flebografía final después de la colocación de una endoprótesis de 14x60mm en la VCS (flecha). La vena innominada izquierda y la circulación colateral han dejado de visualizarse. El aumento del retorno venoso a la VCS y la aurícula derecha lleva a un llenado de la arteria pulmonar (punta de flecha).
La implantación de endoprótesis en la VCS se intentó en 56pacientes (46varones, 10mujeres), de 34-84años de edad (media 59,3; desviación estándar [DE] 10,7). Se obtuvieron muestras tumorales mediante biopsia transbronquial (n=40, 71,4%), biopsia transtraqueal (n=2, 3,6%), mediastinoscopia (n=10, 17,9%), decorticación pulmonar (n=1, 1,8%) o no se obtuvo ninguna muestra (n=3, 5,4%). Las enfermedades malignas subyacentes fueron las siguientes: adenocarcinoma pulmonar (n=17, 30,4%), carcinoma de pulmón microcítico (n=15, 26,8%), carcinoma de pulmón espinocelular (n=9, 16,1%), carcinoma de pulmón neuroendocrino macrocítico (n=2, 3,6%), linfoma (n=2, 3,6%), mesotelioma (n=1, 1,8%), carcinoma de mama metastásico (n=2, 3,6%), carcinoma renal metastásico (n=1, 1,8%), indiferenciado (n=3, 5,4%) y desconocido (n=4, 7,1%). La estadificación TNM fue el siguiente: estadioIIIA (n=2, 3,6%), estadioIIIB (n=13, 23,2%) y estadioIV (n=41, 73,2%). Se aplicó tratamiento de resección pulmonar (n=3, 5,4%), quimioterapia (n=24, 42,9%), radioterapia (n=3, 5,4%), quimioterapia y radioterapia (n=25, 44,6%) o ningún tratamiento adyuvante (n=4, 7,1%). En 27 (48,2%) de los pacientes el síndrome de VCS fue una manifestación inicial de la enfermedad, definida como un intervalo de tiempo entre diagnóstico e implantación de endoprótesis inferior a 30días (tabla 1).
Características de los pacientes
| Característica | Valor |
| Número de pacientes | 56 |
| Número de intervenciones | 57 |
| Sexo, n (%) | |
| Varones | 46 (82,1) |
| Mujeres | 10 (17,9) |
| Edad en años, media (DE) | 59,3 (10,7) |
| Vía de abordaje de la biopsia, n (%) | |
| Broncoscopia | 40 (71,4) |
| Transtraqueal | 2 (3,6) |
| Mediastinoscopia | 10 (17,9) |
| Decorticación pulmonar | 1 (1,8) |
| Ninguno | 3 (5,4) |
| Histología del cáncer, n (%) | |
| Adenocarcinoma | 17 (30,4) |
| Carcinoma microcítico | 15 (26,8) |
| Carcinoma espinocelular | 9 (16,1) |
| Carcinoma neuroendocrino macrocítico | 2 (3,6) |
| Linfoma | 2 (3,6) |
| Mesotelioma | 1 (1,8) |
| Adenocarcinoma de mama metastásico | 2 (3,6) |
| Carcinoma renal metastásico | 1 (1,8) |
| Indiferenciado | 3 (5,4) |
| Desconocido | 4 (7,1) |
| Estadio TNM del cáncer, n (%) | |
| IIIA | 2 (3,6) |
| IIIB | 13 (23,2) |
| IV | 41 (73,2) |
| Resección pulmonar, n (%) | 3 (5,4) |
| Tratamiento adyuvante, n (%) | |
| Quimioterapia | 24 (42,9) |
| Radioterapia | 3 (5,4) |
| Quimioterapia y radioterapia | 25 (44,6) |
| Ninguno | 4 (7,1) |
| Intervalo de tiempo entre diagnóstico e implantación de endoprótesis, n (%) | |
| <30 días | 27 (48,2) |
| ≥30 días | 26 (46,4) |
| Biopsia no realizada | 3 (5,4) |
Se utilizó anestesia local de forma estándar. Se recurrió a una anestesia general en 2pacientes (3,5%): un paciente esquizofrénico no colaborador y otro al que se practicó simultáneamente una mediastinoscopia. Se utilizó de forma estándar un acceso venoso femoral derecho percutáneo. Se utilizó la vena femoral izquierda en 3casos tras fallar el acceso femoral derecho. El acceso por la yugular derecha se utilizó únicamente en el primer paciente. La yugular izquierda se combinó con el acceso de vena femoral derecha en 2casos de oclusión de la vena innominada bilateral. Uno de estos casos se interrumpió tras superar la obstrucción debido a una taquicardia ventricular. En los demás se obtuvo con la técnica de guía through-and-through (fig. 2). Se determinó la localización de la obstrucción venosa, el tipo de obstrucción y la posición de la implantación de endoprótesis. Las endoprótesis utilizadas fueron Sinus-XL (Optimed) (n=20, 30,5%), Smartstent (Cordis) (n=15, 26,3%), Wallstent (Boston Scientific) (n=11, 19,3%) y Express (Boston Scientific) (n=3, 5,9%). El número de endoprótesis por paciente osciló entre 0 y 4. La longitud de implantación de endoprótesis fue de entre 0 y 160mm. El diámetro de la endoprótesis osciló entre 10 y 24mm. La media de duración de la intervención fue de 54,3min, con una DE de 29min (tabla 2).
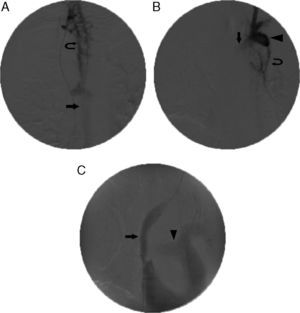
Implantación de endoprótesis en la vena cava superior (VCS) y la vena innominada izquierda. A)Flebografía inicial obtenida a través de la vía de acceso femoral, con la punta del catéter colocada en la vena yugular interna derecha, que muestra una oclusión de la VCS y las venas innominadas derecha e izquierda, un agrandamiento y llenado retrógrado de la vena ácigos (flecha) y una circulación colateral (flecha curvada). B)Flebografía obtenida con un acceso por la vena yugular interna izquierda, que muestra una oclusión de la vena innominada derecha (flecha), llenado retrógrado de la vena subclavia (punta de flecha) y circulación colateral (flecha curvada). C)Flebografía final tras la colocación de 2 endoprótesis solapadas de 18×60 y 20×60mm en la VCS y en la vena innominada izquierda (flecha). Obsérvese el llenado enérgico de la arteria pulmonar (punta de flecha). La obstrucción se superó a través de una vía de acceso por la vena yugular izquierda, la guía con lazo y las endoprótesis introducidas a través de la vena femoral derecha (técnica through-and-through o flossing).
Características de la implantación de endoprótesis
| Característica | Valor |
| Anestesia, n (%) | |
| General | 2 (3,5) |
| Local | 55 (96,5) |
| Acceso vascular, n (%) | |
| Femoral derecha | 51 (89,5) |
| Femoral izquierda | 3 (5,3) |
| Femoral derecha y yugular izquierda | 1 (1,8) |
| Femoral derecha y yugular izquierda (through-and-through) | 1 (1,8) |
| Yugular derecha | 1 (1,8) |
| Localización de la obstrucción venosa, n (%) | |
| Yugular derecha, vena innominada derecha y vena innominada izquierda | 3 (5,3) |
| Yugular derecha, vena innominada derecha, vena innominada izquierda y vena cava superior | 2 (3,5) |
| Vena innominada derecha y vena cava superior | 3 (5,3) |
| Vena innominada derecha, vena innominada izquierda y vena cava superior | 6 (10,5) |
| Vena innominada derecha y vena cava superior | 1 (1,8) |
| Vena cava superior | 42 (73,7) |
| Tipo de obstrucción venosa, n (%) | |
| Grupo 1 | 39 (68,4) |
| a) Estenosis de vena cava superior (VCS) | 37 (64,9) |
| b) Oclusión de vena innominada unilateral con estenosis de vena innominada contralateral y VCS normal | 2 (3,5) |
| Grupo 2 | 12 (21,0) |
| Oclusión de VCS y exclusión de oclusión de vena innominada bilateral | |
| Grupo 3 | 6 (10,5) |
| Oclusión de vena innominada bilateral con independencia del estado de la VCS | |
| Localización de la implantación de endoprótesis, n (%) | |
| Ninguno | 8 (14,0) |
| Vena yugular derecha, vena innominada derecha y vena cava superior | 1 (1,8) |
| Vena innominada derecha y vena cava superior | 5 (8,8) |
| Vena innominada izquierda y vena cava superior | 6 (10,5) |
| Vena cava superior | 37 (64,9) |
| Tipo de endoprótesis, n (%) | |
| Ninguna | 8 (14,0) |
| Sinus-XL (Optimed) | 20 (30,5) |
| Smartstent (Cordis) | 15 (26,3) |
| Wallstent (Boston Scientific) | 11 (19,3) |
| Express (Boston Scientific) | 3 (5,9) |
| Endoprótesis por intervención, n (%) | |
| 0 | 8 (14,0) |
| 1 | 35 (61,4) |
| 2 | 9 (15,8) |
| 3 | 3 (5,3) |
| 4 | 2 (3,5) |
| Longitud de implantación en mm, n (%) | |
| 0 | 8 (14,0) |
| 40 | 10 (17,5) |
| 60 | 28 (49,1) |
| 80 | 1 (1,8) |
| 100 | 5 (8,8) |
| 120 | 2 (3,5) |
| 160 | 3 (5,3) |
| Diámetro máximo de endoprótesis en mm, n (%) | |
| 0 | 8 (14,0) |
| 10 | 3 (5,3) |
| 12 | 4 (7,0) |
| 14 | 11 (19,3) |
| 16 | 5 (8,8) |
| 18 | 15 (26,3) |
| 20 | 6 (10,5) |
| 22 | 4 (7,0) |
| 24 | 1 (1,8) |
| Duración de la intervención en minutos, media (DE) | 54,3 (29) |
La TE fue de 49/57 (86%). El éxito se asoció al tipo de obstrucción agrupada de la siguiente forma: grupo1 (a: estenosis de VCS, y b: oclusión de vena innominada unilateral con estenosis de vena innominada contralateral y VCS normal), TE: 39/39 (100%), IC: 0,905-1,00; grupo2 (oclusión de VCS y exclusión de oclusión de vena innominada bilateral), TE: 9/12 (75%), IC: 0,35-0,797, y grupo3 (oclusión de ambas venas innominadas con independencia del estado de la VCS), TE: 1/6 (16,6%), IC: 0,004-0,64 (tabla 3). Estas diferencias eran estadísticamente significativas: grupo1 frente a grupo2+3 (p<0,001) y grupo2 frente a grupo3 (p=0,032). El análisis bivariado mostró una TE mejor en los varones (43/47 frente a 6/10, p=0,025) y cuando la biopsia era transbronquial en comparación con la mediastinoscopia, la punción transtraqueal y la decorticación pulmonar (37/40 frente a 4/14, p=0,065). El análisis multivariante puso de manifiesto que tan solo el tipo de obstrucción se asociaba a la TE: grupo1 frente a grupo2+3 (p=0,003; odds ratio: 0,037). La TE no estaba relacionada con la edad, la histología del cáncer, el estadio TNM, los tratamientos adyuvantes y la duración de la intervención. Todos los pacientes en los que la intervención tuvo éxito obtuvieron un alivio total o parcial del síndrome de VCS.
Resultados de implantación de endoprótesis
| Resultados | Valor |
| Tasa de éxitos, n (%) | 49/57 (86,0) |
| Grupo 1 | 39/39 (100) |
| a) Estenosis de vena cava superior (VCS) | 37/37 (100) |
| b) Oclusión de vena innominada unilateral con estenosis de vena innominada contralateral y VCS normal | 2/2 (100) |
| Grupo 2 | 9/12 (75,0) |
| Oclusión de VCS y exclusión de oclusión de vena innominada bilateral | |
| Grupo 3 | 1/6 (16,6) |
| Oclusión de vena innominada bilateral con independencia del estado de la VCS | |
| Complicaciones agudas, n (%) | 9/57 (15,8) |
| Migración de endoprótesis | 3 (5,3) |
| Disritmia cardiaca | 3 (5,3) |
| Asistolia y bradicardia | 1 (1,8) |
| Taquicardia supraventricular | 1 (1,8) |
| Taquicardia ventricular | 1 (1,8) |
| Hemorragia | 3 (5,3) |
| Hemopericardio | 1 (1,8) |
| Hemoptisis | 1 (1,8) |
| Hematoma de psoas | 1 (1,8) |
| Muerte relacionada con la intervención, n (%) | 2 (3,5) |
| Oclusión de endoprótesis, n (%) | 2 (3,5) |
| Asintomática | 1 (1,8) |
| Sintomática | 1 (1,8) |
| Supervivencia del paciente (meses) | |
| Mediana | 2,7 |
| Rango | 0-29,6 |
La tasa de complicaciones agudas fue del 15,8% (n=9). Los pacientes en los que se dieron las complicaciones fueron de mayor edad que los demás (67,8 frente a 57,6años, p=0,019). Se produjo una migración de la endoprótesis hacia la aurícula derecha en 3pacientes (5,3%): un paciente con una endoprótesis implantada en la VCS y 2 con endoprótesis colocadas en la confluencia de la vena innominada izquierda (VII) y la VCS. La migración se detuvo con la colocación proximal de una o 2 endoprótesis adicionales. Se produjeron disritmias en 3pacientes (5,3%): asistolia y bradicardia después de la implantación de endoprótesis, que requirió un marcapasos cardiaco transvenoso (n=1, 1,8%); taquicardia ventricular durante la manipulación de la guía intracardiaca a través de un abordaje yugular izquierdo, que se trató con cardioversión eléctrica e hizo que se abortara la intervención (n=1, 1,8%), y taquicardia supraventricular después de la implantación de endoprótesis en la confluencia de la VII y la VCS, que se trató con amiodarona intravenosa (n=1, 1,8%). Se produjeron hemorragias en 3 pacientes (5,3%): hemopericardio en un paciente con un derrame pericárdico previo que se expandió pero sin colapso del ventrículo derecho y en el que la pericardiocentesis obtuvo 300cc de líquido sanguinolento (n=1, 1,8%); hemoptisis después de la implantación de endoprótesis en un paciente que había sangrado anteriormente y que se trató de inmediato con broncoscopia con láser (n=1, 1,8%), y hematoma de psoas del lado izquierdo, contrario al del acceso venoso femoral, diagnosticado al tercer día después de la implantación de la endoprótesis, que causó una caída de la hemoglobina de 10,1 a 5,8mg/dl y que finalmente cesó (n=1, 1,8%). Se produjo una oclusión de la endoprótesis en 2pacientes (3,5%): una fue asintomática y se produjo 3meses después de la implantación de la endoprótesis por una estenosis de la VCS que se dejó sin tratar, y otra fue sintomática y se produjo 1,5meses después de la implantación de la endoprótesis por una oclusión de la VCS y que se trató con una nueva implantación de endoprótesis realizada con éxito en la VII y la VCS.
Se produjo la muerte relacionada con la intervención en 2pacientes (3,5%). Uno de ellos fue el primer paciente de esta serie, que falleció 6h después de la intervención sin que se identificara una causa. El otro paciente presentó una migración de las endoprótesis implantadas en la VII y la VCS, y falleció 8h después, presumiblemente por una migración adicional de la endoprótesis (tabla 3).
La supervivencia de los pacientes fue corta (mediana 2,7meses; rango <1-29,6meses). Seis pacientes vivieron más de un año. La supervivencia pareció ser inferior en los pacientes que presentaron el síndrome de VCS en los primeros 30días siguientes a la biopsia del tumor (p=0,078). La supervivencia se redujo en los 4pacientes que se consideró que se encontraban en un estadio demasiado avanzado para la quimioterapia o la radioterapia (rango 0-0,63meses frente a 0-29,6meses, p<0,001). No se observaron diferencias en la supervivencia de los pacientes en los que se obtuvo un éxito de la implantación de endoprótesis en comparación con los pacientes en los que esta fracasó, ni tampoco en las complicaciones asociadas a la intervención, la histología del cáncer, el estadio TNM, los tratamientos adyuvantes, el tipo de obstrucción de la VCS o la edad o el sexo de los pacientes (tabla 3).
DiscusiónLa implantación de endoprótesis en la VCS es un tratamiento efectivo y rápido para el síndrome de VCS, siempre que el paciente pueda permanecer en decúbito supino y no sea alérgico a los contrastes yodados.
Hay varias técnicas que merece la pena comentar. La vía de acceso yugular permite obtener una flebografía que es útil para guiar la superación de la obstrucción y un trayecto más corto hasta la VCS, pero es laboriosa y molesta para el paciente y el operador. Además, la tumefacción en el cuello puede hacer que la punción de la vena sea difícil y, si la intervención no tiene éxito, la hemostasia de la entrada venosa puede ser peligrosa, sobre todo cuando se utilizan vainas de 10F. La evitación de la migración de la endoprótesis requiere el empleo de un tamaño superior al que correspondería y una longitud de más de 60mm, con preferencia por las endoprótesis únicas frente a las solapadas, en especial en la confluencia de la VII y la VCS, ya que la curva hace que la fijación de la endoprótesis sea inestable. Se produjo una mala aposición en el extremo superior a lo largo de la curva interna de las endoprótesis colocadas en la confluencia de VII y VCS (conformación en pico de pájaro) en 3 de 6casos pero sin perturbaciones del flujo. El uso de un tamaño superior al que correspondería debe tener en cuenta la variabilidad del diámetro venoso en función del balance de líquidos, la posición del cuerpo y el alivio de la obstrucción con la implantación de endoprótesis, quimioterapia o radioterapia. El trombo puede hacer que la superficie de fijación de la endoprótesis sea deslizante. Se observó con frecuencia una estenosis residual refractaria a la dilatación con balón, pero ello no se asoció a un fracaso clínico.
Se han utilizado varios tipos de endoprótesis para el tratamiento del síndrome de VCS: balón expansible, acero inoxidable autoexpansible, nitinol autoexpansible y nitinol recubierto de PTFE autoexpansible. Los datos disponibles de diversas series sugieren resultados similares para las diversas endoprótesis4-12. Fagedet el al.11 observaron más complicaciones con las endoprótesis de más de 16mm de diámetro. Sin embargo, el diámetro de la endoprótesis viene determinado por el vaso nativo en sí y no puede usarse un tamaño inferior al que correspondería para superar esta característica. Recientemente, un estudio comparativo del tratamiento con endoprótesis con recubrimiento frente a las no recubiertas ha puesto de manifiesto que las primeras aportan una permeabilidad acumulativa superior, pero sin diferencias en el éxito clínico y en la supervivencia de los pacientes12.
En comparación con otras series de etiología mixta benigna y maligna5,6 o de etiología tan solo maligna4,7-12, la TE fue inferior (86% frente al 97,6%). Esto puede deberse al abandono de la intervención de implantación de endoprótesis en la VCS tras no poder superar la obstrucción a través de la vía de acceso femoral, sin intentar un acceso yugular o humeral en 7 de 8 casos sin éxito. La TE fue del 100% en el grupo1 (estenosis), del 75% en el grupo2 (oclusiones) y del 16,6% en el grupo3 (oclusiones de ambas venas innominadas). Se han descrito mejores resultados en los casos de estenosis en comparación con los de oclusión8. La tasa de complicaciones agudas fue mayor en los pacientes ancianos, y ello coincidía con lo indicado por otras series (15,8% frente al 6,7-15%)7-11. La disritmia cardiaca, la migración de la endoprótesis y las complicaciones hemorrágicas se dieron con la misma frecuencia (5,3%). Estas complicaciones fueron graves y requirieron capacidades específicas para abordarlas: cardioversión eléctrica, marcapasos cardiaco, pericardiocentesis y broncoscopia con láser. La mortalidad asociada a la intervención fue similar a la de otras series (3,5% frente al 0-2,4%)7-11. La tasa de oclusiones de las endoprótesis fue inferior (3,5% frente al 13,4-21,9%)7-11, y ello puede deberse a la exclusión inicial de los casos difíciles en los que falló la intervención, que eran propensos a una posterior trombosis11, a un seguimiento inexacto o a una supervivencia de los pacientes más breve en esta serie (mediana 2,7meses frente a 6meses). Los pacientes con un éxito o un fallo de la implantación de endoprótesis tuvieron igual supervivencia, lo cual resalta el carácter paliativo de la implantación de endoprótesis en la VCS. Los pacientes en los que el síndrome de VCS apareció como manifestación inicial tuvieron una supervivencia más corta que la de los demás, debido posiblemente a que la aparición temprana del síndrome de VCS refleja una forma más agresiva de la enfermedad.
ConclusiónLa implantación de endoprótesis constituye un tratamiento de primera línea efectivo para el síndrome de VCS maligno. Aporta un alivio sintomático inmediato y sostenido y una vía de acceso venoso central para la administración de quimioterapia.
AutoríaGonçalo Sobrinho operó a los pacientes, concibió el estudio, obtuvo los datos, analizó e interpretó los datos y redactó el artículo.
Pedro Aguiar realizó el análisis estadístico de los datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Dra. Paula Wright la revisión del manuscrito.