La papilomatosis laríngea recurrente (PLR) se caracteriza por el crecimiento recurrente de papilomas en el tracto respiratorio. Está causada por el virus del papiloma humano (VPH) y son los serotipos 6 y 11 — bajo riesgo oncogénico— los implicados en cerca del 90% de los casos1, siendo rara la participación de otros serotipos (16, 18, 31, 33)1. Su incidencia es desconocida; en EE.UU. se estima que afecta a 4,3:100.000 niños y 1,8:100.000 adultos2. Presenta una distribución bimodal, con una forma juvenil y otra adulta3. La forma juvenil representa la primera causa de tumores benignos laríngeos en niños y la segunda de disfonía, siendo este el síntoma guía más frecuente4, pero dada su clínica inespecífica, el diagnóstico puede retrasarse hasta un año5. La infección por VPH 11 y el diagnóstico antes de los 3 años de edad son los mayores factores de riesgo para el desarrollo de formas graves, asociadas a más recurrencias3. En las formas más agresivas puede haber un compromiso severo de la vía aérea que obligue a la realización de traqueostomía. Su curso clínico es impredecible, presentando un espectro clínico variable, desde la remisión progresiva y espontánea hasta la conversión maligna (2%)6, pasando por recurrencias y diseminación endobronquiales de las lesiones papilomatosas6. Se asocia a una alta morbilidad e impacto psicosocial en pacientes y familiares y a un importante gasto sanitario7. Actualmente no existe tratamiento curativo3,4. El pilar fundamental del tratamiento es la cirugía: tratamientos endoscópicos repetidos que permiten la desobstrucción de la vía aérea3,4. Han sido probados numerosos tratamientos médicos adyuvantes, pero con limitada efectividad8, siendo los más frecuentemente usados cidofovir intralesional9 e interferón sistémico10. La diseminación subglótica de las lesiones papilomatosas empeora el pronóstico de forma considerable3, al dificultar el abordaje quirúrgico3. Según la bibliografía existente, el cidofovir nebulizado ha sido utilizado en casos de diseminación distal11,12, con buena tolerancia al tratamiento y buena respuesta de la enfermedad al mismo11,12 (fig. 1).
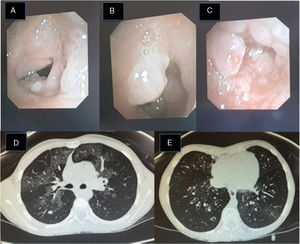
(A) Imagen de fibrobroncoscopia: lesiones perladas en el tercio posterior de las cuerdas vocales y pliegues vestibulares de la glotis, que se extienden a la tráquea, estenosando la luz traqueal un 90% (B). Dichas lesiones son fácilmente sangrantes (C). (D) Imagen de TACAR pulmonar: patrón pulmonar bilateral en vidrio deslustrado y un nódulo de 6mm en el segmento posterior del lóbulo superior derecho. (E) TACAR pulmonar: dilataciones bronquiales cilíndricas con ligero engrosamiento mural de bronquios.
Presentamos nuestra experiencia con el uso compasivo de cidofovir nebulizado en 2 pacientes pediátricos con PLR con diseminación endobronquial, con una evolución tórpida e importantes efectos secundarios. Se ha obtenido el consentimiento de los representantes legales para la publicación de ambos casos.
Caso clínico 1: niña con antecedentes personales de prematuridad e intubación orotraqueal al nacimiento. Diagnosticada de PLR por VPH 6 a los 9 meses de edad por estridor inspiratorio progresivo. Portadora de traqueostomía desde los 3 meses del diagnóstico. Tras el diagnóstico ha precisado intervenciones quirúrgicas mensuales para la resección de lesiones y ha recibido tratamiento adyuvante con interferón alfa subcutáneo, cidofovir intralesional, 3-indolcarbinol oral y vacunación tetravalente frente al VPH (GardasilTM). A los 3 años, en control de fibrobroncoscopia, se objetiva lesión papilomatosa en el bronquio principal derecho, iniciando tratamiento con cidofovir nebulizado (4ml con concentración 10mg/ml, 3 veces por semana). Tras la administración de la quinta dosis consulta por hemoptisis franca y desaturación, precisando ingreso hospitalario para el control de la sintomatología. Se suspendió cidofovir nebulizado tras lo cual no ha vuelto a presentar episodios de sangrado.
Caso clínico 2: niña diagnosticada de PLR por VPH 11 a los 18 meses de edad, precisando traqueostomía para mantener la permeabilidad de la vía aérea, siendo aún portadora de la misma. Desde el diagnóstico precisó cirugías quincenales/mensuales, y ha recibido tratamiento con cidofovir intralesional y sistémico, interferón alfa subcutáneo y vacunación tetravalente anti-VPH (GardasilTM). A los 8 años acude a consulta por dificultad respiratoria progresiva, observándose en fibrobroncoscopia lesiones papilomatosas en la tráquea (fig. 1). Se decide iniciar cidofovir nebulizado a una menor concentración, dada la experiencia previa (4ml con concentración 5mg/ml, 3 veces/semana), con buena respuesta clínica inicial (lesiones papilomatosas mínimas residuales a los 6 meses). A los 9 meses de iniciar el tratamiento presenta síndrome constitucional junto con hipoxemia y aumento de la dificultad respiratoria. Se realiza TACAR pulmonar que pone de manifiesto áreas focales parcheadas con densidad en vidrio deslustrado y bronquiectasias cilíndricas bibasales bilaterales (fig. 1), hallazgos que, junto con la clínica, llevan a establecer el diagnóstico de bronquiolitis obliterante con neumonía organizada (BONO). Se suspende cidofovir nebulizado y se inician corticoides a 2mg/kg, siendo posible la retirada del oxígeno y la mejoría clínica. En el TACAR pulmonar de control se observa una mejoría radiológica, tanto del patrón en vidrio deslustrado como de las bronquiectasias cilíndricas. Actualmente la corticoterapia ha sido suspendida, realizando tratamiento con aerosolterapia y fisioterapia respiratoria para esta condición.
En conclusión, el manejo terapéutico de la PLR constituye un reto dada la falta de alternativas terapéuticas eficaces, no carentes de efectos adversos importantes. A falta de estudios controlados y que incluyan cohortes significativas, la evidencia publicada a día de hoy11,12 no recomienda el uso de cidofovir nebulizado en pacientes con PLR, ya que los efectos secundarios del mismo son potencialmente graves y su efectividad dudosa.
La publicación de la experiencia de eficacia y seguridad de tratamientos «off-label» en esta rara enfermedad podría ayudar a optimizar la toma de decisiones terapéuticas en la práctica clínica diaria, mejorando el manejo y la calidad de vida de estos pacientes.