Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una de las causas mayores de morbilidad y mortalidad en la actualidad y, además, la única de las causas mayores de mortalidad cuya incidencia va en aumento1. A pesar de los progresos en el diagnóstico y el tratamiento de la EPOC en los últimos 20 años apenas disponemos de pautas terapéuticas que puedan mejorar eficazmente el deterioro progresivo de la función pulmonar o del estado de salud de los pacientes2. Se trata además de una enfermedad todavía insuficientemente diagnosticada y tratada, en la que se precisa individualizar el tratamiento, disponer de mejores fármacos y de más estudios que aclaren las dudas sobre algunos tratamientos actuales3.
Dado que la inflamación crónica de la vía respiratoria es una de las características dominantes en la patogenia de la EPOC, algunos investigadores han sugerido que los glucocorticoides inhalados (GI) podrían mejorar los resultados para la salud de estos pacientes4, a pesar de que diversos estudios no han podido demostrar una modificación significativa en la tasa de deterioro del volumen espiratorio máximo en el primer segundo (FEV1), patrón de medida que indica por el momento la situación o la progresión de la enfermedad. Por ello, el papel de los GI en el tratamiento de la EPOC es actualmente controvertido, pero se van acumulando pruebas que soportan algunas recomendaciones terapéuticas5, que parten de ensayos clínicos bien controlados. Su escasa acción sobre la caída del FEV1, al igual que ocurre con el resto de las terapias farmacológicas empleadas6, no impide que consigan otros beneficios de interés, como la reducción del número de exacerbaciones o la mejoría de los síntomas y el estado de salud.
Inflamación en la EPOC
La inflamación y el remodelado son dos aspectos clave en la patogenia de la EPOC, enfermedad que se caracteriza por la presencia de obstrucción crónica y poco reversible al flujo respiratorio (disminución del FEV1 y de la relación FEV1/capacidad vital forzada [FVC]) causada principalmente por una reacción inflamatoria frente al humo del tabaco7; así, se acepta que el consumo de tabaco es la causa principal de los cambios inflamatorios producidos en los pulmones de los fumadores, aunque afortunadamente sólo una parte de ellos, los fumadores susceptibles, producen una respuesta anómala que condiciona el desarrollo de alteraciones anatómicas en la vía respiratoria y en el parénquima pulmonar.
La inflamación se acompaña, además, de otras situaciones que hacen del proceso de la EPOC una alteración multifactorial en la que intervienen la disfunción mucociliar, los cambios estructurales en la vía respiratoria, la limitación al flujo respiratorio y la afección sistémica.
La presencia de inflamación en la EPOC puede justificarse por 4 hechos demostrados: infiltrado linfocitario de la mucosa bronquial con presencia de CD8+, aumento de polimorfonucleares en el lavado alveolar, presencia de moléculas de adhesión en la mucosa e incremento de óxido nítrico en el aire exhalado. Pero, además, en esta enfermedad se han descrito simultáneamente algunos aspectos relacionados con la inflamación sistémica: presencia de citocinas inflamatorias en plasma (TNF alfa), moléculas de adhesión en los polimorfonucleares, aumento de la actividad oxidativa en los linfocitos y la alteración oxidativa del sistema muscular esquelético.
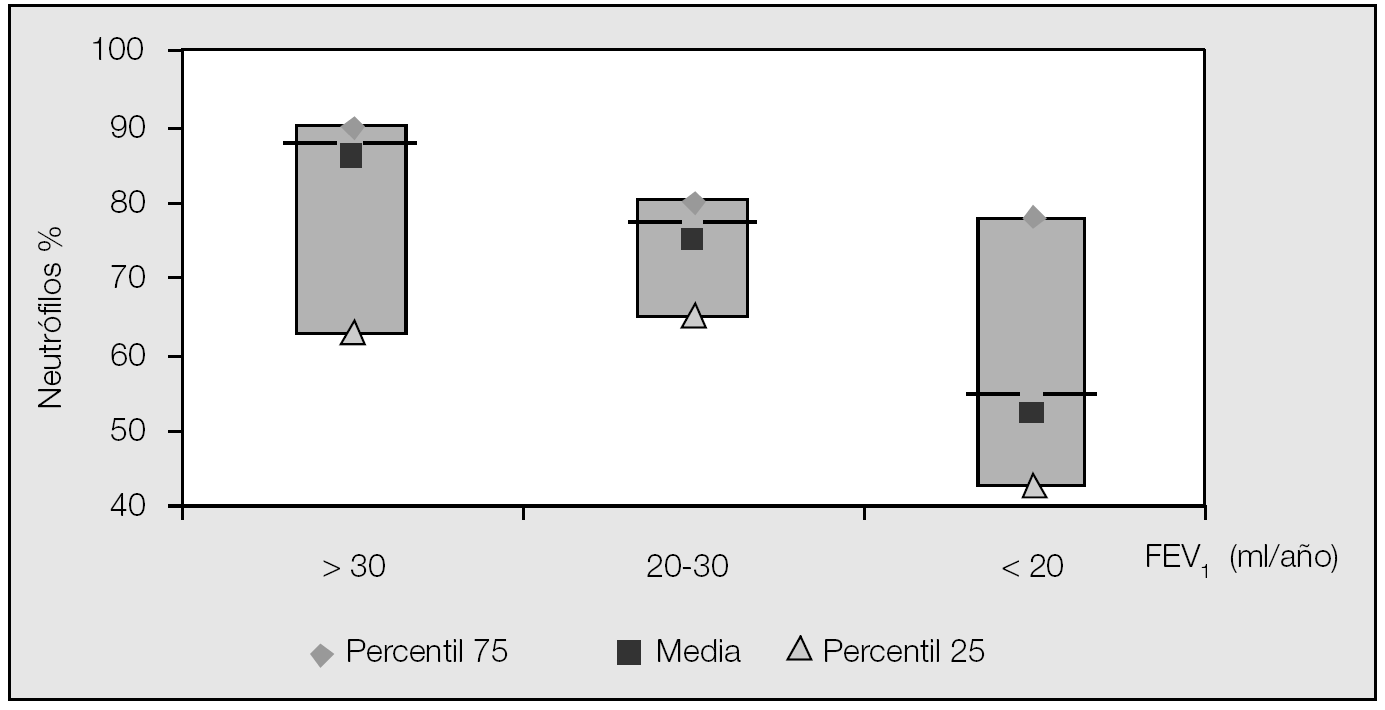
Algunos estudios son significativos a este respecto. Stanescu8 demuestra que la inflamación neutrofílica de la vía respiratoria se relaciona con la EPOC al consignar que los pacientes que perdían más de 30 ml/año de su FEV1, en un seguimiento llevado a cabo durante 15 años, tenían en el esputo porcentajes significativamente más elevados de neutrófilos, frente a los que experimentaban una pérdida menor de la función pulmonar (fig. 1). El estudio de Pesci et al9 demuestra, en el lavado alveolar de 12 pacientes con EPOC frente a 10 controles, un aumento de interleucina 8 (IL-8), de los valores de mieloperoxidasa (MPO) y de proteína catiónica eosinofílica (ECP), y sugiere que el consumo de cigarrillos se asocia con un incremento de los mediadores inflamatorios capaces de producir el daño en la mucosa bronquial.
Fig. 1. Porcentaje de neutrófilos en el esputo en relación con la pérdida del volumen espiratorio máximo en el primer segundo (FEV1) (ml/año)8.
Los estudios simultáneos de Chanez10, realizado en 25 pacientes, y Pizzichini11, llevado a cabo en 18 pacientes, a pesar del escaso número de sujetos con EPOC evaluados, unen la respuesta positiva a los corticoides en estos pacientes a la presencia de un mayor número de eosinófilos y valores altos de FCP en el lavado alveolar y el esputo, respectivamente, lo que indica la presencia de diversas circunstancias en algunos pacientes con EPOC con una respuesta positiva a los coticoides. Por razones evidentes, estos estudios apenas se han podido comparar con los ensayos clínicos pero, en conjunto, han demostrado que los GI disminuyen varios índices de inflamación de la vía aérea en la EPOC, como la extravasación, la actividad quimiotáctica, el recuento neutrofílico o el aumento de la actividad antiproteolítica, pero ninguno de estos estudios revela una correlación clínica con los cambios en la evolución de la enfermedad.
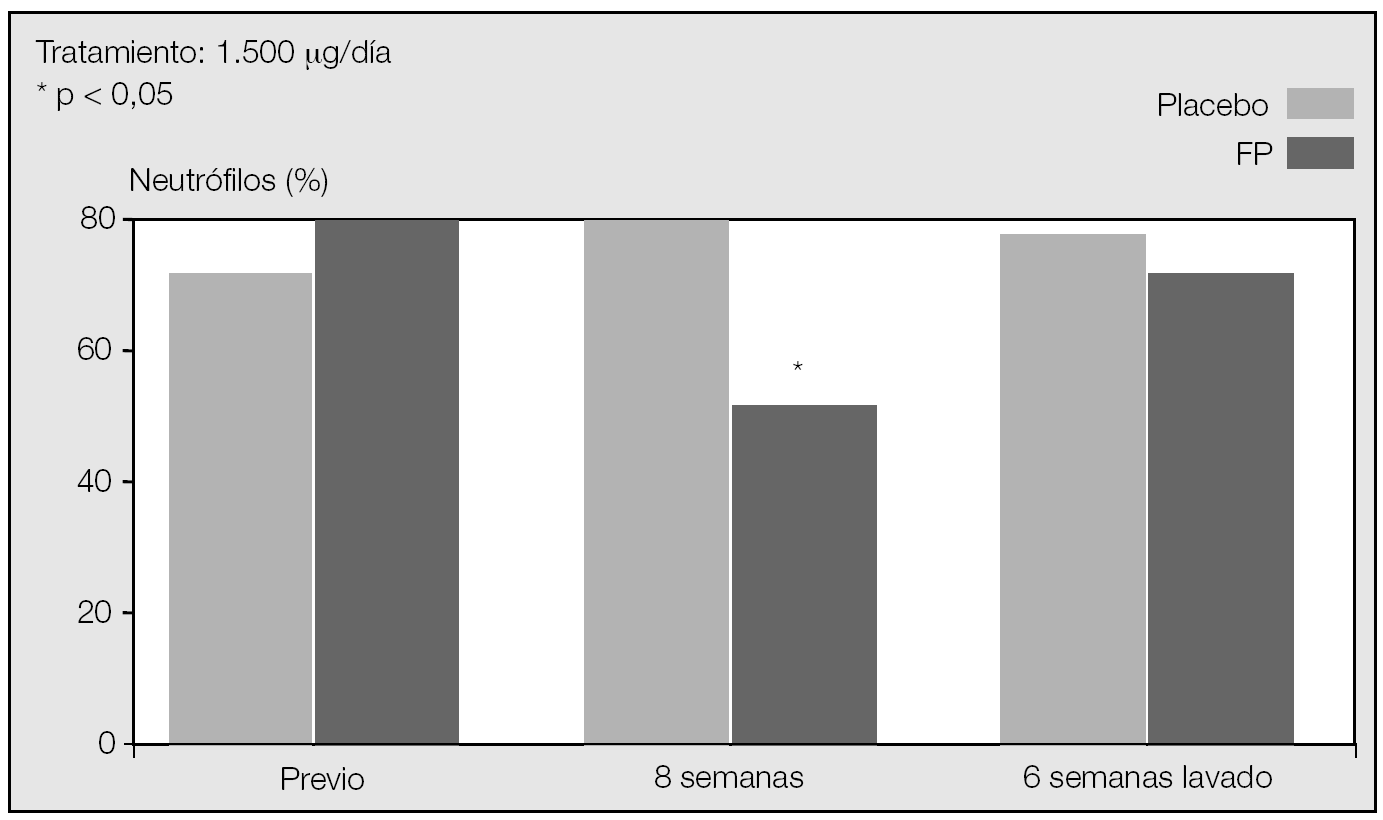
Los efectos antiinflamatorios de los GI han sido también recientemente demostrados. Ferrera12 encuentra, tras 2 semanas de tratamiento con beclometasona a dosis de 500 μg/12 h, una reducción significativa del óxido nítrico exhalado frente a placebo en pacientes con EPOC. Del mismo modo, Yildiz et al13 demostraron una reducción significativa del número de neutrófilos en el esputo de pacientes con EPOC tras 8 semanas de tratamiento con fluticasona a dosis de 1.500 μg/día (fig. 2).
Fig. 2. La fluticasona reduce el número de neutrófilos en el esputo en los pacientes con enfermedad pulmonar obstructiva crónica tras 8 semanas de tratamiento13.
Estos estudios han sido reforzados por el reciente trabajo de Hattotuwa14, en el que, tras realizar una biopsia bronquial al inicio y después de 3 meses de tratamiento con fluticasona a dosis de 500 μg/12 h en pacientes con EPOC y un FEV1 de 1,30 l de media, pudo demostrar una reducción del cociente CD8+/CD4+ en el epitelio y una reducción del número de mastocitos subepiteliales en los pacientes tratados frente a placebo. Además, por primera vez se establece una relación entre estos cambios y el comportamiento clínico, observándose con el tratamiento una reducción de la tos, la expectoración y la necesidad de medicación de rescate, durante los 3 meses de seguimiento. Debe hacerse una cuidadosa interpretación de estos resultados, ya que no deben relacionarse, necesariamente, estos cambios patológicos con el resultado clínico, lo que indica que aún no se ha establecido claramente la patogenia de la EPOC y todavía no se han identificado por completo las células y las moléculas responsables de ella. Desde el punto de vista clínico, los resultados obtenidos en este estudio, con una selección de pacientes y un tratamiento similar al estudio ISOLDE15, hacían esperar una mejoría, con un claro efecto de los GI que en ambos estudios no modificó el declive del FEV1 de los pacientes.
Tratamiento antiinflamatorio
Los estudios que han analizado la respuesta de los GI a corto plazo no han demostrado una mejoría significativa en la función pulmonar ni en el grado de protección frente a los agentes broncoconstrictores16. En cualquier caso, se produce una dificultad añadida al observar la respuesta de una medida terapéutica a medio y largo plazo17; algunos estudios recientes se han planteado la valoración en períodos prolongados de todos los posibles beneficios del uso de GI en la EPOC.
Una revisión sistemática18, publicada recientemente, de todos los ensayos aleatorizados comparativos demostró los efectos beneficiosos de los corticoides inhalados sobre los resultados clínicos, como la tasa de exacerbaciones. Cabe destacar que estos beneficios se obtuvieron en ausencia de cualquier efecto apreciable sobre la tasa de deterioro del FEV1, y en buena parte siguen siendo desconocidos los mecanismos que subyacen a estas observaciones. Se ha demostrado, como ya hemos comentado, que el tratamiento con dosis moderadas/altas de corticoides inhalados durante varias semanas atenúa significativamente alguno de los componentes de la inflamación de las vías respiratorias en la EPOC. Además, también pueden atenuar la hiperreactividad bronquial19, un factor de riesgo conocido de morbimortalidad en la EPOC.
En 1999, un metaanálisis realizado por Van Grunsven20 incluyó todos los trabajos llevados a cabo entre 1983 y 1996 acerca del tratamiento con corticoides en la EPOC, que abarcaba 94 referencias. Seleccionados 5 estudios con más de 24 meses de tratamiento y correctamente ejecutados, se concluyó que los pacientes con EPOC moderada-grave tuvieron un beneficio en el FEV1 tras 2 años de tratamiento. Esta mejoría se estableció para una edad media de 61 años y un FEV1 medio del 45% del teórico, en 0,034 l/año entre el grupo placebo (n = 88) y el grupo activamente tratado (n = 95).
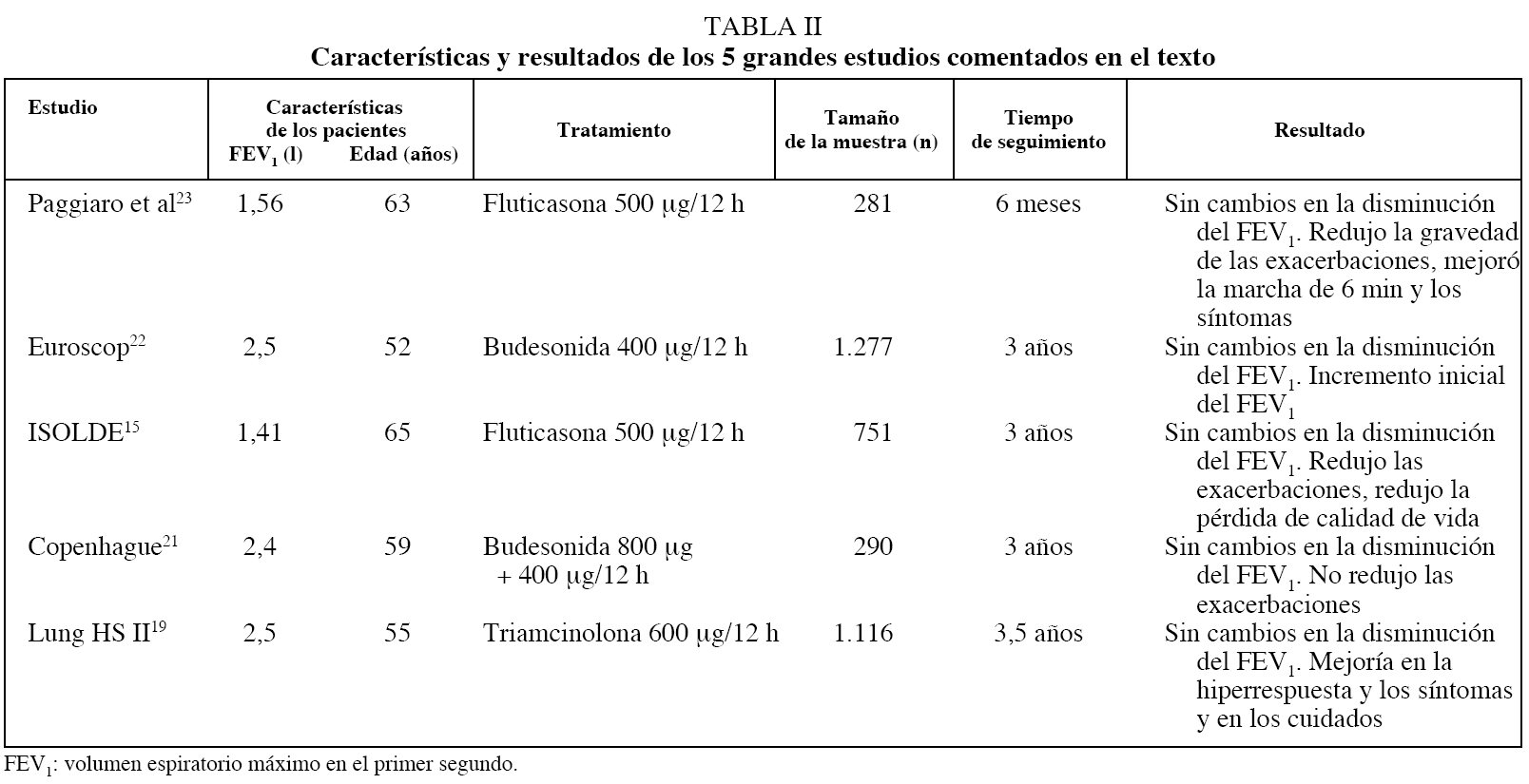
Después de este trabajo han aparecido 4 grandes estudios que merecen ser comentados. El estudio de la Ciudad de Copenhague21, que incluyó a 290 individuos tratados con budesonida a dosis de 400 μg/12 h durante 3 años, no obtuvo una mejoría significativa en el declive del FEV1, que fue de 41,8 ml/año para el grupo placebo y de 45,1 ml/año para el tratado con budesonida. El segundo estudio, el EUROSCOP22, es más amplio y abarca a 1.277 pacientes con FEV1 del 77% de media, tratados con budesonida durante 3 años. Se constató una pérdida de FEV1 de 140 ml para el grupo activamente tratado frente a 180 ml para el grupo placebo. El uso de budesonida se asoció con una pequeña mejoría funcional al principio del tratamiento, pero no fue un efecto apreciable a largo plazo.
El tercer estudio ISOLDE15 incluyó a 751 varones y mujeres con edades comprendidas entre 40 y 75 años y un FEV1 del 50%. En él, la fluticasona a dosis de 500 μg/12 h no alteró el declive del FEV1 durante 3 años de tratamiento, pero redujo el número de exacerbaciones (al 25%) y retrasó significativamente la pérdida en la calidad de vida (en 9 meses). En este sentido, los abandonos por problemas respiratorios fueron menores en el grupo de tratamiento que en el grupo placebo (el 25 frente al 19%), lo que constata la mejoría anteriormente comentada. El cuarto de los estudios citados, el Lung Health Study II19, incluyó un gran número de pacientes (1.116). En ellos (con un FEV1 del 30-90%) la inhalación de triamcinolona a dosis de 600 μg/12 h no mostró mejoría en el declive del FEV1, pero mejoró la hiperrespuesta bronquial y los síntomas respiratorios y disminuyó el uso de cuidados médicos por problemas respiratorios. Estos 4 grandes estudios han puesto de manifiesto que no se altera la disminución del FEV1 por el uso de GI (tabla I), pero se consiguen beneficios adicionales para los pacientes tratados que pueden justificar su uso en determinadas condiciones.
Otra aportación interesante es la de Paggiaro et al23, que en 281 pacientes ambulatorios, de edades comprendidas entre 50 y 75 años y con un FEV1 del 35-90%, tratados con fluticasona a dosis de 500 μg/12 h durante 24 semanas, demostró un incremento del test de marcha de 6 min significativamente mejor que los tratados con placebo. Además, se redujo la gravedad de las exacerbaciones de forma significativa en el grupo tratado frente al grupo placebo.
El análisis de estos trabajos puede proporcionar una visión pesimista (tabla II), al no observarse beneficios con el tratamiento de GI en uno de los parámetros básicos de la evolución de la enfermedad como es el FEV1, pero deben valorarse también los efectos positivos encontrados: reducción de síntomas, disminución de la hiperrespuesta bronquial, reducción de exacerbaciones en número y gravedad, disminución del uso de cuidados médicos, mejoría de la tolerancia al ejercicio y mejoría en la calidad de vida de los pacientes. En resumen, los efectos beneficiosos de la inhalación de GI en la EPOC son muy limitados en comparación con el efecto que consiguen en los pacientes con asma. Los GI causan un modesto incremento del FEV1 pero no lo mantienen y, por tanto, no impiden su descenso progresivo en estos pacientes. Los objetivos secundarios pueden obtenerse al disminuir el número y la gravedad de las exacerbaciones, mayor en los pacientes más graves, y una mejoría de los síntomas respiratorios y generales.
Se han valorado los efectos secundarios de los GI usados a largo plazo. En opinión de algunos autores, el tratamiento no ha demostrado ser nocivo. La controversia más importante es su influencia sobre la densidad mineral ósea y puede llegar a considerarse irrelevante en una población con una limitada expectativa de vida. A la vez, deben considerarse las ventajas del uso de GI, al disminuir el número de tandas de corticoides orales, reducir las exacerbaciones y favorecer la estabilidad clínica. Los efectos secundarios más importantes quedan reflejados en la tabla III. Se señalan como principales efectos secundarios la candidiasis oral, la disfonía, la desmineralización ósea24, la formación de cataratas25 y el glaucoma26 que, en general, se desarrollan en función de la dosis. Por consiguiente, desde la perspectiva de la seguridad sería deseable un tratamiento con dosis reducidas, pero aún se desconoce si éste (< 500 μg/día equivalentes de beclometasona) tiene las mismas ventajas que el tratamiento con dosis moderadas o altas, ya que apenas disponemos de estudios en este sentido.
Importancia de la dosis
Algunos estudios recientes demuestran que la terapia con GI puede beneficiarse de la asociación con betaadrenérgicos de acción prolongada. Así, determinados estudios con budesonida/formoterol han demostrado que estos fármacos forman parte de una terapia eficaz para el tratamiento de la EPOC moderada-grave, ya que reducen las exacerbaciones y procuran mejorías precoces y mantenidas de la función pulmonar y los síntomas, junto con la calidad de vida relacionada con la salud, con un perfil de seguridad similar al placebo27. La asociación de estas 2 terapias, que pueden ser complementarias en sus efectos28, se demuestra también en otros estudios con la asociación salmeterol/fluticasona, que consigue mejorar sustancialmente el flujo respiratorio (FEV1 y flujo espiratorio máximo matutino) y alivia la disnea, con una mejor puntuación en las pertinentes escalas y un menor uso de medicación de rescate29. En este mismo sentido, un importante estudio30 realizado en 1.465 pacientes demuestra que esta misma asociación de fármacos produce un control mejor de los síntomas y de la función pulmonar sin mayor riesgo de efectos secundarios que cuando se usa cualquiera de los fármacos solos. Aunque algunos estudios31 demuestran que es necesario un tratamiento continuado de 3 meses para conseguir una verdadera mejoría en la función pulmonar, se van aportando evidencias de los efectos aditivos de las terapias antiinflamatorias y broncodilatadoras en la EPOC.
Los resultados prometedores del tratamiento con GI han sido contrarrestados por la consideración de los posibles efectos secundarios. Por ello, sería deseable un tratamiento eficaz con la menor dosis posible. Un reciente estudio32, que observó a 3.397 pacientes durante 3 años después del alta hospitalaria, valoró la importancia de la dosis de GI y demostró un beneficio protector de estos fármacos respecto a la mortalidad de los pacientes, cuya supervivencia se extiende hasta los 3 años. Además, el tratamiento con dosis medias y altas se relaciona con una mejora de la supervivencia en comparación con las dosis reducidas o indeterminadas. Los resultados sugieren que cuando se utilizan GI para el tratamiento de la EPOC es preciso que los clínicos consideren la utilización de, al menos, 500 μg/día de beclometasona o su equivalente para obtener los máximos beneficios de supervivencia.
Supervivencia de la EPOC
En el momento actual se encuentra en marcha un amplio estudio, el Towards a Revolution in Copd Health (TORCH), de carácter prospectivo y controlado33, que nos dará la respuesta a la pregunta clave de si los GI son capaces de disminuir la mortalidad de los pacientes con EPOC. Este estudio tardará al menos 5 años en responder a esta cuestión. Sin embargo, hay una evidencia indirecta de que esto podría ser así. El estudio de Sinn34 demostró que los pacientes que recibieron GI a su alta tras una exacerbación tuvieron menos número de ingresos a causa de la EPOC y una menor sensación de extrema gravedad durante un año de seguimiento. En este mismo sentido, otro reciente trabajo35, en el que tras 4 meses de tratamiento con fluticasona se suspendió la medicación a 121 pacientes con EPOC y un FEV1 del 56% de media, frente al grupo de 123 pacientes de las mismas características que continúan con tratamiento, demuestra que hubo una mayor frecuencia de episodios respiratorios graves en el grupo placebo y, por el contrario, no se produjeron exacerbaciones graves en el grupo de tratamiento activo. Además, los pacientes del grupo placebo tuvieron un mayor deterioro de la calidad de vida en cuanto al estado de salud autopercibido.
Algunos estudios que reflejan la vida real, sin pacientes seleccionados y atendidos por sus médicos de familia de una forma similar36, demuestran que el uso regular de fluticasona, sola o en combinación con salmeterol, aumenta la supervivencia de los pacientes con EPOC en el ámbito de la atención primaria. Estos resultados implican un posible efecto farmacológico del tratamiento combinado sobre la progresión de la EPOC igual al descrito por otros autores con respecto a los GI inhalados aislados32.
En conclusión, parece que el uso regular de GI solos o en combinación con betaagonistas mejora la supervivencia de los pacientes con EPOC.