Introducción
La fibrosis pulmonar idiopática (FPI) es la más común de las neumonías intersticiales idiopáticas y, de hecho, la más agresiva de todas las enfermedades pulmonares intersticiales difusas1,2. Tiene una prevalencia estimada de 3 a 20 casos por 100.000 personas, afecta generalmente a mayores de 50 años y es más frecuente en varones y fumadores3,4.
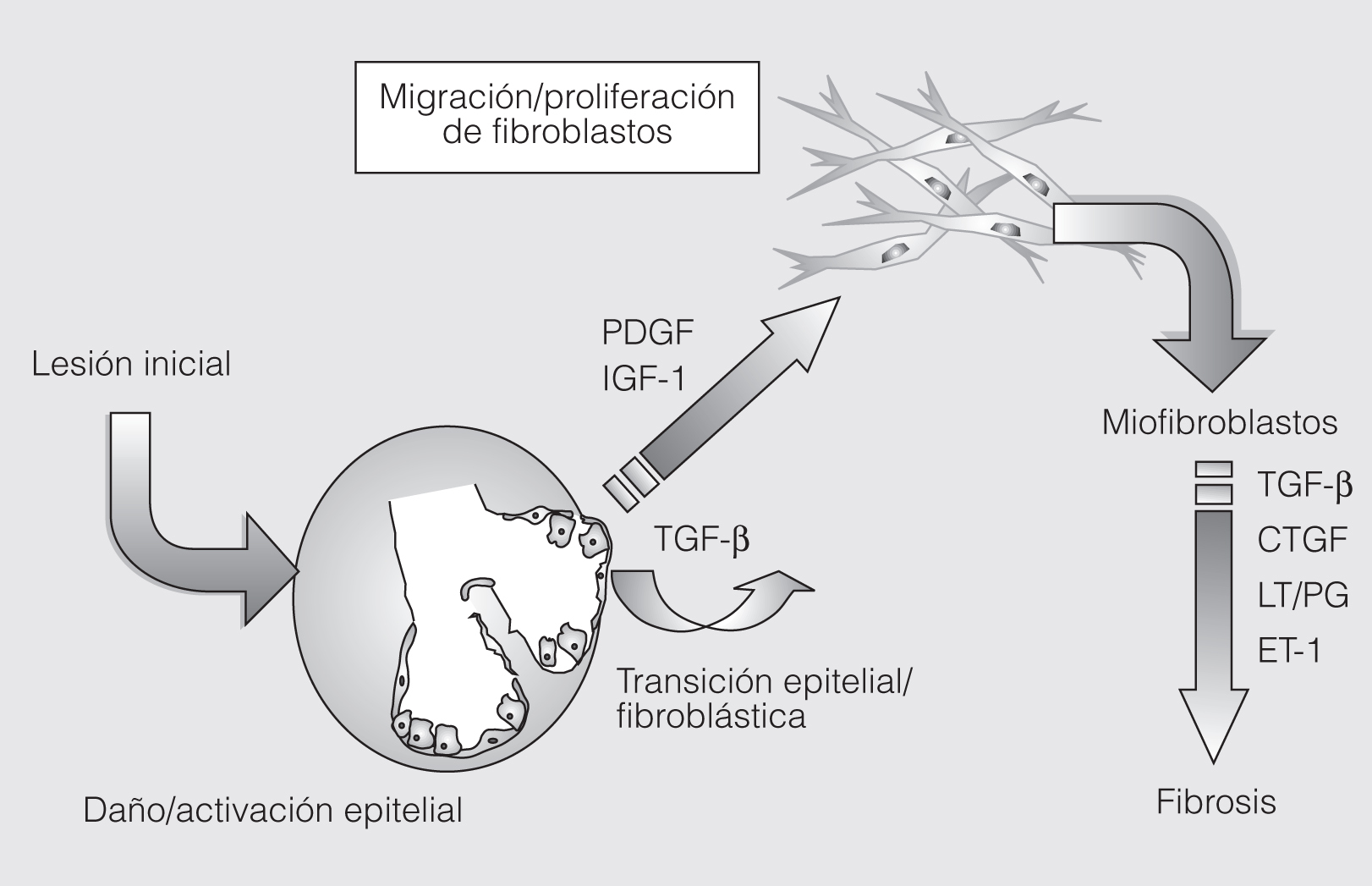
Durante muchos años se consideró que la persistencia de células inflamatorias en el intersticio y los espacios alveolares (alveolitis) era la causa del proceso fibrótico. Sin embargo, el tratamiento diseñado (y utilizado durante los últimos 50 años) para combatir el componente inflamatorio (corticoides, medicamentos inmunodepresores/citotóxicos) no ha mostrado ningún beneficio5. Recientemente, se ha planteado que la inflamación no desempeña un papel importante en la patogenia de la FPI, que es más bien una enfermedad "epitelial-fibroblástica"6,7 (fig. 1). Así, se ha postulado la existencia de al menos 2 vías diferentes para el desarrollo de fibrosis pulmonar: a) la vía inflamatoria, que participa en las enfermedades pulmonares intersticiales difusas asociadas al uso de diferentes medicamentos, exposición a agentes ocupacionales y/o ambientales y enfermedades autoinmunitarias, entre otras. En estos padecimientos se puede identificar claramente una fase inicial de inflamación que puede seguirse de una fase tardía de fibrosis, y b) la vía epitelial/fibroblástica, que participa en la patogenia de la FPI. De acuerdo con este paradigma, la lesión y activación epiteliales pueden orquestar una respuesta fibrótica sin participación de la inflamación.
Fig. 1. Posible secuencia de los mecanismos patogénicos involucrados en la fibrosis pulmonar idiopática. La activación epitelial se traduce en la liberación de múltiples señales profibróticas responsables de la expansión de la población de fibroblastos/miofibroblastos y finalmente del depósito exagerado de matriz extracelular con destrucción de la arquitectura pulmonar.
El pasado y el presente: corticoides e inmunodepresores
El tratamiento tradicional de la FPI ha implicado cursos prolongados con elevadas dosis de corticoides, ya sean solos o en combinación con medicamentos inmunodepresores o citotóxicos. Sin embargo, aunque no hay ensayos terapéuticos prospectivos controlados frente a placebo, varios estudios retrospectivos han demostrado que no existe beneficio con ninguna forma de tratamiento utilizado hasta la fecha. Por ejemplo, en un estudio retrospectivo que incluyó a 487 pacientes con FPI se demostró que los que no recibieron ningún tratamiento presentaron una supervivencia similar (y con menos efectos secundarios) que los que recibieron corticoides u otros medicamentos como la colchicina8. Más aún, en el análisis univariado se observó que el uso de prednisona se asociaba a una mayor mortalidad (odds ratio: 1,5). Asimismo, una revisión reciente de 164 pacientes con FPI (82 tratados con la combinación prednisona y ciclofosfamida y 82 no tratados) demostró que el tratamiento combinado no tuvo ningún efecto en la supervivencia9. Un consenso internacional avalado por las sociedades americana y europea de la especialidad llegó a una conclusión similar2. Sin embargo, en ese mismo informe se estableció (con escaso fundamento científico) que se podía probar el tratamiento con corticoides (0,5 mg/kg/día durante 4 semanas, con disminución gradual) combinados con azatioprina y/o ciclofosfamida durante 3-6 meses y observar la respuesta. Este tratamiento sólo debe prolongarse en pacientes que muestren una respuesta objetiva evaluada por diferentes pruebas funcionales. En todo caso, lo que actualmente no se recomienda en absoluto es el uso de corticoides sin combinarlos con otro medicamento inmunodepresor, preferiblemente la azatioprina. Se han utilizado empíricamente otros fármacos en la FPI, como la colchicina, la D-penicilamina y en ocasiones la ciclosporina A, al parecer sin resultados5.
El presente y el futuro: nuevos enfoques terapéuticos. Ensayos clínicos en curso
Interferón γ1b
El interferón gamma (IFN-γ) es una citocina pleiotrópica con efectos antifibróticos, tales como inhibición de la proliferación de fibroblastos y síntesis de colágeno, los cuales se deben en parte a su capacidad de bloquear el factor transformador de crecimiento beta (TGF-β)10. Asimismo, reduce significativamente la respuesta fibrosante en modelos experimentales de lesión pulmonar11. En un primer estudio realizado en humanos se demostró (en un número muy reducido de enfermos) que la utilización de 200 μg de IFN-Υ1b 3 veces a la semana por vía subcutánea con dosis bajas de prednisolona mejoraba de forma significativa las pruebas funcionales respiratorias después de un año de seguimiento12. Estos antecedentes originaron un importante estudio multicéntrico de fase III que incluyó a 330 enfermos que recibieron IFN-γ1b o placebo. Después de un año de seguimiento no se observaron diferencias ni en la supervivencia ni en la función pulmonar13. Un análisis retrospectivo posterior reveló que el IFN-γ1b al parecer mejoró la supervivencia en los pacientes que presentaban enfermedad moderada --capacidad vital forzada (FVC) ≥ 55%--. A fin de probar este hallazgo de manera prospectiva se ha iniciado un nuevo protocolo diseñado para enfermedad moderada (FVC ≥ 55% y capacidad de difusión del monóxido de carbono > 35%) en el que se espera incluir a más de 600 enfermos con FPI --International Study of Survival Outcomes in IPF with Interferon-γ1b (INSPIRE)--.
Pirfenidona
La pirfenidona (5-metil-1-fenil-2-[1H]-piridina) inhibe la síntesis de colágeno y disminuye la fibrosis pulmonar en varios modelos experimentales14. En un estudio prospectivo pero abierto se trató con este medicamento a 54 pacientes con FPI, 46 de los cuales estaban empeorando con tratamientos convencionales15. Después de 6 meses de seguimiento (pirfenidona: 40 mg/kg/día; dosis máxima de 3.600 mg/día), las pruebas funcionales respiratorias (PFR) se estabilizaron o incluso mejoraron en algunos enfermos, pero los datos son difíciles de interpretar, ya que sólo 41 de ellos tenían PFR repetidas. La supervivencia con pirfenidona fue del 78 y el 63% al año y 2 años, respectivamente. Hace poco se comunicaron los resultados de un nuevo ensayo, doble ciego, con pirfenidona frente a placebo en 107 pacientes con FPI (72 con pirfenidona y 35 con placebo)16. Los pacientes que recibieron pirfenidona mostraron descenso menor de las PFR y una aparente protección contra las exacerbaciones agudas que los asignados a placebo. Sin embargo, este estudio se continuó en forma no cegada a los 9 meses, lo que hace difícil su evaluación. Está previsto iniciar un nuevo estudio de fase III en 2006 (http:// www.intermune.com).
N-acetilcisteína
Diversos estudios han demostrado que en la FPI existe un aumento significativo del estrés oxidativo y que éste contribuye al deterioro del epitelio alveolar. La N-acetilcisteína (NAC) aumenta la síntesis de glutatión, un potente mediador antioxidante tanto in vitro como in vivo, y su administración por vía oral disminuye la respuesta fibrótica en ratones expuestos a bleomicina17,18. En un estudio prospectivo pero abierto, Behr et al19 trataron a 18 pacientes con NAC (600 mg 3 veces al día por vía oral) durante un período de 12 semanas y observaron una mejoría significativa en las PFR. Este efecto beneficioso se asoció con un incremento de las concentraciones de glutatión local y una reducción de la metionina oxidada, un marcador del estrés oxidativo. Recientemente ha finalizado un estudio multicéntrico de fase III que ha evaluado la eficacia de la NAC en una cohorte de pacientes con FPI (IFIGENIA: Idiopathic Pulmonary Fibrosis International Group Exploring NAC I Annual study). Se incluyó a 55 pacientes de 6 países europeos a los que se aleatorizó para recibir 1.800 mg/día de NAC o placebo durante un año, en combinación con prednisona y azatioprina. Después de un año, los pacientes que recibieron NAC mostraron una tasa menor de declive de la función pulmonar --tanto en la FVC, que fue del 9% (p < 0,05), como en la capacidad de difusión del monóxido de carbono, que fue del 24% (p < 0,005)-- en comparación con los que recibieron placebo (http://www.zambongroup.com). La NAC puede contemplarse como un agente coadyuvante en el tratamiento de la FPI.
Inhibidores de tirosincinasa: mesilato de imatinib (Gleevec®)
El mesilato de imatinib es un inhibidor de las proteincinasas que muestra actividad contra la tirosincinasa Bcr-Abl, el receptor del factor de crecimiento derivado de plaquetas y el receptor c-kit de la tirosincinasa20. Este medicamento se usa para el tratamiento de la leucemia mielógena crónica y de tumores gastrointestinales. Lo más interesante es que varias acciones del mesilato de imatinib tienen un fuerte efecto antifibrosante. Por ejemplo, la inhibición de la tirosincinasa c-Abl bloquea varios de los efectos profibróticos del TGF-β, mientras que la inhibición del receptor del factor de crecimiento derivado de plaquetas puede bloquear la migración y proliferación de fibroblastos. Estudios recientes muestran que el mesilato de imatinib protege contra la fibrosis inducida por bleomicina y por radiaciones en ratones y ratas, respectivamente21,22. La experiencia clínica con este medicamento en oncología, así como la evidencia experimental de su eficacia como agente antifibrosante, ha llevado a la iniciación de un ensayo clínico de fase II en pacientes con FPI (http://www.coalitionforpf.org/IPFResearch). Sin embargo, es conveniente señalar que se han comunicado casos aislados de pacientes con neoplasias que recibían mesilato de imatinib y que desarrollaron neumonitis intersticial.
Antagonistas del factor de necrosis tumoral alfa: etanercept (Enbrel®)
El factor de necrosis tumoral alfa (TNF-α) es una citocina multifuncional que parece tener algunas actividades profibróticas. Estudios experimentales han demostrado que la administración del receptor del TNF soluble recombinante atenúa la fibrosis por bleomicina y que ratones deficientes en los receptores del TNF-α prácticamente no desarrollan fibrosis por sílice23,24. El bloqueo del TNF-α se utiliza en enfermedades humanas. Por ejemplo, anticuerpos quiméricos contra el TNF-α o una proteína soluble de fusión contra el receptor --etanercept (Enbrel®), infliximab (Remicade®) y adalimumab (Humira®)-- tienen efectos benéficos en el tratamiento de la artritis reumatoide, enfermedad de Crohn, psoriasis y espondilitis anquilosante activa25. En la FPI existe escasa experiencia. En un estudio preliminar abierto en 9 pacientes con FPI que habían empeorado con el tratamiento convencional, se observó que el uso de etanercept estabilizaba la función pulmonar en un período de 19 meses de seguimiento26. Recientemente ha finalizado un estudio de fase II multicéntrico, prospectivo y doble ciego frente a placebo para evaluar su seguridad y eficacia en pacientes con FPI, cuyos resultados deberían presentarse a la comunidad médica en el curso de este año.
Antagonistas de la endotelina 1: bosentán
La endotelina 1 ha mostrado ser una molécula con fuertes efectos fibrogénicos, como la inducción de proliferación de fibroblastos y su diferenciación a miofibroblastos e incremento de la síntesis de moléculas de matriz extracelular. Se encuentra incrementada en los pulmones de pacientes con FPI, donde la expresan sobre todo las células del epitelio alveolar. Experimentalmente se ha demostrado que la inyección percutánea de un plásmido que expresa endotelina en pulmones de rata induce cambios fibróticos que se localizan específicamente en las regiones donde se expresa este gen27,28. Asimismo, ratones transgénicos que sobrexpresan la pre-proendotelina 1 humana desarrollan fibrosis pulmonar difusa y progresiva sin ninguna agresión gatillante29. Sobre la base de estos hallazgos se ha intentado su bloqueo en modelos experimentales y así se ha demostrado que la administración oral de bosentán, un antagonista no selectivo del receptor de la endotelina 1, protege contra la fibrosis inducida por bleomicina en ratas30.
El bosentán se utiliza actualmente para el tratamiento de la hipertensión arterial pulmonar y es bien tolerado por esta población de pacientes31. En la actualidad un estudio multicéntrico de fase II/III está evaluando su eficacia, seguridad y tolerabilidad en pacientes con FPI (BUILD-1: Bosentan Use in Interstitial Lung Disease; www.actelion.com). Los resultados de este estudio se esperan para principios de 2006.
Equilibrio de leucotrienos y prostaglandinas, y perspectivas terapéuticas
Diversos estudios han planteado que un exceso de leucotrienos o una disminución de algunas prostaglandinas favorece la generación de un microambiente pulmonar profibrótico. Los leucotrienos, derivados de la 5-lipooxigenasa, se encuentran elevados en pulmones con FPI, mientras que la prostaglandina E2, un producto de la ciclooxigenasa, se encuentra significativamente disminuida en fibroblastos de pulmones con FPI32,33. La prostaglandina E2 tiene muchos efectos antifibróticos, entre los que figuran la inhibición de la migración, proliferación y contractibilidad de fibroblastos5. Por otro lado, ratones deficientes en 5-lipooxigenasa no desarrollan fibrosis por bleomicina, lo que indicaría que los leucotrienos desempeñan un papel profibrótico in vivo34. En la actualidad, la Universidad de Michigan desarrolla un ensayo clínico de fase II para analizar la seguridad y eficacia del zileutón, un inhibidor de la 5-lipooxigenasa, en pacientes con FPI. Asimismo, se acaba de iniciar un protocolo terapéutico con iloprost inhalado (ACTIVE: a Clinical Trial in IPF to Improve Ventilation and Exercise; http://www.4ventavis.com, CoTherix, Inc.). Esta prostaciclina es un potente y selectivo vasodilatador pulmonar, por lo que preserva la relación ventilación/perfusión. Es importante señalar además que el iloprost puede mejorar la hipertensión arterial pulmonar secundaria a la fibrosis, lo que teóricamente le agregaría un efecto benéfico adicional.
Antagonistas del factor de crecimiento de tejido conjuntivo
El factor de crecimiento de tejido conjuntivo es una proteína matricelular rica en cisteínas que media parte de los efectos fibrogénicos del TGF-β1. Este factor de crecimiento se encuentra elevado en la FPI y se localiza en células del epitelio alveolar y fibroblastos intersticiales35. Recientemente, el Laboratorio FibroGen Inc. (www. fibrogen.com) ha desarrollado un anticuerpo monoclonal humano que neutraliza la actividad del factor de crecimiento de tejido conjuntivo. Un estudio pequeño de fase I para determinar la seguridad del producto en pacientes con FPI demostró que una perfusión única durante 2 h (1 o 3 mg/kg) no provocó ningún efecto adverso en pacientes con FPI moderada. Actualmente se está iniciando un estudio de fase II.
Antagonistas del factor transformador del crecimiento beta
El TGF-β es el más agresivo mediador profibrosante y en la actualidad se realizan numerosos esfuerzos para desarrollar inhibidores específicos. Existen 3 isoformas del TGF-β, (TGF-β1, TGF-β2 y TGF-β3), de los cuales en especial el primero está fuertemente implicado en la patogenia de la fibrosis de todos los órganos estudiados hasta la fecha, incluida la FPI36,37. El TGF-β1 induce la diferenciación de fibroblastos a miofibroblastos, la transición de células epiteliales a fibroblastos y la síntesis de moléculas de matriz extracelular, además de favorecer la apoptosis de células del epitelio alveolar. Diversos estudios experimentales han demostrado que el bloqueo de este factor tiene un efecto protector en el desarrollo de la fibrosis. Por ejemplo, la administración de un receptor soluble quimérico con alta afinidad por el TGF-β1, pero incapaz de iniciar los eventos de señalización intracelular, reduce significativamente la fibrosis pulmonar en hámsters, aún cuando se administre después de varias agresiones con bleomicina38. Estos hallazgos experimentales han llevado al desarrollo de numerosas estrategias que intentan inhibir su acción en humanos.
Anticuerpos monoclonales anti-TGF-β. Se han utilizado en la esclerodermia (http://www.genzyme.com) y en la fibrosis postrabeculectomía39. Resultados preliminares del proyecto en esclerodermia (International Scleroderma Workshop, Cambridge, Reino Unido, 2004) mostraron que el anticuerpo es seguro y bien tolerado, aunque no se pudo concluir si realmente ejercía (sobre la fibrosis cutánea) un efecto objetivamente benéfico. En el caso de los pacientes con cirugía por glaucoma se utilizó el anticuerpo anti-TGF-β2 (lerdelimumab) para prevenir la cicatriz posquirúrgica, con resultados alentadores39. Recientemente, se ha aprobado un ensayo clínico de fase I con un anticuerpo monoclonal humano anti-TGF-β (GC-1008) en pacientes con FPI (Cambridge Antibody Technology y Genzyme; http://www.coalitionforpf.org/IPFResearch).
Inhibidores de los receptores y proteincinasas asociadas al TGF-β. El complejo funcional de los receptores del TGF-β está formado por 2 receptores transmembranales de serina/treonina tipo II y 2 de tipo I. Actualmente, se están desarrollando varios inhibidores de proteincinasas contra el receptor I del TGF-β (TβRI, también conocido como ALK5) tanto para el cáncer como para las enfermedades fibrosantes, y se encuentran en estudio ensayos preclínicos para evaluar su seguridad y eficacia40. Recientemente Bonnieaud et al41 han estudiado el efecto de un potente y selectivo inhibidor de la actividad cinasa del ALK5 (SD-208) en un modelo experimental de fibrosis pulmonar en ratas provocado por la transferencia del gen de la forma activa del TGF-β1. Mediante el uso de diversas técnicas histológicas, bioquímicas y de expresión global de genes (micromatrices de ARN complementario) los autores demostraron que la inhibición de la actividad de ALK5 bloquea tanto la respuesta fibrogénica temprana como la progresión de la fibrosis cuando ya está establecida. El tratamiento con SD-208 inhibió significativamente la expresión de todos los mediadores fibrogénicos estimulados por el TGF-β1, como los de matriz extracelular, diversos factores de crecimiento e inhibidores de metaloproteinasas de matriz. Estos resultados apuntan a un posible papel terapéutico de este tipo de inhibidores en la fibrosis pulmonar.
Finalmente, las vías de señalización estimuladas por el TGF-β pueden inhibirse a través de un enfoque epigenético, usando oligonucleótidos antisentido dirigidos contra las Smad que promueven las señales del TGF-β en el interior de las células o incluso contra alguna de las isoformas del TGF-β, o bien provocando la sobreexpresión de las Smad inhibitorias. No existe experiencia en pacientes con enfermedades fibrosantes, pero recientemente ha concluido un estudio de fase IIb con un oligonucleótido antisentido al TGF-β3 (AP12009) en pacientes con glioblastoma y astrocitoma anaplástico (http://www.antisense-pharma.com), aunque sus resultados aún no se han publicado.
El futuro: nuevas estrategias
Nuevos inhibidores de la producción de matriz extracelular. El caso de la relaxina
La relaxina, una hormona relacionada con el embarazo, disminuye la expresión tanto de los colágenos fibrilares como de la fibronectina e incrementa la de la co-lagenasa 1. Estas actividades antifibrogénicas se han corroborado in vivo en varios modelos experimentales de fibrosis pulmonar42. Resulta interesante un estudio aleatorizado y doble ciego controlado con placebo que se realizó en pacientes con esclerodermia grave43. Se administraron relaxina humana recombinante (25 o 100 μg/kg) o l placebo por perfusión subcutánea continua durante 6 meses. A las 4, 12 y 24 semanas el grupo que recibió la dosis menor mostró una reducción significativa de las lesiones cutáneas. Sorprendentemente, el grupo que recibió la dosis mayor no mostró diferencias respecto al grupo placebo. Los efectos secundarios más comunes fueron menometrorragia, anemia reversible y reacciones cutáneas locales. Desafortunadamente, el seguimiento posterior no corroboró estos hallazgos y Connetics Corporation interrumpió el ensayo de fase III en el año 2000.
Tratar las células del epitelio alveolar
Está ampliamente documentado en diversas enfermedades humanas, incluidas las pulmonares, que la incapacidad para regenerar los epitelios dañados promueve la fibrosis. En este contexto, es posible hipotetizar que la administración de mitógenos de células epiteliales o células progenitoras capaces de diferenciarse en células epiteliales alveolares puede tener un efecto beneficioso en el tratamiento de la fibrosis.
Agentes que promueven la proliferación epitelial. El mediador más prometedor es el factor de crecimiento de hepatocitos (HGF), un ligando del receptor de la tirosincinasa c-Met, que protege del desarrollo de fibrosis en varios órganos incluso si se usa días o semanas después de la agresión experimental. Se han realizado 2 interesantes estudios en fibrosis pulmonar experimental. En el primero de ellos, Yaekashiwa et al44 provocaron la fibrosis en ratones mediante la perfusión continua de bleomicina durante 7 días. La administración simultánea o posterior de HGF redujo significativamente la respuesta fibrótica, lo que indica que este mediador (que también reduje la apoptosis epitelial) puede ser útil para prevenir o incluso tratar la fibrosis pulmonar. En otro experimento, la administración del recombinante humano del HGF 3 y 6 días después de la administración intratraqueal de bleomicina disminuyó la acumulación de colágeno intersticial y la extensión de la fibrosis45.
En cuanto al tratamiento génico antifibrosante con HGF, se ha explorado en fibrosis hepática y fibrosis renal. En un modelo de cirrosis hepática letal inducida con dimetilnitrosamina en ratas, las transfecciones repetidas del gen del HGF humano en el músculo esquelético inhibieron el aumento del TGF-β1 y de miofibroblastos, redujeron la muerte celular por apoptosis de los hepatocitos y dieron lugar a la completa resolución de la fibrosis46. El tratamiento con el gen del HGF fue efectivo incluso cuando se inició 4 semanas después de la agresión inicial, cuando la fibrosis ya se había desarrollado. Se han comunicado resultados similares en un modelo de fibrosis renal crónica inducida por la obstrucción ureteral unilateral en ratones, en los que la administración sistémica de un plásmido que codificaba para el HGF dio lugar a una notable reducción de la fibrosis renal47.
Células troncales y su posible papel en la regeneración del epitelio alveolar. Evidencias recientes indican que las células troncales adultas pueden diferenciarse in vitro e in vivo en distintas estirpes celulares, incluidas las epiteliales, y que esto puede ocurrir en el pulmón in vivo48. Por ejemplo, Suratt et al49 investigaron la presencia de células masculinas en el pulmón de mujeres que habían recibido trasplantes de células troncales hematopoyéticas de donadores masculinos. Los autores encontraron numerosas células quiméricas epiteliales (2,5-8,0%) y endoteliales (37,5-42,3%) en los pulmones de las mujeres receptoras. Recientemente, en un elegante experimento conducido por Ortiz et al50, se demostró que células troncales de ratones Balb/c resistentes a la bleomicina administradas a ratones C57BL/6 sensibles a bleomicina fueron capaces de alcanzar el pulmón, diferenciarse a células de tipo epitelio alveolar y protegieron a los ratones susceptibles del desarrollo de inflamación y fibrosis pulmonar.
Sin embargo, el uso terapéutico de células troncales adultas tiene múltiples desafíos que vencer; entre otros, el rechazo inmunológico, el desconocimiento del número óptimo de células madre que deben trasplantarse (el injerto local puede ser escaso) y la elucidación de los mecanismos de movilización, entrada al órgano diana y diferenciación de las células troncales en las células deseables (p. ej., epiteliales). En este contexto, algunos experimentos han demostrado que las células troncales adultas pueden llegar al pulmón después de una lesión, diferenciarse en fibroblastos y contribuir a la fibrosis51.
Lo que teóricamente podría superar muchos de estos problemas sería la llamada clonación terapéutica. En este contexto, recientemente se han desarrollado líneas de células troncales embrionarias, específicas de paciente e inmunoidénticas, por transferencia nuclear de células cutáneas de pacientes en oocitos donados52. Estas líneas son pluripotentes y cromosómicamente normales, se unen al ADN de los pacientes y podrían permitir la clonación terapéutica.
¿Qué hacer hoy con un paciente con fibrosis pulmonar idiopática?
Si el paciente cumple con los requisitos para participar en cualquiera de los ensayos clínicos experimentales en curso, debe inscribirse en uno de ellos y, simultáneamente, entrar en la lista de espera para trasplante pulmonar. Si las condiciones generales o funcionales del enfermo lo impiden, el tratamiento debe ser conservador y puede incluir corticoides y broncodilatadores inhalados, NAC, colchicina, oxígeno y rehabilitación pulmonar.
Correspondencia: Dr. M. Selman.
Instituto Nacional de Enfermedades Respiratorias.
Tlalpan, 4.502; Col. Sección XVI.
14080 México DF. México.
Correo electrónico: moiselman@salud.gob.mx