Aunque el número de trasplantes pulmonares en España es cada año mayor, es necesario aumentar el número de órganos disponibles para aliviar las listas de espera. Los donantes en asistolia controlada (DAC) (Maastricht III) son una realidad a nivel internacional y contribuyen significativamente a aumentar el número de donantes. En este trabajo presentamos nuestro protocolo de DAC y la experiencia inicial en España usando injertos pulmonares provenientes de este tipo de donantes. Desde enero 2012 a diciembre 2014, se han realizado 3 trasplantes pulmonares bilaterales. De ellos, en 2 casos se realizó preservación ex vivo y en el otro preservación tradicional en frío. Ninguno de los pacientes desarrolló disfunción primaria del injerto grado 3, no se registró mortalidad hospitalaria y la supervivencia al primer año fue del 100%. Estos resultados iniciales, y la experiencia internacional, deberían contribuir al desarrollo de protocolos similares para fomentar el aprovechamiento de los DAC.
Although the number of lung transplants in Spain is increasing annually, more organs are required to ease waiting lists. Controlled non-heart beating donors (NHBD) (Maastricht III) are a reality at international level, and contribute significantly to increasing donor numbers. In this study, we present our NHBD protocol and the initial experience in Spain using lung grafts from this type of donor. Three bilateral lung transplants were performed between January 2012 and December 2014. Preservation was by ex-vivo lung perfusion in 2 cases and by traditional cold ischemia in the other. None of the patients developed grade 3 primary graft dysfunction, no in-hospital mortality was recorded and 1-year survival was 100%. These initial results, and international experience, should help to develop similar protocols to encourage the use of controlled non-heart beating donors.
La escasez de donantes es un problema que afecta a las listas de espera de todos los grupos de trasplante pulmonar, por lo que es fundamental explorar todas las fuentes de potenciales donantes, como son los donantes con criterios extendidos (donantes en asistolia controlada [DAC] y no controlada, de edad avanzada, y otros), donantes vivos y técnicas de perfusión ex vivo.
Hardy et al. realizaron el primer trasplante pulmonar en 1963 a partir de un órgano de un donante en asistolia1. A finales de los noventa, Egan et al. reabrieron el interés por la donación pulmonar en asistolia2, y Love et al.3 llevaron a cabo el primer trasplante pulmonar con éxito procedente de un DAC. A partir de ahí, este tipo de donantes se ha convertido en una fuente adicional y fiable de órganos en muchos países, contribuyendo a aumentar significativamente el número de trasplantes con excelentes resultados4–6.
Los donantes en asistolia no controlada son actualmente una realidad en nuestro medio, contribuyendo al incremento del número de trasplantes pulmonares realizados7,8. Aprovechando esta experiencia, y con el respaldo de los trabajos publicados por otros grupos, nuestro centro ha puesto en marcha un protocolo similar con el objetivo de aprovechar los injertos de los DAC y así incrementar el número de trasplantes pulmonares.
Observación clínicaA continuación se resume el protocolo de DAC en nuestro centro. Tras la aceptación por parte de la familia de la limitación de las técnicas de soporte vital (LTSV) sobre un paciente, se plantea la donación de órganos. En caso afirmativo, el paciente es evaluado como potencial donante en función de los mismos criterios que usamos para la donación en muerte encefálica9.
Una vez considerados todos los parámetros se administra un bolus de 1.000UI/kg de heparina y se procede a LTSV habitualmente en quirófano.
Nuestro centro acepta 2h de tiempo máximo entre la LTSV y la parada cardiaca (fase agónica). Si en ese tiempo no se produce la asistolia, el paciente vuelve a la UCI. El tiempo de isquemia caliente (TIC) se define como el tiempo entre que la presión arterial media (PAM) desciende de 60mmHg y la perfusión fría de solución de preservación a través de la arteria pulmonar. Este tiempo ha de ser de 60min como máximo para considerar los injertos como válidos.
Tras la asistolia y 5min de observación del paciente, el médico responsable de la LTSV certifica la muerte. Se reintuba al paciente, y se comprueba mediante fibrobroncoscopio que no se ha producido broncoaspiración durante la fase agónica. Mientras, se realiza una esternotomía media, se canula la arteria pulmonar para comenzar con la perfusión con una solución de dextrano pobre en potasio (Perfadex®) y se inspeccionan los injertos procediendo de idéntico modo que en una extracción estándar.
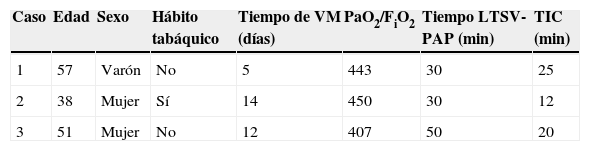
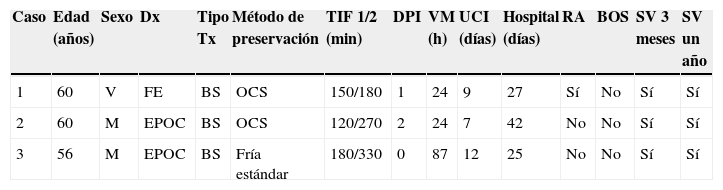
En cuanto a los resultados, entre enero 2012 y diciembre 2014, se han evaluado 26 pacientes como posibles donantes tras la aceptación de LTSV por parte de la familia. De ellos, 23 fueron donantes, de los que únicamente 3 cumplían los criterios para donación pulmonar. Los resultados de estos trasplantes se detallan en las tablas 1 y 2.
Características de los donantes
| Caso | Edad | Sexo | Hábito tabáquico | Tiempo de VM (días) | PaO2/FiO2 | Tiempo LTSV-PAP (min) | TIC (min) |
|---|---|---|---|---|---|---|---|
| 1 | 57 | Varón | No | 5 | 443 | 30 | 25 |
| 2 | 38 | Mujer | Sí | 14 | 450 | 30 | 12 |
| 3 | 51 | Mujer | No | 12 | 407 | 50 | 20 |
TIC: tiempo de isquemia caliente; Tiempo LTSV-PAP: tiempo transcurrido entre la retirada de las medidas de soporte vital y la perfusión de la solución de preservación a través de la arteria pulmonar; VM: ventilación mecánica.
Características de los receptores, tipo de trasplante y evolución postoperatoria
| Caso | Edad (años) | Sexo | Dx | Tipo Tx | Método de preservación | TIF 1/2 (min) | DPI | VM (h) | UCI (días) | Hospital (días) | RA | BOS | SV 3 meses | SV un año |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 60 | V | FE | BS | OCS | 150/180 | 1 | 24 | 9 | 27 | Sí | No | Sí | Sí |
| 2 | 60 | M | EPOC | BS | OCS | 120/270 | 2 | 24 | 7 | 42 | No | No | Sí | Sí |
| 3 | 56 | M | EPOC | BS | Fría estándar | 180/330 | 0 | 87 | 12 | 25 | No | No | Sí | Sí |
BS: bilateral secuencial; BOS: bronquiolitis obliterante; Dx: diagnóstico; FE: fibroenfisema; M: mujer; OCS: Organ Care System; RA: rechazo agudo; SV: supervivencia; TIF 1/2: tiempo de isquemia fría del primer injerto/segundo injerto; Tx: trasplante; V: varón; VM: ventilación mecánica.
Ninguno de los pacientes desarrolló una disfunción primaria del injerto (DPI) grado 3 o severa. Por otro lado, no hubo ningún caso de mortalidad a los 30 días ni hospitalaria, y la supervivencia a los 3 meses y un año fue del 100%.
DiscusiónA nivel internacional, los DAC han supuesto un importante incremento en el número de donantes consiguiéndose resultados equiparables a los trasplantes con donantes en muerte encefálica6 en cuanto a DPI y a supervivencia. En nuestro caso, los 3 trasplantes realizados con este tipo de donantes no difieren de la línea que dibujan otros grupos con más experiencia.
En cuanto a la preservación, los 2 primeros donantes fueron reevaluados con el sistema de perfusión ex vivo Organ Care System (OCS® Lung, TransMedics, Inc.). Los injertos se mantuvieron con parámetros funcionales y de oxigenación óptimos, consiguiéndose además tiempos de isquemia fría cortos, puesto que el sistema permite la preservación en normotermia de los órganos. El tercer caso cumplía escrupulosamente todos los criterios de validez, por lo que la preservación fue convencional en frío.
Un tema controvertido en cuanto al uso de DAC es la heparinización del donante previa a la LTSV. Nuestro grupo prefiere la administración de heparina antes de la LTSV debido al riesgo de un tromboembolismo pulmonar, aunque sea en forma de microtrombos10. Sin embargo, otros administran la heparina tras la parada cardiaca con excelentes resultados4.
En conclusión, en este trabajo se detallan los 3 primeros casos realizados a nivel nacional con muy buenos resultados. Esta experiencia, sumada a la ya extensa experiencia internacional, debería servir para implementar el desarrollo de protocolos para DAC en las unidades de cuidados intensivos del país, fomentando la donación pulmonar.
Agradecemos el esfuerzo y la dedicación a todos los integrantes del equipo de trasplante pulmonar (cirujanos, neumólogos, anestesistas, enfermería y auxiliares), así como a la Coordinación de Trasplantes y Unidad de Cuidados Intensivos del Hospital Universitario Puerta de Hierro-Majadahonda.
Andrés Varela de Ugarte (Servicio de Cirugía Torácica)
Piedad Ussetti (Servicio de Neumología)
Mar Córdoba Peláez (Servicio de Cirugía Torácica)
David Gómez de Antonio (Servicio de Cirugía Torácica)
José Manuel Naranjo Gómez (Servicio de Cirugía Torácica)
José Luis Campo-Cañaveral de la Cruz (Servicio de Cirugía Torácica)
Silvana Crowley Carrasco (Servicio de Cirugía Torácica)
Lucas Hoyos Mejía (Servicio de Cirugía Torácica)
Daniel Valdivia Concha (Servicio de Cirugía Torácica)
Lidia Macías Sotuela (Servicio de Cirugía Torácica)
Francisco Javier Moradiellos Díez (Servicio de Cirugía Torácica)
Juan José Rubio Muñoz (Coordinación de Trasplantes)
Christian García Fadul (Servicio de Neumología)
Rosalía Laporta Hernández (Servicio de Neumología)
Miriam Aguilar Pérez (Servicio de Neumología)
Cristina García-Gallo (Servicio de Neumología)
Ana Isabel González Román (Servicio de Anestesiología y Reanimación)
Pelayo de Merlo Martínez (Servicio de Anestesiología y Reanimación)
María Reyes Iranzo Valero (Servicio de Anestesiología y Reanimación)