Los estudios de anatomía patológica (AP) del pulmón en pacientes que fallecen por COVID-19 nos han permitido entender el daño pulmonar producido por el virus SARS-CoV-21,2. En el contexto de la pandemia COVID-19, la realización de una autopsia tiene varias limitaciones. La Sociedad Española de Anatomía Patológica (SEAP) recomendaba no realizar autopsias por el riesgo biológico de contagio para los ejecutores de esta y por el riesgo de propagación del virus3. Solo se recomendaba realizarlas en centros con salas con nivel de seguridad BSL-3, equipadas con cabinas de seguridad biológica tipo II y filtros HEPA, poco comunes en España3. Ante estas limitaciones, la SEAP propuso la obtención de muestras post mortem de pacientes como una alternativa a la autopsia en los centros en que no se reuniese las condiciones de bioseguridad4. En una reciente revisión sistemática de estudios histológicos del pulmón publicados en infección por COVID-19, 33 de 171 (19%) pacientes incluyeron biopsias pulmonares obtenidas post mortem5. Ninguno de los estudios publicados fue realizado en hospitales de España.
En nuestro centro redactamos un protocolo para la obtención de biopsias pulmonares percutáneas en el post mortem inmediato que fue aprobado por el comité ético de investigación médica (número protocolo: HCB/2020/0487). Se obtuvo consentimiento de los familiares de los pacientes en todos los casos incluidos. En caso de tratarse de un paciente con diagnóstico de COVID-19, se ponían en contacto de forma inmediata con el equipo de cirugía torácica para la obtención de muestras mediante biopsia por aguja gruesa (BAG). Durante el periodo de estudio entre el 4 y el 27 de mayo/2020 se realizaron biopsias a un total de 13 pacientes. Las características clínicas de los pacientes y los tratamientos recibidos están descritos en la tabla 1.
Características generales de los 13 pacientes estudiados, n (%)/mediana (percentiles: 25-75)
| Sexo | |
| Mujer, n (%) | 4 (31) |
| Varón, n (%) | 9 (69) |
| Edad media | 78 (68-83) |
| Enfermedades previas | |
| Enfermedades respiratorias?a, n (%) | 2 (15) |
| Hipertensión arterial, n (%) | 7 (54) |
| Diabetes mellitus, n (%) | 4 (31) |
| Enfermedad cardiovascular, n (%) | 3 (23) |
| Terapia recibida | |
| Hidroxicloroquina/azitromicina, n (%) | 11 (84) |
| Lopinavir/ritonavir, n (%) | 9 (69) |
| Tocilizumab, n (%) | 5 (38) |
| Anakinra, n (%) | 6 (46) |
| Corticoides, n (%) | 11 (85) |
| Antibióticos, n (%) | 10 (77) |
| Ingreso en unidad de cuidados intensivos | 9 (62) |
| Intubación orotraqueal+ventilación mecánica | 4 (31) |
| Ventilación mecánica no invasiva | 4 (31) |
| Oxigenoterapia de alto flujo | 4 (31) |
| Días de ingreso hospitalario | 30 (5-44) |
Las biopsias se realizaron con equipos de protección individual completos mediante la utilización de agujas manuales (Tru-Cut® Biopsy Device 14G×15cm) o semiautomáticas (Bard® MissionTM Disposable Core BiopsyInstrument 14G×16cm). La toma de muestras se realizó mediante referencias anatómicas, estableciéndose 3 áreas de punción por cada hemitórax: anterior, lateral y posterior. Se puncionó cada área tantas veces como se considerase oportuno para obtener un cilindro de tejido pulmonar. Las muestras obtenidas se introdujeron de forma inmediata en cápsulas de seguridad precargadas con formalina (SafeCapsule SC021 y SC022 de DiaPath) para realizarse el análisis anatomopatológico diferido. Las muestras se procesaron tras fijación 24h en formol y se incluyeron en bloques de parafina, siguiendo el procedimiento habitual. Además de hematoxilina-eosina, en cada caso se realizaron tinciones de tricrómico de Masson para evaluar la fibrosis intersticial, tinción de Perls para evidenciar los depósitos de hemosiderina y tinción de plata metenamina para identificar hongos. Se realizó tinción inmunohistoquímica para actina de músculo liso para identificar los miofibroblastos.
La tabla 2 muestra los resultados de las biopsias. De forma global, se obtuvo en un 73% (57 de 78 punciones) muestras de tejido pulmonar. No se identificaron contagios por SARS-CoV-2 debido al procedimiento. El patrón histológico más frecuente fue el daño alveolar difuso (DAD) (n=9; 75%). En 2 pacientes se objetivo un DAD exudativo y en 8 un DAD en fase proliferativa (66,7%). En 3 pacientes los cambios de DAD se asociaban también con focos de neumonía organizada fibrinosa aguda (AFOP) y en 2 pacientes se asociaban con focos de neumonía organizada. Los cambios de neumonía organizada se encontraban en 3 pacientes, dos de ellos con DAD, y otro asociado a hemorragia alveolar. En la gran mayoría de las muestras se observó ensanchamiento celular intersticial moderado o grave (n=7; 58,3%). En todos estos casos se observó la presencia de miofibroblastos en intersticio. En 6 casos se observó fibrina intraalveolar (50%). Por otro lado, la BAG sirvió para incluir otros diagnósticos adicionales (tabla 2): hemorragia pulmonar (n=3), fibrosis pulmonar relacionada con el tabaco (n=1), infección por Pneumocystis jirovecii (n=1), linfangitis carcinomatosa (n=1). No se observaron microtrombos vasculares en las muestras analizadas. Se incluyen como material suplementario los casos más significativos de las muestras con hallazgos radiológicos e histológicos representativos (figs. 1S-5S).
Características de los hallazgos patológicos
| Caso | Neumonía organizada | Ensanchamiento celular intersticial | Miofibroblastos en intersticio (actina) | Membranas hialinas | Fibrina intraalveolar | Inflamación | Reactividad neumocitos | Cambios citopáticos | Hemosiderófagos | Microtrombos vasculares | Diagnóstico histológico | Otros |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | No | Moderado | Sí | No | Sí | PMN focal | Sí | Sí | Focal | No evidentes | AFOP/DAD-p | |
| 2 | Sí (focal) | Moderado/grave | Sí | No | No | No | Sí | No | No | No evidentes | Neumonía organizada focal/DAD-p | |
| 3 | No | Moderado | Sí | No | Sí | PMN focal | Sí | Sí | No | No evidentes | AFOP/DAD-p | |
| 4 | No | Moderado | Sí | No | Sí | No | Sí | Sí | Sí | No evidentes | AFOP/DAD-p | Enfisema+SRIF+hemorragia |
| 5 | Sí | Leve | No | No | No | No | No | No | Sí | No evidentes | Neumonía organizada | Hemorragia |
| 6 | No | Muy leve | Muy escasos | No | No | No | No | No | No | No evidentes | Cambios intersticiales mínimos | |
| 7 | No | No | No | No | No | No | No | No | No | No evidentes | Linfangitis carcinomatosa con cambios mínimos en el parénquima | |
| 8 | No | Grave | Sí | No | No | Crónica | Sí | Sí | No | No evidentes | DAD-p | |
| 9 | No | Leve (focal) | Si (focal) | Sí | Focal | PMN | Sí | Sí | No | No evidentes | DAD-ex con focos de DAD-p y neumonía | |
| 10 | No | Grave | Sí | No | Sí | Crónica | Sí | No | No | No evidentes | DAD-p. Infección por Pneumocystis | Enfisema |
| 11 | Focal | Leve | Muy escasos | No | Sí (focal) | PMN focal | Focal | No | No | No evidentes | Cambios mínimos y focal AFOP | |
| 12 | Sí | Leve | Escasos | Sí | No | Crónica focal | No | No | No | No evidentes | Neumonía organizada con DAD-ex | |
| 13 | No | Grave | Sí | No | Focal | PMN focal | Sí | Sí | No | No evidentes | DAD-p |
AFOP: acute fibrinous and organizing pneumonia (neumonía organizada fibrinosa aguda); DAD: daño alveolar difuso; DAD-ex: fase exudativa; DAD-p: fase proliferativa; SRIF: smoking-related interstitial fibrosis (fibrosis pulmonar relacionada con el tabaco).
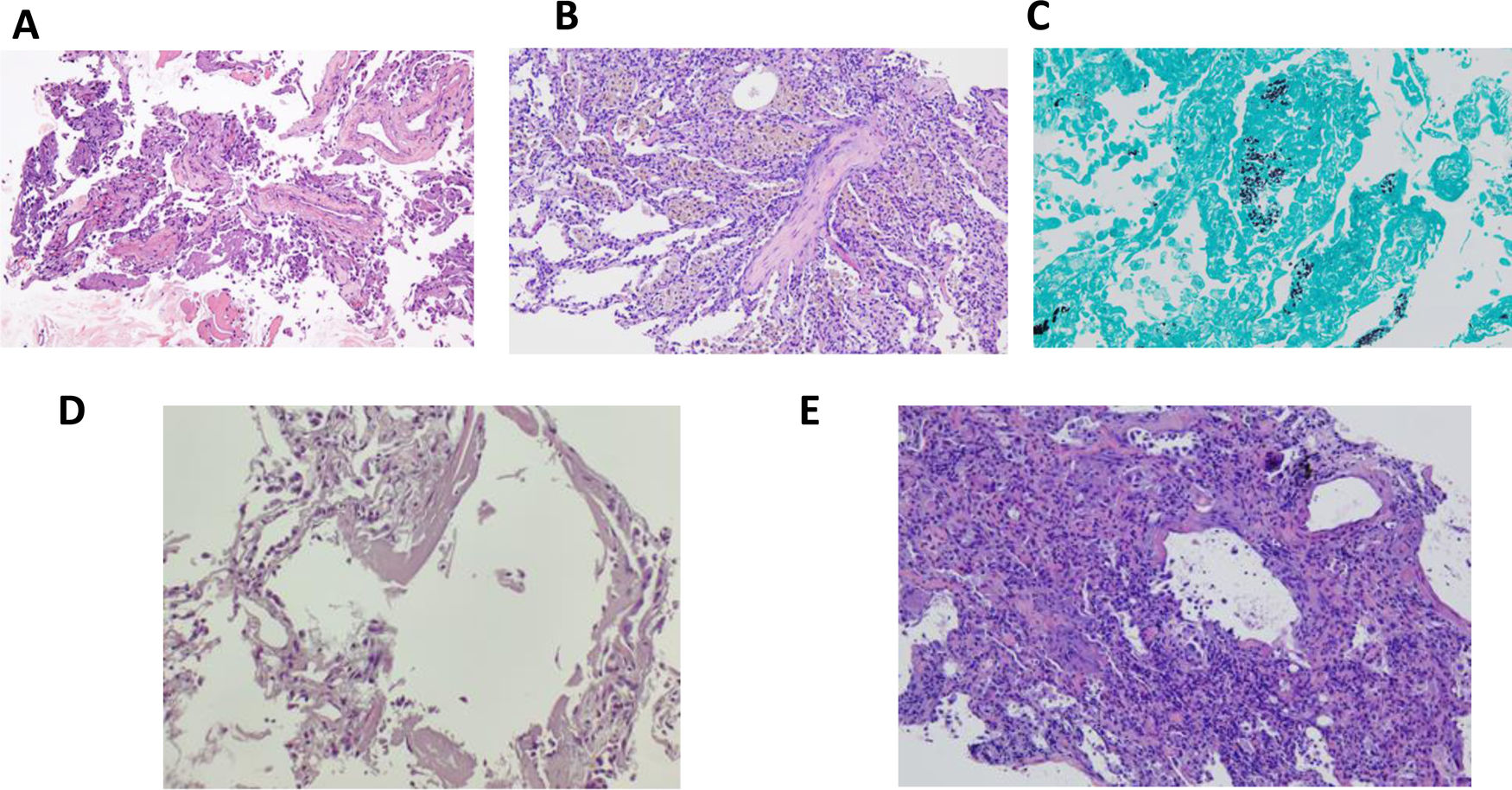
Paciente 4: A) AFOP. Presencia de fibrina en alveolos (H&E, ×200). Paciente 5: B) Neumonía organizada con seudo-pólipo de tejido conectivo en el centro, y la presencia de macrófagos pigmentados en los alveolos adyacentes, correspondientes a hemosiderófagos. Ausencia de reactividad en los neumocitos (H&E, ×100). Paciente 9: C) Presencia de microorganismos con morfología de Pneumocystis jirovecii (tinción de plata metenamina, ×100). Paciente 12: D) Presencia de membranas hialinas en las luces alveolares (H&E, ×100). Paciente 13: E) Se observa daño alveolar difuso en fase proliferativa con engrosamiento intersticial y reactividad neumocitaria (H&E, ×100).
Este estudio presenta datos de biopsias pulmonares percutáneas por neumonía COVID-19 publicado por primera vez en nuestro país, demostrándose que es una técnica segura y eficaz, como alternativa a la autopsia en aquellos casos que no se pueda realizar. Respecto a los hallazgos histológicos, se confirma que los hallazgos más frecuentes son el daño alveolar difuso en cualquier de sus fases evolutivas, junto con la aparición de patrones de neumonía organizada y AFOP, tal como se ha descrito previamente5. La biopsia pulmonar además sirvió para confirmar otras complicaciones clínico-radiológicas concomitantes con la infección por SARS-CoV-2.
Este estudio presenta el mayor número de pacientes de las series de biopsias post mortem publicadas. Sin embargo, tiene una serie de limitaciones. Primero, se ha incluido un número limitado de pacientes y de un único centro hospitalario. Segundo, a diferencia de la técnica de elección que es la autopsia, las muestras obtenidas del pulmón solo reflejan una pequeña área del pulmón, a diferencia de la información que puede obtenerse en una autopsia. Sin embargo, los hallazgos obtenidos son muy similares a los resultados obtenidos en las autopsias publicadas, lo que refuerza la fiabilidad de dicha técnica5.
En conclusión, la biopsia pulmonar post mortem mediante BAG es una medida eficaz y segura para el estudio histológico de la neumonía por COVID-19. En el contexto de una coordinación óptima de un equipo multidisciplinar, puede ser una alternativa en los casos en que se requiera muestras de tejido pulmonar y no se pueda realizar una autopsia.
FinanciaciónEste trabajo ha sido financiado con la subvención SLT008/18/00176 y el apoyo del Departamento de Salud de la Generalitat de Catalunya, en la convocatoria de ayudas 2019-2021, en régimen competitivo, para la financiación de diferentes programas y acciones instrumentales incluido en el Plan Estratégico de Investigación e Innovación en Salud 2016-2020. También ha sido financiado por Fondos FEDER (PI19/01152), SEPAR, SOCAP, FUCAP e Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS). Este trabajo ha sido financiado con fondos de mecenazgo ad hoc para la investigación del COVID-19, procedentes de donaciones de ciudadanos y organizaciones al Hospital Clinic de Barcelona-Fundació Clinic per a la recerca Biomedica (DN040703).
Conflicto de interesesLos autores no presentan ningún conflicto de intereses con el presente estudio.
Los autores quieren agradecer a los respectivos profesionales sanitarios que han participado en el estudio y en atender a los pacientes que han ingresado por COVID-19.