El seguimiento del paciente con EPOC debe efectuarse de manera coordinada entre los diferentes niveles asistenciales.
Primera valoración en el primer nivel asistencial- 1.
Historia clínica con especial atención al tabaquismo, los antecedentes de asma o atopia, antecedentes de tos y expectoración crónica, la frecuencia de agudizaciones, las posibles comorbilidades y tratamientos concomitantes.
- 2.
Evaluación del grado de disnea mediante la escala modificada del Medical Research Council (mMRC).
- 3.
Espirometría con prueba broncodilatadora para establecer el diagnóstico definitivo de EPOC, valorar la gravedad de la obstrucción y la posibilidad de un diagnóstico de ACO. Calcular el índice de masa corporal (IMC) con el peso y la talla.
- 4.
En caso confirmado de EPOC, realizar radiografía de tórax para descartar complicaciones y valorar posible fenotipo enfisema.
- 5.
Analítica sanguínea básica con especial atención a la leucocitosis y fibrinógeno (marcadores de inflamación)1, poliglobulia, eosinofilia (marcador de ACO) y determinación de alfa-1 antitripsina.
- 6.
Evaluación de la calidad de vida y del grado de control con el cuestionario COPD Assessment Test (CAT)2.
- 7.
Con los datos obtenidos, identificar el nivel de riesgo y, si es posible, el fenotipo clínico y calcular el índice BODE3 o BODEx4 para obtener el pronóstico.
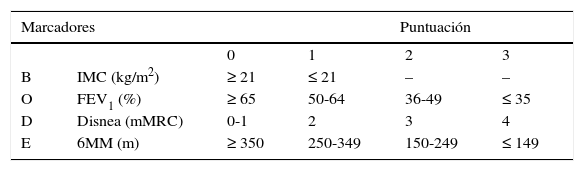
El índice BODE, propuesto por Celli et al5, es un índice multicomponente de gravedad pronóstico de la EPOC. Integra la información del IMC (B, de body mass index), volumen espiratorio forzado en el primer segundo (FEV1) (O, de airflow obstruction), disnea (D) y capacidad de ejercicio (E), evaluada mediante la prueba de marcha de 6 minutos. Un incremento en un punto del índice BODE se asocia a un aumento del 34% en la mortalidad por todas las causas y del 62% en la mortalidad de causa respiratoria5. En su conjunto, el índice BODE es más útil que el FEV1 como variable pronóstica.
En la tabla 1 se muestran los componentes del BODE y su ponderación, que oscila entre 0 y 10 puntos, de menor a mayor riesgo de mortalidad. Esta puntuación se agrupa en los siguientes 4 cuartiles:
- •
Cuartil 1: 0-2 puntos.
- •
Cuartil 2: 3-4 puntos.
- •
Cuartil 3: 5-6 puntos.
- •
Cuartil 4: 7-10 puntos.
Índice BODE2.
| Marcadores | Puntuación | ||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | ||
| B | IMC (kg/m2) | ≥ 21 | ≤ 21 | – | – |
| O | FEV1 (%) | ≥ 65 | 50-64 | 36-49 | ≤ 35 |
| D | Disnea (mMRC) | 0-1 | 2 | 3 | 4 |
| E | 6MM (m) | ≥ 350 | 250-349 | 150-249 | ≤ 149 |
6MM: distancia recorrida en la prueba de los 6 minutos de marcha; FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; mMRC: escala modificada del Medical Research Council.
Hay una amplia experiencia en el uso del índice BODE y se ha comprobado su utilidad en distintas situaciones clínicas, como la predicción de agudizaciones6, la asociación con ansiedad-depresión7, la respuesta a la rehabilitación pulmonar8 o la cirugía de reducción de volumen9.
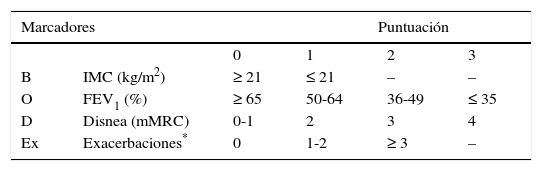
Aunque la determinación de los 4 componentes del BODE es relativamente sencilla, lo cierto es que la generalización del índice ha sido más lenta de lo esperado, especialmente en atención primaria, probablemente debido a la necesidad de realizar la prueba de marcha de 6 minutos que, aunque de baja complejidad y coste, exige disponibilidad de tiempo y un espacio adecuado para su realización. Por este motivo, algunos autores han propuesto la sustitución de esta prueba de ejercicio (E del índice BODE) por el registro de las exacerbaciones graves (Ex de exacerbaciones graves), en lo que se denomina índice BODEx10. Ambos índices muestran un elevado grado de correlación y similar capacidad pronóstica de mortalidad.
La tabla 2 muestra los componentes del BODEx y su ponderación. En este índice la puntuación obtenida oscila entre 0 y 9 puntos y se agrupa en los siguientes cuartiles:
- •
Cuartil 1: 0-2 puntos.
- •
Cuartil 2: 3-4 puntos.
- •
Cuartil 3: 5-6 puntos.
- •
Cuartil 4: 7-9 puntos.
Índice BODEx.
| Marcadores | Puntuación | ||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | ||
| B | IMC (kg/m2) | ≥ 21 | ≤ 21 | – | – |
| O | FEV1 (%) | ≥ 65 | 50-64 | 36-49 | ≤ 35 |
| D | Disnea (mMRC) | 0-1 | 2 | 3 | 4 |
| Ex | Exacerbaciones* | 0 | 1-2 | ≥ 3 | – |
Ex: exacerbaciones; FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; mMRC: escala modificada del Medical Research Council.
Para la evaluación de la disnea en los índices BODE/BODEx, se recomienda utilizar la escala mMRC11 que clasifica la disnea en 4 grados (tabla 3).
Escala de disnea modificada del Medical Research Council.
| Grado | Actividad |
|---|---|
| 0 | Ausencia de disnea al realizar ejercicio intenso |
| 1 | Disnea al andar de prisa en llano o al andar subiendo una pendiente poco pronunciada |
| 2 | La disnea le produce una incapacidad de mantener el paso de otras personas de la misma edad caminando en llano o tener que parar a descansar al andar en llano a propio paso |
| 3 | La disnea hace que tenga que parar a descansar al andar unos 100 m o pocos minutos después de andar en llano |
| 4 | La disnea le impide al paciente salir de casa o aparece ante actividades como vestirse o desvestirse |
Ex: exacerbaciones; FEV1: volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; mMRC: escala modificada del Medical Research Council.
El CAT es un cuestionario estandarizado, breve y sencillo que se ha desarrollado para ser utilizado en la práctica clínica asistencial12,13. Consta de 8 sencillas preguntas que miden aspectos sobre la tos, la expectoración, la opresión torácica, la disnea, las actividades domésticas, la autoconfianza, el sueño y la energía. Cada una de estas preguntas puede ser ponderada en una puntuación que oscila entre 0 (mejor) y 5 (peor), por lo que su puntuación global se sitúa entre 0 y 40 puntos y el impacto sobre la calidad de vida guarda estrecha relación con estas puntuaciones14. La validación internacional muestra que el CAT tiene buena validez y fiabilidad. En España, además de la validación específica, también se han analizando otros aspectos — como la sensibilidad al cambio durante las exacerbaciones, su variabilidad en medidas repetidas y su sensibilidad como herramienta de seguimiento de la EPOC o la posibilidad de uso autoadministrado— con buenos resultados15,16.
El CAT es muy útil para ayudar en la comunicación entre médico y paciente, ya que permite identificar aspectos del impacto de la enfermedad que pueden pasar desapercibidos en el interrogatorio habitual. Es importante en el seguimiento para detectar cambios clínicamente importantes (> 2 unidades) y una puntuación del CAT elevada, aun en presencia de una función pulmonar conservada o un bajo nivel de síntomas16,17, debe ponernos en alerta. Es recomendable cumplimentar el CAT en cada visita de seguimiento clínico.
Derivación al segundo nivel asistencialSe recomienda remitir el paciente al segundo nivel asistencial en las siguientes situaciones:
- •
Paciente de alto riesgo con dudas en el tratamiento o seguimiento.
- •
Si no se dispone de espirómetro, hay que remitir siempre al paciente al segundo nivel para confirmar el diagnóstico.
- •
Pacientes con frecuentes exacerbaciones (2 o más al año).
- •
Presencia de cor pulmonale.
- •
Tras un ingreso hospitalario a causa de la EPOC (en caso de que no haya sido atendido por un neumólogo).
- •
Indicación de oxigenoterapia continua domiciliaria.
- •
Enfermedad en sujetos jóvenes o con sospecha o concentraciones plasmáticas bajas de déficit de alfa-1 antitripsina.
- •
Valoración de posibles tratamientos quirúrgicos (bullectomía, reducción de volumen, trasplante) o de ventilación mecánica no invasiva.
- •
Disnea desproporcionada en pacientes con obstrucción de grado moderado (FEV1 > 50%).
- •
Rápido deterioro clínico o de la función pulmonar.
- •
Si no es posible realizar la prueba de la marcha y es necesario calcular el índice BODE.
Las revisiones habituales por el segundo nivel asistencial en pacientes estables con buena evolución son menos necesarias.
Visita de control en la EPOC estableEn cada visita de control se ha de realizar una evaluación que incluya:
- •
Valoración clínica: con registro de síntomas respiratorios y escala de disnea mMRC, estado nutricional mediante el IMC.
- •
Identificación de agudizaciones (número, gravedad y necesidades de tratamiento).
- •
Interrogar por síntomas de posibles comorbilidades, como la enfermedad cardiovascular, la diabetes mellitus, los trastornos de ansiedad-depresión y la osteoporosis, por su impacto en la historia natural de la enfermedad y la necesidad de adecuar su tratamiento.
- •
Cuantificar el impacto de la EPOC sobre la calidad de vida y el grado de control clínico mediante el cuestionario CAT.
- •
Espirometría, para estimar el pronóstico, y la evolución de la función pulmonar y su respuesta al tratamiento. Se recomienda repetir la espirometría forzada anualmente en todos los pacientes diagnosticados de EPOC. En caso de realizar cambios en el tratamiento se puede repetir a los 2-3 meses para valorar la respuesta.
- •
En las visitas de seguimiento debe incidirse en el consejo antitabaco y comprobar la adecuación del tratamiento (detección de posibles efectos adversos, revisión de la técnica inhalatoria y del correcto cumplimiento del tratamiento).
- •
Además, debe evaluarse la respuesta al tratamiento, es decir, si se han alcanzado los objetivos propuestos. En función de los logros conseguidos con el tratamiento —y a tenor de la afectación de la función pulmonar, del control de síntomas (grado de disnea), del impacto sobre la calidad de vida (mediante el CAT) y del número de exacerbaciones desde el último control— debe decidirse el ajuste de dicho tratamiento.
Para la evaluación objetiva del cumplimiento con la medicación inhalada se ha desarrollado el cuestionario TAI (Test de Adherencia a los Inhaladores)18. Es un cuestionario sencillo que permite identificar el mal cumplimiento con la terapia inhalada y a la vez detectar si la falta de cumplimiento es de tipo errático o deliberado, con lo que ayuda a diseñar estrategias para mejorar el cumplimiento.
Visita en el segundo nivel asistencialAdemás de las acciones enumeradas en la visita en el primer nivel asistencial, en este nivel se pueden solicitar otras exploraciones que pueden ayudar a establecer el diagnóstico, categorización del fenotipo y evaluación de la gravedad, siempre que sea necesario y siguiendo los criterios de derivación indicados anteriormente:
- 1.
Evaluar la tolerancia al ejercicio mediante la prueba de la marcha de 6 minutos, un examen sencillo que se correlaciona con las mediciones objetivas de la actividad física habitual y sirve para calcular el índice BODE19.
- 2.
Tomografía computarizada de tórax de alta resolución. En pacientes agudizadores para diagnosticar la posible presencia y extensión de bronquiectasias20. En pacientes con enfisema se realizará, si se precisa, la evaluación de posibles tratamientos quirúrgicos21.
- 3.
Volúmenes pulmonares estáticos y prueba de transferencia del CO. Para el estudio del enfisema y de la disnea desproporcionada con el grado de obstrucción al flujo aéreo.
- 4.
Determinaciones analíticas más complejas en el caso de pacientes con agudizaciones frecuentes o EPOC especialmente grave: estudio de la inmunidad humoral y celular, fenotipos o genotipo de la alfa-1 antiripsina22, entre otros.
- 5.
Cultivo de esputo y susceptibilidad antibiótica en pacientes con agudizaciones recurrentes, en número superior a 2 al año y que requieran tratamiento con antibióticos, fracaso terapéutico de las agudizaciones o sospecha de infección bronquial crónica.
- 6.
Otras pruebas: estudio del sueño, pruebas de esfuerzo, estudio de comorbilidades, etc.
Está bien establecido el incremento del tratamiento de acuerdo a la progresión de la enfermedad o a su gravedad. Sin embargo, es muy escasa la evidencia disponible sobre la posible reducción o retirada del tratamiento en pacientes que consiguen una mejoría o estabilidad clínica. Sobre la base de la evidencia existente, se puede recomendar:
- 1.
El tratamiento broncodilatador ejerce su efecto solamente durante su administración, por lo que es muy probable que la retirada de un broncodilatador o su sustitución por otro de menor potencia broncodilatadora o menor duración de acción produzca un empeoramiento funcional y/o sintomático23.
- 2.
En pacientes con ACO se puede ensayar la reducción de la dosis de CI hasta conseguir la mínima dosis eficaz, al igual que se realiza en el tratamiento del asma. No se recomienda dejar a estos pacientes con tratamiento con BDLD sin CI.
- 3.
En pacientes con fenotipo agudizador no es posible especificar una pauta de reducción del tratamiento en caso de estabilidad. Deberá realizarse según juicio clínico, empezando por la retirada de los fármacos que probablemente son menos activos o que presentan mayor probabilidad de efectos adversos a corto o largo plazo.
- 4.
El tratamiento a largo plazo con CI está asociado a la posible aparición de efectos adversos24. Por este motivo, es esencial evaluar en cada paciente la relación beneficio-riesgo del uso de estos fármacos. Hay un alto grado de consenso en que la retirada de los CI es posible, aunque el acuerdo es menor a la hora de delimitar las características de los pacientes en los que se debe llevar a cabo25.
Existen estudios que indican que la retirada indiscriminada de los CI puede incrementar la inflamación bronquial26 y asociarse a un incremento en el riesgo de agudizaciones27. Sin embargo, trabajos recientes con una gran población de pacientes moderados o graves no han encontrado un mayor riesgo de agudizaciones al retirar los CI, siempre que se sustituyan por un tratamiento broncodilatador adecuado28,29. Análisis secundarios de estos estudios muestran que la concentración de eosinófilos en sangre puede ser también un buen marcador para identificar a los pacientes que pueden discontinuar los CI sin riesgo, incluso con obstrucción al flujo aéreo grave y agudizaciones durante el año previo, siempre que sigan un tratamiento con doble terapia broncodilatadora30. De forma parecida, otros trabajos sugieren que la retirada de los CI es segura en pacientes leves-moderados (FEV1 > 50%) que no han presentado agudizaciones, o incluso con agudizaciones durante el año previo, siempre que se optimice la broncodilatación31.
A efectos prácticos, se recomienda la retirada de los CI en todos aquellos pacientes que los están recibiendo sin indicación, es decir, a los pacientes con obstrucción al flujo aéreo de leve a moderada (FEV1 > 50%) y que no hayan tenido agudizaciones durante el año previo.
Además, la retirada se debe considerar en pacientes más graves (FEV1 < 50%) si tienen riesgo de efectos adversos relacionados con los CI: neumonías previas, osteoporosis, diabetes mal controlada, fragilidad cutánea, etc. En estos casos, se debe valorar la concentración de eosinófilos en sangre y aconsejar la retirada si su concentración es inferior a 300 células/pl, ya que concentraciones superiores constituyen un criterio de ACO e indican la necesidad del uso de CI.
En pacientes que estén en tratamiento con CI y que no se puedan incluir en ninguno de estos 2 grupos no existe evidencia suficiente para recomendar su retirada y esta deberá ser valorada por el médico, de nuevo según la evaluación del beneficio-riesgo de cada paciente de forma individual.
En ningún caso deben retirarse los CI a pacientes con ACO, entre los que se incluyen los pacientes con concentraciones de eosinófilos en sangre > 300 células/pl.
Aunque en el mayor estudio clínico realizado hasta la fecha se utilizaba una pauta descendente de la dosis de CI29, la evidencia acumulada en otros estudios clínicos sugiere que la retirada puede realizarse sin reducción de la dosis.
El tratamiento farmacológico de los pacientes con EPOC debe revaluarse periódicamente, pues la edad, los cambios en las comorbilidades, la estacionalidad de los síntomas y las exacerbaciones, la disponibilidad de nuevos fármacos y las nuevas estrategias de tratamiento, unidos a medidas de higiene y no farmacológicas, deben permitir personalizar el tratamiento y mejorar los resultados clínicos.