El dasatinib (Sprycel®; Bristol-Myers Squibb, New York, EE. UU.) es un inhibidor de amplio espectro y de segunda generación de la tirosina cinasa, y un medicamento potente y eficaz para el tratamiento de la leucemia mieloide crónica (LMC)1. Sin embargo, el uso de este fármaco es complicado, debido a una de sus reacciones adversas específicas, el derrame pleural2.
La incidencia de derrame pleural asociado con el dasatinib difiere dependiendo de la fase de la enfermedad, la presencia de comorbilidades y la dosis o el intervalo de dosis2. Cortes et al. comunicaron que la incidencia total de derrame pleural en pacientes con LMC que recibieron 100mg de dasatinib una vez al día fue de un 29%1. El derrame pleural, también puede derivar en la necesidad de suplementación de oxígeno o, como resultado de una inestabilidad hemodinámica o respiratoria, inducir situaciones potencialmente mortales en aproximadamente un 5% de los pacientes tratados con dasatinib1,2. Se han propuesto diversos mecanismos responsables del desarrollo del derrame pleural asociado con el dasatinib, que comprenden la inhibición inespecífica del receptor β del factor de crecimiento plaquetario o de otras moléculas implicadas en vías inmunológicas, pero el mecanismo exacto no se ha aclarado3.
Describimos un caso de derrame pleural asociado con el dasatinib, con características histológicas de hiperplasia histiocítica nodular (HHN) pleural.
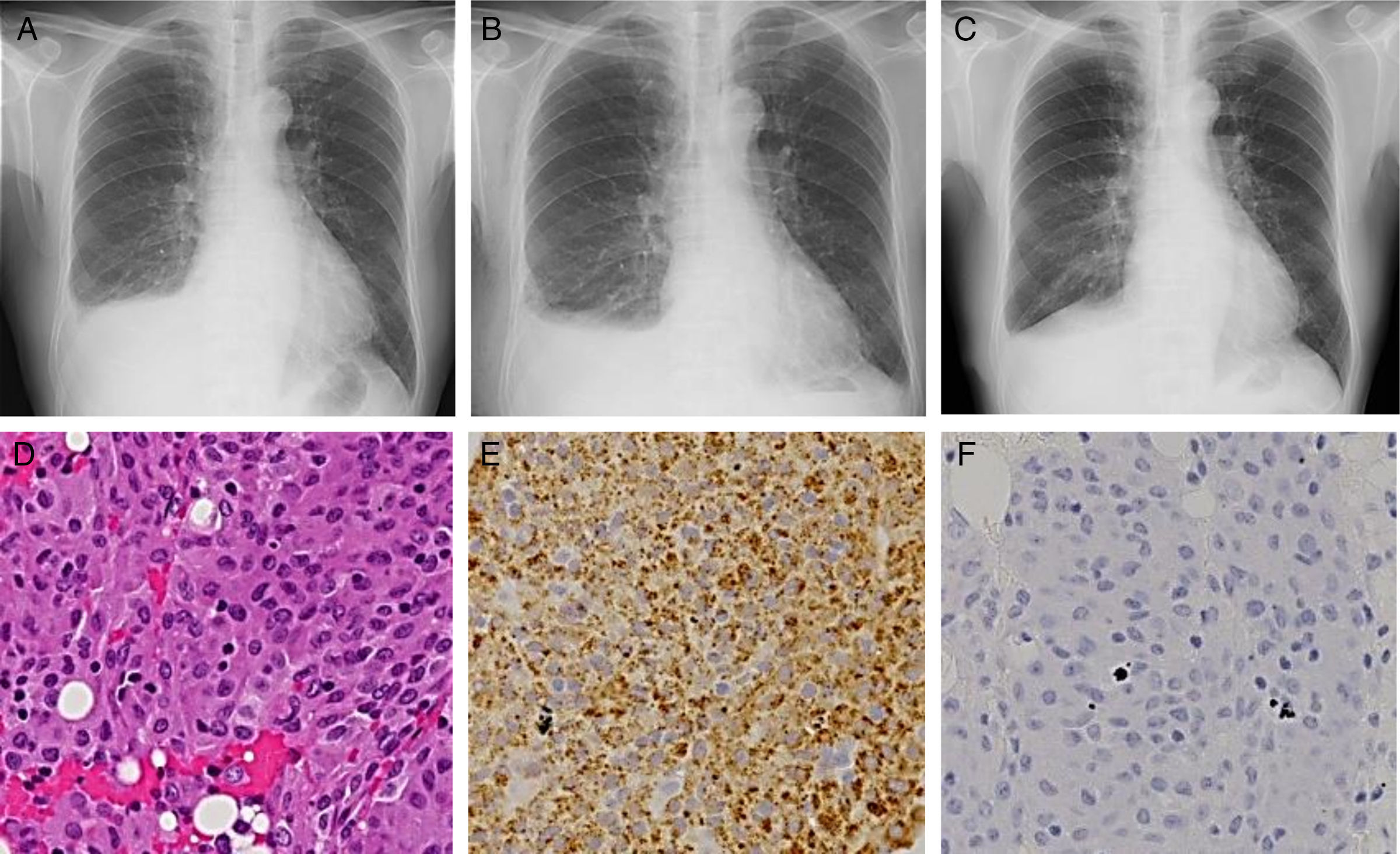
Se trata de un varón de 73 años y exfumador, a quien se había diagnosticado de LMC a los 70 años de edad. Inicialmente, el paciente había recibido tratamiento con 100mg de dasatinib una vez al día, pero esta dosis se redujo hasta 70mg por observarse trombocitopenia. Los antecedentes médicos del paciente incluían epilepsia y fibrosis retroperitoneal, para la que había recibido corticoides orales desde los 68 hasta los 70 años. Unos 2 meses más tarde, el paciente había referido disnea de esfuerzo. El porcentaje de linfocitos en sangre periférica fue de un 59,1% (4.200μl) y la prueba de anticuerpos antinucleares negativa. El recuento de transcritos del gen de fusión BCR/ABL1 en sangre periférica fue inferior a un 0,1%, lo que es indicativo de que la respuesta molecular de la LMC continuaba siendo mayor. La radiografía de tórax mostró la presencia de un derrame pleural derecho (fig. 1A) y la tomografía axial computarizada torácica no reveló signos de engrosamiento pleural, ni de afectación del parénquima pulmonar. En el análisis del derrame pleural se observó la presencia de exudado de predominio linfocitario (64%), 30,2U/l de adenosina desaminasa, 1,37ng/ml de antígeno carcinoembrionario y menos de 100.000mg/ml de ácido hialurónico. En la citología y el cultivo del líquido pleural no se detectaron enfermedades malignas, ni microorganismos infectantes. En la gammagrafía con citrato de galio67 no se observó captación del isótopo.
Imágenes de radiografía torácica durante la primera visita a nuestro servicio (A), 3 semanas después de la biopsia pleural (B) y 2 semanas después de la suspensión del dasatinib (C). Imagen microscópica con tinción de hematoxilina-eosina (D; 200 aumentos) e imágenes microscópicas inmunohistoquímicas que muestran anticuerpos anti-CD68 (E; 200 aumentos) y S-100 (F; 200 aumentos).
Se practicó una biopsia pleural mediante toracoscopia, guiada por vídeo, para determinar la naturaleza de la enfermedad pleural. En los cortes de las muestras de la biopsia teñidos con hematoxilina-eosina se constató la presencia de agregados de una población homogénea de células con citoplasma eosinofílico (fig. 1D). En los análisis inmunohistoquímicos se observó que la mayoría de las células expresaban el antígeno CD68, (fig. 1E), pero no expresaban los antígenos AE1/AE3, citoqueratina 7, citoqueratina 20, calretinina o CD34. Las células inmunorreactivas al CD68 también mostraron positividad a la vimentina y negatividad a las proteínas S-100 (fig. 1F) y desmina. Estos resultados histológicos e inmunohistológicos condujeron al diagnóstico de HHN.
Tres semanas después de practicar la biopsia pleural, el paciente había acumulado más líquido pleural (fig. 1B). El tratamiento con dasatinib se suspendió durante 2 semanas y se observó mejoría del derrame pleural derecho (fig. 1C). Tras reanudar la administración del dasatinib, no se detectó aumento de líquido pleural.
Hasta donde alcanza nuestro conocimiento, esta es la primera comunicación de un caso de derrame pleural asociado con dasatinib en el que se diagnosticó HHN pleural por métodos histológicos e inmunohistológicos.
Identificamos que la causa del derrame pleural era el dasatinib porque observamos que su volumen dependía del tratamiento con dicho agente. Además, el análisis del líquido pleural concordó con resultados comunicados en informes previos. Se ha descrito, que comorbilidades como enfermedades cardíacas, insuficiencia renal, hipertensión, enfermedad pulmonar obstructiva crónica y linfocitosis (>3.600μl) son factores de riesgo de derrame pleural asociado con dasatinib4,5 y, de hecho, en nuestro caso detectamos linfocitosis.
La patogenia del derrame pleural asociado con el dasatinib se desconoce y solo 2 estudios han investigado su origen a partir de biopsias pleurales6,7. Bergeron et al. detectaron infiltrados linfocitarios o mieloides en la pleura6, mientras que Ustun et al. observaron pleuritis fibrinosa organizada7. El presente caso es el primero en el que se halló HHN pleural.
La HHN es un proceso proliferativo benigno con predominio de histiocitos inmunorreactivos frente al CD688,9. Podría tratarse de un proceso reactivo causado por diversas situaciones, tales como irritación mecánica, inflamación o un tumor10. En el caso que nos ocupa, el paciente no refería antecedentes de cirugía, y la LMC se encontraba en fase de respuesta molecular mayor. Tampoco se detectó carcinoma primario ni metastásico en el derrame pleural, ni en las biopsias. Por consiguiente, consideramos que la HHN de este paciente fue una posible causa del derrame pleural asociado con el dasatinib, pero podría ser secundaria al derrame. Es fundamental examinar la causa del derrame pleural asociado con el dasatinib mediante futuros estudios que implementen el uso de la biopsia pleural.
El tratamiento del derrame pleural asociado con el dasatinib comprende toracocentesis terapéutica, suspensión temporal del dasatinib (como se describe en este informe) y una tanda de prednisona de corta duración2. Desafortunadamente, en un pequeño porcentaje de pacientes tratados con dasatinib, el derrame pleural puede ser incontrolable1,2. Son necesarios más estudios de investigación para poder identificar el mecanismo del desarrollo de los derrames pleurales y permitir ofrecer un tratamiento óptimo a los pacientes que reciben dasatinib.
Agradecemos los comentarios del Dr. Eiji Yamada con relación a los hallazgos histopatológicos.