El enfisema se ha asociado a una disminución de la expresión de VEGF y VEGFR-2 y a la presencia de un número elevado de células alveolares apoptósicas. El factor de crecimiento queratinocítico estimula la síntesis de VEGF, lo cual proporciona, a su vez, un mantenimiento de la estructura pulmonar normal a través de la vía de Akt. En este estudio hemos investigado el posible papel del rHuKGF en la mejora de la falta de regulación de la vía de supervivencia celular mediada por Akt en ratones enfisematosos.
MétodosSe establecieron 3 grupos experimentales: grupos de enfisema, tratamiento y control. Los pulmones de los ratones se trataron terapéuticamente en 3 ocasiones mediante la instilación orofaríngea de 10mg de rHuKGF/kg de peso corporal tras la inducción del enfisema mediante elastasa pancreática porcina. Posteriormente, se obtuvo tejido pulmonar de los ratones para la realización de exámenes de histopatología y biología molecular.
Resultados y discusiónLas microfotografías de histopatología y el análisis del índice de destrucción han mostrado que el agrandamiento del espacio aéreo inducido por la elastasa y la pérdida de alvéolos se recuperaron en el grupo de tratamiento. El rHuKGF estimula la producción de VEGF, que a su vez induce la vía de supervivencia celular mediada por Akt en los pulmones enfisematosos. Se produjo un aumento significativo de la expresión de mRNA de VEGF, VEGFR, PI3K y Akt, mientras que hubo una disminución notable de Pten, caspasa-9 y Bad en el grupo de tratamiento en comparación con el grupo de enfisema, y los resultados fueron comparables a los del grupo de control. Además, la expresión de VEGF a nivel proteico concordaba con la observada a nivel de mRNA.
ConclusiónLos suplementos terapéuticos de rHuKGF mejoran la mala regulación de la vía de Akt en el trastorno del enfisema, dando lugar a una supervivencia celular alveolar a través de una activación de la vía de la supervivencia celular dependiente de VEGF endógena. Así pues, el rHuKGF podría ser un posible fármaco para el tratamiento del enfisema.
Emphysema has been associated with decreased VEGF and VEGFR-2 expression and the presence of high numbers of apoptotic alveolar cells. Keratinocyte growth factor stimulates VEGF synthesis which in turn confers normal lung structure maintenance via the Akt pathway. In this study the potential role of rHuKGF in the improvement of deregulated Akt mediated cell survival pathway in emphysematous mice was investigated.
MethodsThree experimental groups, i.e., emphysema, treatment and control groups, were prepared. Lungs of mice were treated on 3 occasions by oropharyngeal instillation of 10mg rHuKGF per kg body weight after induction of emphysema with porcine pancreatic elastase. Subsequently, lung tissues from mice were collected for histopathology and molecular biology studies.
Results and discussionHistopathology photomicrographs and destructive index analysis have shown that elastase-induced airspace enlargement and loss of alveoli recovered in the treatment group. rHuKGF stimulates VEGF production which in turn induces the Akt mediated cell survival pathway in emphysematous lungs. mRNA expression of VEGF, VEGFR, PI3K and Akt was significantly increased while Pten, Caspase-9 and Bad was notably decreased in treatment group when compared with emphysema group, being comparable with the control group. Moreover, VEGF protein expression was in accordance with that found for mRNA.
ConclusionTherapeutic rHuKGF supplementation improves the deregulated Akt pathway in emphysema, resulting in alveolar cell survival through activation of the endogenous VEGF-dependent cell survival pathway. Hence rHuKGF may prove to be a potential drug in the treatment of emphysema.
La enfermedad pulmonar obstructiva crónica es un causa importante de la carga de asistencia sanitaria en todo el mundo y la única de las principales causas de muerte cuya prevalencia está aumentando1. En EE. UU. comporta una morbilidad del 4% y se sitúa en el cuarto lugar de las causas de muerte1. El enfisema pulmonar, que se produce con la enfermedad pulmonar obstructiva crónica, es un diagnóstico anatomopatológico, definido por un agrandamiento destructivo permanente de los espacios aéreos distales a los bronquiolos terminales, que contribuye a limitar el flujo aéreo y se cree que es irreversible2. Hasta el momento no disponemos de ningún tratamiento eficaz para restablecer un parénquima pulmonar con un intercambio de gases normal después de que se hayan establecido las alteraciones enfisematosas. Aunque se ha descrito un papel prometedor del tratamiento con ácido all-trans-retinoico en modelos del enfisema en roedores3, no hay ningún tratamiento de eficacia clínica probada que fomente la recuperación del enfisema establecido4,5. Así pues, la inducción de una regeneración alveolar continúa siendo un importante reto para el desarrollo de nuevos tratamientos para el enfisema6.
El factor de crecimiento queratinocítico (KGF) es un mitógeno potente en diferentes tipos de células epiteliales y facilita la reparación de la piel, la córnea y el recubrimiento gastrointestinal mediante la estimulación de la división y crecimiento de las células7–9. Esta reparación epitelial ha motivado un interés por su posible uso para el tratamiento de la lesión epitelial en la lesión pulmonar aguda10. El KGF modula varios mecanismos que se ha observado que son importantes en la reparación del epitelio alveolar y, por tanto, ha generado un interés como posible intervención terapéutica en la lesión pulmonar aguda. El primer estudio sobre el efecto protector del KGF exógeno en un modelo en roedores con lesión pulmonar aguda fue el presentado por Panos et al.11. Los autores indicaron que la administración intratraqueal de KGF humano recombinante (rHuKGF) estimulaba la proliferación de las células de tipo 2 del epitelio alveolar in vivo y reducía la lesión pulmonar inducida por la hiperoxia en las ratas. Posteriormente, el KGF exógeno se ha explorado ampliamente con fines de protección del pulmón frente a la lesión pulmonar experimental, como la inducida por bleomicina12,13, neumonía por Pseudomonas aeruginosa14, ácido clorhídrico15,16, ácido oleico17 o radiación y bleomicina18. Recientemente, los datos de un modelo de perfusión pulmonar humano ex vivo de la lesión pulmonar inducida por endotoxina han indicado que el tratamiento con KGF mejora la función de barrera epitelial y endotelial pulmonar, y mejora la tasa de eliminación del líquido alveolar, con lo que reduce el edema alveolar19. Tiene interés señalar que los suplementos de rHuKGF aplicados a pulmones enfisematosos muestran una regeneración pulmonar del epitelio alveolar y el endotelio capilar, así como una transformación y mantenimiento del tejido intersticial20. Además, el KGF tiene tendencia a estimular la producción de factor de crecimiento endotelial vascular (VEGF) en los queratinocitos humanos21–23. El VEGF es un mitógeno específico de las células endoteliales y participa en la reparación de las heridas, la angiogénesis, la permeabilidad microvascular y la protección vascular. Sin embargo, su expresión en la producción de células está estrictamente regulada por factores de crecimiento22. En condiciones normales, estos factores de crecimiento no estimulan de manera directa la angiogénesis, pero pueden modularla a través de la modulación de la expresión de VEGF en tipos celulares específicos, ejerciendo por tanto un efecto angiogénico o antiangiogénico indirecto24. Entre estos factores de crecimiento, el factor de crecimiento fibroblástico 425, el KGF26, el PDGF27 y el factor de crecimiento transformador β28 son los que pueden potenciar la producción de VEGF, que a su vez activa la vía de fosfatidilinosítido-3’-OH cinasa (PI3K)-Akt29. En especial en el pulmón, la vía de PI3K-Akt regula múltiples procesos celulares, incluida la proliferación, supervivencia, crecimiento y motilidad de las células alveolares30,31. Así pues, en el presente estudio, investigamos el posible papel del suplemento exógeno de KGF en la inducción de la supervivencia celular mediada por Akt, mediante la activación de PI3K y sus dianas distales en el enfisema (fig. 1).
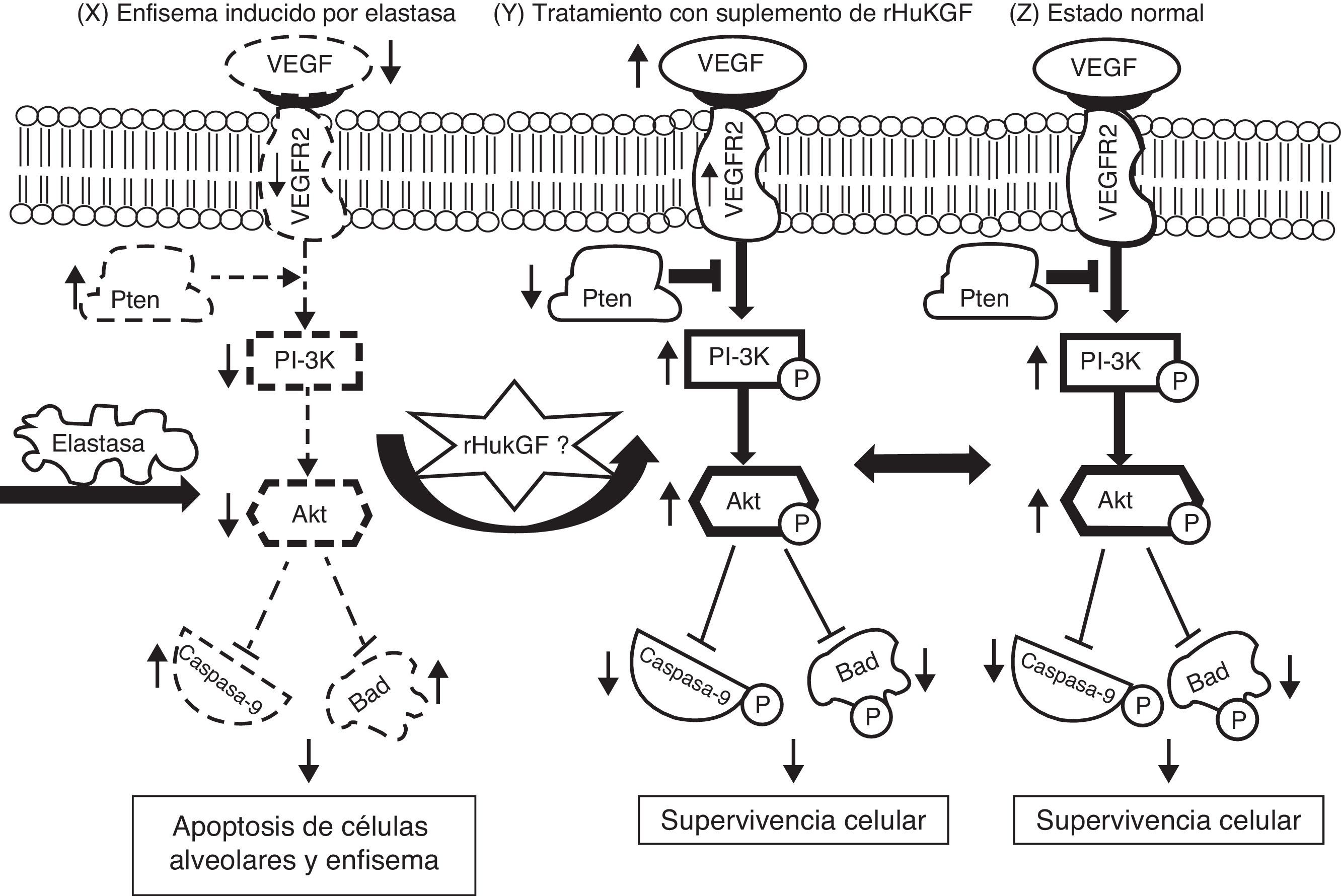
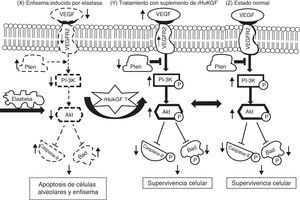
Hipótesis sobre el mecanismo de la inducción por el rHuKGF de la señalización de supervivencia mediada por Akt en el enfisema. El enfisema inducido por elastasa reduce los niveles de VEGF y de VEGFR2, con lo que modifica la señalización de supervivencia a través de PI-3K/Akt. Los factores de crecimiento (como VEGF, KGF etc.) y los factores de supervivencia activan receptores que reclutan PI3K hacia la membrana, lo cual activa a su vez la cinasa Akt. El antagonista Pten inhibe la supervivencia celular mediante una regulación negativa (que se indican con una flecha hacia abajo) de la vía de Akt a través de la desfosforilización. El Akt fosforila y compromete la función de las proteínas caspasa-9 y Bad, que intervienen en las vías de la muerte celular. Esta hipótesis corresponde a la desregulación de la supervivencia celular mediada por Akt en el grupo de enfisema inducido por elastasa (X). Se sabe que diversas moléculas, entre las que se encuentran varios factores de crecimiento, desempeñan un papel clave en la reparación y desarrollo del pulmón y en la supervivencia celular. En este caso, se cree que el suplemento de rHuKGF (S) induce la vía de supervivencia celular mediada por Akt en el enfisema y debe ser idéntico al grupo sano (Z). Akt: cepa de ratón Ak; Bad: promotor de muerte asociado a Bcl-2; PI3K: fosfatidilinosítido-3′-OH cinasa; Pten: homólogo de fosfatasa y tensina en cromosoma 10; t: timoma; VEGF: factor de crecimiento endotelial vascular; VEGFR2: receptor de VEGF.
Todos los experimentos realizados en animales se llevaron a cabo atendiendo a lo establecido en las guías institucionales que compilaban las regulaciones nacionales e internacionales, y han sido aprobados por el gobierno regional (IAEC, Ministerio de Medio Ambiente y Silvicultura, India). Todos los modelos animales experimentales se prepararon según lo descrito por Yildirim et al.20. Se utilizaron ratones machos C57BL de 8 semanas y libres de patógenos, con un peso corporal de unos 20g, que fueron asignados aleatoriamente a 3 modelos experimentales diferentes. Se mantuvo a los ratones bajo anestesia de isoflurano y se les administró o bien elastasa o bien rHuKGF/solución salina mediante instilación orofaríngea. Los detalles del desarrollo de los modelos experimentales se describen en el texto que sigue y en la figura 2:
- –
Modelo de control (solución salina+solución salina [SS]; n=8): La instilación orofaríngea se utilizó para administrar 40μl de solución salina los días 1, 10, 31, 34 y 37.
- –
Modelo de enfisema (elastasa+solución salina [ES]; n=8): Se indujo un enfisema mediante la instilación orofaríngea de elastasa pancreática porcina (2,25mg/kg de peso corporal) en los pulmones de ratones los días 1 y 10. Sin embargo, los pulmones tratados con elastasa recibieron solución salina el día 31, 34 y 37.
- –
Modelo terapéutico del enfisema (elastasa+rHuKGF [EK]; n=8): A los pulmones tratados con elastasa se les aplicaron 10mg/kg de peso corporal de rHuKGF mediante instilación orofaríngea los días 31, 34 y 37.
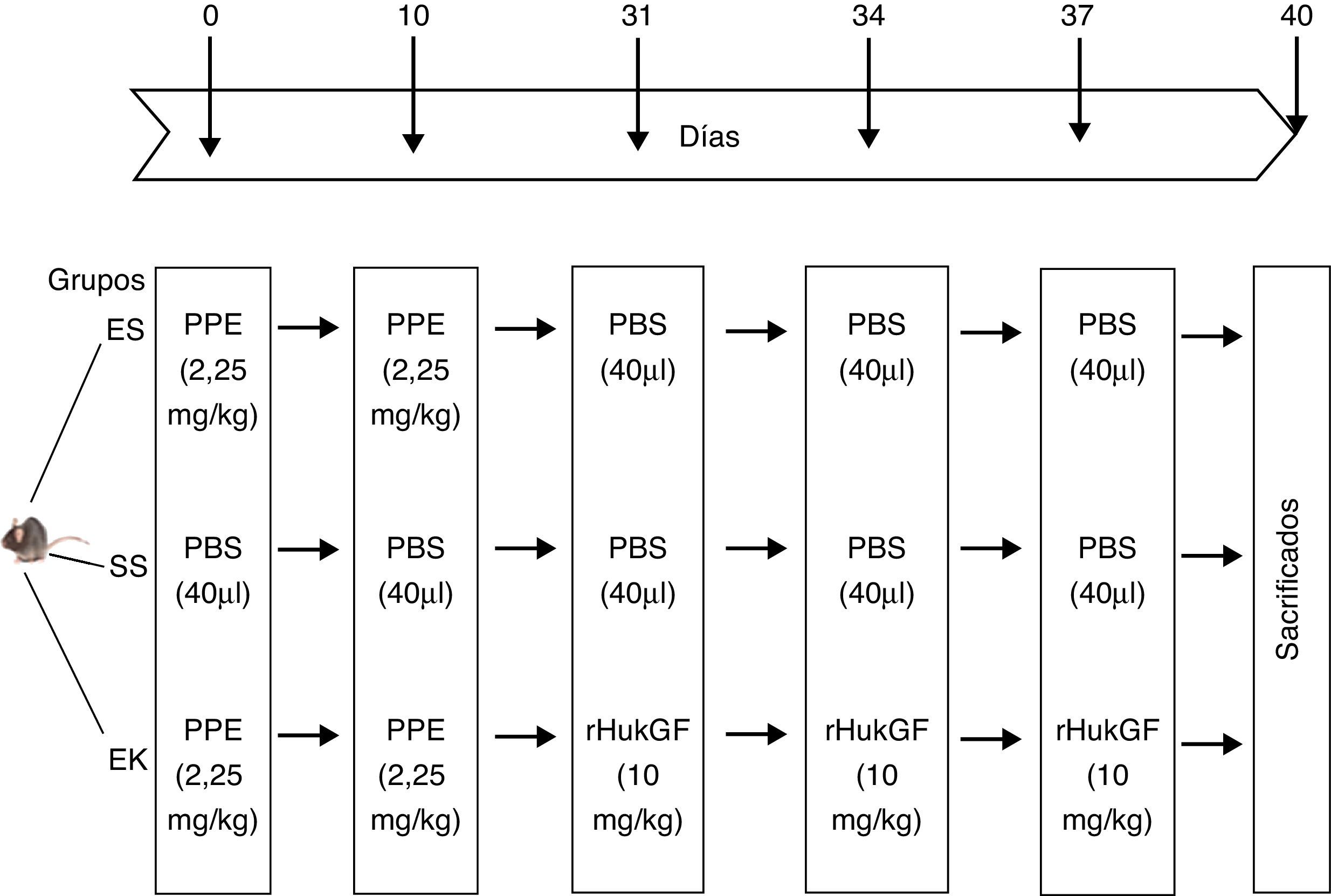
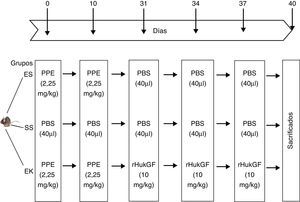
Representación esquemática del diseño experimental. El día 0 y el día 10, los ratones recibieron una instilación orofaríngea de 40μl de solución salina, con o sin elastasa pancreática porcina (2,5mg/kg de peso corporal). Los días 31, 34 y 37, los animales recibieron una instilación orofaríngea de 40μl de solución salina o de rHuKGF (10mg/kg de peso corporal). El día 40, los animales fueron sacrificados y se extrajeron los pulmones para los análisis de histopatología y de biología molecular. EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano).
En el día 40, los animales fueron sacrificados con el método de luxación cervical. Se ventilaron los pulmones artificialmente y se perfundieron con solución salina tamponada con fosfato estéril, para la extracción de la sangre. Se utilizó el pulmón derecho para los análisis de histopatología, mientras que los tejidos del pulmón izquierdo se sumergieron de inmediato en un tanque de nitrógeno líquido y se conservaron a −80°C hasta el momento del análisis para los estudios de biología molecular.
Fijación del pulmónLos pulmones derechos se fijaron mediante instilación en la vía aérea de paraformaldehído tamponado con fosfato al 6% a una presión de 20cm de columna de líquido y se conservaron una noche en el refrigerador. La deshidratación, limpieza e infiltración se realizaron con el empleo de protocolos estándares. Los cortes de tejido procesados se colocaron en un bloque de parafina y se dejaron enfriar y solidificar antes de realizar los cortes de tejido. A continuación se eliminó la parafina del tejido 3 veces mediante Xylene y se volvió a hidratar con diferentes concentraciones de etanol. Con el empleo de un microtomo (microtomo rotatorio, Spencers, India), se realizaron cortes de tejido finos, de 5μm. Los cortes de tejido finos se tiñeron con hematoxilina y eosina (H&E).
MorfometríaDestrucción del parénquima: Se utilizó una técnica de recuento de puntos microscópicos para determinar el grado de destrucción del parénquima, en lo que se denomina un análisis de índice de destrucción (DI)32. Se colocó una lámina transparente con 83 puntos de recuento sobre una impresión en tamaño A4 de las imágenes microscópicas procedentes de los cortes teñidos. Para cada pieza pulmonar se utilizó la media de 3 cortes diferentes, y se seleccionaron en los cortes generalmente 3 campos no solapados representativos. La evaluación de la presencia de destrucción se llevó a cabo mediante el recuento de los puntos de solapamiento de espacios alveolares y ductales, según lo descrito por Robbesom et al.33. Se calculó el porcentaje del total de puntos incluidos en las diversas categorías de espacios aéreos destruidos, para obtener el DI, utilizando la fórmula [D/(D+N)]x100%, en donde D=destruidos y N=normales. Se calcularon las diferencias de DI en los grupos de enfisema y de tratamiento respecto al grupo de control (100%).
Aislamiento del ARN total del pulmón izquierdo y síntesis de cDNAPara investigar la expresión relativa del mRNA en el tejido pulmonar, se extrajo el ARN total con el empleo de una técnica basada en el RNeasy Mini Kit (Qiagen, Nueva Delhi, India) con una pequeña modificación del protocolo de Muyal et al.34. Se determinó la cantidad y la pureza del ARN total con Nanodrop (Thermo Scientific, EE. UU.) mientras que la calidad de la integridad del ARN total se evaluó analizando el ARN ribosómico 18S y 28S en una electroforesis en gel de agarosa teñida con bromuro de etidio al 1,2%. Se sintetizó el cDNA de primera hebra mediante la introducción de cantidades iguales de ARN (300ng) de cada muestra en un volumen de reacción total de 20μl con el empleo de un cebador Oligo dt (Qiagen, Nueva Delhi, India) y un Omniscript RT Kit (Qiagen, Nueva Delhi, India) y los respectivos protocolos. La reacción se incubó a 37°C durante 1h en Thermoblock TB2 (Biometra, Goettingen, Alemania).
Cuantificación de mRNA relativaSe realizó una PCR en tiempo real para determinar el factor de amplificación de los genes diana (tabla 1) en un formato de 96 pocillos de Stratagene Mx 3005P (Agilent Technologies, Inc., EE. UU.) en un volumen de reacción total de 20μl, utilizando 10μl de un QuantiTect SYBR Green PCR Kit (Qiagen, Nueva Delhi, India), 1μl de cada cebador oligonucleótido directo e inverso con especificidad de secuencia (10pmol), 7μl de agua y 1μl de cDNA. Las condiciones de los ciclos térmicos utilizadas en todas las reacciones fueron las siguientes: paso 1: 95°C durante 15min; 30 ciclos de paso 2 (95°C durante 45s); paso 3 (temperatura de templado del cebador oligonucleótido de secuencia específica; véase la tabla 1 para los 35s); y paso 4 (72°C durante 45s), seguido de un tiempo de paso 5: 72°C, 5min.
Información de los cebadores: secuencia y tamaño de amplicón de las secuencias diana
| Nombre del gen | Cebador izquierdo [5’-3’] | Cebador derecho [5’-3’] | Longitud de amplicón (pb) |
|---|---|---|---|
| VEGFA | CAGGCTGCTGTAACGATGAA | GCATTCACATCTGCTGTGCT | 140 |
| VEGFR2 | ACCAAGGCGACTATGTTTGC | GGGCAAGTCACTTCAATGGT | 160 |
| PI3K | CAAAGCGGAGAACCTATTGC | CCGGTGGCAGTCTTGTTAAT | 138 |
| Akt1 | GTGAAAGAGAAGGCCACAGG | GTCGTGGGTCTGGAATGAGT | 165 |
| Pten | AGACCATAACCCACCACAGC | TACACCAGTCCGTCCCTTTC | 127 |
| Caspasa-9 | GATGCTGTCCCCTATCAGGA | CGATGTACCAGGAGCCACTT | 151 |
| Bad | GGAGCTTAGCCCTTTTCGAG | GCTTTGTCGCATCTGTGTTG | 166 |
Akt: timoma de cepa de ratón Ak; Bad: promotor de muerte asociado a Bcl-2; PI3K: fosfatidilinosítido-3’-OH cinasa; Pten: homólogo de fosfatasa y tensina en cromosoma 10; VEGF: factor de crecimiento endotelial vascular; VEGFR2: receptor de VEGF.
Se extrajo la proteína total de 100mg de WLT con el empleo de un kit de extracción de proteína total (Biochem Life Sciences, Nueva Delhi, India). El protocolo para western blot de VEGF se ha llevado a cabo según lo descrito por Yildirim et al. para el western blot de VEGFR220.
Análisis estadístico de la cuantificación de mRNA relativaSe determinaron los niveles de genes diana de mRNA relativos al control endógeno de actina β, según la fórmula de 2 elevado a la potencia de delta del umbral de ciclo (2ΔCt), en donde ΔCt=Ct, gen de referencia–Ct, gen de estudio. Se evaluó la significación estadística de las diferencias entre los grupos experimentales con el empleo de una prueba de Mann-Whitney no paramétrica (GraphPad Prism versión 4, San Diego, EE. UU.). Los niveles de significación se indican mediante *=p<0,05; **=p<0,01.
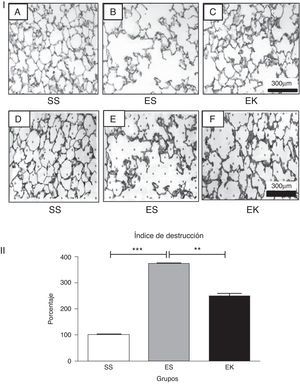
ResultadosEfectos del factor de crecimiento queratinocítico humano recombinante sobre la arquitectura tisularLa instilación orofaríngea de 2,25mg de elastasa pancreática porcina /kg de peso corporal en 2 ocasiones (días 0, 10) produjo un enfisema pulmonar grave, tal como se muestra en la figura 3-I-B de una microfotografía obtenida en el estudio histopatológico. Sin embargo, la microfotografía de los pulmones enfisematosos tratados con rHuKGF mostró de manera evidente la recuperación de los tabiques alveolares perdidos en el grupo de tratamiento (EK, fig. 3-I-C) y fue comparable al grupo de control (SS, fig. 3-I-A). En la determinación del DI de los cortes de tejido de los 3 modelos animales (fig. 3-I-D, E y F), el modelo de ratones enfisematosos mostró unos valores de DI significativamente superiores a los del modelo de control (p<0,001). Sin embargo, el DI se redujo significativamente (p<0,001) en el caso de los modelos de tratamiento, es decir, los pulmones enfisematosos de ratones tratados con rHuKGF (fig. 3-II).
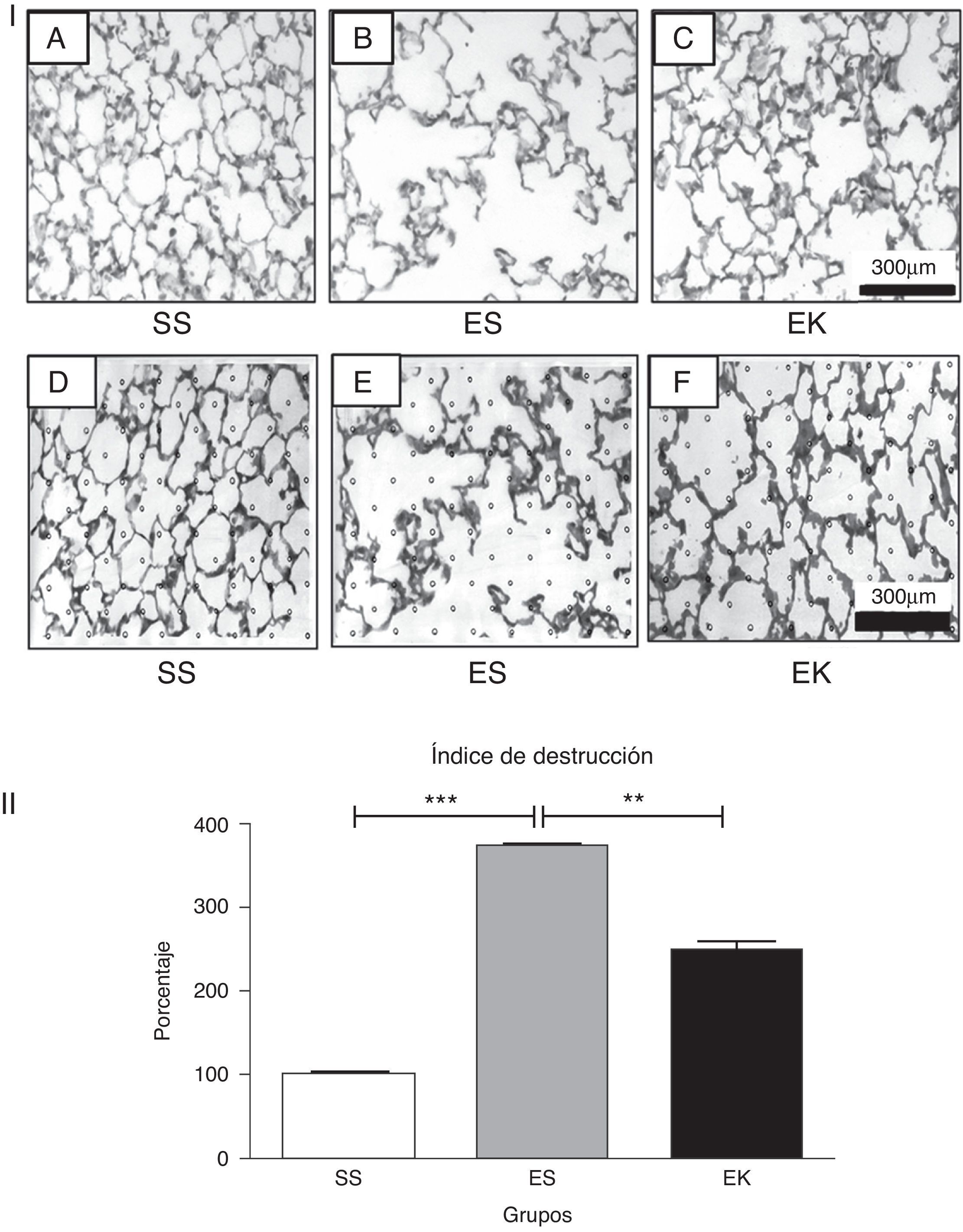
(3-I). Histopatología del área de intercambio de gases. Cortes de tejido con tinción de hematoxilina y eosina que muestran (A) una histología normal en los pulmones de control, (B) una rarefacción de los tabiques alveolares con espacios aéreos agrandados en los pulmones con enfisema y (C) un aumento de los espacios aéreos con engrosamiento de los tabiques alveolares en los pulmones tratados. Todas las microfotografías se tomaron con unos aumentos idénticos. Para la determinación del índice de destrucción, se coloca una lámina transparente con 80 puntos distribuidos por igual sobre la imagen digitalizada impresa de un corte con tinción de HE (D, E, F). Para cada punto, se determina el área circundante según los criterios mencionados en el apartado de Métodos. EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano).
(3-II). Análisis estadístico del índice de destrucción. A diferencia de lo observado en los pulmones sanos (SS), hubo un aumento significativo del índice de destrucción porcentual en el caso de los pulmones enfisematosos (ES), mientras que este se redujo con el suplemento de rHuKGF en los pulmones enfisematosos (EK). Los gráficos indican los valores de media con desviación estándar. Los datos se analizaron mediante la prueba de t para datos no emparejados, con objeto de evaluar el efecto del rHuKGF y la elastasa, respectivamente (fig. 3-II). EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano). ***p ≤ 0,001 y **p ≤ 0,01 frente al correspondiente grupo de control.
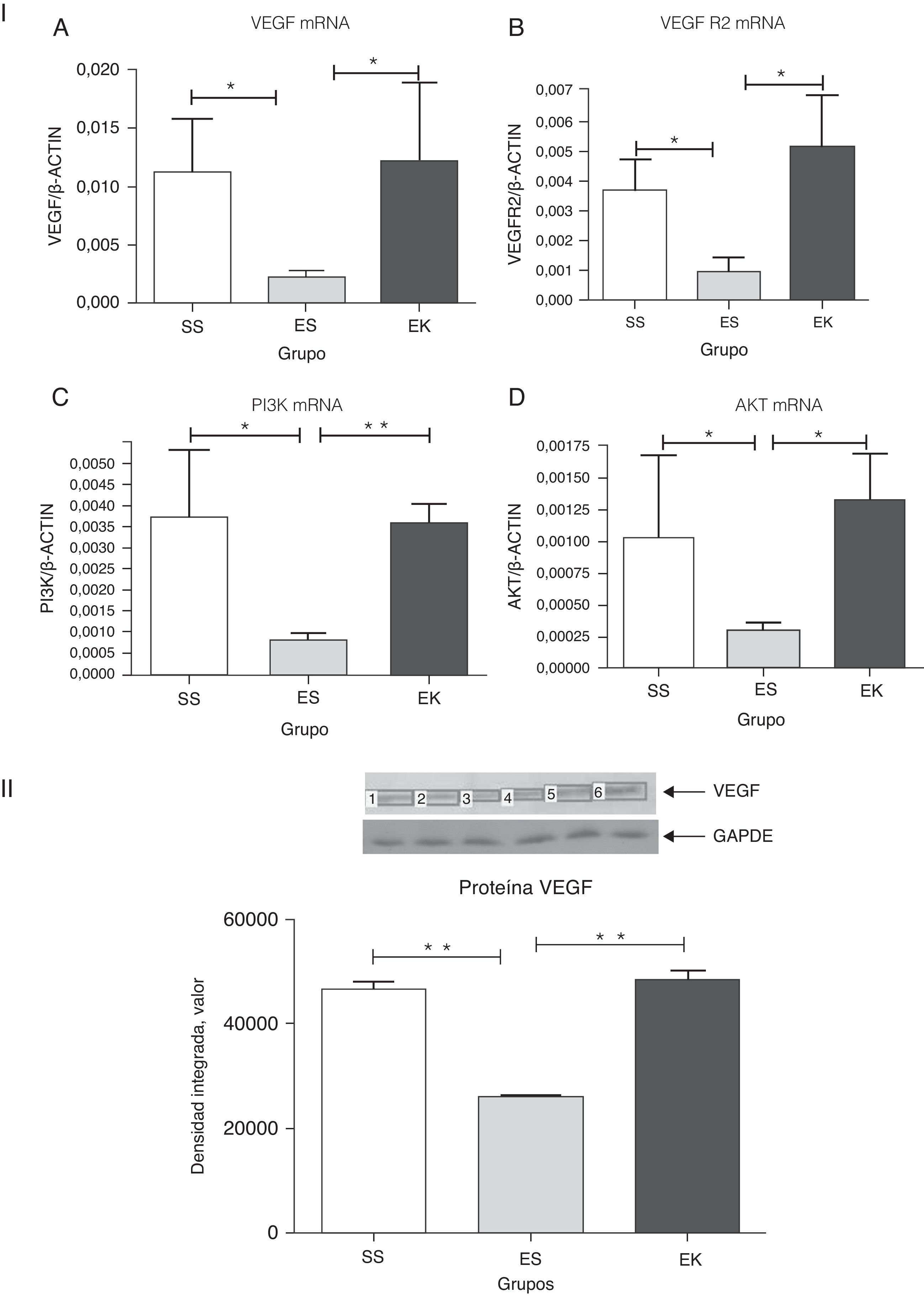
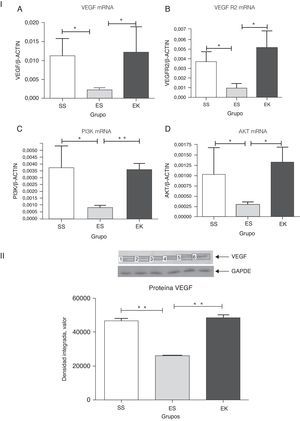
En un estado normal, la unión de VEGF al VEGFR2 activa la cascada de señalización de Akt distal, lo cual interviene, a su vez, en la supervivencia de las células (fig. 1). Para determinar si el suplemento de rHuKGF induce la cascada de señalización de Akt en los pulmones enfisematosos, evaluamos los niveles de expresión de mRNA de VEGF, VEGFR 2, PI3K y Akt respectivamente. En contraste con los pulmones enfisematosos, el grupo de tratamiento (EK) muestra la inducción favorable de los niveles de mRNA de VEGF (p<0,05), VEGFR2 (p<0,03), PI3K (p<0,001) y Akt (p<0,02), respectivamente. Sin embargo, la expresión de estos genes estaba notablemente reducida en los pulmones enfisematosos (ES) en comparación con los sanos (SS) (fig. 4-I). Además, en la validación de la expresión de VEGF a nivel de proteína, el análisis de western blot para el VEGF muestra un patrón similar al observado a nivel de mRNA (fig. 4-II).
(4-I). Expresión relativa del mRNA de VEGF, VEGFR2, PI3K y Akt (A-D) en tejido pulmonar completo. Los niveles de VEGF, VEGFR2, PI3K y Akt presentaron una regulación negativa significativa en el grupo de enfisema (ES) en comparación con el grupo de control (SS). En cambio, los niveles de VEGF, VEGFR2, PI3K y Akt presentaron una regulación positiva significativa en el grupo de tratamiento (EK) y fueron comparables a los del grupo de control. Se determinaron los niveles de mRNA de los genes diana con los valores relativos respecto al gen de referencia endógeno de la actina β, según la fórmula de 2 elevado a la potencia de delta del umbral de ciclo (2ΔCt), en donde ΔCt=Ct, gen de referencia–Ct, gen diana. Akt: cepa de ratón Ak; EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); PI3K: fosfatidilinosítido-3′-OH cinasa; rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano); VEGF: factor de crecimiento endotelial vascular; VEGFR2: receptor de VEGF. *p<0,05 y **p<0,01 frente al respectivo grupo de control.
(4-II). Análisis de densitometría de western blot de VEGF. La densitometría de western blot de VEGF puso de manifiesto un patrón similar al observado a nivel del mRNA (fig. 4-IA). Los gráficos indican los valores de media con desviación estándar. Los datos se analizaron mediante la prueba de t para datos no emparejados, con objeto de evaluar el efecto del rHuKGF y la elastasa, respectivamente. Akt: cepa de ratón Ak; EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); PI3K: fosfatidilinosítido-3′-OH cinasa; rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano); VEGF: factor de crecimiento endotelial vascular; VEGFR2: receptor de VEGF. **p<0,01 frente al respectivo grupo de control.
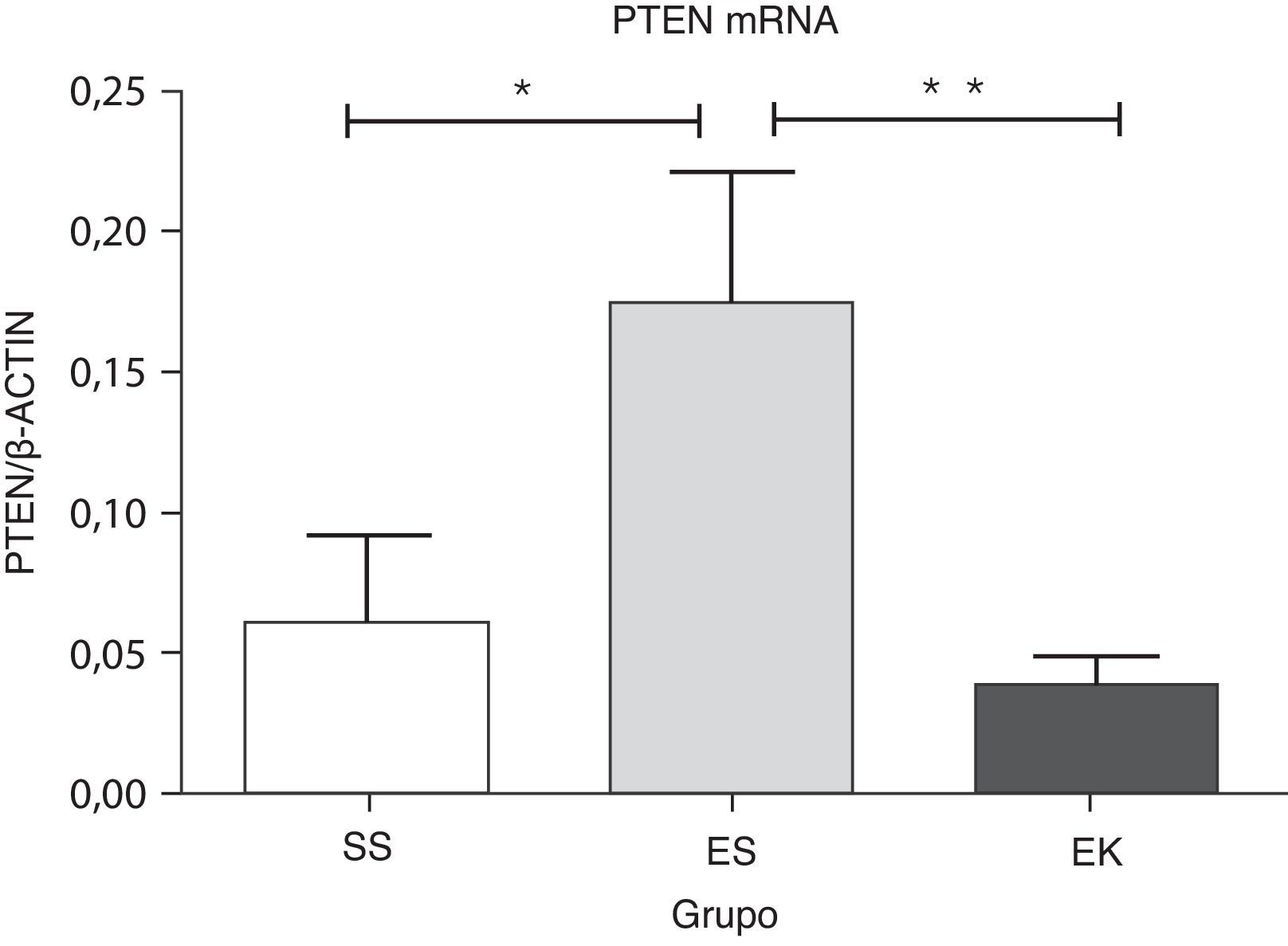
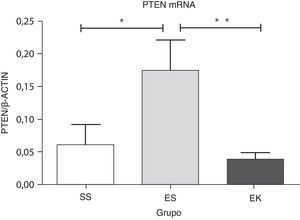
Se ha descrito que el Pten es un regulador negativo de la vía de supervivencia celular de Akt. Su sobreexpresión da lugar a una desregulación de la señalización de la supervivencia celular. Nuestros datos muestran una regulación positiva significativa de la expresión del mRNA del Pten (p<0,04) en los pulmones enfisematosos (ES) en comparación con los sanos (SS). El papel beneficioso del rHuKGF en los pulmones enfisematosos se apreció también en una reducción significativa del nivel de mRNA de Pten (p<0,008) en comparación con el grupo de ES, y es importante señalar que fue comparable a lo observado en los pulmones sanos (fig. 5).
Expresión relativa del mRNA del antagonista (Pten) de la vía de Akt en el tejido pulmonar completo. El nivel de expresión de Pten mostró una inducción significativa en los pulmones expuestos a elastasa, a diferencia del grupo de tratamiento. En el grupo de tratamiento hubo una disminución significativa de los niveles de expresión de Pten, con unos resultados comparables a los del grupo de control. Los niveles de mRNA de los genes diana se determinaron con los valores relativos respecto al gen de referencia endógeno de la actina β según la fórmula de 2 elevado a la potencia de delta del umbral de ciclo (2ΔCt), en donde ΔCt=Ct, gen de referencia–Ct, gen diana. Los gráficos indican los valores de media con desviación estándar. Los datos se analizaron mediante la prueba de t para datos no emparejados, con objeto de evaluar el efecto del rHuKGF y la elastasa, respectivamente. EK: elastasa- rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano); VEGF: factor de crecimiento endotelial vascular. *p<0,05 y **p ≤ 0,01 frente al respectivo grupo de control.
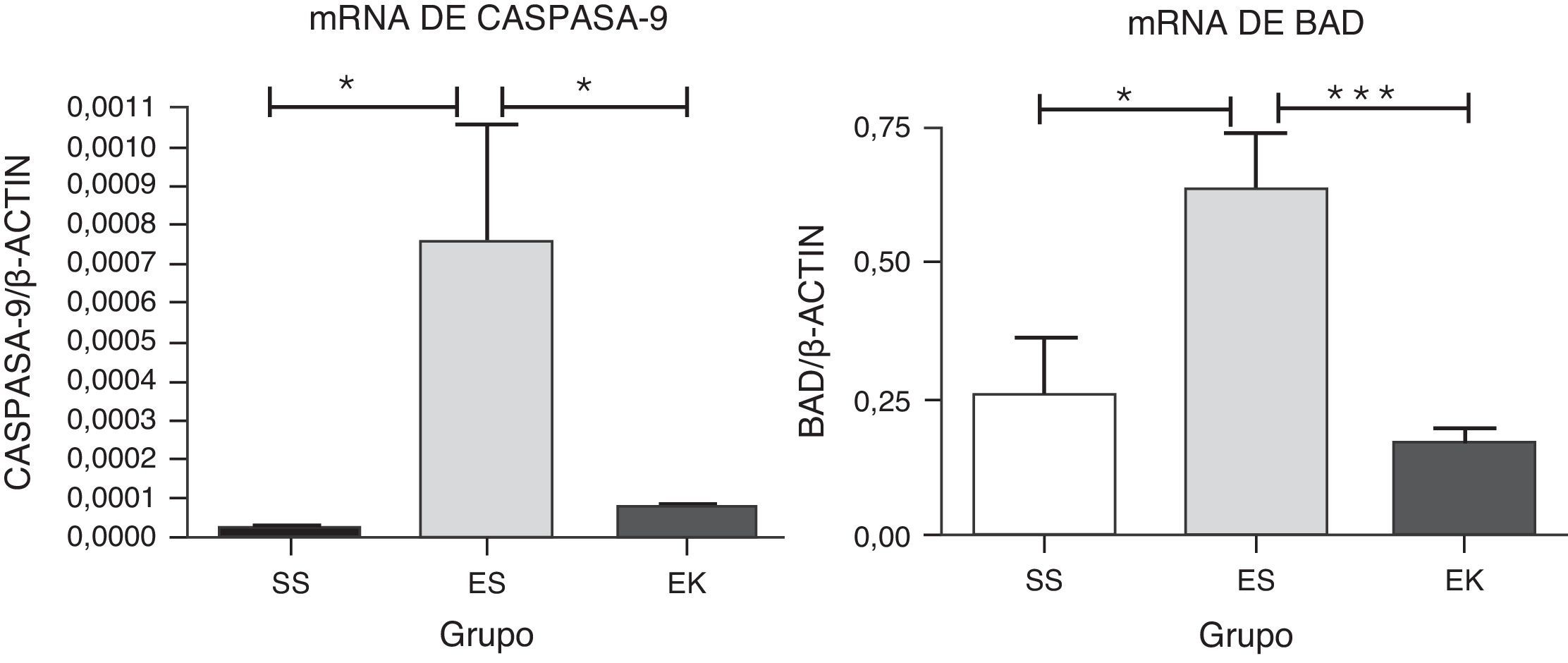
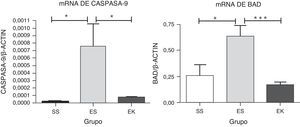
Para que se produzca una pérdida de unidades alveolares, sería de prever que, incluso en el modelo de enfisema con elastasa pancreática porcina, hubiera también una cierta apoptosis de las células alveolares. Para evaluar la apoptosis en nuestros modelos animales experimentales, se estudió la expresión de mRNA de marcadores de la apoptosis, es decir caspasa-9 y Bad, en la vía Akt. En este caso, los niveles normalizados de mRNA de caspasa-9 (p<0,01) y Bad (p<0,01) en el tejido pulmonar enfisematoso (ES) mostraron una regulación positiva significativa en comparación con los pulmones sanos (SS). Sin embargo, se observó un efecto prometedor del rHuKGF en el estado de enfisema (EK). En el grupo de tratamiento (EK), observamos una reducción de los niveles de expresión de caspasa-9 (p<0,02) y Bad (p<0,0007) en comparación con los pulmones enfisematosos (ES), lo cual indica que el rHuKGF tiene una tendencia a contrarrestar la apoptosis de las células alveolares (fig. 6).
Expresión relativa de mRNA de marcadores de apoptosis (caspasa-9 y Bad) en el tejido pulmonar completo. El nivel de expresión de caspasa-9 y Bad mostró una inducción significativa en los pulmones expuestos a elastasa, a diferencia del grupo de tratamiento. En el grupo de tratamiento hubo una disminución significativa de los niveles de caspasa-9 y Bad, con unos niveles de expresión comparables a los del grupo de control. Los niveles de mRNA de los genes diana se determinaron con los valores relativos respecto al gen de referencia endógeno de la actina β según la fórmula de 2 elevado a la potencia de delta del umbral de ciclo (2ΔCt), en donde ΔCt=Ct, gen de referencia–Ct, gen diana. Los gráficos indican los valores de media con desviación estándar. Los datos se analizaron mediante la prueba de t para datos no emparejados, con objeto de evaluar el efecto del rHuKGF y la elastasa, respectivamente. EK: elastasa-rHuKGF (grupo de tratamiento); ES: elastasa-solución salina (grupo de enfisema); rHuKGF: factor de crecimiento queratinocítico humano recombinante; SS: solución salina (grupo sano). *p<0,05 y ***p ≤ 0,001 frente al respectivo grupo de control.
La patogenia del enfisema pulmonar no se conoce por completo, aunque se han propuesto varios mecanismos, como un desequilibrio de proteasas y antiproteasas, inflamación crónica y estrés oxidativo. Además de estos mecanismos, estudios recientes muestran otro mecanismo involucrado en el desarrollo del enfisema pulmonar que se basa en un aumento de las células endoteliales y epiteliales alveolares apoptósicas en los pulmones35. Sin embargo, la formación del enfisema pulmonar puede interpretarse también como la consecuencia de un fallo de los procesos de reparación del pulmón. En la actualidad, no disponemos de ninguna opción terapéutica que permita la reparación de los alvéolos perdidos en el estado enfisematoso. Así pues, la inducción de una regeneración alveolar continúa siendo un importante reto para el desarrollo de nuevos tratamientos para el enfisema. Tan solo recientemente, la administración de KGF ha mostrado ser el factor de crecimiento potente que posee propiedades tanto protectoras como curativas en el estado de enfisema20,36. Sin embargo, los mecanismos moleculares distales que rigen la supervivencia de las células alveolares no se han abordado por el momento. Así pues, en el presente estudio, hemos intentado mostrar el posible efecto del rHuKGF en la activación de la cascada de señalización de Akt, mediante la estimulación de la producción de VEGF en ratones enfisematosos.
Nuestros resultados muestran claramente un posible papel del rHuKGF en los pulmones de ratones enfisematosos. El papel prospectivo del rHuKGF se observó claramente en la arquitectura tisular con el empleo de histopatología del análisis del DI basado en morfometría. Las microfotografías mostraron la pérdida de los tabiques alveolares en los pulmones enfisematosos en comparación con los pulmones sanos. Se observó que esta pérdida de los tabiques alveolares se recuperaba en el grupo de tratamiento y era del todo comparable a la de los grupos sanos. Yildirim et al. han descrito una observación similar, con el empleo de la longitud de intersección media como instrumento para cuantificar el daño y la recuperación del tejido alveolar20. En nuestro estudio utilizamos un análisis basado en el DI como instrumento para cuantificar tanto el daño como la recuperación del tejido alveolar, con objeto de abordar el papel prospectivo del rHuKGF. El valor medio de DI de los pulmones enfisematosos es superior al valor de los pulmones sanos. Robbesom et al. observaron también un valor de DI similar en los grandes fumadores en comparación con los controles33. Creemos que los valores más altos de DI pueden deberse a las condiciones de medida estrictas de nuestro estudio, lo cual descarta posibles sesgos como un tejido con insuflación subóptima. Tiene interés señalar que los valores de DI se redujeron de manera significativa con el suplemento de rHuKGF en los pulmones enfisematosos. Este efecto recíproco en los valores de DI puede deberse a una regeneración de las paredes de los tabiques alveolares, que dio lugar a un aumento del número de espacios alveolares intactos. Aparte del papel prospectivo del rHuKGF sobre la arquitectura tisular, a continuación, se investigó el papel prospectivo del rHuKGF en la cascada de señalización de Akt en los pulmones de ratones enfisematosos en el presente trabajo.
Según lo indicado por Shiojima et al., la unión del VEGF al VEGFR2 activa la cascada de señalización de Akt, lo cual es importante en la supervivencia, proliferación y migración celulares y en la angiogénesis37. Además, el KGF tiene una posible tendencia a inducir la activación del Akt, lo cual puede ser el mecanismo común subyacente en la citoprotección de las células epiteliales de diferentes tejidos38,39. En el pulmón, Ray et al. obtuvieron unos resultados similares, y señalaron que el KGF estimula la secreción de VEGF, lo cual potencia la citoprotección de las células endoteliales mediante la activación de Akt40,41,29. En este estudio se observó que con el suplemento de rHuKGF en los pulmones enfisematosos, los niveles de mRNA de los genes candidatos (VEGF, VEGFR2, PI3K y Akt), involucrados en la cascada de señalización de Akt, tienen una regulación positiva hasta el nivel óptimo, igual que se observa en los pulmones sanos. Además, la expresión de proteína del VEGF sufrió una inducción significativa en los pulmones enfisematosos tratados con rHuKGF. Esto sugiere que el rHuKGF tiene el potencial de establecer una arquitectura pulmonar normal, tras la pérdida de los tejidos alveolares, mediante la estimulación de la expresión de VEGF en los pulmones enfisematosos. Anteriormente se ha descrito que, en los pulmones enfisematosos de pacientes fumadores y pacientes con enfermedad pulmonar obstructiva crónica, la expresión de mRNA y de proteína de VEGF y VEGFR2 presentaron una regulación negativa42. Esta reducción de la expresión de VEGF/VEGFR puede conducir a una apoptosis de las células endoteliales con los consiguientes cambios enfisematosos43–46.
Además, los pulmones enfisematosos a los que se aplica un suplemento de KGF muestran una inducción en los niveles de mRNA de PI-3K, que estaban reducidos en esos pulmones. Esta inducción de PI-3K mejora la interacción de VEGFR2 con PI-3K para la activación de la cascada de señalización distal, con lo que se mantiene la viabilidad celular47. Además, el efecto favorable del rHuKGF se observó también a nivel del mRNA de Akt. Se observó que la expresión que estaba reducida en el grupo de enfisema aumentaba tras los suplementos de rHuKGF en los pulmones enfisematosos. Esta inducción en la expresión de Akt puede tener múltiples efectos beneficiosos sobre los procesos celulares, en especial en cuanto a la proliferación y supervivencia de las células alveolares. La inducción de la actividad de la Akt cinasa producida por el KGF de un modo dependiente de la dosis y del tiempo ha sido comentada también por Shenying et al.48. Sus resultados concluyeron que el KGF tiene la máxima eficacia en el mantenimiento de la viabilidad celular mediante la estimulación de la actividad de la Akt cinasa antes de la exposición a los estímulos inductores de apoptosis48.
Nosotros observamos también que el rHuKGF tiene el potencial de reducir al mínimo la sobreexpresión de Pten y caspasa-9 a un nivel óptimo en los pulmones enfisematosos. El Pten actúa como un antagonista de la supervivencia celular mediante la regulación negativa de la vía de Akt a través de la desfosforilización49 y por tanto la inhibición del fosfatidilinositol 3, 4, 5-trifosfato (PI [3, 4, 5] P3). Se ha descrito que la sobreexpresión de Pten en el epitelio alveolar causa una notable reducción de la proliferación celular, un aumento notable de la apoptosis y una diferenciación funcional incompleta, lo cual comporta una regulación negativa de la vía de la supervivencia celular50. De igual modo, se ha observado que el aumento de la expresión de la caspasa-9 interviene en la apoptosis celular y la disminución de la supervivencia celular51. En este estudio, los niveles de mRNA de Pten y caspasa-9 en los pulmones enfisematosos tratados con suplementos de rHuKGF presentaron una regulación negativa, a diferencia de lo observado en los pulmones enfisematosos. Estos cambios favorables podrían deberse a una supresión de la sobreexpresión de Pten y caspasa-948 y a una inducción de la activación de Akt que favorece la disminución de la apoptosis de las células alveolares y el aumento de la supervivencia celular.
El Bad proapoptósico es la diana principal de Akt y el Akt fosforila el Bad, con lo que lo hace inactivo para la señal de apoptosis52,53. Datta et al. plantearon la hipótesis de que la vía de PI3K-Akt puede conducir a una fosforilación del Bad y puede inhibir por tanto la muerte celular y promover la supervivencia de las células54,55. En especial en el estado de enfisema Hu et al. mostraron un aumento de la expresión de Bad en las células de músculo liso de vías aéreas humanas56. En nuestro estudio se observó que la expresión de Bad estaba regulada positivamente en los pulmones enfisematosos en comparación con los sanos, lo cual podría deberse al fallo de la fosforilización del Bad por el Akt. Sin embargo, el posible efecto del rHuKGF sobre el Bad se evaluó con mayor detalle en los pulmones enfisematosos. La expresión del Bas mostró una notable regulación negativa en el grupo de tratamiento en comparación con los pulmones enfisematosos y fue idéntica a la de los pulmones sanos. Estos resultados respaldan nuevamente los posibles efectos favorables del suplemento de rHuKGF en un programa de supervivencia y mantenimiento celulares.
Los datos generados por este estudio muestran claramente que el rHuKGF puede ser una medicina molecular potente, que pueda inducir el VEGF endógeno y producir señales de supervivencia importantes que son necesarias para el mantenimiento de la estructura normal del pulmón.
ConclusiónLos resultados de este trabajo ponen de manifiesto la eficacia terapéutica del rHuKGF para rectificar la vía de supervivencia celular dependiente de Akt que está desregulada en el estado de enfisema. Los efectos favorables se apreciaron en la arquitectura del tejido y en su análisis cuantitativo. Además, los genes que se asocian a la vía de la supervivencia celular dependiente de Akt que regulan la supervivencia de las células alveolares se expresaron de manera constructiva con los suplementos de rHuKGF exógeno en los pulmones enfisematosos. Considerados conjuntamente, los resultados indican que el mantenimiento de la supervivencia celular en el grupo de tratamiento fue inducido por la mejora de la vía de supervivencia celular dependiente de Akt; y plantean la posibilidad de tratar a los pacientes con enfisema. No obstante, deberán realizarse estudios más detallados.
Contribuciones específicas de cada autorJai Prakash Muyal participó en el diseño del estudio y llevó a cabo la preparación del modelo animal, el análisis estadístico y supervisó el trabajo y colaboró en la elaboración de la versión preliminar del manuscrito. Dhananjay Kumar llevó a cabo el aislamiento del ARN de los tejidos pulmonares, la síntesis de cDNA y la PCR cuantitativa. Sudhir Kotnala realizó la histopatología, el análisis del índice de destrucción y el western blot. Vandana Muyal participó en el western blot y en la preparación del manuscrito. Amit K. Tyagi colaboró en la preparación de los diferentes modelos animales.
Conflicto de interesesLos autores declaran no tener conflictos de intereses directa ni indirectamente relacionados con el contenido del manuscrito.
Los autores agradecen al Sr. Rashid Ali (Institute of Nuclear Medicine y Allied Sciences, DRDO, Nueva Delhi, India) la ayuda en el manejo de los animales. Los autores agradecen al Departamento de Ciencia y Tecnología, Ministerio de Ciencia y Tecnología, Nueva Delhi (India) la ayuda económica y expresan su sincera gratitud a Swedish Orphan Biovitrum (SOBI), Estocolmo (Suecia) por proporcionar el rHuKGF.