El liver growth factor (LGF, ‘factor de crecimiento de hígado’) es un mitógeno con actividad regeneradora y antifibrótica con actividad incluso en localizaciones extrahepáticas. En este trabajo se administró LGF en un modelo de fibrosis pulmonar inducido con cloruro de cadmio (CdCl2) para estudiar su capacidad antifibrótica.
MétodosSe instilaron 42 ratas Wistar macho con 0,5ml/rata de CdCl2 al 0,025% (n=21) o de salino (n=21). Transcurridos 35 días y una vez establecida la lesión se realizó el tratamiento con LGF y posteriormente el análisis de los parámetros funcionales —capacidad inspiratoria (CI), complianza pulmonar (CL), capacidad vital forzada (CVF) y flujo espiratorio forzado al 75% (FEF75%)—, morfometría —área interna alveolar y distancia media entre paredes alveolares— y contenido en colágeno y elastina.
ResultadosLa fibrosis pulmonar originada mediante CdCl2 se caracterizó por un marcado descenso de la función pulmonar en comparación con los controles. Se redujó un 28% la CI, un 38% la CL, un 31% la CVF y un 54% la FEF75%, descenso que se revirtió parcialmente tras la inyección de LGF —el 18% en CI, el 27% en CL, el 19% en CVF y el 35% en FEF75%—. Además, se observó un incremento en la cantidad de colágeno y elastina del 165 y el 76%, respectivamente, en las ratas del grupo CdCl2 frente a un 110 y un 34% tras la inyección de LGF.
ConclusionesEstos datos demuestran que el LGF mejora la función pulmonar y revierte parcialmente el incremento de las proteínas de matriz pulmonar producido por la instilación con CdCl2.
Liver growth factor (LGF) is a liver mitogen with regenerating and anti-fibrotic activity even at extrahepatic sites. We used LGF in a lung fibrosis model induced by cadmium chloride (CdCl2), to study its antifibrotic capacity.
MethodsForty-two male Wistar rats were administered a single dose of 0.5ml/rat of CdCl2 0.025% (n=21) or the same volume of saline (control group, n=21). After 35 days, once a lesion was established, we started a 3 week treatment with LGF, after which we determined lung function —inspiratory capacity (IC), lung compliance (LC), forced vital capacity (FVC) and expiratory flow at 75% (FEF75%)—, lung morphometry —alveolar internal area (AIA), mean linear intersection (LM)—, and collagen (both by Sirius red and hydroxyproline residues) and elastin contents.
ResultsPulmonary fibrosis in CdCl2 rats was characterized by a marked decrease in pulmonary function with respect to healthy controls —reductions of 28% in IC, 38% in CL, 31% in FVC, and 54% in FEF75%— which was partially recovered after LGF injection —18% IC, 27% CL, 19% FVC and 35% FEF75%—; increase in collagen and elastin contents —165% and 76%, respectively, in CdCl2 rats, versus 110% and 34% after LGF injection—; and increases in AIA and LM, partially reverted by LGF. Conclusions: Together, these data seem to demonstrate that LGF is able to improve lung function and partially reverts the increase in lung matrix proteins produced by CdCl2 instillation.
La fibrosis pulmonar es una enfermedad caracterizada por un empeoramiento progresivo de la función pulmonar1. Existen varios modelos animales que tratan de reproducir esta enfermedad; tal vez, el más extendido sea la inducción con bleomicina (agente fibrogénico muy empleado para estudiar las fases iniciales de la enfermedad) debido a que revierte si el agente no se administra de forma continua2. Para estudiar las fases fibróticas, la evaluación ha de tener lugar en la segunda y la tercera semana desde el momento de la inducción, para ello, existen modelos experimentales más efectivos, como es el caso del cloruro de cadmio (CdCl2), que instilado orotraquealmente en animales y en una única dosis, produce inflamación pulmonar con foco fibrótico acompañado por agrandamiento de los espacios alveolares que recuerda al enfisema centroacinar humano3, pero con predominio de fibrosis. Este agente induce un patrón funcional caracterizado por un descenso en el volumen, la distensibilidad pulmonar y el flujo espiratorio4,5 así como un incremento en las proteínas de la matriz pulmonar, el colágeno y la elastina5,6. Frankel et al7 comprobaron que este modelo reproducía muchas de las características de la respuesta fibrótica observada en humanos y en otros modelos de fibrosis animal. La inflamación aguda remitía hasta valores cercanos a la normalidad hacia el séptimo día, mientras que la cantidad de colágeno permanecía elevada y el volumen pulmonar7,8 descendía.
El liver growth factor (LGF, ‘factor de crecimiento de hígado’) es un mitógeno hepático constituido por un complejo albúmina-bilirrubina9,10 con actividad demostrada tanto in vivo como in vitro. Este factor, purificado por nuestro grupo11, se probó en un modelo de cirrosis inducida con CCl4; la inyección de LGF disminuyó notablemente la acumulación de componentes de la matriz extracelular (colágeno), restauró las enzimas séricas, la integridad estructural y el tejido necrosado, redujo los abscesos y mejoró la hemodinámica12. Recientemente, hemos demostrado la actividad antifibrótica del LGF en ratas con ligadura del conducto biliar, en los que produjo un descenso notable de la acumulación de matriz extracelular, recuperó la función hepática así como redujo factores clave en la extensión de la fibrosis, como el tumor growth factor (TGF-β)13. La acción antifibrótica del LGF está mediada por la disminución de la activación de las células estrelladas y de las células secretoras de la matriz extracelular14. Estudios posteriores también han demostrado que el LGF es capaz de disminuir la fibrosis en la arteria carótida, reducir en un 50% el colágeno de la pared de esta arteria tras 2 semanas de tratamiento, producir una sustancial regeneración de la pared arterial, disminuir la presión sanguínea y mejorar la función vascular en un modelo de ratas con hipertensión espontánea15. Del mismo modo, el LGF fue capaz de estimular los terminales dopaminérgicos, restaurar parcialmente la función motora en un modelo de Parkinson en ratas16 y estimular la neurogénesis y la movilización de las neuronas17.
La actividad mitogénica del LGF en el hígado de ratas está mediada por el aumento de la expresión de ARNm de tumor necrosis factor (TNF-α), y las principales dianas del LGF son las células endoteliales de la vena porta, en las que se ha observado un incremento de la expresión de TNF-α. Además, el LGF también estimula la secreción de TNF-α en cultivos de células endoteliales, sin embargo, no provoca un aumento en la expresión de intercellular adhesion molecule I (ICAM-1) o vascular adhesion molecule I (VCAM-1)18.
Al considerar el efecto del LGF sobre la fibrosis en otros sistemas, este trabajo plantea un estudio preliminar sobre un potencial efecto terapéutico en un modelo de fibrosis pulmonar inducido con CdCl2. La administración de este factor, una vez que el modelo de fibrosis está establecido, muestra datos preliminares de la acción terapéutica del LGF, obtiene mejorías en la función pulmonar y revierte parcialmente el depósito de proteínas de matriz.
Métodos1. Materiales y animales: El Comité de Experimentación Animal de la Fundación Jiménez Díaz-CAPIO aprobó todas las experimentaciones realizadas con animales. A 42 ratas Wistar macho (200–230g) se les realizó instilación orotraqueal con una sola dosis de salino (control, n=21) o de 0,5 ml/rata de CdCl2 al 0,025% (n=21). Tras la instilación, las ratas se devolvieron a sus jaulas, donde se les administró H2O y comida ad líbitum. Transcurridos 35 días de la instilación, se sacrificó un grupo de 15 ratas (8 controles y 7 CdCl2) para confirmar la presencia de fibrosis. El resto de los animales instilados con CdCl2 se dividió en 2 nuevos grupos para tratarse con 6 dosis intraperitoneal (i.p.) (2 inyecciones/semana, durante 3 semanas) de salino (grupo CdCl2, n=7) o 5μg/rata de LGF (grupo LGF, n=7). Cincuenta y cinco días después de la instilación, comparamos los grupos CdCl2 y LGF a nivel funcional, morfométrico y bioquímico. Adicionalmente, a un grupo de ratas control se les realizó un tratamiento con LGF (grupo control+LGF) y se incluyó este grupo en las comparaciones.
2. Pruebas de función pulmonar: El estudio funcional se llevó a cabo en un respirador para pequeños animales (Harvard)5. Las ratas se anestesiaron con pentotal sódico (60mg/kg de peso, i.p.), se traqueotomizaron, se ubicaron en un pletismógrafo y se conectaron a una cánula para permitir la comunicación con el respirador. Tan pronto como las ratas se conectaron al equipo de respiración, se las paralizó con 0,2mg de bromuro de pancuronio y se ventilaron artificialmente. Se midieron los cambios en la capacidad inspiratoria (CI) (ml), la complianza pulmonar (CL) (ml/cm de H2O), la capacidad vital forzada (CVF) (ml) y el flujo espiratorio forzado al 75% (FEF75%) (ml/s).
La CI se consideró como el cambio en el volumen pulmonar hasta alcanzar una presión aérea de 30cm de H2O. Para realizar las curvas cuasiestáticas de presión-volumen se insufló aire a los animales hasta una presión aérea de 30cm de H2O y se forzó la salida de éste a un flujo constante de 1 ml/s hasta alcanzar el volumen residual. La complianza se consideró como el punto de mayor pendiente de la curva de presión-volumen durante la espiración. Finalmente, se indujeron curvas de flujo-volumen, se introdujo aire en las ratas hasta una presión de 30cm de H2O y se provocó la espiración forzada mediante una bomba de vacío (Emerson) a una presión de −(40cm de H2O). A partir de estas curvas, se determinaron la CVF y el FEF75% de la CVF.
3. Morfometría: Tras la realización del estudio funcional, se sacrificaron los animales por sobredosis de pentobarbital y se extrajo el bloque cardiopulmonar. El pulmón izquierdo se pesó y se congeló inmediatamente para realizar las determinaciones bioquímicas correspondientes. El pulmón derecho se fijó aplicando una solución de formaldehido al 10% a una presión constante de 25cm de H2O durante 24h. Después de la fijación, se cogieron 3 lóbulos, se incluyeron en parafina, se realizaron cortes de 5μm de grosor y se tiñeron con hematoxilina-eosina para el estudio morfométrico y rojo sirio para la cuantificación del depósito de colágeno. Mediante la utilización de un programa de análisis de imágenes para las muestras teñidas con hematoxilina-eosina, se calcularon el área interna alveolar (AIA) (μm2) y la media horizontal y vertical de la distancia entre paredes alveolares (LM) (μm). El contenido en colágeno se cuantificó en las muestras teñidas con rojo sirio, y se comparó la birrefringencia de las zonas ricas en colágeno con el área total de tejido de cada campo microscópico. Las imágenes se visualizaron mediante una videocámara (Leica DC 100; Leica Microsystems) con una resolución de 782×582 píxeles, adaptada a un microscopio (Olympus BX40). Los distintos campos se cuantificaron utilizando un objetivo 10× y un adaptador de videocámara 0,5×. Se utilizó un software (Leica Qwin) para el análisis de imágenes, y se calculó el AIA, la LM y la birrefringencia. Cada dato representa el valor medio de al menos 18 campos seleccionados al azar en diferentes cortes.
4. Análisis bioquímico de colágeno y elastina: La cuantificación de colágeno se realizó midiendo el contenido en residuos de hidroxiprolina (HIP). Previamente, el pulmón izquierdo se homogeneizó, y se añadió cloramina T tras la hidrólisis ácida para inducir la oxidación. A continuación se añadió el reactivo de Erlich (Sigma Aldrich) y una vez desarrollada la reacción se valoró la absorbancia de cada muestra a 560nm19. La elastina se purificó mediante homogenización tisular con phosphate buffered saline (PBS) y ácido tricloroacético (TCA) al 10%, centrifugación y tratamiento con TCA al 5% durante 30min a 90°C. Este último precipitado (elastina purificada) se trató con elastasa porcina pancreática tipo iii (Sigma Aldrich) durante 4h a 25°C. La elastina se midió mediante un método colorimétrico, y se utilizó ácido bicincónico (BCA Protein Assay Kit; Pierce, Promega). Como estándares de referencia se tomaron HIP (Sigma Aldrich) y elastina de ligamiento de cuello bovino (Sigma Aldrich). Los resultados se expresaron en miligramos de HIP o elastina por el pulmón izquierdo.
5. Aislamiento y purificación de factor de crecimiento de hígado: El LGF se purificó de suero de rata según el procedimiento previamente descrito20. La pureza y la ausencia de otros factores de crecimiento o contaminantes en la preparación de LGF también se realizaron mediante criterios estandarizados11. Las preparaciones de LGF se liofilizaron y se mantuvieron a 4°C hasta su utilización, momento en el que se disolvieron las distintas alícuotas en salino para su inyección i.p. (el LGF es igualmente activo en inyección i.p. o i.v.). Antes de utilizar el LGF en estos experimentos, se comprobó su actividad in vivo a diferentes dosis mediante su inyección en ratas normales para establecer la dosis a la que producía mayor estimulación de la síntesis de ADN en el hígado, y se determinó para ello la incorporación de timidina tritiada (New England Nuclear; Dreieich, Alemania) en el ADN11. En concordancia con estudios previos, se consideró que la dosis óptima del LGF era de 5,0μg/rata15.
6. Análisis estadístico: Todos los datos se expresaron como la media±error estándar de la media (SEM). Las comparaciones se realizaron mediante ANOVA. El test de la mínima diferencia significativa de Fisher (least significant difference method) se utilizó para el análisis de las diferencias entre medias.
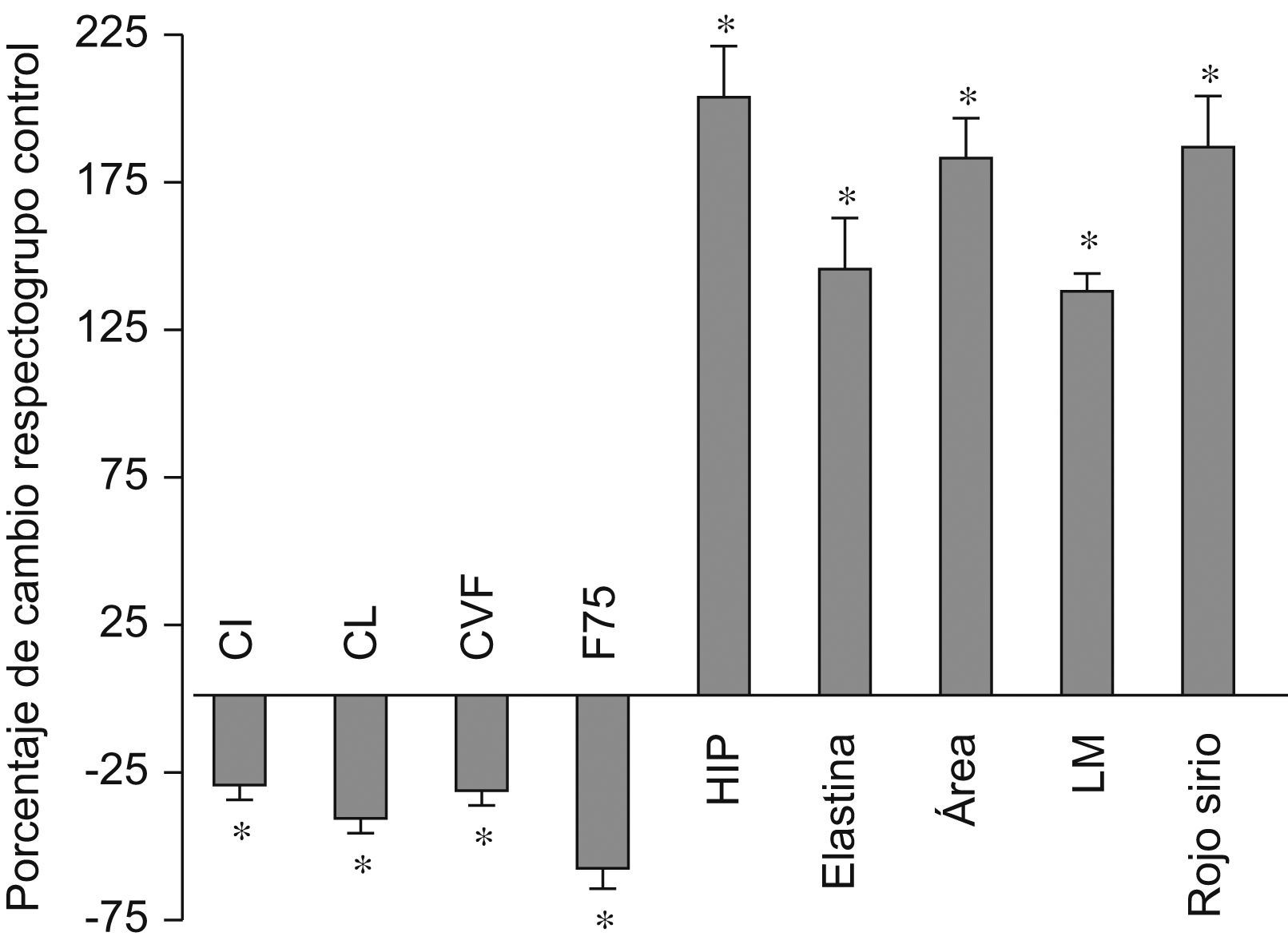
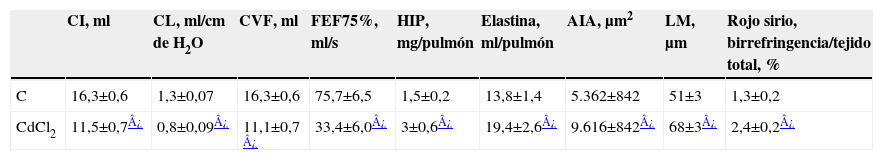
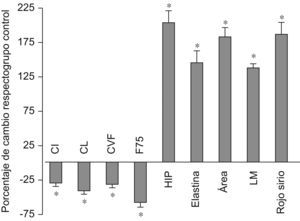
ResultadosTreinta y cinco días después de inducirse la lesión (fig. 1, tabla 1), se detectó un descenso significativo de todas las variables funcionales estudiadas (CI, CL, CVF y FEF75%) con respecto a los valores obtenidos en el grupo control. Por otro lado, se observó un mayor aumento, también significativo, del contenido en proteínas de la matriz extracelular, que normalmente se encuentran presentes en la fibrosis pulmonar, así como un incremento significativo de las variables morfométricas (AIA y LM), que recuerdan el agrandamiento típico de los espacios aéreos del enfisema.
Cambios en todas las variables analizadas en el grupo cloruro de cadmio a los 35 días con respecto al grupo control. AIA: área interna alveolar; CI: capacidad inspiratoria; CL: complianza pulmonar; CVF: capacidad vital forzada; FEF75%: flujo espiratorio forzado al 75%; HIP: hidroxiprolina; LM: distancia media entre paredes alveolares. *p < 0,05 versus control. Todos los datos están expresados como porcentaje respecto del grupo de control.
Datos funcionales, morfométricos y bioquímicos a los 35 días de inducirse la lesión
| CI, ml | CL, ml/cm de H2O | CVF, ml | FEF75%, ml/s | HIP, mg/pulmón | Elastina, ml/pulmón | AIA, μm2 | LM, μm | Rojo sirio, birrefringencia/tejido total, % | |
| C | 16,3±0,6 | 1,3±0,07 | 16,3±0,6 | 75,7±6,5 | 1,5±0,2 | 13,8±1,4 | 5.362±842 | 51±3 | 1,3±0,2 |
| CdCl2 | 11,5±0,7¿ | 0,8±0,09¿ | 11,1±0,7 ¿ | 33,4±6,0¿ | 3±0,6¿ | 19,4±2,6¿ | 9.616±842¿ | 68±3¿ | 2,4±0,2¿ |
AIA: área interna alveolar; CdCl2: cloruro de cadmio; CI: capacidad inspiratoria; CL: complianza pulmonar; CVF: capacidad vital forzada; FEF75%: flujo espiratorio forzado al 75%; H2O: agua; HIP: hidroxiprolina; LM: distancia media entre paredes alveolares.
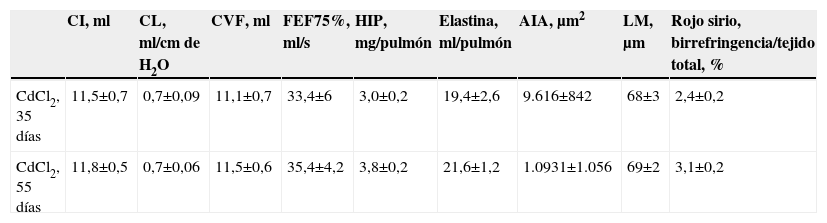
Para confirmar que el LGF no presenta efectos negativos en los animales sanos, se administró a 7 ratas del grupo control el mismo tratamiento que al grupo LGF. No se encontraron diferencias en relación con el grupo control (tabla 2). Tampoco se encontraron diferencias en ninguno de los parámetros estudiados (tabla 3) entre los días 35 y 55 dentro del grupo de ratas a las que se les administró CdCl2, lo que confirmó que la lesión inducida era estable y permanente en el período en el que se aplicó el tratamiento con LGF.
Comparación entre el grupo control y el grupo control+factor de crecimiento de hígado en todas las variables
| CI, ml | CL, ml/cm de H2O | CVF, ml | FEF75%, ml/s | HIP, mg/pulmón | Elastina, ml/pulmón | AIA, μm2 | LM, μm | Rojo sirio, birrefringencia/tejido total, % | |
| CdCl2, 35 días | 11,5±0,7 | 0,7±0,09 | 11,1±0,7 | 33,4±6 | 3,0±0,2 | 19,4±2,6 | 9.616±842 | 68±3 | 2,4±0,2 |
| CdCl2, 55 días | 11,8±0,5 | 0,7±0,06 | 11,5±0,6 | 35,4±4,2 | 3,8±0,2 | 21,6±1,2 | 1.0931±1.056 | 69±2 | 3,1±0,2 |
No se observaron diferencias estadísticas entre grupos.
AIA: área interna alveolar; CdCl2: cloruro de cadmio; CI: capacidad inspiratoria; CL: complianza pulmonar; CVF: capacidad vital forzada; FEF75%: flujo espiratorio forzado al 75%; H2O: agua; HIP: hidroxiprolina; LM: distancia media entre paredes alveolares.
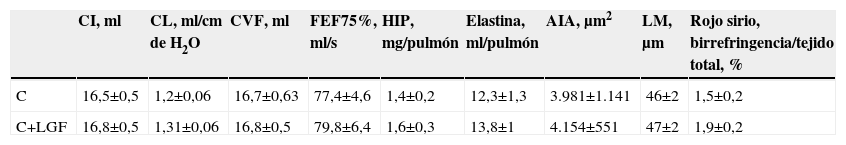
Comparación de los datos funcionales, morfométricos y bioquímicos a los 35 y a los 55 días de la administración de cloruro de cadmio
| CI, ml | CL, ml/cm de H2O | CVF, ml | FEF75%, ml/s | HIP, mg/pulmón | Elastina, ml/pulmón | AIA, μm2 | LM, μm | Rojo sirio, birrefringencia/tejido total, % | |
| C | 16,5±0,5 | 1,2±0,06 | 16,7±0,63 | 77,4±4,6 | 1,4±0,2 | 12,3±1,3 | 3.981±1.141 | 46±2 | 1,5±0,2 |
| C+LGF | 16,8±0,5 | 1,31±0,06 | 16,8±0,5 | 79,8±6,4 | 1,6±0,3 | 13,8±1 | 4.154±551 | 47±2 | 1,9±0,2 |
No se observaron diferencias significativas entre grupos.
AIA: área interna alveolar; CI: capacidad inspiratoria; CL: complianza pulmonar; CVF: capacidad vital forzada; FEF75%: flujo espiratorio forzado al 75%; H2O: agua; HIP: hidroxiprolina; LGF: liver growth factor ‘factor de crecimiento de hígado’;LM: distancia media entre paredes alveolares.
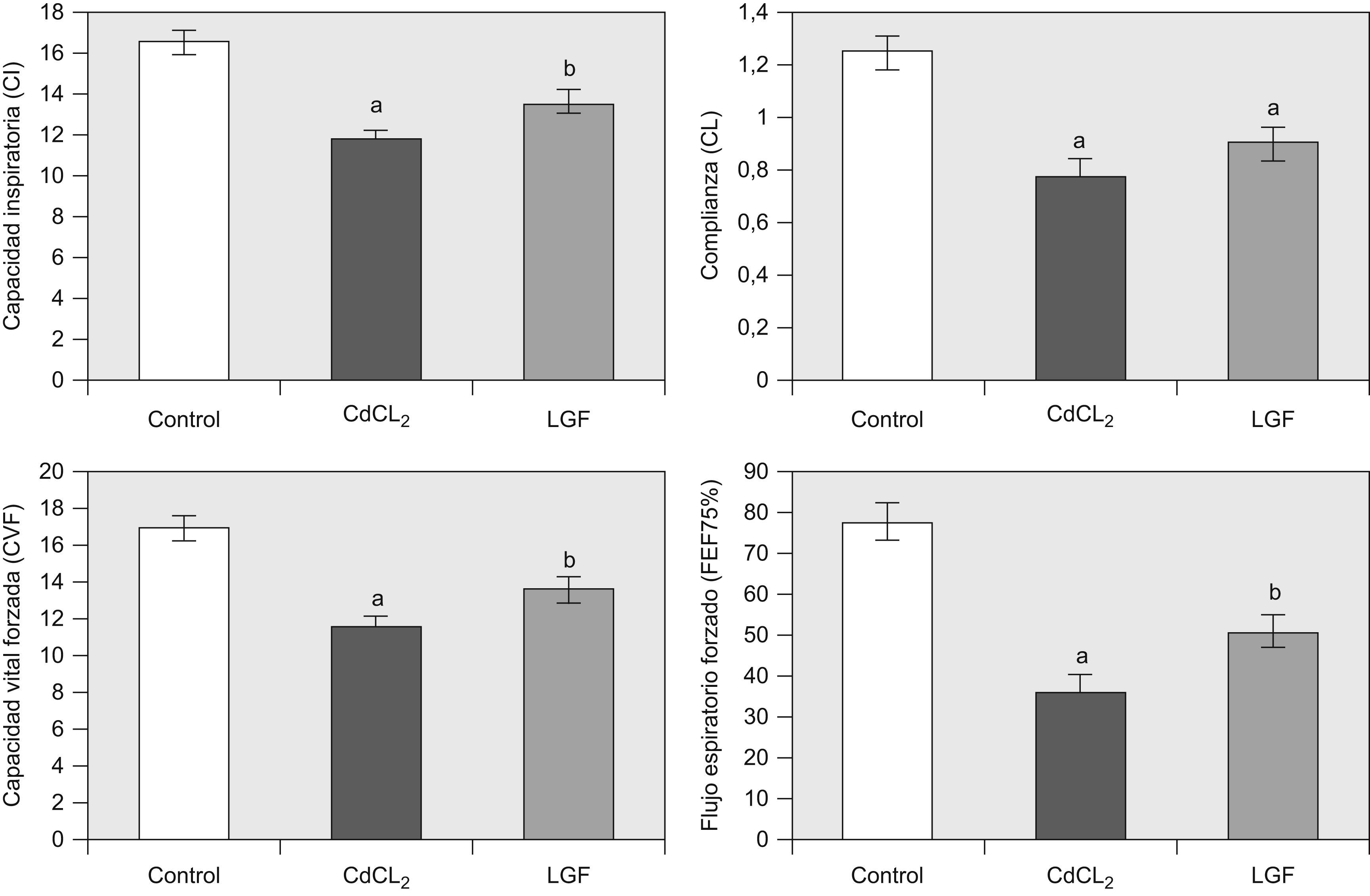
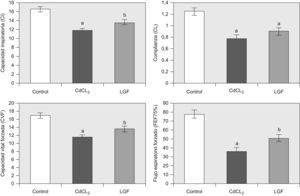
1. Función pulmonar: Los cambios en CI, CL, CVF y FEF75% en los grupos de estudio se muestran en la figura 2. Como ya se ha dicho previamente, la fibrosis pulmonar inducida con CdCl2 produjo un descenso significativo en CI, CL, CVF y FEF75% en comparación con las ratas control. La administración de LGF aproximó todas las variables funcionales a valores cercanos a la normalidad, con variaciones estadísticamente significativas en CI, CVF y FEF75%, pero no en CL (LGF versus CdCl2).
Cambios en las variables funcionales en todos los grupos experimentales. Grupo control (n=6), grupo CdCl2 (n=7) y grupo LGF (n=7). CdCl2: cloruro de cadmio; CI: capacidad inspiratoria; CL: complianza pulmonar; CVF: capacidad vital forzada; FEF75%: flujo espiratorio forzado al 75%; LGF: liver growth factor ‘factor de crecimiento de hígado’. ap<0,05 versus control. bp<0,05 versus CdCl2.
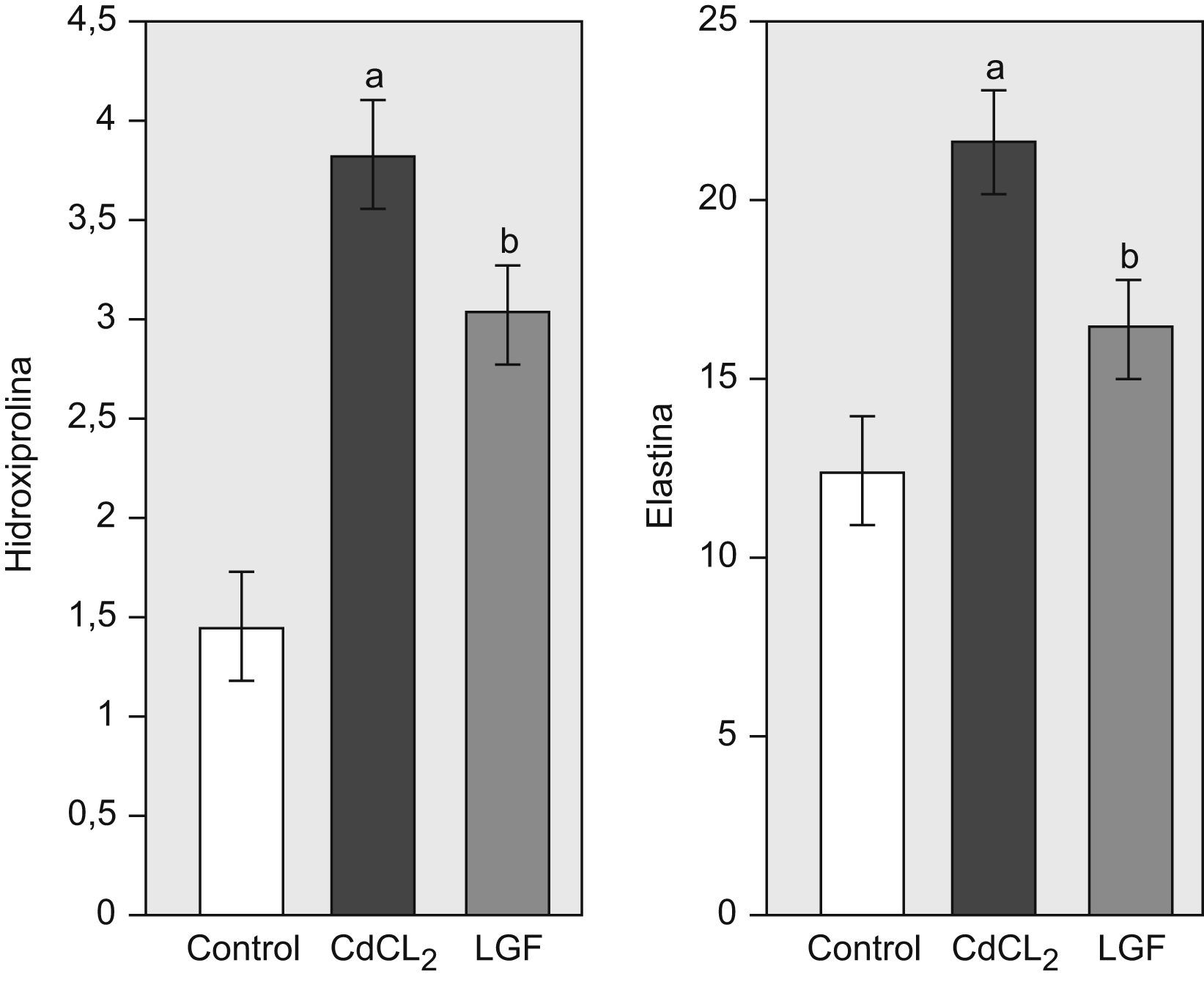
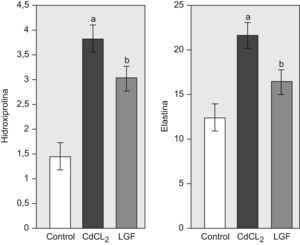
2. Colágeno y elastina pulmonares: El CdCl2 provocó un incremento significativo del contenido en colágeno y elastina en el grupo CdCl2 con referencia a las ratas sanas. Tras el tratamiento con LGF, el contenido pulmonar de colágeno fue menor que el de las ratas que recibieron CdCl2, y esta diferencia fue significativa cuando se valoró en términos de residuos de HIP (fig. 3). También detectamos un descenso significativo del contenido en elastina pulmonar en el grupo LGF con respecto a las ratas que recibieron CdCl2 (fig. 3).
Cambios en las variables bioquímicas en todos los grupos experimentales. Grupo control (n=6), grupo CdCl2 (n=7) y grupo LGF (n=7). Hipodroxiprolina (mg/pulmón) y elastina (mg/pulmón) CdCl2: cloruro de cadmio; LGF: liver growth factor ‘factor de crecimiento de hígado’ ap<0,05 versus control. bp<0,05 versus CdCl2.
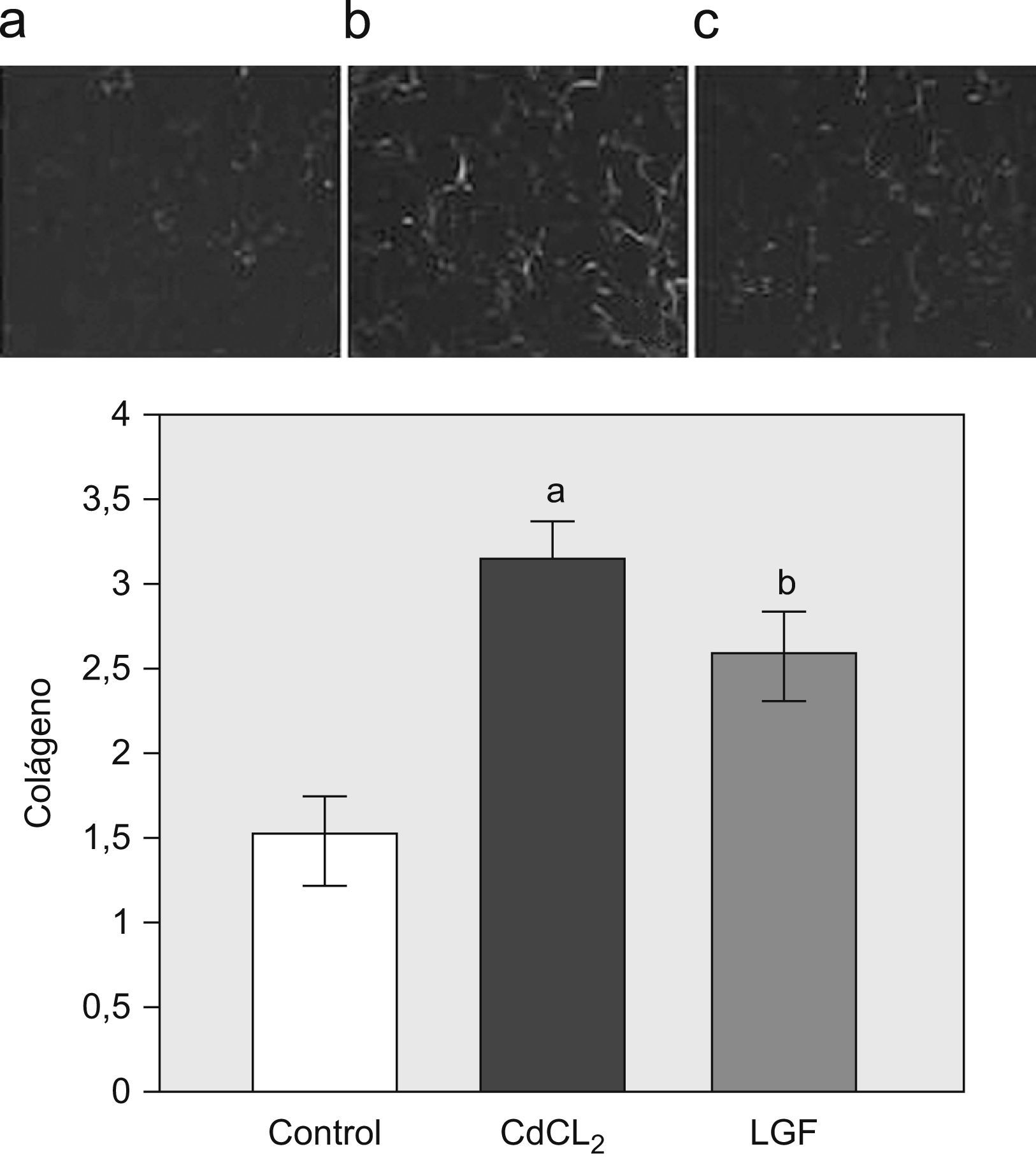
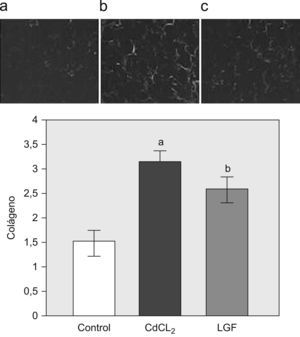
En la figura 4 se muestra un incremento en el depósito de colágeno, analizado mediante birrefringencia de las áreas ricas en colágeno en las tinciones de rojo sirio. El LGF revirtió parcialmente el depósito de matriz, con tendencia a alcanzar los valores normales, pero sin significación estadística.
Estimación de contenido en colágeno mediante birrefringencia con rojo sirio. A) Caso representativo de un pulmón normal de rata. Grupo control (n=6). B) Caso representativo de fibrosis pulmonar inducida con cloruro de cadmio (CdCl2). Grupo CdCl2 (n=7). C) Caso representativo de un pulmón con fibrosis inducida con CdCl2 tratado con liver growth factor (LGF, ‘factor de crecimiento del hígado’. Se puede observar una reducción de las áreas fibróticas. Grupo LGF (n=7). Las imágenes están tomadas con un aumento 100×Los datos se muestran en % Birrefringencia/tejido total. ap<0,05 versus control. bp<0,05 versus CdCl2.
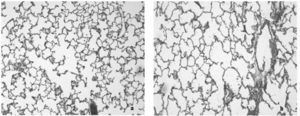
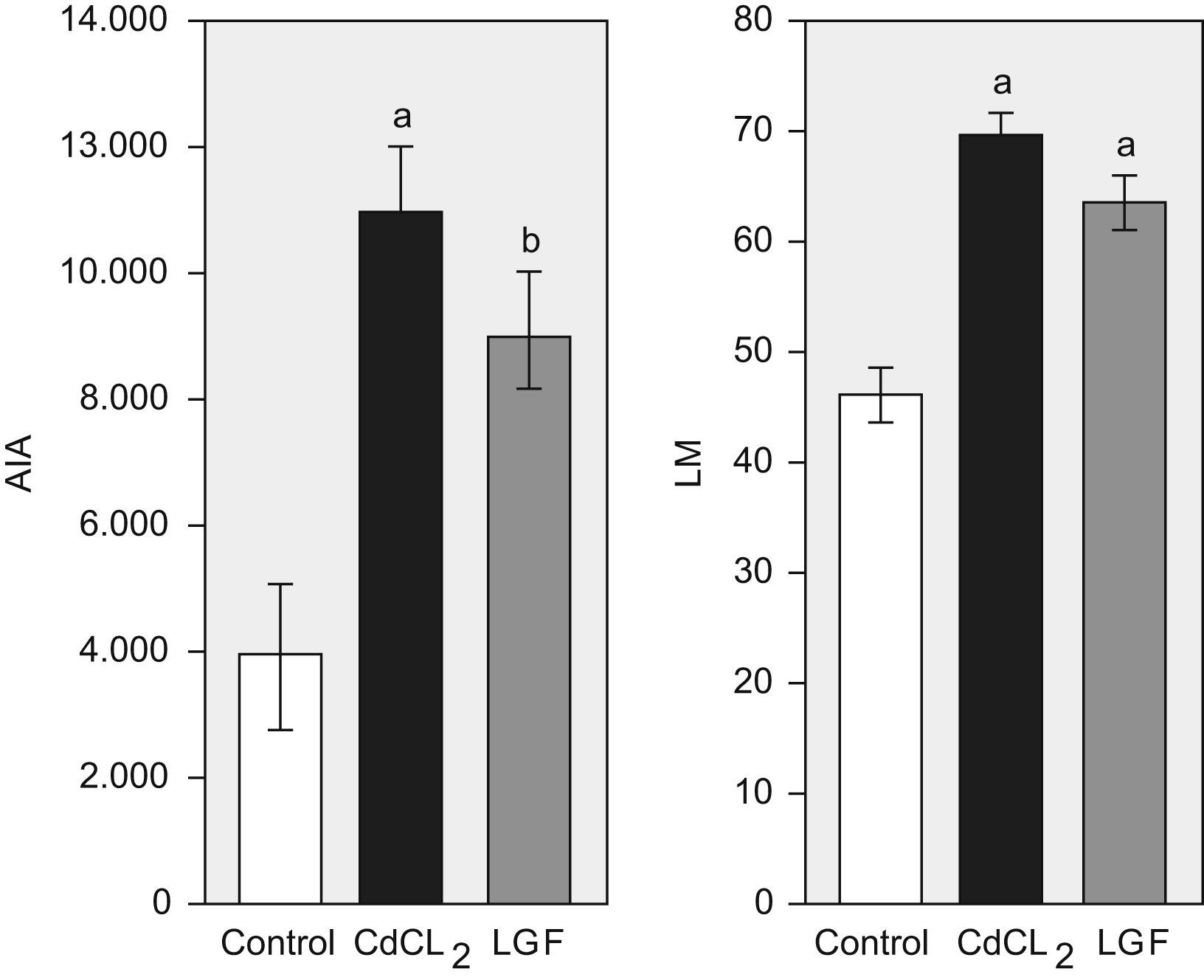
3. Morfometría: El análisis morfométrico de la LM y el AIA muestra un incremento significativo de estas variables en el grupo CdCl2 en comparación con los controles sanos. Tras el tratamiento con LGF, se observó una ligera reducción en la LM y el AIA, pero sin significación estadística (fig. 5). En la figura 6 se observan imágenes de microscopia de un pulmón sano y de otro instilado con CdCl2, donde se aprecia de forma evidente el aumento del tamaño alveolar y la fibrosis peribronquial presente en el grupo afectado.
Cambios en las variables morfométricas (área interna alveolar [μm2] y distancia media entre paredes alveolares [μm]). Grupo control (n=6), grupo CdCl2 (n=7), grupo LGF (n=7) CdCl2: cloruro de cadmio; LGF: liver growth factor ‘factor de crecimiento de hígado’. ap<0,05 versus control. bp<0,05 versus CdCl2.
Cambios morfológicos. A) Caso representativo de un pulmón sano. B) Caso representativo de un pulmón instilado con cloruro de cadmio que muestra enfisema centroacinar con fibrosis peribronquial. Tinciones con hematoxilina-eosina. Las imágenes están tomadas con un aumento 100×CdCl2: cloruro de cadmio.
En este artículo, mostramos que el modelo de lesión pulmonar inducido con CdCl2 tiene un componente fibrótico caracterizado por la disminución de las variables funcionales así como por el incremento en los depósitos de proteínas de matriz y, además, un componente enfisematoso debido a la existencia de agrandamientos alveolares observados en el análisis morfométrico. Sobre este modelo, establecido a los 35 días de la instilación con CdCl2, el tratamiento con LGF revierte parcialmente la lesión fibrótica inducida. Esta afirmación se ve apoyada por la mejora en la mayoría de las variables funcionales (CI, CVF y FEF75%) y el descenso significativo de las proteínas de la matriz pulmonar (HIP y elastina) tras el tratamiento con LGF. Las ratas instiladas con CdCl2 mostraron un descenso de las variables funcionales y un incremento de los niveles de proteínas de matriz semejantes a los 35 y a los 55 días de la instilación, por lo que podemos considerar la lesión causada con CdCl2 como una lesión permanente y, por tanto, los efectos producidos por el LGF como terapéuticos. Que nosotros conozcamos, éste es el primer estudio experimental en el que un tratamiento antifibrótico restaura parcialmente la función pulmonar normal sobre una lesión previamente establecida.
Varios autores han descrito que la fibrosis pulmonar inducida por CdCl2 se caracteriza por el daño funcional, incluyendo el descenso en la capacidad vital, la complianza y el flujo espiratorio forzado; también se incrementa el contenido de proteínas de la matriz pulmonar4,6,21 y aparece enfisema centroacinar22. Si bien el LGF no reduce el agrandamiento alveolar producido por la instilación de CdCl2 de forma significativa, sí existe una tendencia a la mejoría que podría abrir una nueva vía de estudio encaminada al efecto de este factor de crecimiento en el enfisema.
El presente trabajo tiene gran similitud con el previo realizado por Heili Frades et al. En ambos casos se encuentran lesiones pulmonares similares que afectan a la función, al tamaño alveolar y a los niveles de proteínas de la matriz extracelular compatibles con el enfisema centroacinar y la fibrosis peribronquial; en este modelo el tratamiento con N-acetilcisteína (NAC) mejoraba parcialmente el deterioro de la función pulmonar, observado en todas las variables funcionales medidas (CI, CVF y FEF75%), salvo en la CL. Lo mismo ocurre con el depósito de colágeno medido por los residuos de HIP, elevados por la inducción con CdCl2 y parcialmente restaurados por el tratamiento con NAC. El patrón de respuesta observado con el CdCl2 es muy similar al del presente estudio, incluyendo la respuesta al tratamiento. La NAC mejora la lesión fibrótica, si bien la diferencia radica en el modo de administración; mientras que este agente de carácter antioxidante se administró de forma concomitante a la inducción de la lesión, el LGF se administró una vez que ésta estaba instaurada y estabilizada.
El caso de la NAC no es el único en la literatura médica debido a la prevalencia que tiene esta enfermedad y a la dificultad de encontrar dianas terapéuticas efectivas para combatirla23, la búsqueda de tratamientos es continua. Existen muchos estudios realizados en modelos de bleomicina con agentes antifibróticos, como la deferoxamina, el factor de crecimiento de hepatocitos, el factor de crecimiento de queratinocitos, el interferón γ, el gingko biloba, EM703, IMD-0354 y el C-type natriuretic peptide1,24–30, e incluso estudios que abordan otro tipo de tratamiento, como el tratamiento celular basado en la instilación de células alveolares tipo ii como vehículo de regeneración del tejido dañado31; si bien estos agentes tienen la capacidad de reducir la fibrosis, tienen también la limitación de que el agente antifibrótico se añade concomitantemente al desarrollo de la enfermedad, lo que dificulta su empleo como uso terapéutico, ya que esta enfermedad se diagnostica, en la mayoría de los casos, una vez que se ha establecido.
De acuerdo con publicaciones previas, la inflamación celular no es un factor clave tras los primeros días de la instilación del CdCl27. Como el LGF se administró una vez establecida la lesión, es poco probable que la actividad del LGF se deba a un efecto antiinflamatorio, y revierta parcialmente la fibrosis, no obstante, se reconoce que el LGF tiene una considerable actividad como secuestrador de radicales libres32. Recientemente nuestro grupo ha demostrado que la capacidad antifibrótica del LGF está mediada por la inhibición parcial del TGF-β y la transformación de los miofibroblastos13,14, ambos episodios clave en el proceso de depósito de la matriz extracelular. Sin embargo, también es posible que el LGF seleccione células madre e induzca la proliferación de las células endoteliales y alveolares, como ya se ha visto que hacen otros factores de crecimiento27,33–35. En conjunto, estas observaciones indican la necesidad de llevar a cabo nuevos estudios para determinar el mecanismo de acción del LGF en la reparación de la fibrosis en el pulmón.
En conclusión, este trabajo muestra que el tratamiento con LGF, administrado sobre una fibrosis pulmonar previamente establecida mediante la administración de ClCl2, fue capaz de revertir en parte la fibrosis pulmonar, mejorar la función pulmonar y revertir el incremento de las proteínas de la matriz pulmonar. Pendiente de determinar el mecanismo de acción que facilita esta respuesta, la posibilidad de revertir una fibrosis pulmonar previamente establecida abre la posibilidad de que el LGF pueda aplicarse en un futuro en el tratamiento de la fibrosis pulmonar.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.
FinanciaciónFinanciado por el Fondo de Investigaciones Sanitarias (PI050720) y Sociedad Española de Neumología y Cirugía Torácica.



![Cambios en las variables morfométricas (área interna alveolar [μm2] y distancia media entre paredes alveolares [μm]). Grupo control (n=6), grupo CdCl2 (n=7), grupo LGF (n=7) CdCl2: cloruro de cadmio; LGF: liver growth factor ‘factor de crecimiento de hígado’. ap<0,05 versus control. bp<0,05 versus CdCl2. Cambios en las variables morfométricas (área interna alveolar [μm2] y distancia media entre paredes alveolares [μm]). Grupo control (n=6), grupo CdCl2 (n=7), grupo LGF (n=7) CdCl2: cloruro de cadmio; LGF: liver growth factor ‘factor de crecimiento de hígado’. ap<0,05 versus control. bp<0,05 versus CdCl2.](https://static.elsevier.es/multimedia/03002896/0000004600000001/v1_201305150256/S0300289609004244/v1_201305150256/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w98FxLWLw1xoW2PaQDYY7RZU=)